La salud depende del buen funcionamiento de los sistemas homeostáticos (el nervioso, endocrino e inmunitario) y de la adecuada comunicación entre ellos. Se ha comprobado que el estado funcional y redox del sistema inmunitario es un excelente marcador de salud, y que una inmunosenescencia prematura supone una menor esperanza de vida. Dado que las catecolaminas modulan la funcionalidad de las células inmunitarias, la alteración en su síntesis podría contribuir a esa inmunosenescencia. Entre las estrategias que se pueden utilizar para controlarla está el ambiente social.
ObjetivoComprobar si una haploinsuficiencia de la tirosina hidroxilasa (TH), enzima limitante de la síntesis de catecolaminas, generaría una inmunosenescencia prematura, y si es posible la modulación de esta por el ambiente social.
Material y métodosSe usaron ratones machos ICR-CD1 adultos (9±1 meses) hemizigotos (HZ) para la tirosina hidroxilasa (TH-HZ) y controles (WT), que fueron distribuidos en cuatro subgrupos: WT>50% (en la jaula, la proporción de WT fue mayor al 50%), WT<50%, TH-HZ<50% y TH-HZ>50%. En leucocitos peritoneales se valoró la fagocitosis, quimiotaxis y linfoproliferación en presencia de lipopolisacárido. También, la actividad de las enzimas antioxidantes glutatión reductasa y glutatión peroxidasa, y el cociente glutatión oxidado/glutatión reducido.
ResultadosLos TH-HZ>50% presentaron, en leucocitos, una funcionalidad y estado redox deteriorados respecto a WT>50 y similar a ratones viejos. Sin embargo, los TH-HZ<50% mostraron valores similares a los WT<50%.
ConclusiónUna haploinsuficiencia de la enzima TH provoca una inmunosenescencia prematura, la cual puede ser compensada por la convivencia con un número apropiado de animales WT.
Healthy state depends on the appropriate function of the homeostatic systems (nervous, endocrine and immune systems) and the correct communication between them. The functional and redox state of the immune system is an excellent marker of health, and animals with premature immunosenescence show a shorter lifespan. Since catecholamines modulate the function of immune cells, the alteration in their synthesis could provoke immunosenescence. The social environment could be a strategy for modulating this immunosenescence.
AimTo determine if an haploinsufficiency of tyrosine hydroxylase (TH), the limiting enzyme of synthesis of catecholamines, may produce a premature immunosenescence and if this immunosenescence could be modulated by the social environment.
Materials and methodsAdult (9±1 months) male ICR-CD1 mice with deletion of a single allele (hemi-zygotic: HZ) of the tyrosine hydroxylase enzyme (TH-HZ) and wild-type (WT) mice were used. Animals were housed in four subgroups: WT>50% (in the cage, the proportion of WT mice was higher than 50% in relation to TH-HZ), WT<50%, TH-HZ<50% and TH-HZ>50%. Peritoneal leukocytes were collected and phagocytosis, chemotaxis and proliferation of lymphocytes in the presence of lipopolysaccharide were analyzed. Glutathione reductase and glutathione peroxidase activities as well as oxidized/reduced glutathione ratio were studied.
ResultsTH-HZ>50% mice showed a deteriorated function and redox state in leukocytes respect to WT>50% and similar to old mice. However, TH-HZ<50% animals had similar values to those found in WT<50% mice.
ConclusionThe haploinsufficiency of TH generates premature immunosenescence, which appears to be compensated by living together with an appropriate number of WT animals.
El mantenimiento de la salud depende del correcto funcionamiento de los sistemas homeostáticos (los sistemas nervioso, endocrino e inmunitario), y de la adecuada comunicación entre ellos, esto es, de la denominada comunicación neuroinmunoendocrina1. Entre las vías más relevantes en esta comunicación se encuentra la de las catecolaminas (CA), productos finales del eje simpático-adreno-medular, involucrado en la respuesta ante un estrés agudo2,3. Estas neurohormonas son capaces de modular la funcionalidad del sistema inmunitario a través de receptores alfa y beta adrenérgicos presentes en las células inmunitarias, aumentando o disminuyendo tanto la respuesta de la inmunidad innata2,4 como de la inmunidad adquirida5. También la presencia de esos receptores en el sistema nervioso podría generar una modulación indirecta de la inmunidad por los neurotransmisores cerebrales liberados por acción de las CA que afectan la funcionalidad de los leucocitos2. Por ello, una alteración en este eje podría provocar un deterioro de la respuesta inmunitaria, y, consecuentemente, una pérdida del equilibrio homeostático y con ello de la salud.
Durante el proceso de envejecimiento los sistemas homeostáticos se van deteriorando y también la comunicación entre ellos6,7, lo que conlleva la mayor morbimortalidad que acontece en la vejez. El sistema inmunitario, que por sus características ha sido considerado el mejor marcador del estado de salud y longevidad del individuo7,8, sufre una serie de cambios y reestructuraciones con el envejecimiento, proceso denominado inmunosenescencia7,9,10. En el marco de la teoría de la oxidación-inflamación del envejecimiento, se ha propuesto al estado funcional de las células inmunitarias como marcador de la velocidad a la que cada individuo lleva a cabo su proceso de envejecimiento, esto es, de su edad biológica7,11. De hecho, se ha comprobado que animales de experimentación, cronológicamente adultos, que muestran una inmunosenescencia prematura, tienen un proceso de envejecimiento acelerado y una menor esperanza de vida11–13.
En base a que el mantenimiento de una adecuada respuesta homeostática en cada individuo depende de la genética del mismo, pero también del ambiente y estilo de vida7, se están investigando una serie de estrategias de tipo ambiental que permitan hacer más lento el proceso de envejecimiento. En este sentido se han propuesto diferentes sistemas de enriquecimiento ambiental que ralenticen la inmunosenescencia14. El ambiente social, entendido como el ambiente en el que un individuo se desarrolla, puede inducir cambios que condicionen a dicho individuo durante el resto de su vida15. En este contexto, Hashimoto et al.16 comprobaron que animales sanos que convivían con otros con dermatitis desarrollaban pautas conductuales similares a las de los enfermos. También, se ha demostrado que la convivencia de un individuo sano con un enfermo conllevaba una inmunosupresión del sano17,18. Así, el ambiente social se ha relacionado con la salud y el envejecimiento15 y se ha comprobado que ambientes competitivos y negativos se acompañan de alteraciones inmunitarias y con aumento de citoquinas proinflamatorias19. No obstante, los posibles efectos beneficiosos de un ambiente social positivo sobre el sistema inmunitario no han sido investigados.
Por todo ello, el objetivo del presente estudio fue determinar si en un modelo de ratones con una haploinsuficiencia para la enzima tirosina hidroxilasa (TH), enzima limitante de la síntesis de CA, tiene lugar una inmunosenescencia prematura y, de observarla, si el ambiente social en el que se encuentren estos animales podría revertir dicha inmunosenescencia.
Material y métodosAnimalesSe usaron 20 ratones de la cepa ICR-CD1 machos adultos (9±1 meses), de los cuales 10 fueron silvestres (wild-type [WT]) y 10 con la deleción de un alelo de Th (hemizigoto [HZ]). Ambos genotipos se obtuvieron del cruce de machos ICR-CD1 silvestres y hembras ICR-CD1 TH hemizigotas. La cepa ICR-CD1 TH hemizigota fue generada mediante retro-cruces de la cepa C57BL6/J hemizigota para Th y la cepa ICR-CD1 silvestre durante al menos 10 generaciones20. La cepa C57BL6/J hemizigota para Th fue amablemente donada por el Dr. Palmiter21 (Universidad de Washington, Seattle, WA, EE. UU.). Los animales usados fueron hemizigotos debido a que la mutación en homozigosis tiene una alta tasa de letalidad (aproximadamente del 90%) en estado embrionario20,21. Los ratones TH-HZ estaban sanos y aparentemente normales, sin signos de ninguna lesión asociada a la mutación. Los rangos de crecimiento de estos animales fueron similares a los de los animales WT.
Diseño experimentalLos animales fueron estabulados en jaulas con diferente proporción de los genotipos WT y TH-HZ, y se clasificaron en cuatro subgrupos experimentales: WT>50% (la proporción de WT fue mayor al 50% en relación con los TH-HZ en la jaula: 6 WT/4TH-HZ), WT<50% (WT menos del 50%: 4WT/6TH-HZ), TH-HZ<50% (TH-HZ menos del 50% en relación con los WT: 4TH-HZ/6WT) y TH-HZ>50% (TH-HZ más del 50%: 6TH-HZ/4WT). Todos los animales fueron mantenidos con acceso tanto a comida como agua ad libitum. La temperatura (22±2°C) y la luz (fotoperiodo invertido) estuvieron controladas. Todos los ratones fueron manipulados según las directrices del Consejo de la Unión Europea (2010/63/EU), del Real decreto de la legislación española (RD/53/2013) y con la aprobación del Comité de Experimentación Animal de la Universidad Complutense de Madrid.
Obtención de leucocitos peritonealesLas suspensiones peritoneales se obtuvieron sin sacrificar ni anestesiar a los ratones. Para ello se inmovilizaron los animales, el abdomen se limpió con alcohol al 70% y se les inyectó en el peritoneo 3mL de una solución de Hank estéril. Mediante masaje abdominal se recuperó aproximadamente el 80% del volumen inyectado. El tiempo empleado en todo el proceso de extracción de la suspensión peritoneal no superó los cinco min. La viabilidad celular se determinó mediante el test de exclusión azul-tripán, y siempre fue superior al 95%.
Todos los estudios inmunológicos y de estrés oxidativo se realizaron usando las suspensiones peritoneales sin fraccionar, para reproducir de la mejor forma la respuesta inmunológica y de estrés oxidativo que se produce in vivo. Las suspensiones fueron ajustadas a un número específico de macrófagos y linfocitos peritoneales dependiendo del parámetro a analizar, como se describe en la sección correspondiente. Las incubaciones se llevaron a cabo a 37°C, con humedad a saturación y 5% de CO2.
Parámetros inmunológicosCapacidad fagocítica de macrófagosPara valorar la capacidad fagocítica se utilizó una suspensión peritoneal ajustada a 5x105 macrófagos/mL de solución de Hank, siguiendo el método previamente descrito22. Las alícuotas de 0,2mL de la suspensión peritoneal se dispensaron en placas migratory inhibition factor (Sterilin, Teddington, Inglaterra) y se incubaron durante 40 min. Una vez generada la capa de células adherentes (en la que se encuentran los macrófagos), la placa se lavó con tampón salino (PBS), se le añadió 0,2mL de solución de Hank, 0,02mL de bolas de látex (1,09μm diluidas al 1% en PBS, Sigma, St. Louis, MO) y se incubó durante 30 min. Una vez transcurrido este tiempo, se lavó la placa, se fijó, se tiñó y se calculó el índice fagocítico (IF) contabilizando en el microscopio óptico (x100) el número de partículas ingeridas por 100 macrófagos.
Quimiotaxis de linfocitosLa capacidad de quimiotaxis (movilidad inducida hacia un foco infeccioso) de los linfocitos se evaluó utilizando la técnica desarrollada por Boyden23, con modificaciones24. La técnica consiste en el uso de unas cámaras con dos compartimentos separadas por un filtro de nitrocelulosa (Millipore, Cork, Irlanda) con un diámetro de poro de 3μm. En el compartimento superior se añadió una alícuota de 0,3mL de la suspensión peritoneal, ajustada a 5 x 105 linfocitos/mL de solución de Hank, mientras que en el compartimento inferior, para crear un gradiente químico, se incorporó una alícuota de 0,4mL del quimioatrayente fMet-Leu-Phe (Sigma) a una concentración de 10-8 M. Las cámaras se incubaron durante 3h y posteriormente los filtros se fijaron y se tiñeron. Se contabilizó al microscopio (x100) el número de linfocitos presentes en la cara inferior del filtro mediante 4 barridos de 5mm cada uno. El valor obtenido de dicho recuento constituye lo que se denomina índice de quimiotaxis (IQ).
Respuesta proliferativa de los linfocitos al mitógeno lipopolisacáridoLa capacidad de proliferación se valoró mediante el test de transformación linfoblástica en respuesta a lipopolisacárido (LPS) (Sigma), siguiendo el protocolo descrito con anterioridad24, con pequeñas modificaciones. Se prepararon alícuotas de la suspensión peritoneal ajustadas a 1 x 106 linfocitos/mL en medio completo conteniendo RPMI-1640 (PAA, Pasching, Austria), 10% de suero fetal bovino descomplementarizado (Thermo Scientific, Cramlington, Northumberland) y 1% de gentamicina (PAA). Se dispensaron 0,2mL/pocillo de esa suspensión en una placa de 96 pocillos y se añadió 0,02mL/pocillo de LPS (0,1mg/mL) resultando en una concentración final de 1μg/mL LPS por pocillo. El ensayo se realizó por triplicado. Después de una incubación de 48 h, se reemplazaron 0,1mL de medio de cultivo de cada pocillo, por 0,1mL de medio completo conteniendo 0,005mL de una solución de timidina tritiada (3H) a 0,1 mCi/mL en PBS estéril (MP Biomedicals; actividad específica de 35 Ci/mmol). Tras 24h de incubación se recogieron las células y la radioactividad de cada pocillo se midió en un contador beta (LKB). Los resultados se expresaron como cuentas por minuto.
Parámetros de estrés oxidativoActividad glutatión reductasaLa actividad glutatión reductasa (GR) se determinó mediante un método previamente descrito25, con pequeñas modificaciones. Las alícuotas de la suspensión peritoneal se ajustaron a 1 x 106 leucocitos/mL de solución de Hank, se centrifugaron a 1.076g durante 10min a 4°C y los precipitados se resuspendieron con tampón fosfato 50mM conteniendo EDTA 6,3mM (Sigma), pH 7,4. Posteriormente, las muestras se sonicaron (tres ciclos de 10 seg a una potencia del 75%, con intervalos de descanso de 20 seg), y se centrifugaron a 3.200g durante 20min a 4°C. La actividad total se determinó siguiendo la oxidación de beta-nicotinamida adenina dinucleótido fosfato (beta-NADPH, Sigma) a 340nm. Los resultados se expresaron como miliunidades (mU) de actividad enzimática/106 leucocitos.
Actividad glutatión peroxidasaLa actividad de la enzima glutatión peroxidasa se valoró siguiendo el protocolo original descrito por Lawrence et al.26, con pequeñas modificaciones. La suspensión peritoneal se ajustó a 1 x 106 leucocitos/mL de solución de Hank. Posteriormente se centrifugó a 1.076g durante 10min a 4°C y el precipitado se resuspendió en tampón fosfato 50mM pH 7,4. Después, las muestras se sonicaron (siguiendo el protocolo anteriormente descrito) y se centrifugaron a 3.200g durante 20min a 4°C. La actividad total se determinó usando hidróxido de cumeno (cumeno-OOH, Sigma), el cual se oxida por la adición de beta-NADPH, en presencia de glutatión reductasa (Sigma). La reacción se siguió espectrofotométricamente por el decremento de la absorbancia a 340nm. Los resultados se expresaron como miliunidades (mU) de actividad enzimática/106 leucocitos.
Cociente glutatión oxidado/glutatión reducidoEl método que se siguió para la determinación de ambas formas del glutatión (oxidado y reducido) fue uno fluorimétrico previamente descrito27, con pequeñas modificaciones y adaptado a placa de 96 pocillos. El procedimiento se basa en la capacidad de reaccionar del glutatión oxidado (GSSG) a pH 12 y del glutatión reducido (GSH) a pH 8 en presencia de o-phtalaldehido (OPT, Sigma), dando lugar a un compuesto fluorescente en ambos casos. Alícuotas de 1mL de leucocitos peritoneales, ajustadas a 1 x 106 células/mL de solución de Hank, se centrifugaron a 1.200g durante 10min a 4°C. Los precipitados fueron resuspendidos en tampón fosfato EDTA, 0,1M, pH 8 (Sigma). Posteriormente, las muestras se sonicaron (como se describió en el apartado anterior), se adicionaron 0,05mL de HClO4 al 60% (Sigma), y se centrifugaron a 9.500g durante 10min a 4°C. De los sobrenadantes, 0,01mL, se dispensaron en dos placas negras de 96 pocillos (Nunc, Denmark), cada una para valorar una forma de glutatión. Para determinar los niveles de GSSG, se añadieron a cada pocillo 0,01mL de N-etilmaleimida (NEM, 0,04M) (Sigma) para prevenir la interferencia del GSH y se incubó en oscuridad a temperatura ambiente durante 30min. Después se adicionaron 0,184mL de NaOH (0,1N), pH 12,5 y 0,02mL de OPT (1mg/mL en metanol), y se incubó durante 15min en las misma condiciones anteriormente citadas. Por último, se determinó la fluorescencia emitida por cada pocillo a 350nm de excitación y 420nm de emisión. El contenido de proteína de las muestras se determinó mediante el método del ácido bicincronínico (Sigma). Para la medida del contenido de GSH, se añadieron 0,190mL de tampón fosfato con EDTA y 0,02mL de OPT a los 0,01mL del sobrenadante dispensado en los pocillos de la placa. Esta se incubó en oscuridad a temperatura ambiente durante 15min, y la fluorescencia emitida por cada pocillo se midió a 350nm de excitación y 420nm de emisión. El cociente GSSG/GSH se expresó como el contenido de GSSG (pg/mg proteína) dividido entre el contenido de GSH (pg/mg proteína).
Análisis estadísticoLos datos se han expresado como la media±desviación estándar de los valores de cada grupo. El programa estadístico usado fue SPSS versión 21.0 (Chicago. IL, EE. UU.). La normalidad de las muestras fue valorada mediante el test de Kolmorov-Smirnov. Posteriormente, la homogeneidad de las muestras se evaluó mediante el test de Levene. Por último, las medias se compararon mediante el test t de Student de variables independientes. El nivel de significación mínimo fue p<0,05.
ResultadosParámetros inmunológicosLos resultados de las funciones estudiadas se muestran en la figura 1.
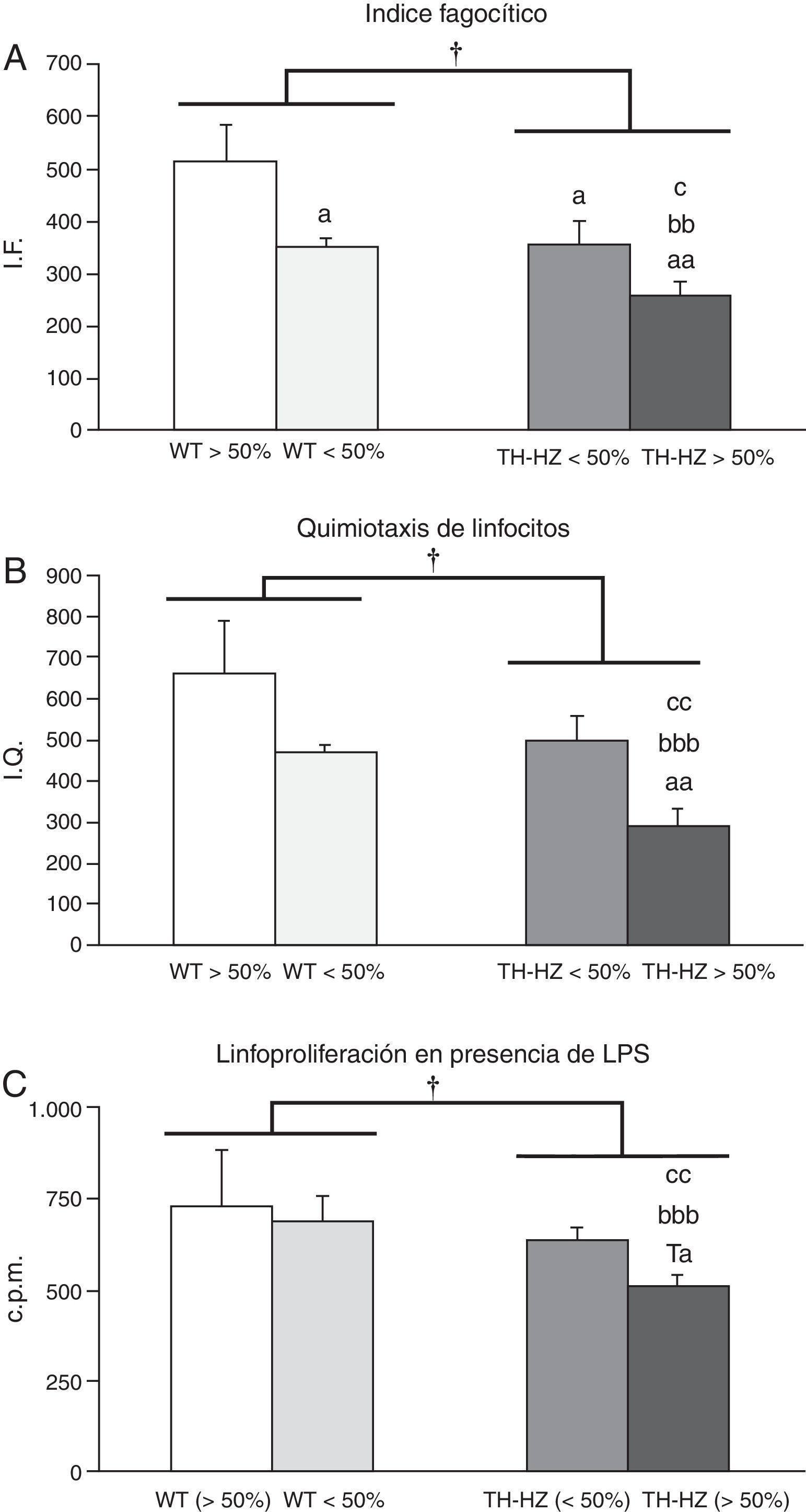
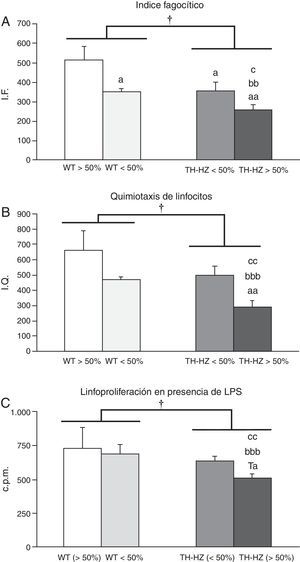
Funciones inmunitarias de los leucocitos peritoneales de ratones silvestres (WT) y con haploinsuficiencia para la enzima tirosina hidroxilasa (TH-HZ), clasificados según la proporción de cada genotipo en la jaula: WT>50% (la proporción de controles fue superior al 50% respecto a los TH-HZ), WT<50% (la proporción de WT fue menor al 50%), TH-HZ<50% (la proporción de TH-HZ fue menor al 50% respecto a los WT) y TH-HZ>50% (la proporción de TH-HZ fue mayor al 50%). Cada columna representa la media±desviación estándar de 5 valores correspondientes a ese número de animales. A) Capacidad fagocítica de macrófagos peritoneales representada por el índice fagocítico (IF), siendo este el número de bolas de látex ingeridas/100 macrófagos. B) Capacidad quimiotáctica de linfocitos peritoneales representada por el índice de quimiotaxis (IQ). C) Capacidad proliferativa de los linfocitos peritoneales en presencia de LPS, representada por las cuentas por millón (cpm). † p<0,05, con respecto a los animales WT; a p<0,05, aa p<0,05, con respecto a los animales WT>50%; bb p<0,01, bbb p<0,001, con respecto a los animales WT<50%; c p<0,05, cc p<0,01, con respecto a los animales TH-HZ<50%. Ta p=0,057 con respecto a los animales WT>50%.
Los IF de los macrófagos (fig. 1 A) de ratones TH-HZ (TH-HZ>50%+TH-HZ<50%), fueron significativamente menores (p<0,05) que los de los animales WT (WT-HZ>50%+WT<50%). El análisis del IF por subgrupos mostró que estas diferencias eran más dramáticas en los animales del subgrupo TH-HZ>50%, los cuales mostraron los menores niveles IF respecto al resto de los subgrupos (WT>50%, p<0,01; WT<50%, p<0,01; TH-HZ<50%, p<0,05). Por el contrario los animales del subgrupo WT>50% presentaron los niveles más altos de IF. Fue interesante comprobar que los animales de los subgrupos TH-HZ<50% y WT<50% tuvieron valores intermedios de IF y similares entre sí, pero significativamente diferentes a los de los subgrupos TH-HZ>50% (p<0,05) y WT>50% (p<0,05) (fig. 1 A).
Capacidad quimiotáctica de linfocitosLa capacidad de quimiotaxis de los linfocitos de los animales TH-HZ, fue significativamente menor (p<0,05) que la de los animales WT (fig. 1 B). Al tener en cuenta los subgrupos, los TH-HZ>50% mostraron los niveles más bajos de IQ con respecto al resto de los subgrupos (WT>50%, p<0,01; WT<50%, p<0,001; TH-HZ<50%, p<0,01). Por el contrario, los subgrupos TH-HZ<50% y WT<50% mostraron valores de IQ semejantes entre sí y no significativamente diferentes a los del subgrupo WT>50%, aunque con tendencia a ser menores (fig. 1 B).
Respuesta proliferativa de los linfocitos en respuesta al mitógeno lipopolisacáridoLa respuesta proliferativa de los linfocitos a la estimulación con LPS (fig. 1 C) fue significativamente menor (p<0,05) en los animales TH-HZ que en los animales WT. Estas diferencias fueron debidas al subgrupo TH-HZ>50%, el cual mostró la menor respuesta proliferativa con respecto al resto de los subgrupos (WT>50%, p=0,057; WT<50%, p<0,01; TH-HZ<50%, p<0,01). Sin embargo, el subgrupo TH-HZ<50% presentó valores de proliferación similares a los de los subgrupos WT<50% y WT>50%.
Parámetros de estrés oxidativoLos resultados de estos parámetros se muestran en la figura 2.
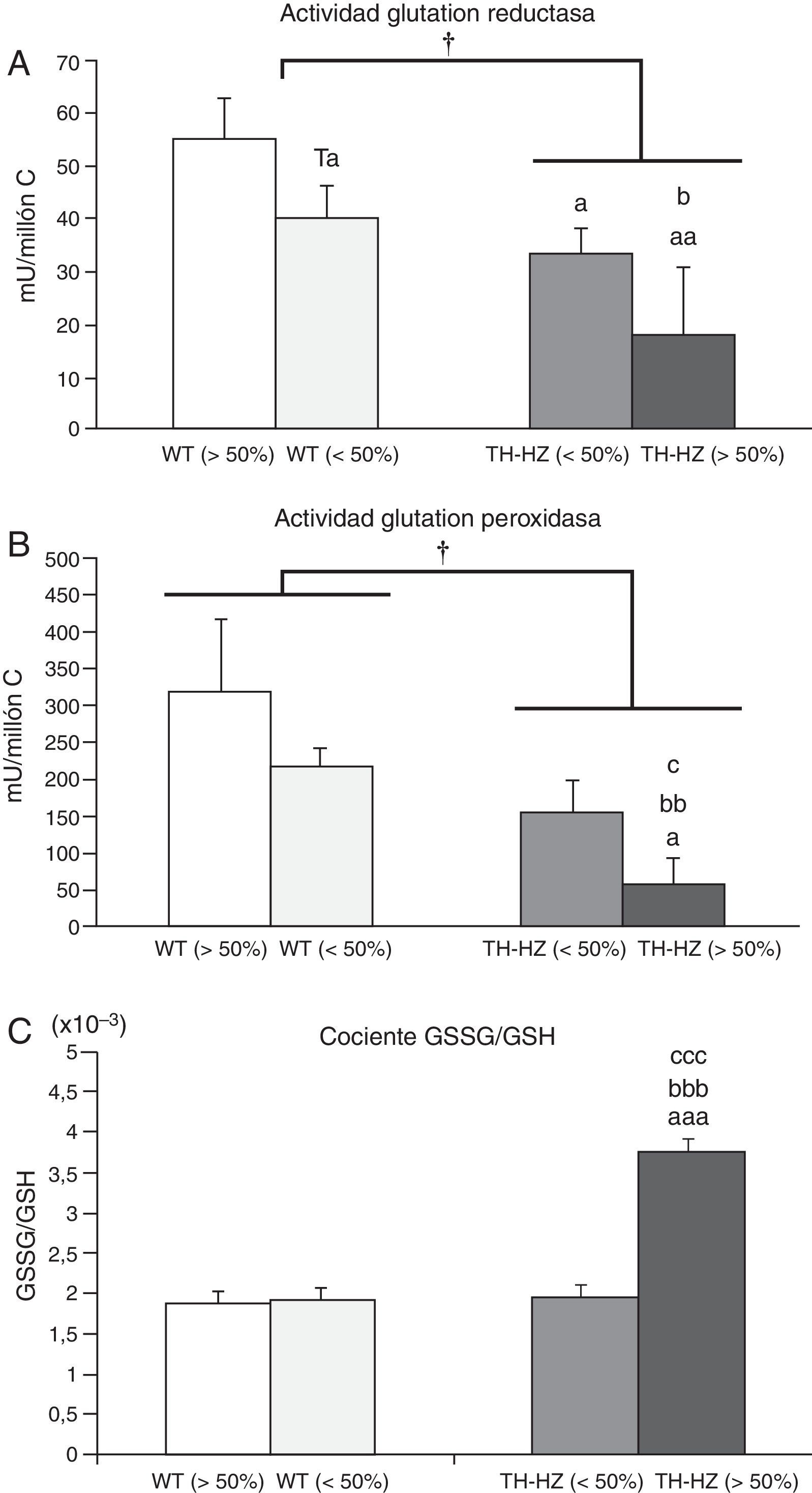
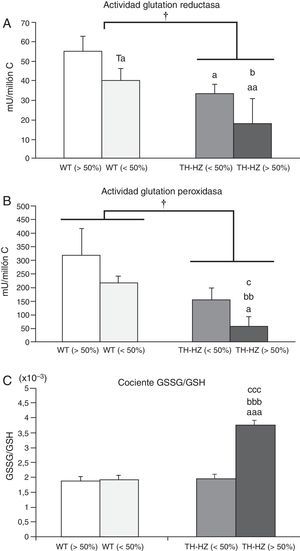
Parámetros de estrés oxidativo de los leucocitos peritoneales de ratones control (WT) y con una haploinsuficiencia para la enzima tirosina hidroxilasa (TH-HZ), clasificados según la proporción de animales en la jaula: WT>50% (la proporción de controles fue superior al 50%), WT<50% (la proporción de WT fue menor al 50% respecto a los TH-HZ), TH-HZ<50% (la proporción de TH-HZ fue menor al 50% respecto a los WT) y TH-HZ>50% (la proporción de TH-HZ fue mayor al 50%). Cada columna representa la media±desviación estándar de 5 valores correspondientes a ese mismo número de animales. A) Actividad glutatión reductasa representada en miliunidades/millón de células leucocitarias (mU/millón C). B) Actividad glutatión peroxidasa representada en miliunidades/millón de células leucocitarias (mU/millón C). C) Cociente glutatión oxidado (GSSG)/glutatión reducido (GSH). † p<0,05 con respecto a los animales WT; a p<0,05, aa p<0,05, aaa p<0,001, con respecto a los animales WT>50%; b p<0,05, bb p<0,01, bbb p<0,001, con respecto a los animales WT<50%; c p<0,05, ccc p<0,001, con respecto a los animales TH-HZ<50%. Ta p=0,055, con respecto a los animales WT>50%.
La actividad de la enzima GR (fig. 2 A) de los leucocitos de los animales TH-HZ fue menor que la de los WT (p<0,05). Estas diferencias se hicieron más marcadas al comparar el subgrupo TH-HZ>50% respeto a los subgrupos WT>50% (p<0,01) y WT<50% (p<0,05). Los subgrupos TH-HZ<50% y WT<50% mostraron valores de actividad similares entre sí, pero significativamente menores que los del subgrupo WT>50% (p=0,055; p<0,05, respectivamente).
Actividad glutatión peroxidasaEn cuanto a la actividad de la enzima glutatión peroxidasa (fig. 2 B), los ratones TH-HZ tuvieron menor actividad que los animales WT (p<0,05). Además, estas diferencias fueron más notables en el subgrupo TH-HZ>50% respecto al resto de los subgrupos (WT>50%, p<0,05; WT<50%, p<0,01; TH-HZ<50%, p<0,05). Los niveles de actividad de los subgrupos TH-HZ<50% y WT<50% no fueron significativamente diferentes a los del subgrupo WT<50%, aunque presentaban tendencia a estar disminuidos.
Cociente glutatión oxidado/glutatión reducidoLos resultados obtenidos del cociente GSSG/GSH están representados en la figura 2.C. No se observaron diferencias significativas entre los animales TH-HZ y los animales WT. Sin embargo, al tener en cuenta los cuatro subgrupos, los TH-HZ>50% mostraron un aumento significativo del cociente con respecto al resto de los subgrupos (WT>50%, p<0,001; WT<50%, p<0,001; TH-HZ<50%, p<0,001). Mientras que el subgrupo el TH-HZ<50% presentó valores del cociente GSSG/GSH similares a los de los subgrupos WT<50% y WT>50%.
DiscusiónAunque se han llevado a cabo algunos estudios sobre los efectos que pueden tener las alteraciones en la síntesis de CA en el sistema inmunitario4,5, el presente trabajo es el primero en abordar el efecto de una haploinsuficiencia de la enzima tirosina hidroxilasa, enzima limitante de la síntesis de CA, sobre varios parámetros de función y estado redox de las células inmunitarias.
Al envejecer se producen una serie de cambios en los sistemas fisiológicos, fundamentalmente en los homeostáticos, que conllevan la reestructuración de los mismos. En el caso del sistema inmunitario esta reestructuración se denomina inmunosenescencia9, la cual se caracteriza por un deterioro de la funcionalidad inmunitaria. Si bien son los linfocitos T y las funciones que llevan a cabo en el marco de la inmunidad adquirida los parámetros que parecen disminuir de forma más evidente al avanzar la edad9, también, la respuesta innata, con actividades como la capacidad fagocítica o la de migración hacia un foco infeccioso (quimiotaxis) se ven disminuidas7, aunque hay más controversia al respecto. Además, el estado de estrés oxidativo, el cual ha sido propuesto como base del proceso de envejecimiento28, y que parece subyacer en la inmunosenescencia7, aumenta con el paso del tiempo. Así, al envejecer se produce una disminución de las defensas antioxidantes y un aumento de los compuestos oxidantes, generándose un estrés oxidativo crónico. Precisamente en la teoría de la oxidación-inflamación del envejecimiento se ha propuesto que el sistema inmunitario, dado su necesidad de producir oxidantes para llevar a cabo sus funciones, podría, al avanzar la edad, y si está mal regulado, aumentar su estado de estrés oxidativo y consecuentemente el del organismo, pudiendo de este modo acelerar la velocidad de envejecimiento del mismo, aumentando, consecuentemente, la morbimortalidad7. De hecho, animales con una inmunosenescencia prematura, observada en parámetros funcionales similares a los analizados en el presente trabajo, y que se acompaña de un estrés oxidativo en sus células inmunitarias, tienen una menor esperanza de vida7,12,13.
Los leucocitos de los ratones TH-HZ, tanto en la fagocitosis y la quimiotaxis, como en la proliferación de los linfocitos en respuesta a LPS, mostraron valores significativamente menores que los correspondientes a los de los WT. Un deterioro de la función inmunitaria ha sido también encontrada por otros autores en animales con una depleción central, tanto física como química, de catecolaminas29,30. En modelos de ratones con inmunosenescencia prematura y una menor esperanza de vida, se ha observado unos resultados similares en esas funciones cuando se comparan con los correspondientes controles de su misma edad7,12,31. También, al comprobar el estado de estrés oxidativo de las células inmunitarias de los ratones TH-HZ, se observó que enzimas antioxidantes como la glutatión reductasa y la glutatión peroxidasa, ambas pertenecientes al ciclo del glutatión, presentaban una menor actividad en comparación con la mostrada por las células de los controles WT. El cociente GSSG/GSH, un indicador del estrés oxidativo32, aunque no mostró diferencias significativas entre ambos grupos experimentales, sí apareció muy elevado en las células del subgrupo TH-HZ>50%. Estos resultados están indicando una situación de mayor oxidación en los leucocitos de los TH-HZ, lo cual ha sido también observado en las células inmunitarias peritoneales de ratones con inmunosenescencia prematura33,34, así como en animales deplecionados de neuronas dopaminérgicas nigroestriatales mediante la inoculación con 6-OHDA35. Todo ello parece demostrar que una deficiencia de la enzima tirosina hidroxilasa genera una inmunosenescencia prematura.
El análisis de los resultados obtenidos en el presente trabajo teniendo en cuenta el ambiente en el que convive cada subgrupo experimental, esto es, la proporción de ratones que existe en cada jaula atendiendo a su genotipo, muestra que el ambiente modula la función y estado redox del sistema inmunitario. Así, se observó que los ratones TH-HZ criados en un ambiente con dominancia del genotipo TH-HZ presentaban el fenotipo de inmunosenescencia más extremo. Por el contrario, ratones con el mismo fondo genético, TH-HZ, pero criados en un ambiente con dominancia del genotipo WT presentaban función inmunológica y estrés oxidativo similares a los de los animales WT que convivían con mayor proporción de TH-HZ (WT<50%). Incluso, algunos de los parámetros analizados eran similares a los del subgrupo WT>50% cuyo sistema inmunitario presenta el mejor estado funcional en todos los parámetros evaluados, tanto inmunológicos como de estrés oxidativo. Es evidente que las diferencias encontradas entre TH-HZ y WT se deben principalmente al subgrupo TH-HZ>50%. Este hecho parece indicar que el ambiente en el que conviven los animales podría estar condicionando el diferente nivel de inmunosenescencia que muestran los ratones TH-HZ>50% y TH-HZ<50% generada por la haploinsuficiencia de Th, lo que apoyaría la relación que ya ha sido propuesta por algunos autores como Seeman y Crimmins entre el ambiente y el envejecimiento15.
Entre los posibles mecanismos que pueden subyacer a este efecto se podría encontrar diferencias en la respuesta comportamental debido a la deficiencia de la Th, mostrando ciertas facetas de conducta social alterada, como ocurre en animales con deficiencia en dopamina36, o la liberación de pistas odoríferas por parte de los animales TH, como ocurre en los experimentos de Parlemo-Neto et al.18. Aún así, lo más probable es que sea un sumatorio de diferentes mecanismos, entre los que posiblemente se encuentren los sugeridos anteriormente.
Aunque previamente se ha demostrado que ratones de la cepa C57/BL6 con una haploinsuficiencia de Th no muestran alteración en los niveles de CA37 en la cepa ICR-CD1 sí se han detectado (resultados en hembras en vías de publicación). Teniendo en cuenta que la plasticidad transcripcional del gen de la Th depende del tipo de cepa38, lo que genera una diferente expresión del gen39, es posible entender las diferencias en los niveles de CA en los ratones de esas dos cepas.
En conclusión, los ratones macho con haploinsuficiencia del gen Th, al tener alterada la síntesis de CA y posiblemente sus niveles en el organismo, presentarían una inmunosenescencia prematura, la cual podría verse modulada por el ambiente social en el que conviven dichos animales. Este mayor efecto del ambiente que de la alteración genética en la capacidad funcional de las células inmunitarias, es un aspecto que debe ser objeto de investigaciones más extensas. Dado el comprobado papel que tienen los parámetros funcionales estudiados como marcadores de salud, de velocidad de envejecimiento y predictores de longevidad7, los resultados obtenidos sugieren que mejorar el ambiente social podría ser una excelente estrategia para ralentizar la inmunosenescencia y consecuentemente la velocidad de envejecimiento de cada individuo, consiguiendo así una longevidad más saludable.
FinanciaciónEste estudio ha sido financiado por las subvenciones del Ministerio español de Ciencia e Innovación (MINECO) (BFU2011-30336); Fondo de Investigaciones Sanitarias del Instituto de Salud Carlos III (PI15/01787); Red Temática de Investigación Cooperativa en Envejecimiento y Fragilidad (RETICEF) (RD 12/0043/0018) del ISCIII-FEDER de la Unión Europea; Centro de Investigación Biomédica en Red de Diabetes y Enfermedades Metabólicas Asociadas (CIBERDEM) del ISCIII-FEDER de la Unión Europea, y Grupo de investigación UCM (GR3/14-910379).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.