En la enfermedad del Alzheimer (EA) se ha comprobado que existe un deterioro en la comunicación neuroinmunoendocrina. Sin embargo, apenas hay estudios a un nivel periférico en esta enfermedad neurodegenerativa, en concreto en lo que respecta a la función inmunitaria. Dado que recientemente se ha establecido que ciertos parámetros de función inmunitaria son marcadores de la velocidad de envejecimiento y pueden predecir la longevidad, el propósito del presente trabajo fue valorar algunas de esas funciones en leucocitos esplénicos de ratones transgénicos para la EA de diversas edades.
Material y métodosSe emplearon ratones triple-transgénicos para la EA (3xTgAD) hembras, así como sus controles no transgénicos (NTg) jóvenes (4±1 meses), adultos (9±1 meses) y maduros (12±1 meses). Se valoraron la quimiotaxis, la actividad citotóxica de las «natural killer» (NK) y la respuesta linfoproliferativa en presencia de los mitógenos concanavalina A y lipopolisacárido en leucocitos esplénicos, funciones que disminuyen al envejecer. Además, se realizó una curva de supervivencia en otro grupo de animales 3xTgAD y NTg.
ResultadosEn los 3xTgAD, con respecto a los NTg, la quimiotaxis se encuentra disminuida en todas las edades, mientras que dicha disminución se observa a los 4 y 9 meses en la linfoproliferación y solo en los jóvenes en el caso de la actividad NK. Los 3xTgAD mostraron una menor supervivencia que los NTg.
ConclusionesLos ratones 3xTgAD presentan una inmunosenescencia prematura, lo que podría explicar su temprana mortalidad. La valoración a nivel periférico de las funciones inmunológicas estudiadas podría ser un indicador del desarrollo de la enfermedad de Alzheimer.
A deterioration of the neuroimmunoendocrine network has been observed in Alzheimer's disease (AD). However, the peripheral immune response has hardly been investigated in this pathology. Since some immune function parameters have been established as good markers of the rate of ageing, and can predict longevity, the aim of the present work was to study some of these functions in splenic leucocytes in transgenic mice for AD of different ages.
Material and methodsYoung female (4±1 months), adult (9±1 months), and mature (12±1 months) triple-transgenic mice for AD (3xTgAD) and non-transgenic (NTg) control mice of the same ages were used. The chemotaxis, the anti-tumour activity of «natural killer» (NK) cells and the lymphoproliferative response in the presence of the mitogens concanavalin A and lipopolysaccharide, functions that decrease with age, were determined in splenic leucocytes. In addition, the differences in lifespan between 3xTgAD and NTg were studied in parallel using other animals, until their death through natural causes.
ResultsIn 3xTgAD, with respect to NTg, chemotaxis decreased at all ages studied, whereas in lymphoproliferative response this reduction was shown at 4 months and 9 months. NK activity was diminished only in young 3xTgAD with respect to NTg. The 3xTgAD showed a shorter lifespan than the NTg control group.
ConclusionsThe 3xTgAD mice show a premature immunosenescence, which could explain their early mortality. The determination of these immune functions at peripheral level could serve as a marker of the progression of the Alzheimer's disease.
La enfermedad del Alzheimer (EA), una de las enfermedades neurodegenerativas más comunes asociadas al envejecimiento, es un trastorno progresivo y dependiente de la edad, por lo que su prevalencia en los últimos años está aumentando dramáticamente en paralelo con el aumento de la esperanza de vida y el envejecimiento de la población. Actualmente, más de 26 millones de personas en todo el mundo presentan EA y se calcula que este número se cuadruplicará para el año 20501, a menos que se encuentre un tratamiento o una cura efectiva.
Durante las últimas 2 décadas ha supuesto un gran reto reproducir la enfermedad neuronal y la sintomatología comportamental de la EA en modelos animales2. Los avances en técnicas genéticas y en la identificación de los genes implicados en el Alzheimer familiar han hecho posible el desarrollo de una serie de modelos transgénicos3, sobre todo en ratones, con el objetivo de reproducir en ellos una o 2 características neuropatológicas principales de la EA: las placas betaamiloides (Aβ) y los ovillos neurofibrilares. Así, el modelo murino triple transgénico para la EA (3xTgAD), que alberga los transgenes APPSwe y tauP301L en un mutante knock-in para PS1M146V, representa el primer y único modelo que mimetiza ambas manifestaciones neuropatológicas del cerebro humano con la EA4,5. En este modelo de ratones 3xTgAD, dichas manifestaciones aparecen y se establecen de manera dependiente a la edad: a los 2,5 meses comenzaría la alteración de la homeostasis neuronal; la inmunorreactividad frente a las placas Aβ intracelulares se aprecian a los 3-4 meses y a los 6 meses se encuentran ya los primeros depósitos extracelulares; la alteración de la proteína tau comenzaría a los 12 meses, edad en la que la afección Aβ está bien instaurada; y finalmente a los 15 meses se observan los ovillos neurofibrilares2,4. Además, en este modelo se desarrolla, también de manera dependiente de la edad, una serie de características típicas de la EA, como la gliosis reactiva, la disfunción sináptica y el déficit en el sistema colinérgico, en el aprendizaje y la memoria, así como alteraciones del comportamiento asociadas a demencia4,6-9.
En la EA, al igual que ocurre con el envejecimiento, se ha comprobado que existe un deterioro en los sistemas fisiológicos reguladores, el nervioso y el inmunitario, y en la comunicación que existe entre ambos, la cual resulta necesaria para una adecuada homeostasis del organismo10,11. En esta afección, así como en las enfermedades neurodegenerativas asociadas al envejecimiento, son numerosos los estudios que abordan el papel del sistema inmunitario en el sistema nervioso central (SNC)12,13, donde se observa un aumento de mediadores inflamatorios y de oxidación asociados a la presencia de las placas Aβ y los ovillos neurofibrilares14,15, así como una sobreactivación de la inmunidad innata frente a ellos16,17. Este hecho facilita la lisis neuronal18 y el consecuente empeoramiento de la afección13,16,19. No obstante, hay que tener en cuenta que la estrecha comunicación existente entre el sistema nervioso y el inmunitario se establece tanto a nivel del SNC como periférico20,21, pero muy pocos estudios se han llevado a cabo en esta enfermedad a nivel periférico.
Dado que en los últimos años se ha demostrado que ciertos parámetros de función inmunitaria pueden ser marcadores de la velocidad de envejecimiento de cada sujeto y predecir la longevidad de los mismos22-28, se llevó a cabo un estudio preliminar de esos parámetros inmunitarios a nivel periférico, en concreto en el bazo, en ratones triple-transgénicos para la EA de 15 meses, es decir, cuando la enfermedad está bien instaurada29. Las alteraciones encontradas en dichos parámetros indican la necesidad de profundizar en estos estudios a nivel periférico para encontrar y acreditar marcadores que puedan reflejar la progresión de la enfermedad. Por todo ello, el propósito del presente trabajo fue valorar algunas de esas funciones inmunológicas en leucocitos esplénicos de ratones transgénicos para la EA (3xTgAD) en diversas edades desde la edad adulta hasta la madurez, es decir, desde la aparición hasta el desarrollo de la EA.
Material y métodosAnimales de experimentaciónSe emplearon ratones (129/C57BL6) triple-transgénicos para la EA (3xTgAD) hembras, así como sus controles no transgénicos (NTg) de las siguientes edades: jóvenes (4±1 meses; n=10), adultos (9±1 meses; n=8) y maduros (12±1 meses; n=10). Además, se utilizaron otros 2 grupos de ratones, 3xTgAD (n=10) y NTg (n=12), para analizar la supervivencia de los animales y, por tanto, su longevidad, y los cuales fueron mantenidos en condiciones estándar de alimentación, con comida y agua ad libitum, a una temperatura de 22±2°C y fotoperiodo invertido. Todos los ratones fueron manipulados según las directrices del Consejo de la Unión Europea (86/609/EEC) y de la Comisión Ética de la Universidad Autónoma de Barcelona (CEEAH/00759).
Separación de leucocitos esplénicosTras la obtención de los bazos de manera aséptica, se homogeneizaron en un tampón fosfato salino (PBS) estéril y se centrifugaron en un gradiente de Ficoll-Hypaque (Sigma-Aldrich, St. Louis, EE. UU.), con una densidad de 1,070g/ml. El halo de leucocitos mononucleares, principalmente linfocitos, fue extraído con la ayuda de una pipeta Pasteur estéril y lavado con PBS. Posteriormente, se determinó el número de linfocitos presentes en cada muestra y se ajustaron a 106 células/ml en medio RPMI 1640 enriquecido con L-glutamina (PAA, Piscataway, EE. UU.) para el análisis de la capacidad de quimiotaxis y de la actividad de las células NK, y en medio completo —RPMI 1640 enriquecido con L-glutamina y suplementado con suero fetal bovino (10%, Gibco, Burlington, Canadá) y gentamicina (10mg/ml, Gibco)— para el estudio de la proliferación. Previamente a cada experimento, se comprobó la viabilidad celular mediante el test de exclusión del azul-tripán (Sigma-Aldrich), siendo en todos los casos mayor del 98%. Todas las incubaciones se realizaron a 37°C en humedad saturante con CO2 al 5%.
QuimiotaxisLa capacidad de movilidad inducida (quimiotaxis) de los leucocitos esplénicos se evaluó utilizando la técnica desarrollada por Boyden30, con algunas modificaciones31. Se analizó la capacidad de estas células en un gradiente químico generado por un péptido formilado, sustancia quimioatrayente (formyl-Met-Leu-Phe, 10−8M, Sigma-Aldrich), para desplazarse atravesando un filtro de nitrocelulosa de 3μm de diámetro de poro (Millipore Ibérica, Madrid, España). Se contabilizaron al microscopio óptico con el objetivo de inmersión (100×) el número de leucocitos observados en 4 barridos de 5mm cada uno. El valor obtenido de dicho recuento se denomina índice de quimiotaxis.
Actividad citotóxica «natural killer»La valoración de la actividad NK de los leucocitos esplénicos se basa en la capacidad de estos para destruir in vitro y de forma espontánea células tumorales; concretamente, se utilizaron como células diana las células YAC-1, procedentes de un linfoma murino. Para determinar la actividad NK de los leucocitos, se utilizó un kit comercial colorimétrico (Cytotox 96, Promega, Madison, EE. UU.), que detecta y valora la actividad de la enzima lactato deshidrogenasa liberada al sobrenadante por las células diana lisadas. El ensayo se realizó por triplicado, siguiendo la metodología descrita previamente32. Los resultados se expresan como porcentaje de lisis.
Capacidad de proliferación de los linfocitos esplénicosLa capacidad de proliferación se valoró mediante el test de transformación linfoblástica en respuesta a mitógenos, concanavalina A (ConA; Sigma-Aldrich) y lipopolisacárido (LPS; Sigma-Aldrich), siguiendo un protocolo estandarizado con anterioridad33. Este ensayo analiza in vitro la respuesta proliferativa frente a mitógenos que reproduce la que tiene lugar in vivo frente a antígenos. Su fundamento reside en la capacidad de los linfocitos maduros de transformarse, en condiciones adecuadas, en células con capacidad de división o linfoblastos. Estos sintetizan ADN, por lo que, añadiendo un precursor de la síntesis marcado (3H-timidina, Leti, Barcelona, España), el crecimiento puede cuantificarse en un contador β de centelleo líquido (LKB, Uppsala, Suecia), del que se obtuvieron las cuentas por minuto (cpm) de cada muestra. Cada ensayo se realizó por triplicado, expresándose los resultados como la media aritmética de cpm en cada triplicado.
Análisis estadísticoEl análisis estadístico de los resultados obtenidos se realizó mediante el paquete estadístico SPSS 15.0. Los resultados se expresan como la media aritmética±error medio estándar de los datos obtenidos en cada una de las diferentes mediciones realizadas por duplicado o triplicado. Para el análisis de los resultados se procedió a la determinación de la normalidad y la homocedasticidad de los datos mediante el test de Kolmogorov-Smirnov y el test de Levene, respectivamente. Todos los grupos experimentales se ajustaron a una distribución normal, por lo que se realizó la prueba de la t de Student. Se estableció un valor de p<0,05 para considerar significativas las diferencias obtenidas. Para el estudio de la longevidad de los animales, se empleó el test de Kaplan-Meier, usando el mismo nivel de significación (p<0,05).
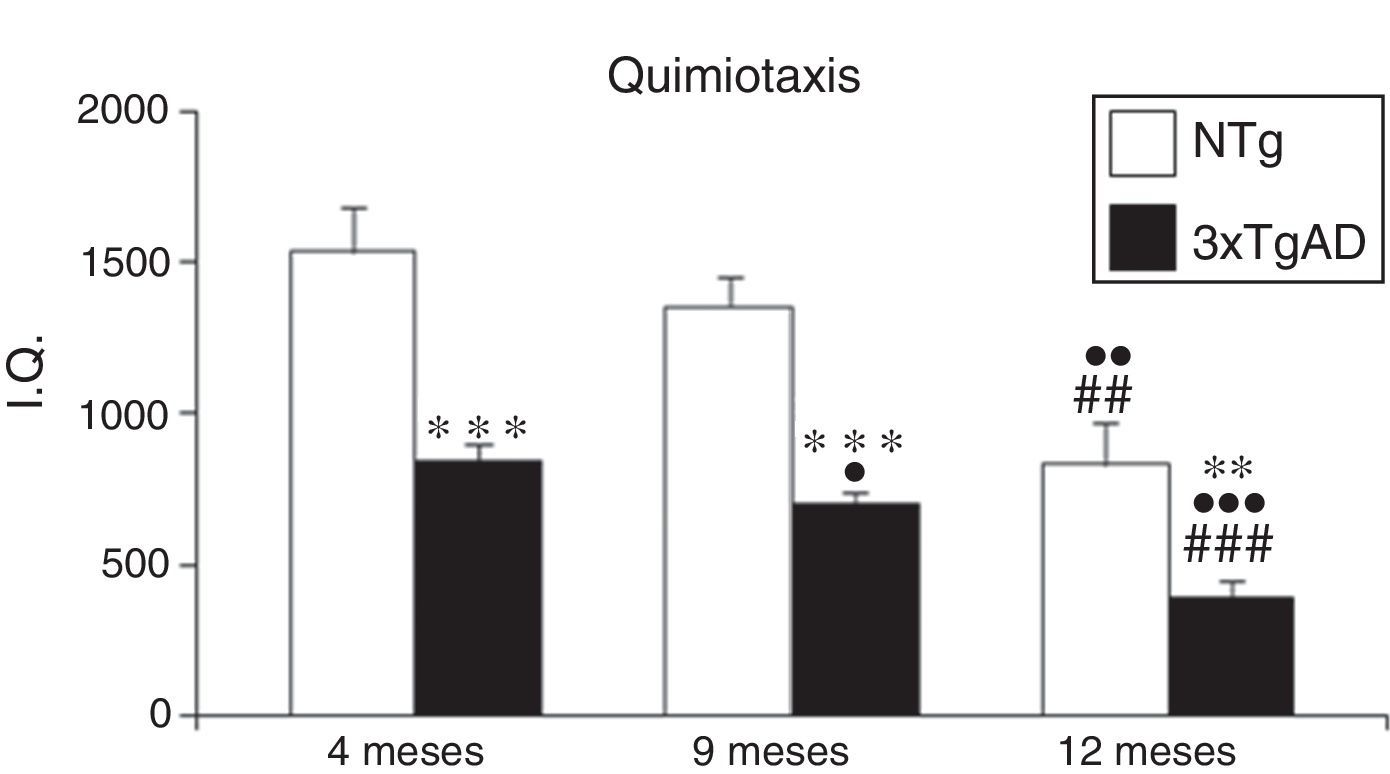
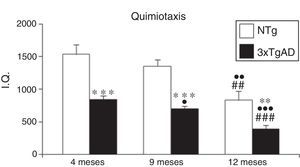
ResultadosLos resultados correspondientes a los índices de quimiotaxis (fig. 1) muestran en los controles NTg una disminución de esta función a los 12 meses (p<0,01) en relación con los jóvenes de 4 meses y a los adultos de 9 meses. Sin embargo, en los 3xTgAD esa disminución se observa a los 9 meses (p<0,05) y a los 12 meses (p<0,001) respecto a los de 4 meses. Comparando los valores obtenidos en los ratones transgénicos respecto a los NTg, los primeros presentan unos índices de quimiotaxis menores en todas las edades (p<0,001 en jóvenes y adultos; p<0,01 en maduros).
Índice de quimiotaxis (IQ) de leucocitos esplénicos a los 4 (jóvenes), 9 (adultos) y 12 meses (maduros) en ratones triple transgénicos para la EA (3xTgAD) y su respectivo control no transgénico (NTg). Cada columna representa la media±EMS de los valores analizados en duplicado (n=10, jóvenes y maduros; n=8, adultos).
**p<0,01 con respecto a los correspondientes valores en NTg.
***p<0,001 con respecto a los correspondientes valores en NTg.
¿p<0,05 con respecto a los correspondientes valores en 4 meses.
¿¿p<0,01 con respecto a los correspondientes valores en 4 meses.
¿¿¿p<0,001 con respecto a los correspondientes valores en 4 meses.
##p<0,01 con respecto a los correspondientes valores en 9 meses.
###p<0,001 con respecto a los correspondientes valores en 9 meses.
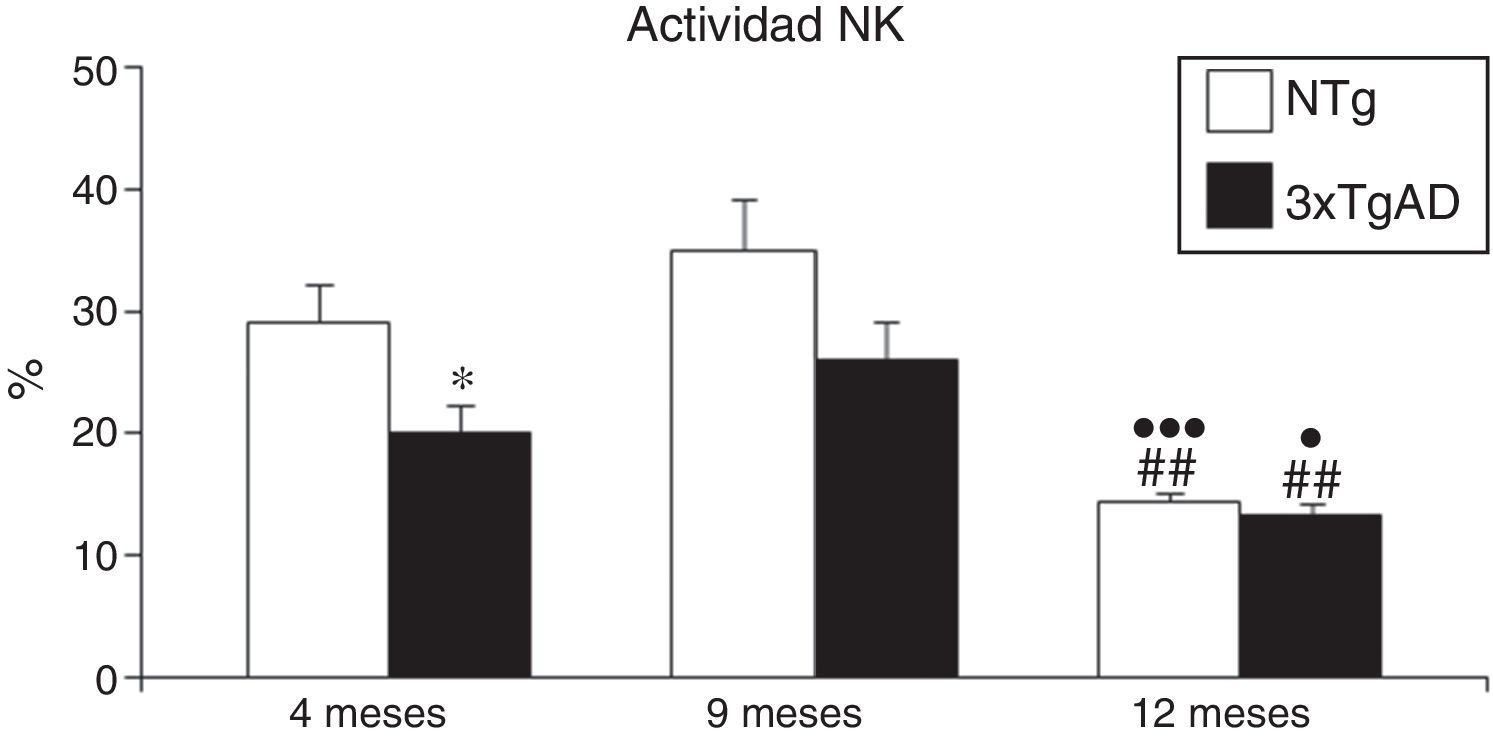
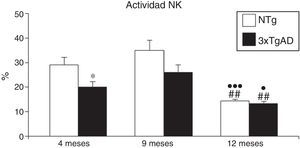
En cuanto a la actividad citotóxica NK (fig. 2), los controles NTg manifiestan una disminución de dicha actividad desde los 9 a los 12 meses (p<0,01), hecho que también ocurre en los 3xTgAD. A los 4 meses, los 3xTgAD ya presentan una actividad significativamente menor que los NTg (p<0,05), la cual desaparece en las otras edades.
Actividad natural killer (NK) expresada en porcentaje de lisis de leucocitos esplénicos a los 4 (jóvenes), 9 (adultos) y 12 meses (maduros) en ratones triple transgénicos para la EA (3xTgAD) y su respectivo control no transgénico (NTg). Cada columna representa la media±EMS de los valores analizados en triplicado (n=10, jóvenes y maduros; n=8, adultos).
*p<0,05 con respecto a los correspondientes valores en NTg.
¿p<0,05 con respecto a los correspondientes valores en 4 meses.
¿¿¿p<0,001 con respecto a los correspondientes valores en 4 meses.
##p<0,01 con respecto a los correspondientes valores en 9 meses.
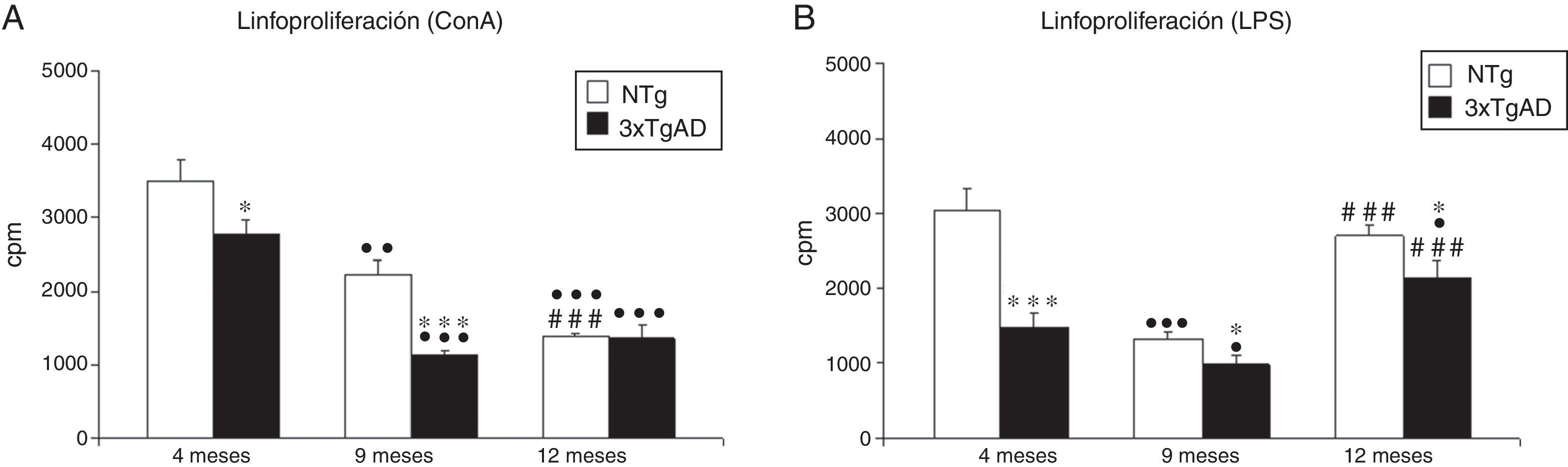
La respuesta linfoproliferativa en respuesta al mitógeno ConA (fig. 3A), específica de los linfocitos T, disminuye con la edad en los controles NTg (p<0,01: 9 meses vs. 4 meses; p<0,001: 12 meses vs. 9 meses). En los 3xTgAD, esa disminución se aprecia a los 9 meses (p<0,001) con respecto a los 4 meses, y se mantiene a los 12 meses. Si comparamos los 3xTgAD con los controles, la proliferación es menor en los 3xTgAD a 4 (p<0,05) y 9 meses (p<0,001), mientras que a los 12 meses no se observan diferencias.
Respuesta linfoproliferativa (cuentas por minuto, cpm) en respuesta a concanavalina A (ConA; A) y lipopolisacárido (LPS; B) de leucocitos esplénicos a los 4 (jóvenes), 9 (adultos) y 12 meses (maduros) en ratones triple-transgénicos para la EA (3xTgAD) y su respectivo control no transgénico (NTg). Cada columna representa la media±EMS de los valores analizados en triplicado (n=10, jóvenes y maduros; n=8, adultos).
*p<0,05 con respecto a los correspondientes valores en NTg.
***p<0,001 con respecto a los correspondientes valores en NTg.
¿p<0,05 con respecto a los correspondientes valores en 4 meses.
¿¿p<0,01 con respecto a los correspondientes valores en 4 meses.
¿¿¿p<0,001 con respecto a los correspondientes valores en 4 meses.
###p<0,001 con respecto a los correspondientes valores en 9 meses.
En lo que respecta a la respuesta linfoproliferativa frente al LPS (fig. 3B), mitógeno específico de los linfocitos B, los controles muestran una disminución de los 4 a los 9 meses (p<0,001), aunque se observa un aumento a los 12 meses. Los 3xTgAD presentan una evolución similar, pero comparándolos con los controles siempre muestran valores menores (p<0,001 en 4 meses; p<0,05 en 9 y 12 meses).
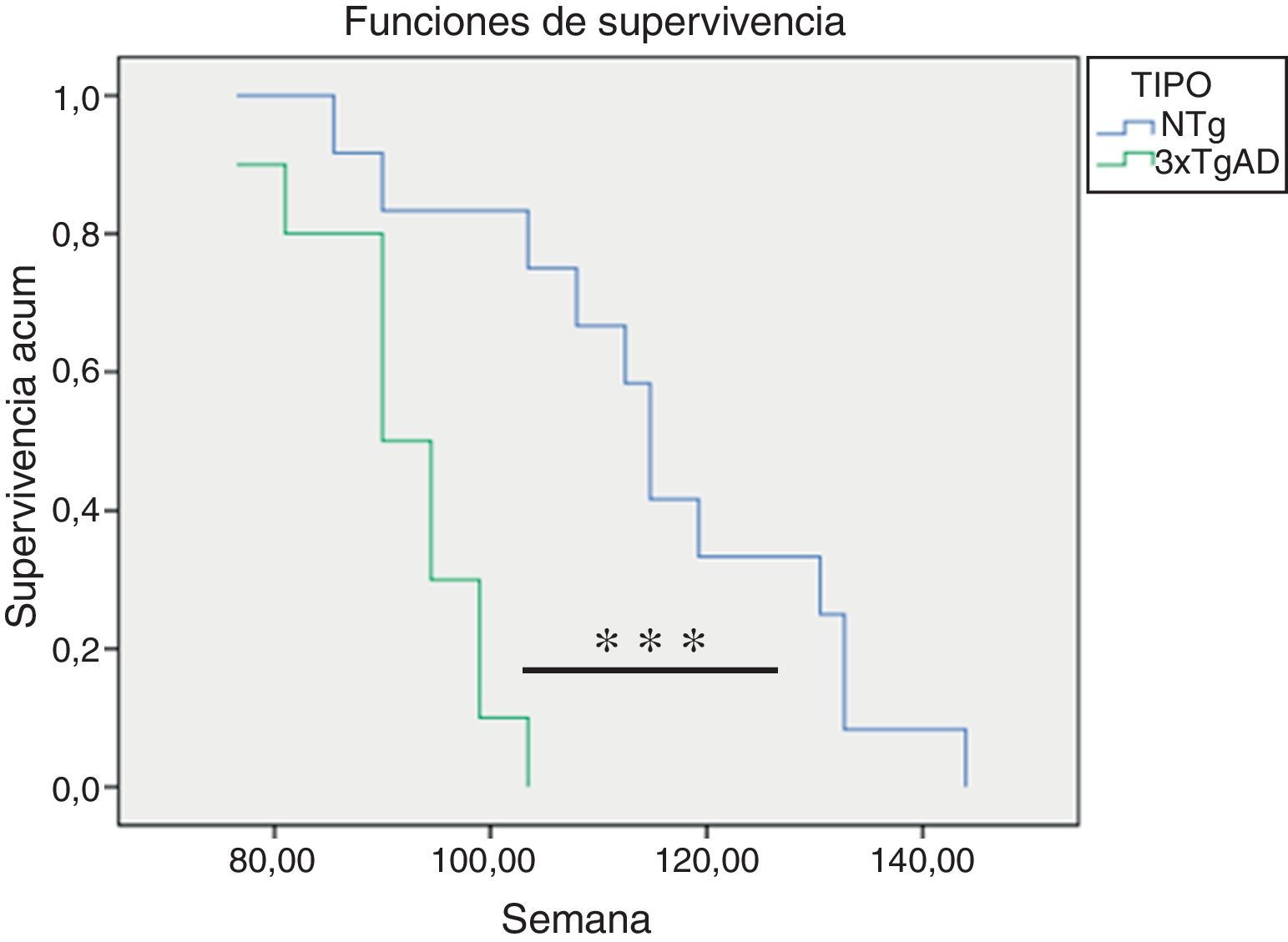
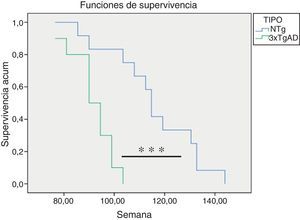
Como se observa en la figura 4, los ratones 3xTgAD vivieron significativamente menos (p<0,001) que los NTg.
DiscusiónEl presente trabajo muestra cómo en los ratones 3xTgAD aparece un declive temprano de algunas funciones inmunológicas durante el desarrollo de la enfermedad. Esta inmunosenescencia prematura podría reflejar el deterioro temprano de la comunicación neuroinmunológica en los 3xTgAD y ser causa importante de su menor supervivencia.
Las 2 funciones estudiadas que forman parte de la respuesta inmunitaria innata, como lo son la capacidad de movilidad de las células inmunitarias hacia un foco infeccioso (quimiotaxis) y la actividad citotóxica antitumoral de las células NK, disminuyen progresivamente con el envejecimiento, como ha sido comprobado en toda una serie de estudios. Esta menor capacidad funcional al envejecer se ha observado en leucocitos de diversas localizaciones, como el bazo, el timo, los nódulos axilares y el peritoneo de distintas cepas de ratón26,34 y en rata35, así como en leucocitos de sangre periférica humana22,36. En la cepa de ratones empleada en este estudio, 129/C57BL6, la cual no había sido previamente estudiada en este sentido, las 2 funciones que se están considerando también disminuyen al avanzar la edad de los animales NTg. Sin embargo, cuando comparamos los ratones 3xTgAD con los controles NTg, los primeros muestran una disminución de la quimiotaxis ya en la edad joven (4 meses), diferencia que se mantiene a lo largo de las otras edades estudiadas. Aunque los datos previamente publicados por nuestro grupo muestran un aumento de la quimiotaxis en los 3xTgAD a los 15 meses29, esto podría deberse a un mecanismo fisiológico de compensación frente a la completa instauración de la afección de la proteína tau (que comienza a los 12 meses), que a los 15 se encuentra totalmente instaurada en estos animales transgénicos. Por otro lado, los ratones 3xTgAD muestran una disminución temprana de la actividad citotóxica de las células NK a los 4 meses, tendencia que se mantiene a los 9 meses; mientras que a los 12 meses tanto los controles NTg como los 3xTgAD poseen unos niveles similares de actividad NK, siendo muy bajo en ambos, posiblemente debido al envejecimiento fisiológico per se que ya se manifiesta en los controles NTg a esa edad.
En cuanto a las alteraciones que aparecen con el envejecimiento en la inmunidad adquirida, los linfocitos T han sido los más ampliamente estudiados y se consideran los más afectados en la inmunosenescencia37,38. Está demostrado que la respuesta proliferativa de estos linfocitos procedentes de sangre periférica36, así como de diversos órganos de roedores25,26,35,39, disminuye con la edad. El presente trabajo muestra que en los ratones controles NTg se cumple este hecho en la respuesta linfoproliferativa al estímulo con ConA. En los ratones 3xTgAD aparece, no obstante, una disminución acelerada de esta respuesta proliferativa, con unos niveles mínimos ya a los 9 meses. A su vez, la respuesta proliferativa de los linfocitos B, medida mediante la utilización del mitógeno LPS, y que se ha observado disminuye con la edad, tanto en humanos40 como en ratones26,41, aparece también disminuida en los animales de nuestro estudio, pero dicha disminución se revierte a los 12 meses, tanto en los ratones controles NTg como en los 3xTgAD. Sin embargo, cabe destacar que en todas las edades estudiadas, los ratones 3xTgAD muestran una menor respuesta linfoproliferativa al LPS en relación con los controles NTg.
Todos estos resultados sobre los cambios con la edad en las funciones inmunitarias estudiadas demuestran que los ratones 3xTgAD se encuentran más envejecidos que sus respectivos controles NTg de igual edad cronológica. Además, el estudio de la supervivencia indica que los ratones 3xTgAD viven significativamente menos que sus respectivos controles NTg. Este hecho vuelve a confirmar que un deterioro temprano en la funcionalidad de las células inmunológicas se relaciona con una menor longevidad22,25. En este aspecto, autores como de la Rosa et al.42 han comprobado que niveles bajos de la actividad citotóxica de las células NK en el anciano son un buen predictor de mortalidad. También estudios longitudinales en personas mayores han demostrado que una baja respuesta linfoproliferativa en respuesta a antígenos o mitógenos se correlaciona con una menor supervivencia43, hecho que se ha comprobado en ratones22. Por el contrario, individuos que llegan a edades avanzadas en buenas condiciones de salud son aquellos que han podido mantener sus células inmunitarias con una capacidad funcional semejante a la de los adultos23,26,41. Todo ello hace destacar que el sistema inmunológico es un buen indicador de morbimortalidad, por lo que su valoración a nivel periférico podría servir como marcador de velocidad de envejecimiento, esto es, de edad biológica de cada individuo22,24.
Además, estas alteraciones inmunológicas podrían estar mostrando el deterioro temprano de la comunicación entre el sistema nervioso y el inmunitario20,44. Así, la valoración de la función inmunitaria podría servir como marcador periférico de la progresión de una enfermedad originada en el SNC como lo es la EA. Es esta una sugerencia importante en la EA, con escasos marcadores diagnósticos periféricos, siendo este un campo científico de enorme interés para futuras investigaciones.
FinanciaciónEste estudio ha sido financiado por subvenciones BFU2011-30336 del Ministerio español de Ciencia e Innovación; 910379ENEROINN del Grupo de Investigación de la UCM; RD06/0013/1004; RD06/0013/1004; RD12/0043/0018 (RETICEF) del ISCIII-FEDER de la Unión Europea. El trabajo también fue apoyado por una beca de formación de personal investigador del Gobierno Vasco concedida a Ianire Mate Otaño (BFI09-52).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosEste trabajo ha recibido el premio «Pañella Casas» 2012 a la mejor comunicación en forma oral del Área Biológica presentada durante el 54.° Congreso Nacional de la Sociedad Española de Geriatría y Gerontología, celebrado en Santiago de Compostela, del 6 al 8 de junio del 2012.