INTRODUCCIÓN
¿Cuáles son los componentes estructurales y los mecanismos fisiológicos que determinan el proceso de envejecimiento? ¿Por qué los humanos podemos alcanzar los 122 años y una rata, en el mejor de los casos, sólo llegar a los 4? La fase posreproductiva de la vida de virtualmente todas las especies multicelulares se caracteriza por la pérdida progresiva de eficiencia de las funciones fisiológicas máximas. En consecuencia, la capacidad para mantener la homeostasis se encuentra atenuada, lo que conlleva, además de un incremento del riesgo de desarrollar cancer y enfermedades cardiovasculares y neurodegenerativas, a la muerte del individuo. La idea de que las especies moleculares reactivas derivadas del oxígeno (reactive oxygen species [ROS]), y especialmente las de origen mitocondrial1-3, están causalmente relacionadas con el proceso básico de envejecimiento representa, hoy por hoy, la teoría con una mayor capacidad explicativa y predictiva de dicho proceso fisiológico4-6. Las evidencias experimentales que nutren esta teoría proceden de varios paradigmas: a) estudios comparativos entre especies animales que difieren en su longevidad máxima y, consecuentemente, en sus tasas de envejecimiento; b) los cambios asociados a la edad que tienen lugar en un individuo durante el envejecimiento, y c) las manipulaciones experimentales, como por ejemplo la restricción calórica y las alteraciones genéticas que modifican la longevidad de una especie dada.
La lesión oxidativa de proteínas se ha propuesto como uno de los mecanismos básicos que enlazan los ROS con el proceso básico de envejecimiento7-9, entendiendo por lesión una modificación química, no enzimática e irreversible. Así, un estado oxidativo elevado debería contribuir a una aceleración de la lesión molecular que conllevaría a una acumulación de la misma con la edad y, en definitiva, al deterioro estructural y funcional del sistema. La lesión oxidativa de proteínas puede ser consecuencia de su exposición directa a especies radicales reactivas (como los ROS)10; o bien puede proceder de reacciones con compuestos carbonílicos reactivos derivados de la oxidación de aminoácidos, hidratos de carbono o ácidos grasos poliinsaturados, dando lugar a la formación de productos de gluco y lipoxidación avanzada, respectivamente, también conocido globalmente como reacción de Maillard o reacción carbonilo-amino11.
A pesar de que hay evidencias que sugieren la existencia de una acumulación de la lesión oxidativa de proteínas con la edad, dicha conclusión no es inequívoca dada la limitación de datos que utilizan marcadores químicos específicos. Por ello, con el objeto de examinar las características moleculares relacionadas con la lesión oxidativa, hemos utilizado métodos de cromatografía de gases/espectrometría de masas para definir el estado basal de lesíon oxidativa proteínica. En el presente estudio, hemos detectado y cuantificado marcadores de diferentes tipos de lesión en las proteínas del hígado y el corazón de ratas macho de animales adultos (8 meses) y de edad avanzada (30 meses). Dichos marcadores caracterizan diversos tipos de lesión: semialdehído glutámico (SAG) y semialdehído aminoadípico (SAAA), como indicadores de oxidación sensu stricto; Nε-carboxietil-lisina (CEL), como marcador de glucoxidación; Nε-carboximetil-lisina (CML) como marcador mixto de reacciones de gluco y lipoxidación, y Nε-malondialdehido-lisina (MDAL) como indicador de lipoxidación. También se ha determinado el perfíl en ácidos grasos de los lípidos de membrana con el objeto de calcular el índice de insaturación de éstas, ya que puede modular los niveles de lesión proteínica y la longevidad. De hecho, se ha sugerido que el grado de insaturación de las membranas celulares desempeña un papel clave en el envejecimiento, ya que modula la lesión oxidativa y lipoxidativa de las macromoléculas12. Así, un elevado grado de insaturación de membrana está asociado con un nivel basal de lesión lipoxidativa también elevado12,13 y el grado de insaturación correlaciona negativamente con la longevidad máxima de una especie14.
MATERIAL Y MÉTODO
Reactivos
Los reactivos procedían de Sigma-Aldrich (St. Louis, MO, Estados Unidos) si no se indica especificamente otra procedencia. [2H8] lisina fue adquirida de CDN Isotopes (CDN Isotopes Inc., Canadá). CML y [2H4]-CML, CEL y [2H4]-CEL, y MDAL y [2H8]-MDAL se prepararon según métodos descritos previamente15-17, al igual que SAG y [2H5]-SAG, y SAAA y [2H4]-SAAA18.
Animales de experimentación
Se utilizaron ratas Sprague-Dawley macho de 8 y 30 meses de edad, que correspondían al grupo adulto joven y viejo, respectivamente. Los animales fueron adquiridos a la edad de 3 meses, alimentados ad libitum y mantenidos a 22 ± 2 °C bajo un régimen controlado de luz: oscuridad (12:12), una humedad relativa del 55 ± 10% y siguiendo las directrices del comité de ética y experimentación animal. Los animales fueron sacrificados por decapitación, y se les extrajo el hígado y el corazón. Se procedió inmediatamente a obtener una porción de ambos órganos, del lóbulo hepático derecho y las cavidades ventriculares, de todos los animales utilizados en el experimento, y se congelaron inmediatamente a 80 ºC. Todas las muestras se obtuvieron post mortem en un tiempo inferior a los 3 min.
Preparación de las muestras
Las muestras tanto de hígado como de corazón fueron sumergidas y lavadas inmediatamente en tampón de homogeneización a 4 °C (10 mM Hepes, 1 μM BHT [2,6-di-tert-butil-4-metilfenol], 1 mM DETAPAC [ácido dietilenotriaminopentaacético], 1 mM ácido fítico, 0,5 μg/ml leupeptina, 0,5 μg/ml aprotinina, 0,7 μg/ml pepstatina, 40 μg/ml PMSF [fluoruro de fenilmetanosulfonio] y 1,1 mM EDTA, ajustado a un pH 7,4). Este primer paso se siguió de la homogeneización en 25 ml de tampón de homogeneización/g de tejido con un sistema tipo Potter-Elvehjem (Glas-Col, Terre Haute, IN). El homogenado fue posteriormente centrifugado a 750 x g durante 5 min a 4 °C para eliminar los restos tisulares. Una alicuota de los sobrenadantes se separó y se utilizó para los diferentes análisis. La concentración de proteína fue determinada mediante el método de Bradford19 utilizando los reactivos de BioRad (BioRad, Munich, Alemania) y albúmina bovina sérica como estándar. Los homogenados se congelaron inmediatamente a 80 °C para posteriores análisis.
Determinación de SAG, SAAA, CML, CEL y MDAL por cromatografía de gases acoplado a espectrometría de masas
La concentración de SAG, SAAA, CML, CEL y MDAL se determinó en las fracciones de homogenado crudo por cromatografía de gases acoplada a espectrometría de masas como se ha descrito previamente20. Brevemente, las muestras, con un contenido total de 500 μg de proteína, fueron delipidadas utilizando cloroformo:metanol (2:1 v/v) en presencia de 0,01% de hidroxitolueno butilado, y las proteínas se precipitaron mediante la adición de ácido tricloroacético a una concentración final del 10% (v/v), seguido de centrifugación. Las proteínas precipitadas fueron inmediatamente reducidas durante toda la noche mediante la adición de 1 ml de una disolución de 500 mM de NaBH4 en 0,2 M tampón borato, pH 9,2, añadiendo una gota de hexanol como agente antiespumoso. Se procedió de nuevo a la precipitación de las proteínas, se añadieron los estándares internos marcados isotópicamente ([2H8]-lisina, [2H4]-CML, [2H4]-CEL, [2H8]-MDAL, [2H5]-SAG, y [2H4]-SAAA) y se procedió a la hidrólisis de las proteínas mediante la adición de 1 ml de 6 M HCl e incubación a 155 °C durante 30 min; posteriormente se procedió al secado de las muestras in vacuo. Los derivados N,O-trifluoroacetil metil éster del hidrolizado de proteínas se llevó a cabo como se ha descrito previamente15. El análisis se llevó a cabo en un cromatógrafo de gases Hewlett-Packard modelo 6890 equipado con una columna capilar HP-5MS (30 m x 0,25 mm x 0,25 μm) acoplado a un detector de espectrometría de masas Hewlett-Packard modelo 5973A. El puerto de inyección se mantuvo a 275 °C; el programa de temperatura fue de 5 min a 110 °C; después, 2 °C/min hasta 150 °C; 5 °C/min hasta 240 °C; 25 °C/min hasta 300 °C, y una meseta final a 300 °C durante 5 min. La cuantificación se realizó mediante la estandarización externa utilizando curvas de estándares construidas a partir de la mezcla de estándares deuterados y no deuterados. La detección y la cuantificación de los diferentes analitos se llevó a cabo mediante la monitorización selectiva de iones específicos. Los iones utilizados fueron: lisina y [2H8]-lisina, m/z 180 y 187, respectivamente; SAG y [2H5]-SAG, m/z 280 y 285, respectivamente; SAAA y [2H4]-SAAA, m/z 294 y 298, respectivamente; CML y [2H4]-CML, m/z 392 y 396, respectivamente; CEL y [2H4]-CEL, m/z 379 y 383, respectivamente, y MDAL y [2H8]-MDAL, m/z 474 y 482, respectivamente. Las concentraciones de los diferentes compuestos se expresaron como el cociente μmol SAG, SAAA, CML, CEL o MDAL/mol lisina.
Análisis de ácidos grasos por cromatografía de gases acoplada a espectrometría de masas
Para el análisis de los ácidos grasos, se procedió a la extracción de los lípidos totales del homogenado con cloroformo:metanol (2:1, v/v) en presencia de un 0,01% (p/v) de BHT12. Brevemente, se extrajo la fase de cloroformo y se evaporó en un flujo de nitrógeno, y los ácidos grasos fueron transesterificados mediante su incubación con 2,5 ml al 5% (v/v) de HCl metanólico a 75 °C durante 90 min. Los ésteres metílicos de ácidos grasos resultantes fueron extraídos mediante la adición de 1 ml de una disolución saturada de NaCl y 2,5 ml de n-pentano. La fase de n-pentano se separó y se evaporó con nitrógeno. El residuo se disolvió en 75 μl de hexano y se utilizó 1 μl para el análisis. La separación de los diferentes ésteres metílicos de ácidos grasos se efectuó con una columna capilar SP2330 (30 m x 0,25 mm x 0,20 μm) en un cromatógrafo de gases Hewlett Packard 6890 Series II. Como detector se utilizó un espectrómetro de masas Hewlett Packard 5973A en el modo de impacto electrónico. El puerto de inyección se mantuvo a 220 °C, y el detector a 250 °C; el programa de temperatura fue de 2 min a 100 °C; después, 10 °C/min hasta 200 °C; 5 °C/min hasta 240 °C, y una meseta final a 240 °C durante 10 min. La identificación de los ésteres metílicos de ácidos grasos se efectuó previamente mediante la comparación con estándares auténticos y según los espectros de masas. Los resultados se expresan como mol %.
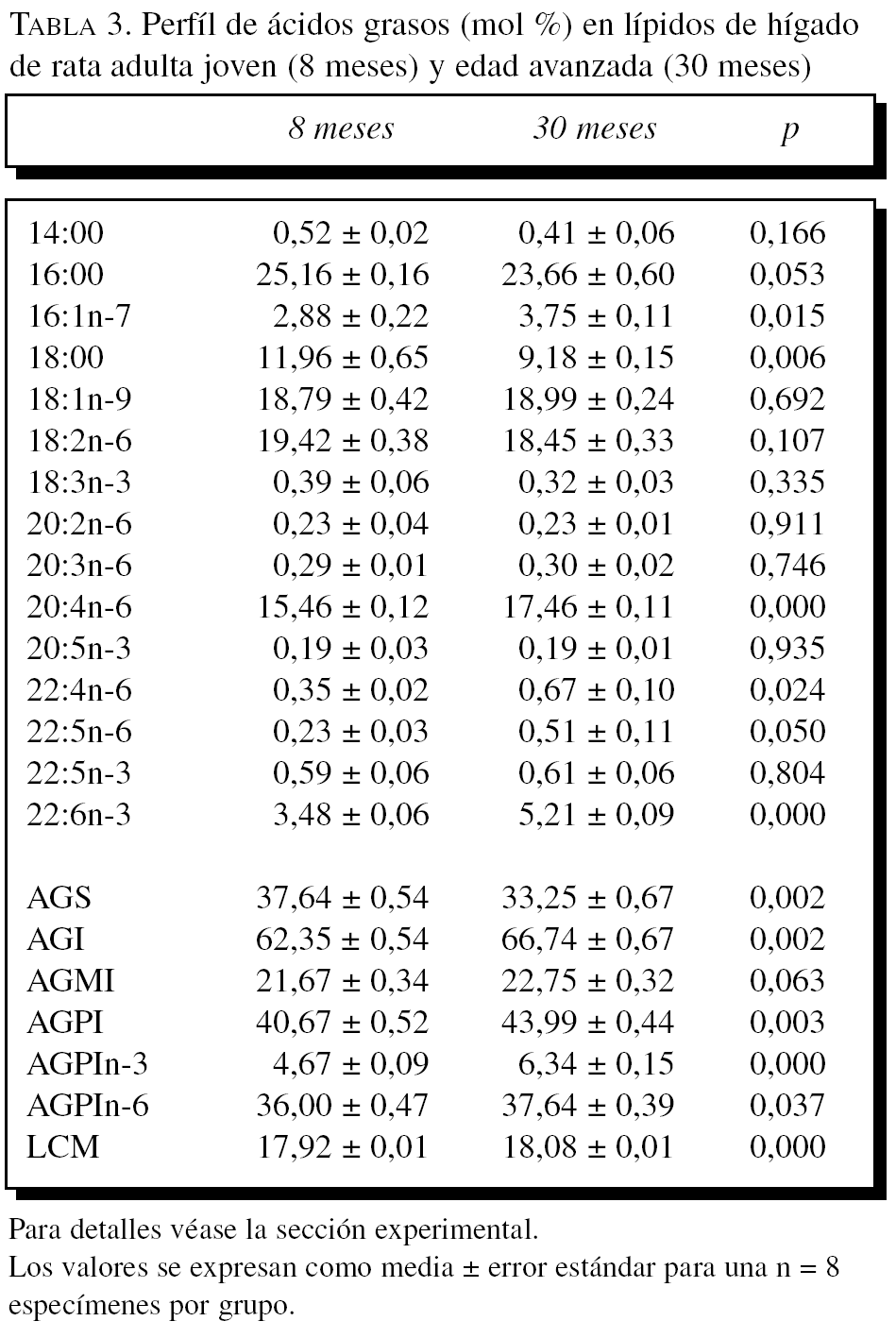
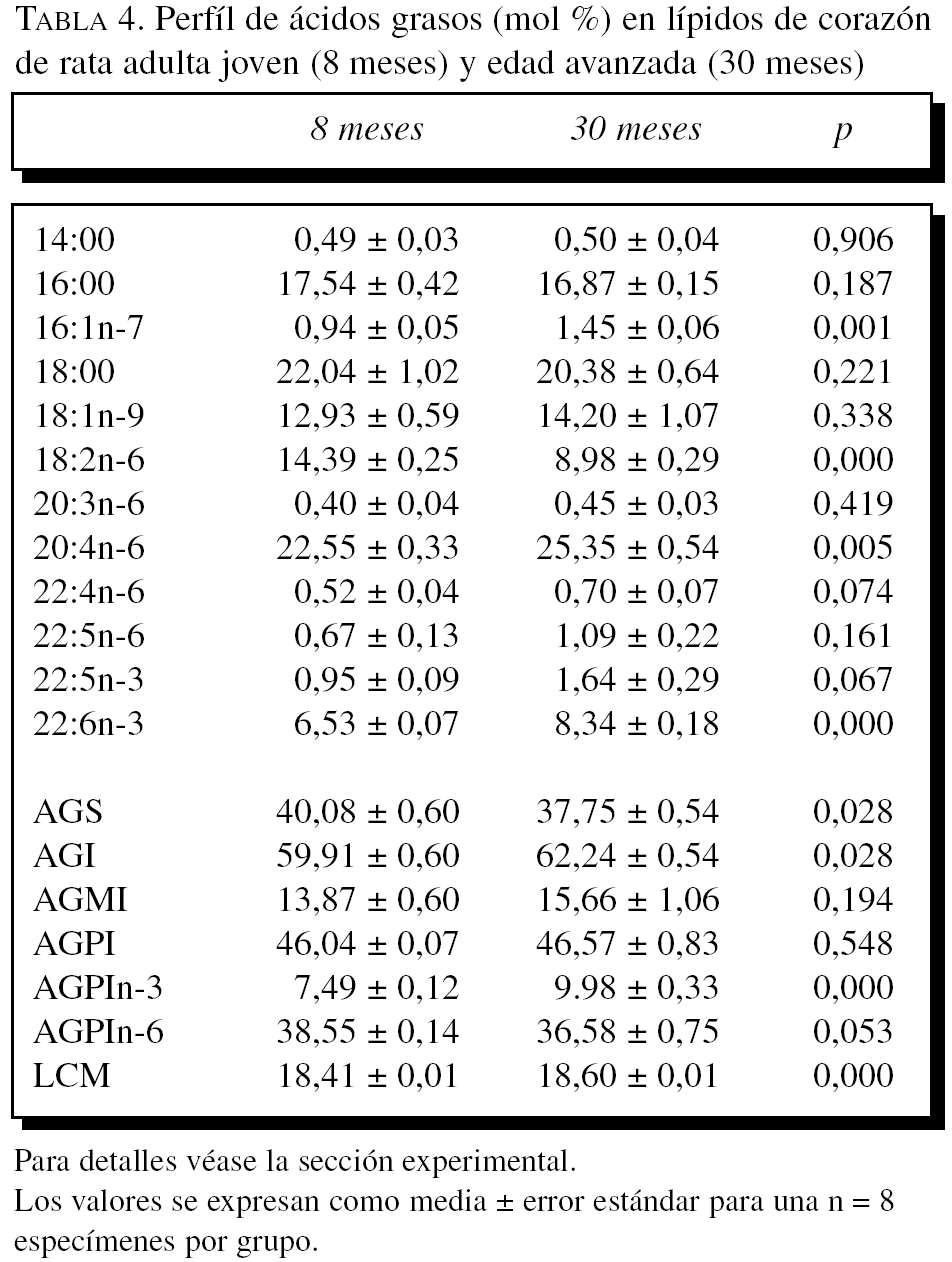
A partir de la composición en ácidos grasos, se procedió al cálculo de los siguientes índices: porcentaje total ácidos grasos saturados (AGS); porcentaje total ácidos grasos insaturados (AGI); porcentaje total ácidos grasos monoinsaturados (AGMI); porcentaje total de ácidos grasos poliinsaturados de las series n-3 y n-6 (AGPI n-3 y n-6); longitud media de cadena (LMC) = [(Σ%Total14 x 14) + (Σ%Total16 x 16) + (Σ%Total18 x 18) + (Σ%Total20 x 20) + (Σ%Total22 x 22)]/100; índice de dobles enlaces (IDE) = [(Σmol% monoenoicos) + (2 x Σmol% dienoicos) + (3 x Σmol% trienoicos) + (4 x Σmol% tetraenoicos) + (5 x Σmol% pentaenoicos) + (6 x Σmol% hexaenoicos)], e índice de peroxidabilidad (IP) = [(0,025 x Σmol% monoenoicos) + (Σmol% dienoicos) + (2 x Σmol% trienoicos) + (4 x Σmol% tetraenoicos) + (6 x Σmol% pentaenoicos) + (8 x Σmol% hexaenoicos)].
Análisis estadístico
Para las diferentes comparaciones se utilizó como prueba estadística la t de Student, que se aplicó una vez la normalidad de la distribución de las variables fue confirmada mediante el estadístico de one-sample Kolmogorov-Smirnov, utilizando el programa SPSS-PC (SPSS, Chicago, IL). En todos los casos se utilizó un valor de p < 0,05 como criterio de significación estadística.
RESULTADOS
Concentraciones basales de los diferentes marcadores de lesión proteínica
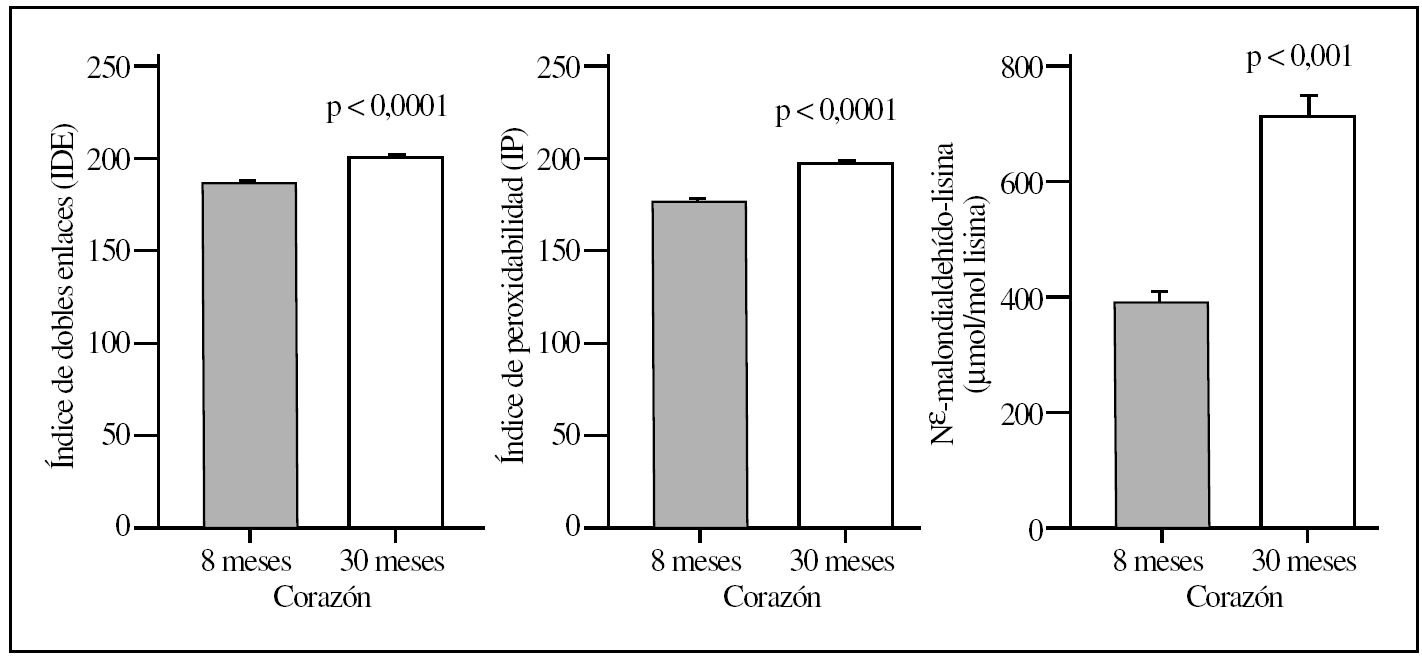
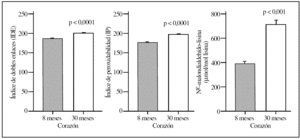
La comparación del hígado y corazón de ratas adultas jóvenes y viejas reveló que el proceso de envejecimiento estaba asociado con diferencias relevantes en los valores basales de los diversos marcadores de lesión proteínica. Así, los 5 marcadores utilizados mostraron valores significativamente elevados (del orden de un 120-150%) tanto en el hígado como en el corazón en el grupo de ratas viejas comparados con el grupo de animales adultos jóvenes (tablas 1 y 2; figs. 1 y 2). No obstante, los mayores incrementos siempre se observaron en corazón y en la concentración de MDAL.
Figura 1.Parámetros del grado de insaturación de membrana (índice de dobles enlaces e índice de peroxidabilidad) y de lesión lipoxidativa a proteínas (MDAL) en el hígado de ratas adultas jovenes (8 meses) comparado con ratas viejas (30 meses). Se muestran las medias ± error estándar de la media de 8 individuos por grupo.
Figura 2.Parámetros del grado de insaturación de membrana (índice de dobles enlaces e índice de peroxidabilidad) y de lesión lipoxidativa a proteínas (MDAL) en corazón de ratas adultas jovenes (8 meses) comparado con ratas viejas (30 meses). Se muestran las medias ± error estándar de la media (EEM) de 8 individuos por grupo.
En términos de comparación interórgano, los marcadores de oxidación proteínica SAG y SAAA, el marcador de lipoxidación MDAL, y el marcador mixto de gluco y lipoxidación CML, todos ellos mostraron valores significativamente más elevados en corazón que en el hígado, independientemente del grupo de edad (tablas 1 y 2; figs. 1 y 2). Por el contrario, CEL mostró unos valores más elevados en hígado que en corazón.
Insaturación de membrana y perfil de ácidos grasos
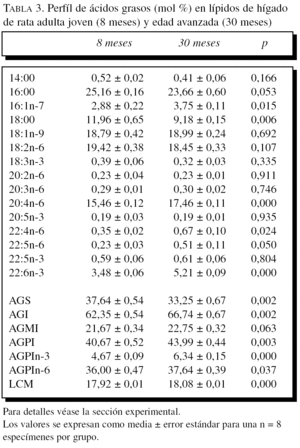
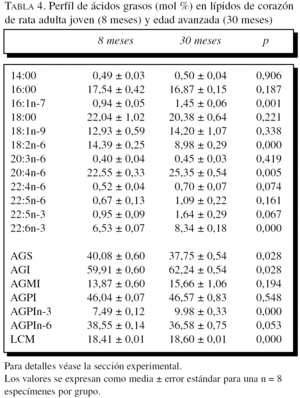
La composición en ácidos grasos de membrana de los dos órganos estudiados, independientemente de la edad, mostró que sus membranas biológicas mantienen un promedio de longitud de cadena similar (18 átomos de carbono), siendo la proporción global de ácidos grasos saturados e insaturados similar (el 40 frente al 60%, respectivamente). Con la edad se observó, tanto en el hígado como en el corazón, un aumento significativo en el número de dobles enlaces y el índice de peroxidabilidad, asociándose dichos cambios a una redistribución del tipo de ácidos grasos en términos de incrementos especialmente significativo en la proporción de AGPI n-3 (tablas 3 y 4).
DISCUSIÓN
Los ROS de origen mitocondrial pueden contribuir de forma significativa a la lesión de macromoléculas intra y extracelulares; esta producción de ROS es un determinante crítico de la longevidad media y máxima de una especie5,6. Se sabe que los ROS pueden oxidar cualquier tipo de macromolécula, y las proteínas son una diana importante. La lesión oxidativa de las proteínas puede ser consecuencia de la exposición directa a las especies reactivas derivadas del oxígeno, así como del nitrógeno y el cloro, y generar productos de oxidación como los semialdehídos glutámico (resultante de la oxidación de prolina y arginina) y aminoadípico (resultante de la oxidación de lisina), entre muchos otros10. Las modificaciones proteínicas también pueden proceder de la reacción con compuestos carbonílicos reactivos de bajo peso molecular derivados de la oxidación de aminoácidos, hidratos de carbono o ácidos grasos poliinsaturados. Estos compuestos carbonílicos pueden reaccionar primariamente con cadenas laterales de lisina, arginina y cisteína, y conducir a la formación de compuestos denominados productos de glucación y lipoxidación avanzada (advanced glycation endproducts [AGE], y advanced lipoxidation endproducts), como CML, CEL y MDAL11.
Sin embargo, continúa siendo un problema no resuelto si la presencia y cantidad de proteínas modificadas oxidativamente desempeña un papel causal en el proceso de envejecimiento o si simplemente refleja un epifenómeno. Si la lesión oxidativa proteínica desempeña un papel mecanístico determinante en el proceso de envejecimiento debería mantenerse en los paradigmas experimentales del envejecimiento. Esto es: a) la diferente longevidad máxima que caracteriza una especie; b) los cambios que tienen lugar en un individuo durante el envejecimiento; c) las intervenciones fisiológicas/farmacológicas que modulan la velocidad de envejecimiento, como, por ejemplo, la restricción calórica, y d) la diferente longevidad de cepas y mutantes específicos para una determinada especie. El presente estudio se enmarca en el segundo paradigma, es decir, en aquellas evidencias relacionadas con cambios en el grado de lesión proteica con el envejecimiento.
Desde un punto de vista simplista, 2 rutas básicas podrían ser la causa del impacto de los ROS en el envejecimiento: a) las rutas o vías que afectan al flujo neto de ROS en el organismo o en tejidos estratégicos, y b) las vías que contribuyen a la reparación o recambio de aquellas estructuras lesionadas. Con esta premisa, si la teoría del envejecimiento basada en el estrés oxidativo es correcta, una de sus predicciones debería ser que los grados de lesión oxidativa de las macromoléculas deberían aumentar con la edad, y aún más en aquellos tejidos especialmente sensibles al proceso de envejecimiento, como los tejidos posmitóticos. Durante las últimas 4 décadas se han llevado a cabo numerosos estudios utilizando un amplio espectro de organismos (desde invertebrados a humanos) con el objeto de responder si los grados de lesión oxidativa aumentan con la edad8,9. Dado que las proteínas son un componente mayoritario en los sistemas biológicos y desempeñan un papel clave en numerosos procesos celulares, un aumento relacionado con la edad en los valores de oxidación proteínica es evidente que debería ser importante fisiológicamente para un organismo. Para evaluar esta circunstancia, diversos estudios, así como el presente trabajo, han evaluado los grados de lesión proteínica en diferentes órganos a diferentes edades.
Los niveles de modificación proteínica se han examinado en proteínas extracelulares como el colágeno, así como en proteínas intracelulares de órganos tales como el cerebro, el hígado, el corazón, el riñón y el músculo esquelético, entre otros, tanto de humanos como de roedores y otras especies animales21. A pesar de que, globalmente, las evidencias parecen indicar una acumulación con la edad de la lesión oxidativa a proteínas, esta conclusión no es inequívoca. Ello es debido, principalmente, a que la mayoría de dichas evidencias se han obtenido utilizando como marcador el contenido en carbonilos; los datos con marcadores específicos son muy limitados y adolecen de un uso sistematizado y, en algunos casos, ofrecen incluso resultados contradictorios. El problema con la determinación de carbonilos se debe a que dicha determinación representa un amplio rango de modificaciones proteínicas e incluso de otros componentes, incluyendo reacciones mediadas por radicales y reacciones no oxidativas10. Esto resulta un problema particularmente importante cuando se evalúa la lesión oxidativa a proteínas, puesto que es probable que la lesión de proteínas específicas de rutas metabólicas críticas pudiera ser crucial en términos de las consecuencias fisiológicas derivadas de un aumento de la lesión oxidativa. Por lo tanto, es evidente que se necesitan estudios más sistemáticos con marcadores específicos con el objeto de clarificar las diferencias observadas entre órganos y especies con la edad. En este contexto, nuestro estudio demuestra un aumento con el envejecimiento de marcadores específicos de modificación proteínica relacionados con diferentes modalidades de lesión química como son la lesión oxidativa directa y la modificación química secundaria a la lesión oxidativa de hidratos de carbono y ácidos grasos poliinsaturados. Las diferencias interórgano observadas en la concentración de los diferentes marcadores están relacionadas con diferencias metabólicas (p. ej., tasa de producción mitocondrial de radicales libres, concentración de sustratos glicolíticos y grado de insaturación de los ácidos grasos precursores ambos de compuestos carbonílicos, y tasas de recambio de proteínas lesionadas, entre otros factores) conducentes a diferentes estados pro-oxidativos. Esto podría explicar las diferencias al alza en las concentraciones basales de diferentes marcadores entre tejidos posmitóticos tales como corazón, cerebro o músculo esquelético, cuando se los compara con órganos como por ejemplo el hígado (posmitótico facultativo).
En resumen, nuestro estudio constata la existencia de un aumento con el envejecimiento de la lesión oxidativa a proteínas y el grado de insaturación de membrana, y que dichos cambios son más significativos en el corazón, como órgano posmitótico. Sin embargo, a pesar de que la mayoría de estudios, incluidos el presente, indican un aumento con el envejecimiento de la lesión oxidativa a proteínas, estos datos avalan, pero no demuestran, un papel clave para la lesión de proteínas en este proceso. Por tanto, es primordial potenciar investigaciones que comprueben que la modulación de la velocidad de envejecimiento y, consecuentemente, el aumento o la disminución de la longevidad, se asocian o no con una reducción o aumento de la lesión proteínica.
Correspondencia: Dr. R. Pamplona.
Departament de Ciències Mèdiques Bàsiques. Facultat de Medicina. Universitat de Lleida.
Montserrat Roig, 2. 25008 Lleida. España.
Correo electrónico: reinald.pamplona@cmb.udl.es.
Recibido el 05-07-05; aceptado el 11-07-05.
Este trabajo ha sido subvencionado parcialmente con fondos del Ministerio de Educación y Ciencia (BFI2003-01287) y la Generalitat de Catalunya (2001SGR00311) a R.P; y una ayuda del Ministerio de Sanidad (FIS, PI020891) a M.P.