INTRODUCCION
La leptina es una hormona secretada esencialmente por el adipocito1 que, a través de receptores específicos en el hipotálamo2, actúa en el control de la ingesta y, consiguientemente, la formación de tejido graso. Además, la leptina desempeña un importante papel en el control de la función ovárica3 y en el desarrollo de la pubertad femenina4. Bajo este aspecto, no parece extraño que las mujeres presenten concentraciones de leptina superiores a las de los varones, si bien la masa grasa en ellas suele ser también superior. Efectivamente, la concentración sérica de leptina depende del contenido corporal en masa grasa3, por lo que, en estudios comparativos entre personas de ambos sexos sin sobrepeso con índices de masa corporal (IMC) muy semejantes, la mencionada diferencia deje de ser significativa5.
En relación con una posible influencia de la edad en las concentraciones de leptina, estudios con ratones ob/ob han mostrado un ascenso de la leptina con la edad que es independiente del peso corporal6, pero en humanos no se ha encontrado esta relación7 o, en todo caso, parece ser inversa8. No obstante, en un estudio de nuestro grupo realizado en una población sana con IMC estrictamente normal se ha registrado una relación inversa con la edad, pero solamente en las mujeres5. No obstante, estudios de cinética indican una disminución de la tasa de producción de leptina con la edad, si bien hay claras diferencias respecto al sexo y al grado de obesidad, ya que este parámetro es superior en las mujeres y aumenta con la masa grasa, mientras que sucede lo contrario con el aclaramiento corporal de leptina9.
La leptina presenta un comportamiento estrechamente relacionado con la secreción de insulina. En general, en la obesidad se encuentran hiperleptinemia e hiperinsulinemia, pero también hay datos que abogan por su interacción. Por un lado, la insulina estimula en los adipocitos la secreción de leptina10 y, por el otro, la leptina reduce la unión de la insulina a los adipocitos11. Es más, la pérdida de la homeostasis ponderal está posiblemente relacionada con una resistencia hipotalámica a la leptina12, y de aquí la hiperleptinemia en el obeso y la paralela aparición de la resistencia insulínica. Efectivamente, el fallo en el sistema leptina-hipotálamo se encuentra íntimamente ligado con una ingesta calórica excesiva y con la consiguiente aparición de resistencia a la insulina13. Por otro lado, obesidad y resistencia a la insulina son 2 situaciones que interactúan en ambas direcciones, es decir, la primera puede preceder a la segunda, o viceversa14.
Debido a la ya conocida disposición del obeso a la aterogénesis, en especial, por la resistencia insulínica y, por tanto, al envejecimiento precoz, conviene saber cuál es el papel que corresponde aquí a la leptinemia. En este trabajo estudiamos la relación entre la leptinemia y la secreción de insulina en obesos de diferentes edades. Además, mediante seguimientos longitudinales pretendemos valorar individualmente la efectividad en el proceso de normalización de los parámetros estudiados, por un lado, de la restricción calórica y, por el otro, de la pérdida de peso.
PACIENTES Y MÉTODO
La base fundamental en el diseño de este estudio es el seguimiento durante un largo período del comportamiento de la leptinemia y de la secreción de insulina en obesos que voluntariamente participaron en este cometido. Un total de 29 personas con una marcada obesidad distribuida sobre todo en el abdomen, 10 varones y 19 mujeres de 19-63 años de edad con un IMC de 35-86, realizaron un régimen alimentario de reducción calórica de moderada intensidad, es decir, de 1.200-1.500 kcal/día. A partir de ese momento se realizan controles ambulatorios espaciados durante un período que oscila entre 0,9 y 3,4 años.
Aproximadamente cada 6 meses se determinaron el peso, la leptinemia y el péptido C eliminado con la orina durante 24 h. Además, en la primera presentación del obeso se valoraron las concentraciones séricas de hormona tiroidea (T4), TSH, cortisol, testosterona y glucemia, junto con la tasa urinaria de cortisol libre y sulfato de dehidroepiandrosterona (DHEA-S) para descartar respectivos trastornos endocrinometabólicos y así homogeneizar la muestra. Entre las personas estudiadas había 8 afectados de diabetes tipo 2 y 11 hipertensos. Entre los diabéticos, 3 eran tratados con metformina (850-1.500 mg/día), además de la dieta hipocalórica y el ejercicio. Ningún diabético estaba siendo tratado con insulina.
Todas las determinaciones hormonales se realizaron por inmunoanálisis o ELISA mediante la utilización de kits comerciales. El coeficiente de variación de la determinación por radioinmunoanálisis (RIA) (Behring) de péptido C en la orina es del 7,5% para el intraanálisis y del 6,5% para el interanálisis. A partir del volumen de orina eliminado en las respectivas 24 h se obtuvo la cantidad total de péptido C eliminada. Con este valor se calculó la cantidad diaria de insulina segregada por el páncreas en ese período, según lo ya publicado por nosotros15. Brevemente, se postula que el 7% del péptido C segregado equimolarmente con la insulina es eliminado de manera invariable por el riñón16, por lo que corrigiendo la cifra obtenida al total teórico, si consideramos que el peso molecular es la mitad del peso molecular de la insulina y que a 1 unidad internacional de actividad biológica de insulina (U) le corresponden 41,67 μg, se establece la cifra de insulina segregada, es decir, las unidades internacionales de insulina segregada en 24 h = (péptido C en orina de 24 h corregido al total teórico x 2)/41,67.
De esta manera se hace ostensible el grado de hipersecreción insulínica en los obesos del estudio, cuyos valores fueron al inicio entre 88 y > 200 U de insulina por día. Al comparar estos valores con los de una población sana sin sobrepeso (41,9 ± 1,5 U/día)15, estas personas presentan una hipersecreción insulínica desde moderada hasta muy elevada.
La determinación de leptina se realiza mediante el kit de RIA (Linco Research Inc.), obteniéndose un coeficiente de variación del método < 4,2% para ambos tipos de análisis.
RESULTADOS
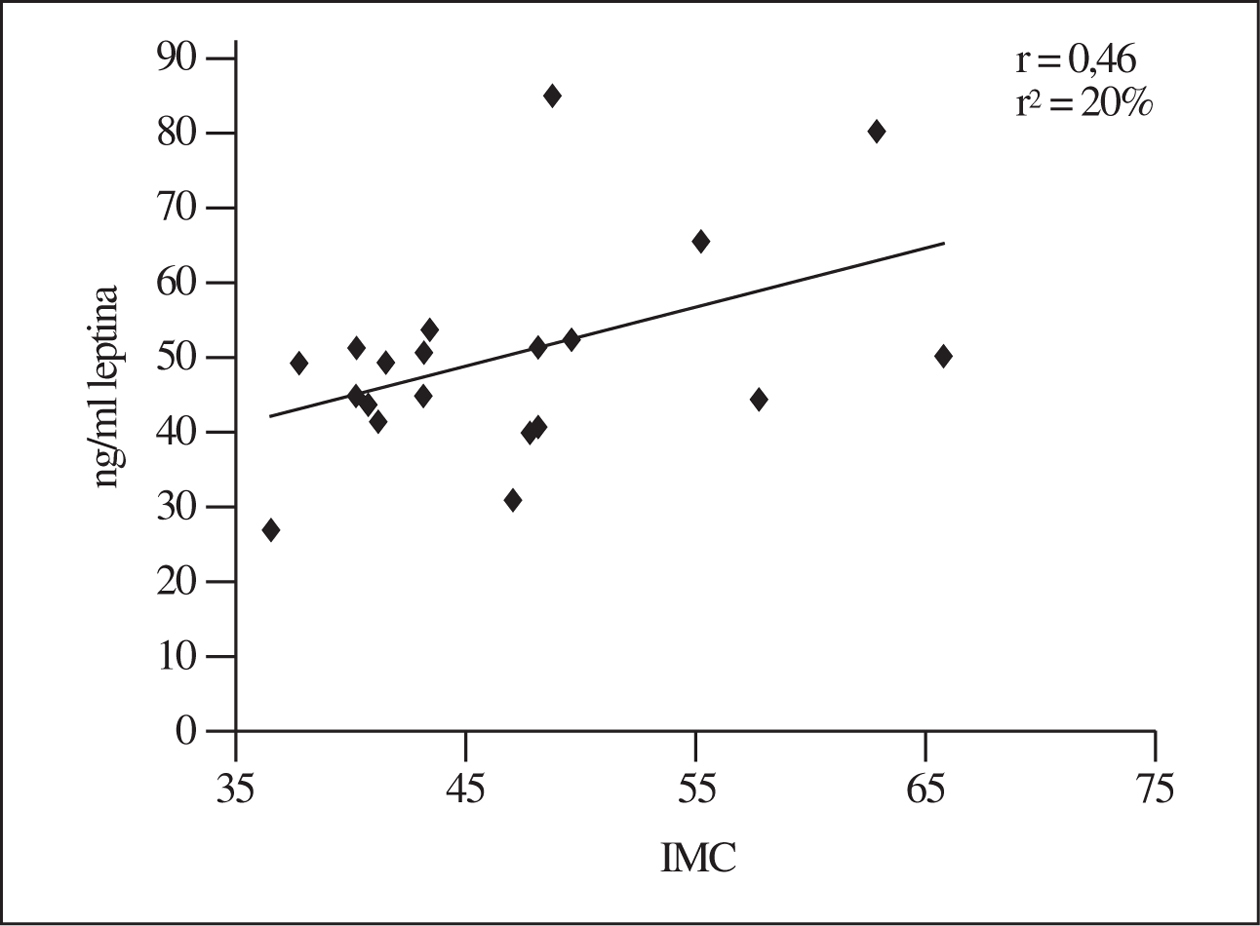
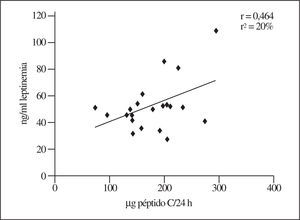
Si se utilizan los valores que inicialmente presentaban los obesos, las mujeres muestran una relación significativa entre leptinemia y el IMC (r = 0,46; r2 = 20%; n = 19). Por el contrario, en los varones no es posible detectar correlación alguna (r < 0,1), si bien el número de obesos de este sexo es menor (n = 10). En la figura 1 se muestra el gráfico correspondiente a las mujeres, del que se deducen valores séricos de leptina muy elevados en los casos de extrema obesidad (véase la referencia a las concentraciones normales en el apartado Discusión).
Figura 1.Relación entre leptinemia y el índice de masa corporal (IMC) al inicio del estudio que, como muestra este gráfico, sólo se observa en las mujeres.
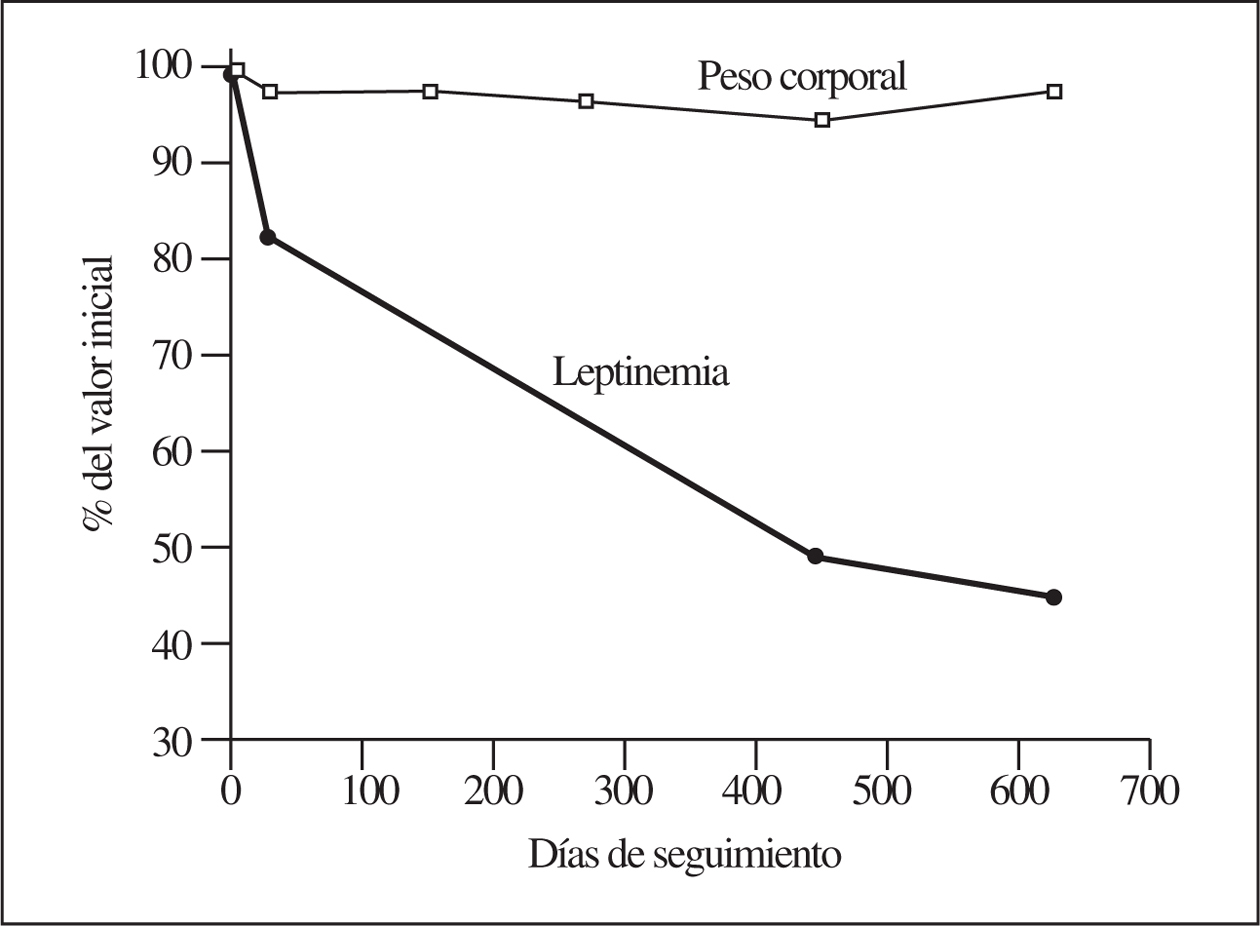
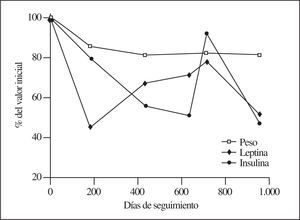
No obstante, como se demuestra en el seguimiento de las personas estudiadas, el descenso de la leptinemia está influido primariamente por la reducción calórica, ya que no parece dependiente de la respectiva respuesta ponderal. En la figura 2 se presentan los valores de seguimiento de una mujer de 33 años como ejemplo demostrativo. Mientras la leptinemia desciende a un 45% del valor inicial, el peso corporal lo hace de forma insignificante, es decir, entre el 5 y el 2%.
Figura 2.Estudio longitudinal del comportamiento de la leptinemia en comparación con el peso corporal, en respuesta a una moderada reducción calórica de la ingesta en una mujer de 33 años con valores iniciales de 110 kg de peso (IMC = 40) y de 24,7 ng/ml de leptina. Obsérvese la discrepancia entre la marcada reducción de la leptina sérica y la casi inapreciable del peso corporal. IMC: índice de masa corporal.
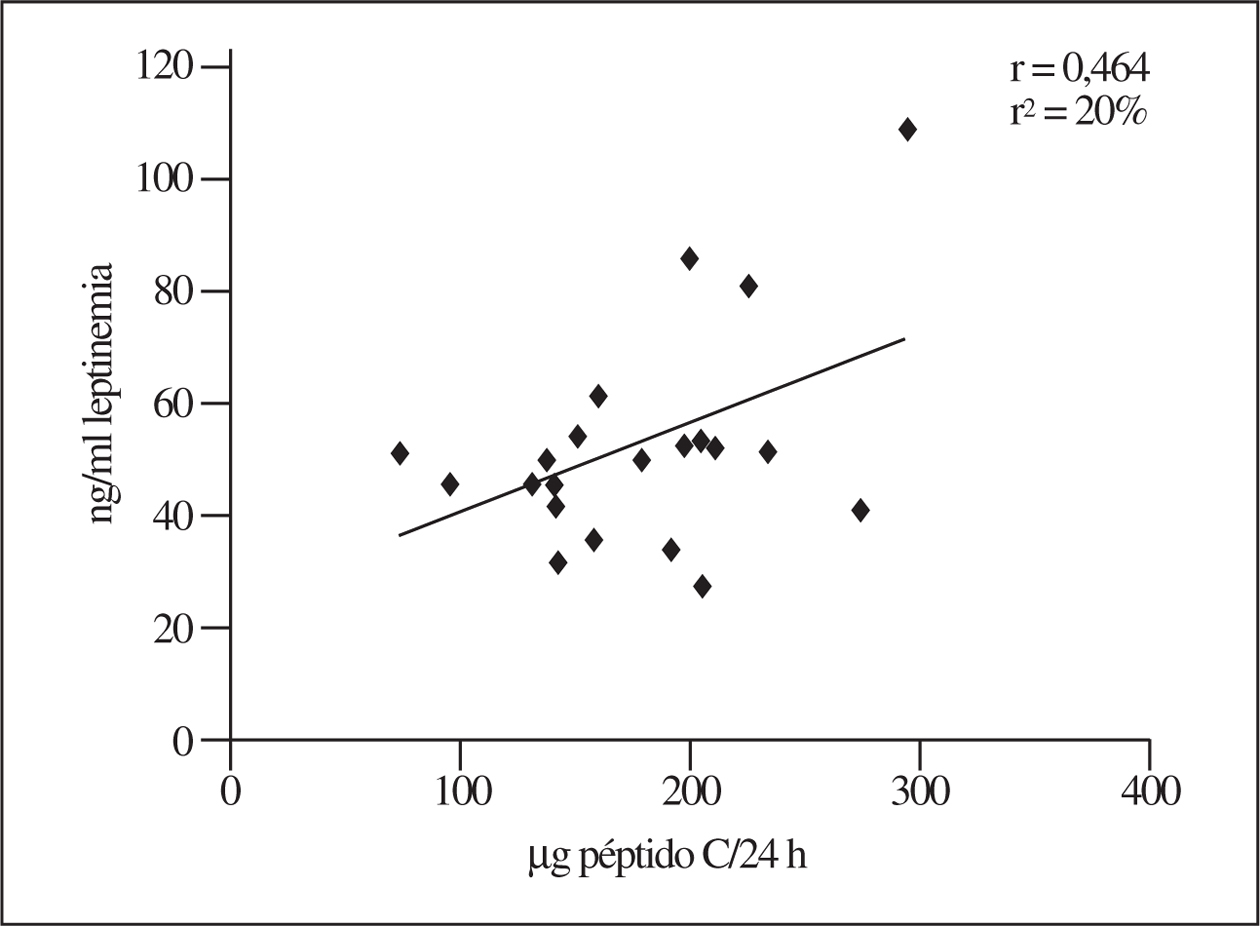
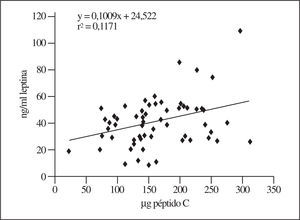
Respecto a la respuesta insulínica en comparación con la de la leptinemia a la reducción calórica, hay una relación entre ambos parámetros, aunque dentro de un amplio margen. En la figura 3 se muestra una correlación significativa con los valores iniciales. Por el contrario, como se muestra en la figura 4, esta relación se debilita manifiestamente cuando se introducen los valores del estudio longitudinal que representan la respuesta a la reducción calórica moderada, aunque la relación entre leptinemia y secreción insulínica es estrecha (r2 = 50%) en los jóvenes menores de 30 años, pero no cuando se trata de individuos mayores de 40 años (r2 = 20%) (no se muestran las presentaciones gráficas).
Figura 3.Relación entre la leptina sérica y la secreción insulínica, aquí representada por la excreción urinaria de péptido C (valores al inicio del estudio, antes de comenzar con la restricción calórica).
Figura 4.Relación entre la leptina sérica y la secreción insulínica, aquí representada por la excreción urinaria de péptido C, pero tras introducir los valores obtenidos durante el seguimiento de los obesos con la restricción calórica. Obsérvese el marcado debilitamiento de esta relación en comparación con los valores de la figura 3.
En efecto, nuestros resultados apuntan hacia una respuesta a la reducción calórica globalmente equivalente, pero más inmediata en el caso de la leptinemia que en el de la secreción insulínica. La figura 5 es un ejemplo demostrativo: ambos parámetros descienden tras la aplicación de la reducción calórica pero la leptina muestra una mayor magnitud en el tiempo más inmediato. Posteriormente, la observación de la dieta poco rigurosa por parte del obeso en cuestión cambia el comportamiento de la leptinemia que ya muestra un ascenso, mientras que persiste la curva descendente de la secreción de insulina. Cuando se hace patente el abandono de la dieta con cierta ganancia de peso, ésta última equipara el comportamiento ascendente de la leptina para después, una vez retomada la dieta prescrita, mostrar un descenso de ambos parámetros, aun cuando es casi de 1 año el período que separa las 2 últimas determinaciones.
Figura 5.Estudio longitudinal del comportamiento de la leptinemia y la secreción de insulina a partir de la excreción urinaria de péptido C y el peso corporal, en un varón de 41 años de 171 kg de peso (IMC = 61), con 60,9 ng/ml de leptina sérica y con 96,7 UI de secreción insulínica diaria como valores iniciales. Obsérvese la inmediata respuesta de la leptinemia, tanto respecto al claro descenso a la reducción calórica como en cuanto al ascenso, cuando el obeso, más allá del día 200, ostensiblemente no se atiene a la dieta recomendada, que finalmente vuelve a seguir.
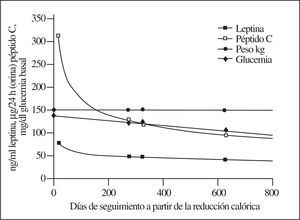
A fin de cuentas, hay un comportamiento paralelo entre leptinemia y secreción insulínica que se evidencia cuando los controles son muy espaciados y la dieta de restricción calórica es bien llevada por el obeso, descartándose los picos provocados por las trasgresiones dietéticas. En la figura 6 se exhibe un ejemplo al respecto: aunque el peso corporal permanece sin una marcada reducción, es ostensible un descenso continuado de los 2 parámetros hormonales, además del de la glucemia basal.
Figura 6.Curso de la leptinemia, secreción diaria de insulina y glucemia en un varón de 48 años con peso corporal de 170 kg en todos los controles e hiperglucemia. La secreción de insulina, calculada mediante la eliminación urinaria de péptido C, desciende desde 201 hasta 65 UI/día. Obsérvese, en un control generalmente muy espaciado, el descenso en los parámetros endocrinometabólicos sin cambio apreciable en el peso corporal.
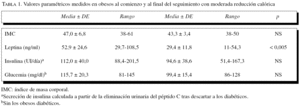
La tabla 1 es una muestra representativa de lo expresado con anterioridad. Aquí se muestran los resultados en los obesos al comienzo y al final del período de seguimiento con la restricción dietética. Como se puede observar, todos los parámetros presentan una tendencia hacia la normalización, pero sólo el descenso de la leptinemia es estadísticamente significativo.
DISCUSION
Posiblemente, el papel etiológico de la leptina en la obesidad está basado en la pérdida de su efecto regulador de la homeostasis ponderal. En cambio, la importancia etiológica de la insulina no implica directamente la obesidad, pero sí la complicación aterogénica. No obstante, el denominador común de ambas hormonas en la obesidad parece ser la resistencia contra sus efectos fisiológicos, lo que conduciría a la elevación de los correspondientes valores en el marco de una respuesta contrarreguladora. En nuestro estudio, la hiperleptinemia es muy manifiesta y oscila entre 29,7 y 108 ng/ml. Estos valores contrastan con los de personas sanas con IMC normal, que en el margen de edad de 20-92 años oscilan en las mujeres entre 7,7 y 11,6 ng/ml, y en los varones entre 8,9 y 11,8 ng/ml5.
Hay datos que abogan a favor de cierto potencial patogénico de la hiperleptinemia, especialmente relacionado con la alteración en la señalización insulínica en el adipocito17, pero hasta el momento no se ha demostrado un daño directamente desarrollado. No obstante, algunos trabajos relacionan la hiperleptinemia con el grado de esclerosis coronaria18 y otros con la hipertensión arterial19 e, incluso, como predictor del infarto cerebral26. Por otro lado, parece indudable que la hipersecreción de insulina o hiperinsulinemia, así como la obesidad, reducen el potencial de vida hasta en un 22%20. Esta circunstancia afectaría a nuestra muestra de obesos, que predominantemente presentan obesidad mórbida.
Nuestros resultados destacan, como ya lo han hecho otros estudios, la importancia del IMC en la génesis de la resistencia a la insulina, pero también su relación con la hiperleptinemia. No obstante, la elevación del IMC no parece determinante en el desarrollo de la resistencia insulínica y tampoco en la elevación de las concentraciones de leptina, como también se ha observado en el caso del ovario poliquístico21. Por el contrario, de acuerdo con otros estudios22, la ingesta exagerada de calorías parece ser el factor de riesgo primario causante de la hiperleptinemia. La respuesta inmediata a la reducción calórica, sin que todavía se manifieste beneficio ponderal, habla en favor de esa importancia etiológica. Es más, si parece clara la influencia de la sobrealimentación en la leptinemia, también lo es si consideramos el efecto normalizador de la reducción calórica. Esta observación aboga en favor de un mecanismo directo que pudiera ser autofágico23. Efectivamente, dando lugar a su «autolimpieza», degradando membranas y organelas alteradas que se acumulan en su interior, las células podrían recuperar la sensibilidad hormonal, incluso antes de iniciarse el descenso ponderal.
Considerando el amplio espectro de morbilidad que acompaña a la obesidad y su directa implicación en el envejecimiento, que acelera su progreso y, por tanto, acorta la vida, conviene decidir un tratamiento en edades tempranas cuya eficacia involucre el aspecto etiológico, que en primer plano parece ser la resistencia hipotalámica a la leptina24. Como apuntábamos con anterioridad, de nuestro estudio puede deducirse la importancia de la reducción calórica, que bien podría estar directamente vinculada con la desaparición de tal resistencia. Es bien conocido que la reducción de la ingesta prolonga la vida en los animales de experimentación, al mismo tiempo que mejora la sensibilidad a la insulina25. Por otro lado, también se sabe que la sobrealimentación conduce a la resistencia a la leptina13. En este sentido, nosotros observamos un efecto inmediato en las concentraciones de leptina que finalmente conduce a la disminución, hacia la normalidad, de la secreción de insulina.
AGRADECIMIENTOS
Agradecemos la colaboración técnica de Isabel Andueza Agara y Rosario Lozano en la toma de muestras y realización de las determinaciones.
Este trabajo se ha llevado a cabo con el apoyo económico prestado por la Fundación Yébenes-Velo en 1999-2000.