La neurociencia cognitiva del envejecimiento tiene como objeto de estudio la actividad cerebral y los procesos cognitivos asociados a la edad. Con el fin de comprender la dinámica de la actividad neurocognitiva en los adultos mayores, la presente revisión pone de relieve 4 modelos explicativos. El primero de ellos (HAROLD) resalta la bilateralidad cerebral, principalmente, en el córtex prefrontal. El segundo paradigma (PASA) hace especial hincapié en la polarización neuronal (anterior-posterior). El tercer modelo (CRUNCH) relaciona la actividad manifiesta del cerebro con el nivel de complejidad de la tarea. El último de ellos (ELSA) pone el acento en la distribución espacial y temporal de la actividad cerebral en las diferentes fases de la recuperación. Aunque diferentes en su contenido, los 4 modelos explicativos son perfectamente compatibles con los hallazgos reportados por las técnicas de neuroimagen, sugiriendo, de cara a la intervención, la utilización de estrategias de compensación y reserva cognitiva que ayuden a optimizar el rendimiento de los adultos mayores.
The aim of the cognitive neuroscience of aging is the study of brain activity and the cognitive processes associated with age. In order to understand the dynamics of neurocognitive activity in older people, the present review highlights four explanatory models. The first one (HAROLD) highlights brain bilaterality, mainly in the pre-frontal cortex. The second paradigm (PASA) places special emphasis on neuronal polarisation (anterior-posterior). The third model (CRUNCH) relates the manifest activity of the brain to the level of complexity of the task. The last one (ELSA) emphasises the spatial and temporal distribution of brain activity in the different phases of recovery. Although different in their content, the four explanatory models are perfectly compatible with the findings reported by neuroimaging techniques, suggesting the use of compensation strategies and cognitive reserve for interventions that may help to optimise the performance of older people.
La neurociencia cognitiva del envejecimiento es una disciplina en pleno auge1-3. El origen de la misma se remonta al interés en relacionar los hallazgos neurocientíficos con la investigación cognitiva. De esta manera, sería plausible encontrar un soporte físico a las teorías que estudian los procesos cognitivos, correlacionando la actividad neuronal con las conductas normal y patológica. Según Cabeza et al.4, el envejecimiento afecta a las estructuras cerebrales y los procesos cognitivos, por lo que medir la sintaxis entre estos 2 elementos ayudaría a comprender los cambios asociados a la edad. Así, desde una perspectiva neurológica, el envejecimiento normal conlleva una pérdida de tejido cerebral, tanto en peso como en volumen, por lo que ciertas capacidades cognitivas verán mermada, en mayor o menor medida, su funcionalidad5. No obstante, este cambio estructural no se distribuye de manera uniforme por todo el cerebro, sino que se extiende a regiones específicas, contribuyendo, así, a la comprensión de las pérdidas y ganancias observadas en esta población6,7.
Diversos trabajos han puesto de relieve que las personas mayores, en comparación con las personas jóvenes, manifiestan un incremento de la actividad cerebral, principalmente en el córtex prefrontal dorsolateral, cuando ambos grupos llevan a cabo tareas en las que se ven implicados diversos dominios cognitivos8,9. En este sentido, 2 teorías explicativas han intentado desentrañar la naturaleza de este fenómeno. Por un lado, la «teoría de la compensación»10 subraya que los mayores intentan compensar el deterioro de las funciones cerebrales, dedicando mayores esfuerzos a una tarea concreta, independientemente del rendimiento. De forma paralela, una baja actividad cerebral en la ejecución de una tarea se ha interpretado como un signo de deterioro, atribuyendo su etiología al uso ineficiente de estrategias (o un déficit en funciones ejecutivas). Así, la palpable sobreactivación de los mayores suele correlacionar con un mejor rendimiento, reforzando así esta primera hipótesis. Sin embargo, cabe señalar que, en muchos casos, dicha sobreactivación no se traduce necesariamente en un rendimiento superior. Gutchess et al.11 encontraron, en una tarea de memoria episódica, que los jóvenes mostraron un mejor rendimiento que los mayores. De hecho, la neuroimagen resaltó que los adultos jóvenes activan, en mayor medida, el lóbulo temporal medial, mientras que los ancianos compensan este deterioro fisiológico activando, principalmente, el córtex prefrontal, por lo que los resultados deben interpretarse con cierta cautela, esto es, teniendo en cuenta la manifestación conductual propiciada por la actividad cerebral. Por otro lado, la «teoría de la desdiferenciación» pone de relieve que el cerebro de un adulto mayor va perdiendo, progresivamente, especialización funcional, lo que se traduciría en una sobreactivación neuronal. El origen de esta teoría se gesta en que, con el paso de los años, hay un paulatino aumento de las correlaciones entre diferentes medidas cognitivas, lo que a nivel neurológico implica la generalización del funcionamiento cerebral. En esta línea, Baltes y Lindenberger12 encontraron que la correlación media de 5 medidas cognitivas discrepantes fue de 0,31 en jóvenes, mientras que en mayores fue de 0,71, atribuyendo estos datos a redes funcionales específicas en el primer grupo y a un patrón difuso en el segundo. Por lo tanto, variables que a priori son independientes en la juventud consiguen interrelacionarse en la tercera edad. Otro trabajo que refuerza este paradigma es el llevado a cabo por Dennis y Cabeza13. Estos autores revelaron que el aprendizaje explícito de los adultos jóvenes implicaba el reclutamiento de neuronas en el hipocampo, mientras que el aprendizaje implícito conllevaba la participación de los ganglios basales. Sin embargo, en el caso de los adultos mayores, ambas regiones eran igualmente activadas en los 2 tipos de aprendizaje, apoyando de esta manera la hipótesis de la desdiferenciación. A pesar de que las 2 teorías parecen interpretar los datos diferencialmente, Cabeza et al. plantean que ambos modelos son perfectamente compatibles de cara a la interpretación de los resultados obtenidos en neuroimagen.
El objetivo del presente artículo es revisar los principales modelos explicativos del envejecimiento neurocognitivo en personas mayores sanas, poniendo de relieve los trabajos experimentales que comparan la activación cerebral y ejecución de adultos jóvenes y mayores en diferentes dominios neurocognitivos.
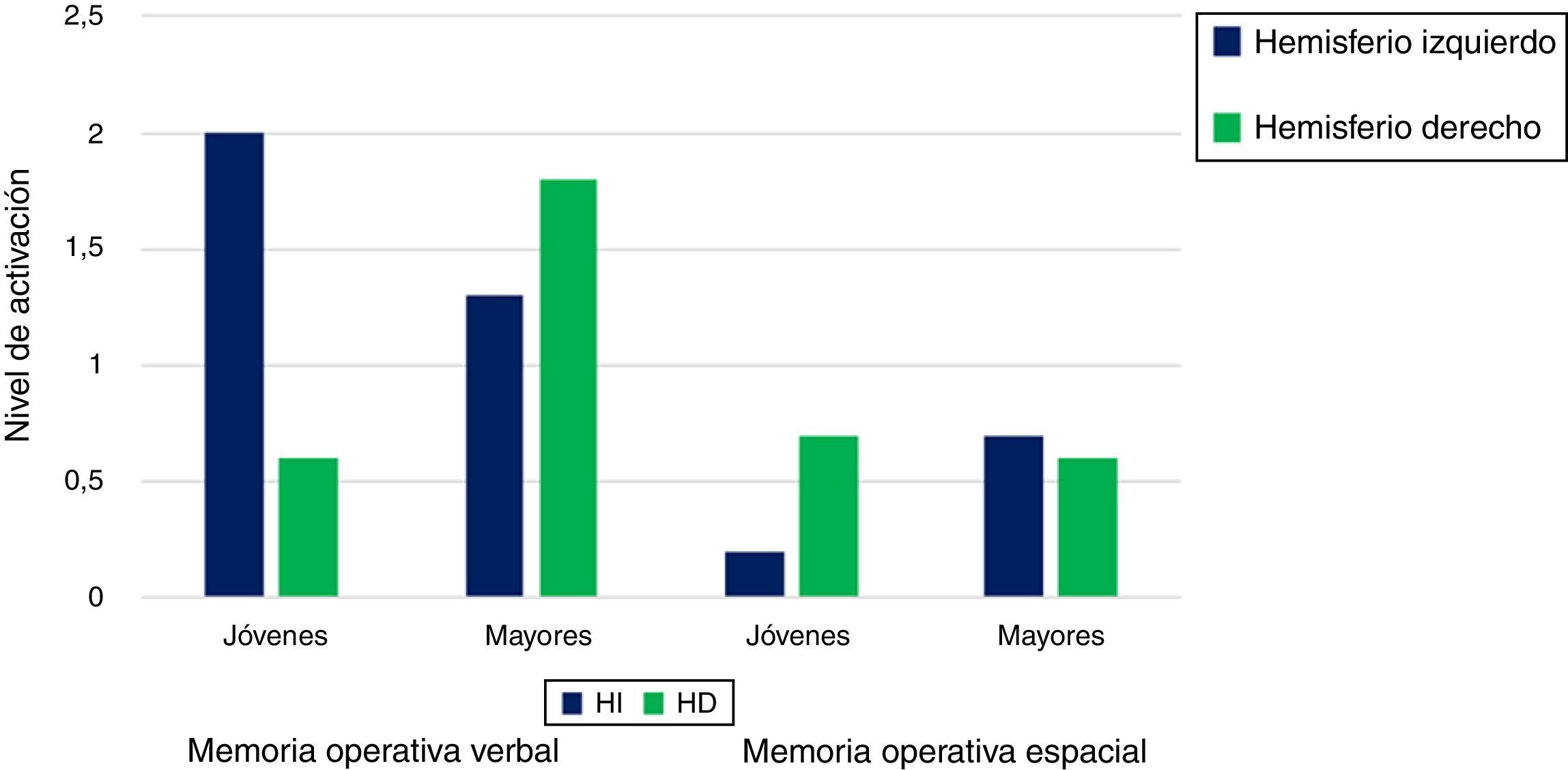
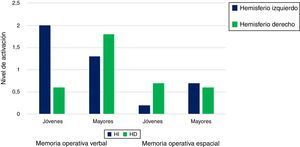
DesarrolloModelo de reducción de la asimetría hemisféricaAdentrándonos en el primer paradigma, el modelo hemispheric asymmetry reduction in older adults (HAROLD) plantea que, durante la realización de tareas cognitivas, la actividad del córtex prefrontal, en adultos mayores, presenta un patrón bilateral, mientras que, en el caso de los adultos jóvenes, es asimétrica14. Una evidencia, a favor de este modelo, proviene de Cabeza et al.15, quienes solicitaron a sus participantes memorizar un grupo de pares asociados. Los resultados, en el grupo de jóvenes, mostraron una lateralización izquierda en la fase de codificación y una lateralización derecha en la fase de recuperación. Sin embargo, los ancianos evidenciaron bajos niveles de activación en el córtex prefrontal durante la codificación, así como una sobreactivación del mismo (bilateralidad) durante la recuperación, sugiriendo, además, que este último grupo manifiesta problemas para elaborar estrategias durante el proceso de codificación, dedicando mayores recursos ejecutivos en la última fase con el fin de acceder a la información disponible. La manifiesta reducción de la asimetría hemisférica en personas mayores ha sido corroborada en diversas medidas de memoria episódica y con diferentes tipos de material (verbal y pictórico)16-18. En lo referente al constructo de memoria operativa, la actividad del córtex prefrontal en jóvenes tiende a exhibir lateralización izquierda para el material verbal y lateralización derecha para el material espacial. En contraposición, los adultos mayores ostentan un patrón de activación bilateral en ambas tareas (fig. 1). En lo relativo a la dimensión perceptiva, Grady et al.19 sometieron a sus participantes a una tarea de reconocimiento de caras en la que los jóvenes manifestaron, en relación con los mayores, una mayor actividad occipital. En cambio, estos últimos presentaron significativa bilateralidad en la zona anterior del cerebro, lo que denota que la ausencia de asimetría hemisférica se produce tanto para tareas que requieren un procesamiento superficial (perceptiva) como profundo (semántica). En síntesis, los ancianos suelen reclutar el hemisferio izquierdo y el derecho con independencia del tipo de material y el nivel de complejidad de la tarea, probablemente con el objetivo de compensar los déficits neurocognitivos asociados a la edad.
Modelo HAROLD. Nivel de activación del córtex prefrontal izquierdo y derecho en adultos jóvenes y asultos mayores en tareas de memoria operativa verbal y espacial.
Fuente: Cabeza14.
Además de las dimensiones cognitivas mencionadas, también se ha detectado bilateralidad en tareas de inhibición, en las cuales la persona debe suprimir respuestas irrelevantes. Así, Nielson et al.20 pidieron a un grupo de participantes que realizaran una prueba característica para valorar la inhibición motora basada en el paradigma go/no-go. La resonancia magnética funcional (fMRI) detectó que el control inhibitorio en jóvenes se asociaba a una mayor actividad del córtex prefrontal y regiones parietales del hemisferio derecho. Sin embargo, los adultos mayores, en congruencia con otros estudios previos, exhibieron un patrón bilateral de actividad en el córtex prefrontal.
En relación con el rendimiento, la mayoría de estudios que obtienen un patrón HAROLD ponen de relieve que la sobreactivación inter-hemisférica observada en adultos mayores produce mejores puntuaciones. Por ejemplo, Reuter-Lorenz et al.21 indicaron que los mayores que presentaban un patrón de actividad de bilateralidad cerebral obtuvieron mejor rendimiento en una tarea de memoria operativa en relación con los mayores que no exhibieron dicha bilateralidad y que, por ende, tuvieron peores puntuaciones. De resultados como estos se deduce que la reducción de la asimetría hemisférica favorecería el éxito en la ejecución de una tarea cognitiva. Al hilo de estos datos, Cabeza14, defensor de la teoría compensatoria, realizó una investigación en la cual reunió 3 grupos de participantes: jóvenes sanos, mayores con altas capacidades en pruebas de memoria y mayores con bajas capacidades en dichas pruebas. Los resultados informaron que los jóvenes tuvieron una mejor ejecución, así como asimetría prefrontal (con mayor actividad del hemisferio derecho). Por otra parte, los ancianos con alta ejecución no mostraban una activación asimétrica cerebral, o lo que es lo mismo, evidenciaron un patrón de actividad bilateral, mientras que aquellos con baja ejecución exhibieron sobreactivación del córtex prefrontal derecho, sugiriendo, de esta manera, que la actividad HAROLD puede ser el reflejo de un proceso compensatorio subyacente. Algunos autores22,23 sostienen la idea de que los mayores logran acceder al contenido episódico activando el córtex prefrontal derecho. Sin embargo, cuando la tarea aumenta su nivel de exigencia, y los ancianos consideran que acceder a la información deseada requiere algún tipo de estrategia o esfuerzo adicional, activan también el córtex prefrontal izquierdo.
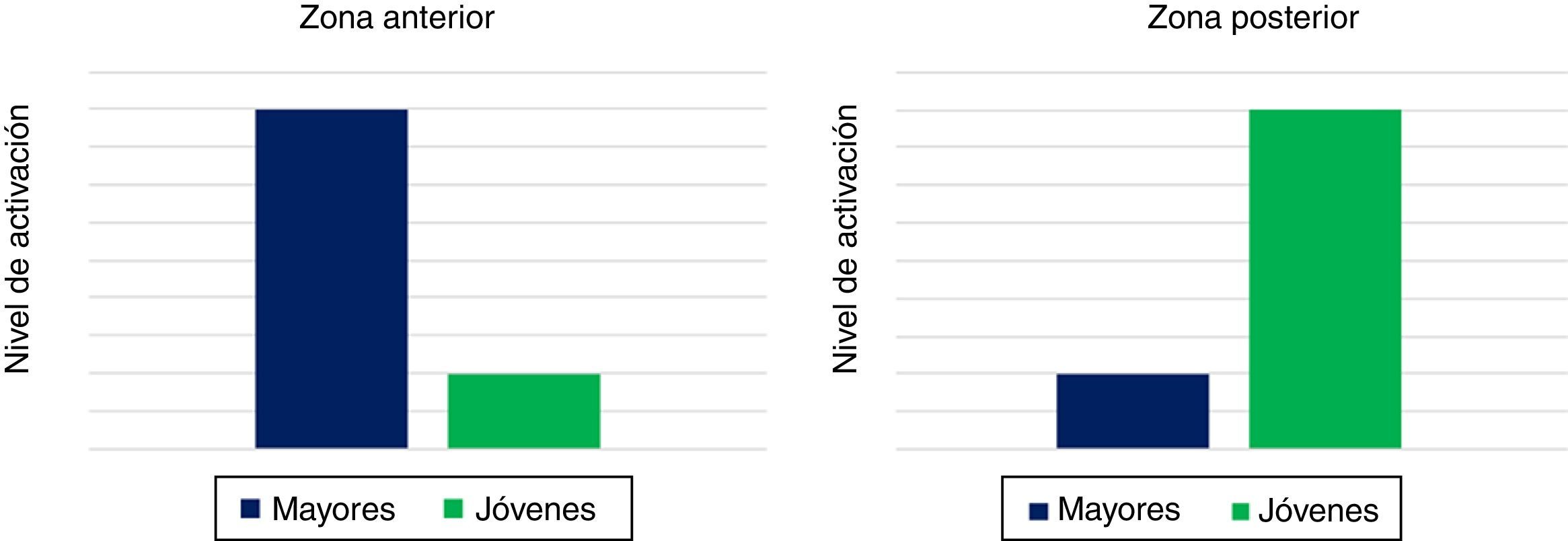
Modelo de activación anterior-posteriorEl modelo posterior-anterior shift in aging (PASA) se asienta sobre la premisa de que el proceso de envejecimiento lleva consigo cambios en la actividad cerebral de las regiones anteriores y posteriores24,25. Siendo más específicos, el cerebro del anciano disminuye su actividad posterior (occipitotemporal), desplazándola hacia regiones cerebrales anteriores (fig. 2). La literatura científica ha demostrado, en múltiples trabajos, que la región posterior está relacionada con las capacidades cognitivas básicas (e.g. percepción visual), mientras que la región anterior implica actividades cognitivas superiores (e.g. planificación y toma de decisiones). De esta manera, cuando los adultos jóvenes realizan actividades que impliquen el manejo de estímulos visuales, tienden a activar, en mayor medida, regiones occipitales, al mismo tiempo que las regiones anteriores ven reducida su actividad. Este modelo parte de estudios neurocientíficos que analizan las capacidades sensoriales en jóvenes y mayores. Payer et al.26 pusieron de manifiesto que el decremento sensorial observado en mayores (e.g. visión) se acompaña de un incremento en el reclutamiento de neuronas en el córtex prefrontal, mientras que, en el caso de los jóvenes, se produce el patrón inverso. Así, las limitaciones observadas en el primer grupo obstaculizarán la comprensión y ejecución de las diferentes tareas cognitivas planteadas por el experimentador, por lo que se observa una tendencia a la bilateralidad en el córtex prefrontal con el fin de compensar estas dificultades. Desde el campo de la electrofisiología, el trabajo de Osorio et al.27, utilizando potenciales evocados, resaltó que los adultos mayores, a diferencia de los adultos jóvenes, exhiben una reducción de la onda P300 en áreas posteriores del cerebro, así como un mayor reclutamiento neuronal en zonas frontales, amparando nuevamente la hipótesis de la compensación. Conviene destacar que esta bilateralidad no se plasma solo en el córtex prefrontal, ya que se ven implicadas otras regiones situadas en el polo anterior. Asimismo, el grupo de Payer subraya que, con la edad, las operaciones cognitivas básicas y las tareas familiares se vuelven cada vez más complejas, por lo que los adultos mayores recurrirían a un «reaprendizaje» de las mismas. La corteza prefrontal, al ser una estructura muy flexible y versátil, juega un papel fundamental en la dirección de la activación (de regiones occipitales hacia regiones frontales), razón por la cual los adultos mayores tienden a reducir los patrones de actividad cerebral observados. No obstante, Davis et al.24 se cuestionan si el paradigma PASA es producto de la complejidad de la tarea o, más bien, atribuido a los efectos del envejecimiento normal. Para intentar clarificar esta cuestión, se analizaron, mediante fMRI, las áreas implicadas en 2 tareas diferentes: una de memoria episódica (complejidad alta) y otra de percepción visual (complejidad baja), con el objetivo de identificar, en ambas pruebas, cambios en la actividad cerebral asociados a la edad. Los resultados arrojaron que, con independencia de la dificultad de la tarea, el patrón PASA fue hallado en el grupo de mayores sanos. Además, en línea con la hipótesis compensatoria, los incrementos de la actividad prefrontal correlacionaron positivamente con una correcta ejecución. En contraposición, se obtuvo una correlación inversa entre el rendimiento y la actividad en la región occipital. En definitiva, aunque no se pueden excluir otras interpretaciones en lo referente a PASA, la relación entre la actividad frontal y el rendimiento cognitivo también sugiere una función compensatoria.
Esquema modelo PASA. Nivel de activación anterior (izquierdo) y posterior del cerebro (derecho) en adultos jóvenes y mayores durante la realización de tareas cognitivas.
Fuente: Davis et al.24.
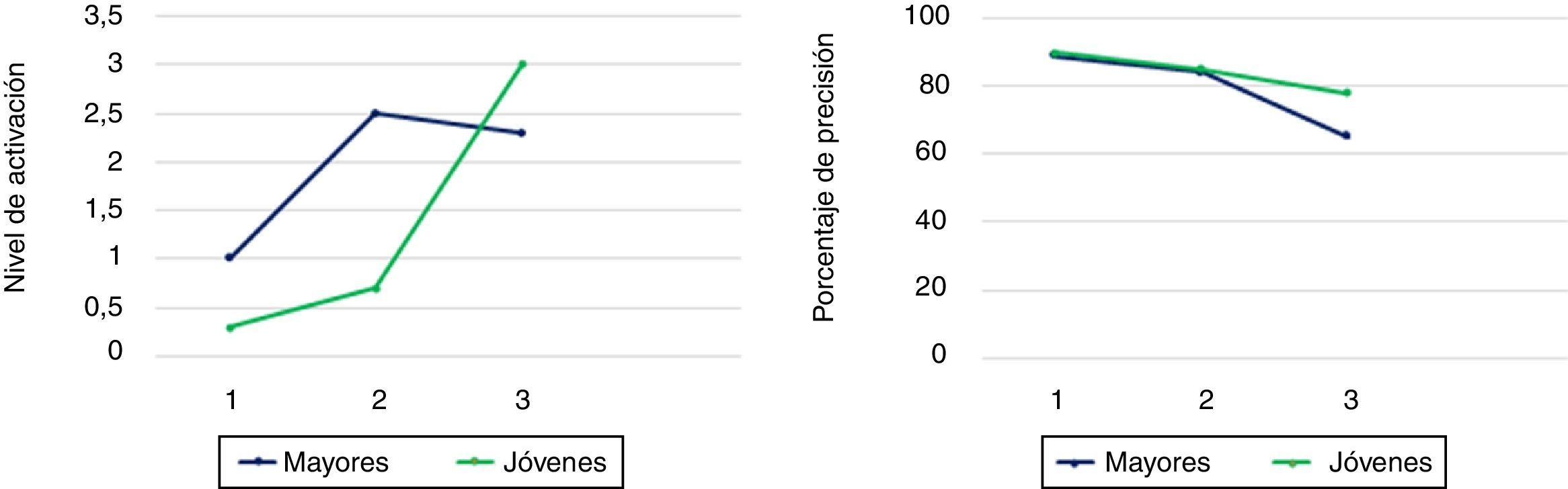
Esta nueva propuesta denominada compensation related utilization of neural circuits hypothesis (CRUNCH) establece una relación entre la sobreactivación cerebral y los niveles de complejidad de las tareas cognitivas10,28. Así, a mayor complejidad de las mismas, mayor cantidad de recursos cognitivos han de ser reclutados para el correcto desempeño de un individuo, por lo que, en las pruebas de neuroimagen, se observará una elevada activación cerebral. No obstante, se ha observado que este patrón es vulnerable al proceso de envejecimiento. En efecto, el trabajo de Reuter-Lorenz y Cappell mostró que cuando la carga de una tarea de memoria operativa verbal era baja, las personas mayores sobreactivan el córtex prefrontal dorsolateral con el fin de obtener un rendimiento similar al de los jóvenes. El matiz de este trabajo se circunscribe al hecho de que, a medida que la carga va incrementándose, los jóvenes activan el córtex prefrontal dorsolateral, mientras que los mayores alcanzan su máximo nivel de capacidades implicadas en la tarea, por lo que, a partir de un determinado nivel de complejidad, se muestran incapaces de cumplir con el nivel de demanda requerido, disminuyendo la actividad cerebral y, por ende, su rendimiento (fig. 3). Este modelo, al igual que los anteriores, mantiene abierta la incógnita con relación a los factores que promueven el potencial compensatorio. Al parecer, los programas de prevención del deterioro cognitivo, la educación, el ejercicio físico, la buena alimentación, las relaciones sociales, entre otras variables, favorecerían la competencia necesaria para resolver tareas cognitivas. Por el contrario, la privación del sueño, el daño neurológico y los factores genéticos limitarían la reserva cognitiva, por lo que los adultos mayores verían obstaculizada su capacidad para desenvolverse en determinadas tareas que adviertan una demanda cognitiva mayor29.
Modelo CRUNCH. Niveles de activación cerebral (izquierda) y porcentaje de precisión (derecha) en adultos jóvenes y adultos mayores en tareas con baja, media y alta complejidad cognitiva.
Fuente: Reuter-Lorenz y Cappell10.
Siguiendo con el planteamiento del modelo CRUNCH, Schneider-Garces et al.30 emplearon una tarea de memoria operativa en una muestra de participantes jóvenes y mayores, quienes debían retener un número determinado de ítems que variaban en su grado de complejidad. Los resultados encontraron, en el grupo de mayores, una mayor activación del córtex prefrontal izquierdo y derecho (bilateralidad) cuando el nivel de demanda de la tarea era bajo, así como ausencia de actividad cerebral cuando la carga cognitiva era alta. Los resultados de este, y otros estudios, son coherentes con la propuesta de que el exceso de activación reflejaría una compensación funcional de recursos limitados para los déficits asociados a la edad en tareas cognitivas complejas. En este sentido, el córtex prefrontal dorsolateral sería el área responsable de mantener las representaciones mentales al mismo tiempo que un individuo manipula información procedente del ambiente, evitando, así, que los estímulos irrelevantes puedan interferir en la realización de la actividad en curso. En el caso de los adultos mayores, es bien sabido que son más sensibles al efecto de la interferencia31, por lo que suprimir un estímulo que no esté asociado con el objetivo deseado (mientras resuelven, por ejemplo, una tarea de memoria operativa) demanda una cantidad de recursos neurocognitivos que, en muchas ocasiones, se ven afectados en personas de la tercera edad. Por esta razón, cuando los niveles de exigencia de una actividad son «bajos para los participantes jóvenes», para los mayores suelen ser lo suficientemente complejos como para exigir la activación de los hemisferios izquierdo y derecho, aunque tengan la competencia necesaria para resolver una tarea y obtener buenas puntuaciones. Todo lo contrario ocurre en tareas con alta carga cognitiva, donde las estrategias de manipulación o transformación de la información excederían las capacidades del adulto mayor, dando como resultado el patrón CRUNCH.
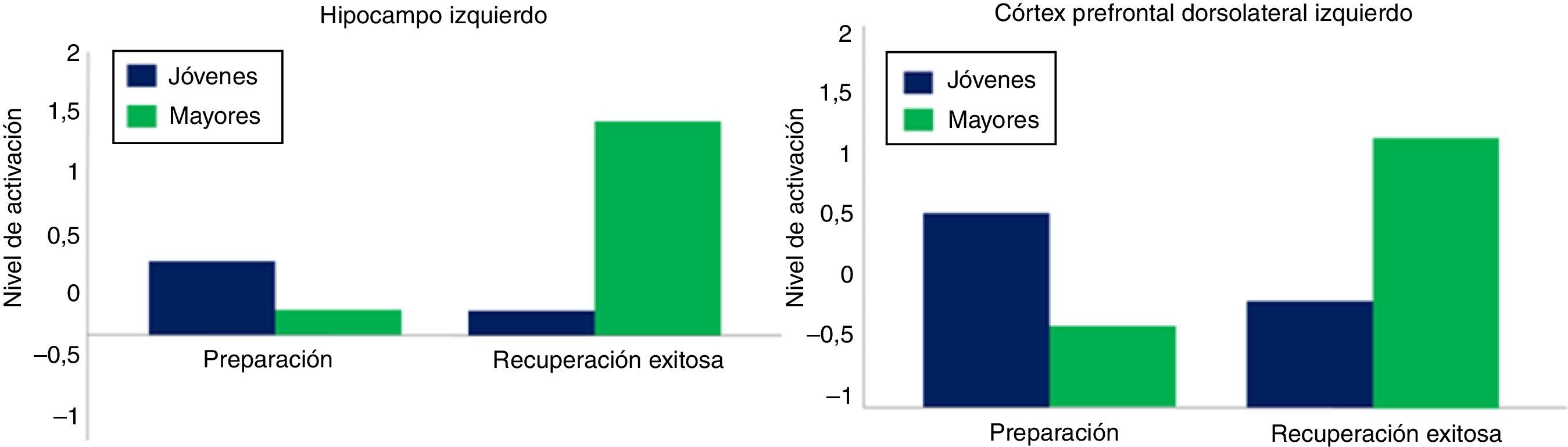
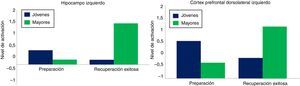
Modelo de transición neuralEste último modelo denominado early-to-late shift in aging (ELSA) se halla muy relacionado con los procesos de codificación, almacenamiento y recuperación de la información. Tiene su origen en el hecho de que los adultos mayores suelen mostrar cambios, tanto en la distribución espacial de las activaciones cerebrales como en la dinámica temporal de las mismas32. Dew et al. solicitaron a sus participantes (jóvenes y mayores sanos) realizar una tarea de control ejecutivo y memoria. Durante la sesión, los experimentadores presentaron a los mismos diferentes pares de letras (e.g. X-E), donde «X» era la señal y «E» era el estímulo diana. El objetivo de los participantes fue responder a la letra diana (presionar una tecla) cada vez que le precediera la misma señal presentada en la fase de codificación. De lo contrario, deberían omitir o inhibir su respuesta. Los resultados mostraron que, con la edad, las estrategias de control ejecutivo variaron en su distribución temporal, esto es, estrategias proactivas en jóvenes (mediadas por la señal) y estrategias reactivas en mayores (mediadas por el estímulo diana). La fMRI demostró que, en el caso de los jóvenes, la activación del córtex prefrontal dorsolateral e hipocampo izquierdo fueron mayores en el momento en que apareció la señal (fase de preparación para la recuperación) y no durante la presentación del estímulo diana (fase de recuperación exitosa). Por el contrario, los adultos mayores exhibieron en la última fase un patrón bilateral de activación, lo que sugiere que estas personas suelen fallar al emplear la información procedente de la señal, utilizando la letra diana como estímulo clave que compense los déficits en esta capacidad. En resumen, este trabajo denota que los adultos mayores desplazan las estrategias de control ejecutivo de un inicio temprano a un inicio tardío (fig. 4).
Modelo ELSA. Nivel de activación del hipocampo izquierdo (izquierda) y el cortex prefrontal dorsolateral izquierdo (derecha) en adultos jóvenes y adultos mayores durante la fase de preparación y recuperación exitosa.
Fuente: Dew et al.32.
Por otra parte, la reducida activación del lóbulo temporal medial (hipocampo izquierdo, amígdala izquierda y giro parahipocampal derecho) en mayores, durante la fase de preparación, es coherente con el déficit en la codificación de la información, lo que repercutirá negativamente en el rendimiento a largo plazo. Una explicación alternativa a los presentes hallazgos es que los adultos mayores activan más áreas cerebrales en la fase de recuperación exitosa puesto que acceden a todo tipo de información en la memoria a largo plazo (relevante e irrelevante), la cual compite con las huellas de memoria necesarias para el desenvolvimiento de la tarea. Sin embargo, los datos obtenidos en mayores revelan una correlación positiva entre la activación cerebral y la respuesta conductual adecuada, por lo que esta hipótesis quedaría descartada. Para resolver la naturaleza de este asunto, Dew et al. recurren, al igual que en los 3 paradigmas mencionados, a la teoría de la compensación, enfatizando que solo los adultos mayores con alto rendimiento exhiben este patrón de activación, mientras que aquellos con bajo rendimiento previo son más proclives a una disminución de la actividad cerebral en las 2 fases, lo cual podría ser, según estos autores, un indicador precoz de un posible deterioro cognitivo.
ConclusionesLos modelos expuestos en esta revisión ilustran diferentes puntos de vista sobre el envejecimiento neurocognitivo, todos ellos perfectamente compatibles con los supuestos de compensación y desdiferenciación observados en los diferentes trabajos empíricos. De esta manera, el modelo HAROLD pone de relieve la reducción de la asimetría hemisférica en las personas mayores, por lo que determinadas áreas cerebrales presentan menos lateralización, en relación con los jóvenes. Estos resultados han sido replicados utilizando pruebas de memoria episódica, semántica, operativa, control inhibitorio y percepción, pudiendo afirmar, por tanto, que se trata de un fenómeno generalizado y no específico de dominio. Así, los ancianos reclutan más regiones cerebrales con el fin de ejecutar una tarea que, a priori, necesitaba la actividad de un solo hemisferio, favoreciendo, con ello, un incremento de la tasa de aciertos.
Por otro lado, el modelo PASA focaliza su propuesta en la existencia de un patrón inverso de activación entre regiones anteriores y posteriores observado en jóvenes y mayores. En el caso de los jóvenes, hay una tendencia a activar las áreas posteriores (occipitotemporales) a la par que las regiones anteriores ven reducida su estimulación (frontales-parietales). Sin embargo, en el caso de los adultos mayores, e independientemente del nivel de complejidad de la tarea, se observa el patrón contrario, favoreciendo, así, un rendimiento similar en los 2 grupos. El modelo CRUNCH subraya que, con el paso de los años, se demandan más recursos cognitivos que beneficien la ejecución de una tarea con baja carga cognitiva. En síntesis, cuando dichas tareas sobrecargan el sistema cognitivo de la persona mayor, este tiende a reclutar más regiones cerebrales de las que las personas jóvenes suelen emplear para una correcta ejecución. Sin embargo, llega un momento en que la complejidad de la actividad en curso puede superar los umbrales que el cerebro de una persona de la tercera edad es capaz de mantener, promoviendo un abandono del sistema de procesamiento y, por tanto, bajas puntuaciones en la tarea sugerida. Finalmente, el modelo ELSA hace especial hincapié en que las diferencias neurocognitivas halladas en los patrones de activación también comportan, con la edad, un patrón temporal diferencial, lo que parece mostrar que los ancianos recurren a estrategias de control de la acción que compensen los déficits ejecutivos advertidos en la literatura científica.
La técnica de investigación que, hoy en día, sustenta, mayoritariamente, la comprensión de los fenómenos neurocognitivos es la neuroimagen. Este método aporta muchas ventajas al estudio de los procesos superiores, al comparar el rendimiento de la población joven con la mayor. Así, en muchos trabajos, y dependiendo de la metodología empleada, se ha encontrado que la actividad cerebral de los mayores es reducida en muchos casos. Sin embargo, cada vez son más frecuentes los estudios que observan el patrón contrario. La neuroimagen estructural in vivo y la examinación post mortem del tejido cerebral han revelado una amplia gama de cambios cerebrales asociados a la edad8. En resumen, y a pesar de las diversas interpretaciones, hay un consenso general en afirmar que, con el paso de los años, el cerebro sufre cambios estructurales y funcionales que afectarán, en mayor o menor medida, a la persona. En relación con los cambios estructurales, Jiménez33 pone de relieve que la reserva cerebral de cada ser humano (diferencias individuales asociadas al número de neuronas, calidad de las sinapsis o ramificaciones dendríticas) promoverá una mayor o menor susceptibilidad a la patología cerebral y determinará la magnitud de los síntomas clínicos asociados a una lesión. Por otra parte, los cambios funcionales hacen referencia a la reserva cognitiva, que alude a la capacidad de un individuo para optimizar el rendimiento en un dominio cognitivo mediante el reclutamiento alternativo de redes neuronales. De esta manera, tener una mayor o menor reserva cognitiva dependerá de una serie de variables internas (e.g. genéticas) y, sobre todo, externas (e.g. educación, nivel ocupacional, ocio y tiempo libre, ejercicios físico y cognitivo), que tomarán un papel relevante en los diferentes estadios del ciclo vital.
La mayoría de los autores citados interpretan los resultados obtenidos de los 4 modelos recurriendo a la teoría de la compensación. Según este planteamiento, los mayores seleccionan la conducta deseada que optimice su rendimiento y compense los déficits asociados a la edad34. Sin embargo, conviene tener en cuenta que los hallazgos han sugerido 2 tipos de compensación: una exitosa y otra infructuosa. La primera subraya que la activación cerebral observada en mayores es proporcional al éxito en el rendimiento. Por lo tanto, estas personas suelen emplear regiones alternativas del cerebro, que, por norma, los jóvenes no suelen utilizar en la realización de una tarea. La compensación infructuosa ilustra que la mayor activación cerebral de los mayores es inversamente proporcional al éxito en el rendimiento. Según esta visión, a mayor cantidad de neuronas reclutadas, peor rendimiento en las tareas, lo cual sería un signo de un posible deterioro cognitivo.
Finalmente, es relevante recalcar que los modelos analizados no son excluyentes entre sí. De la misma forma, el supuesto teórico de la compensación y el de la desdiferenciación pueden coexistir a la vez, sin que sea necesaria la prevalencia y/o superioridad de una sobre la otra. Sin embargo, es evidente que el modelo HAROLD se ha extendido significativamente en el campo de la neurociencia cognitiva debido a los diversos estudios que lo sustentan. Los datos presentados en esta revisión nos permiten abrir nuevas puertas a la investigación con el fin de generar un modelo integrador que nos ayude a comprender las diferencias obtenidas en el envejecimiento neurocognitivo y, por otro lado, diseñar intervenciones adaptadas al nivel cognitivo de cada persona, que fomenten la selección de procesos compensatorios con el fin de optimizar su rendimiento y estimular su bienestar emocional.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.