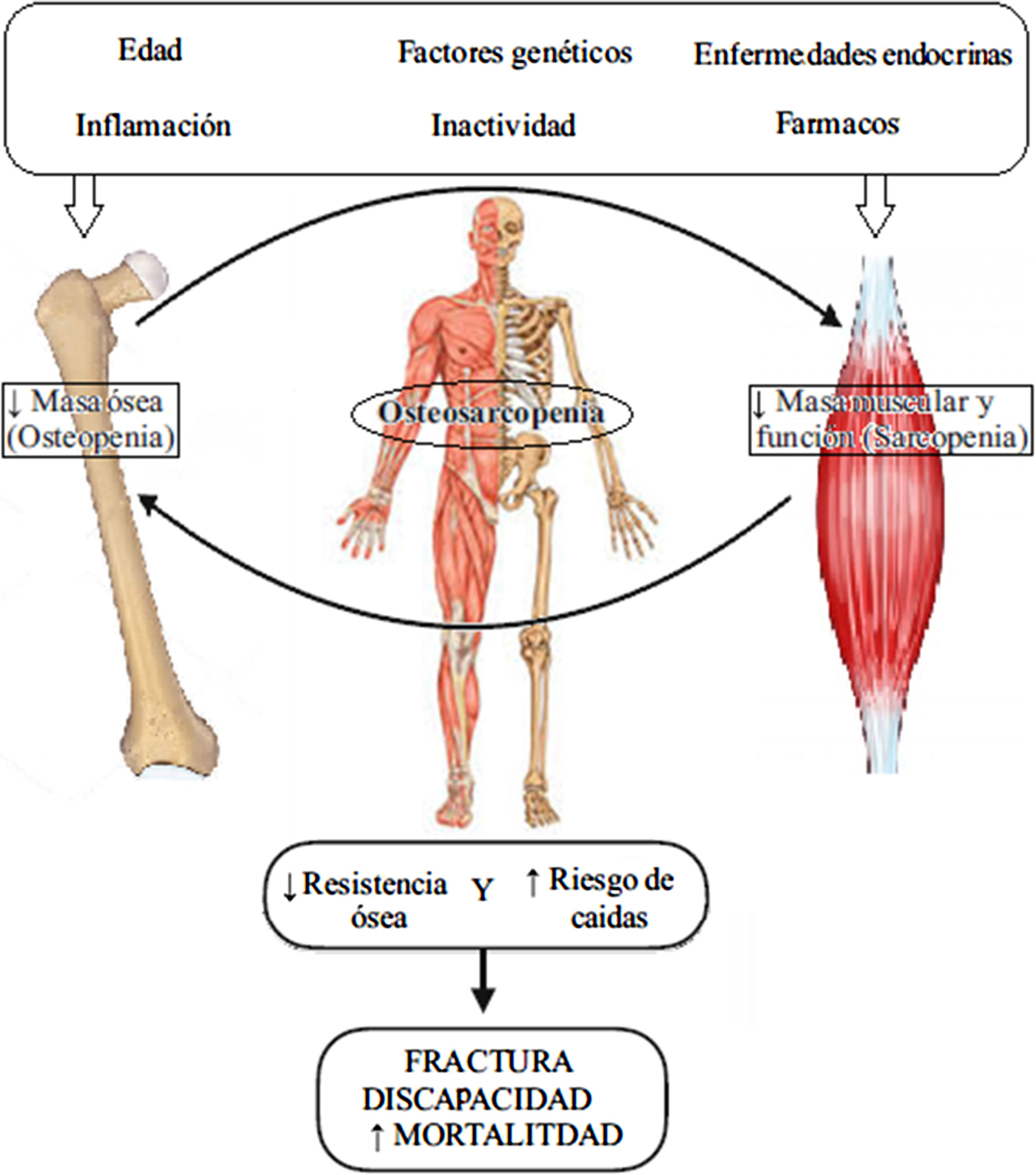
La osteosarcopenia es un fenotipo fruto de la combinación de sarcopenia y baja densidad mineral ósea. Basado en la relación entre hueso y músculo este fenotipo se encuentra asociado a un mayor riesgo de caídas, fracturas, dependencia y coste sanitario que sus componentes por separado. Dada sus características, se puede considerar como un nuevo síndrome geriátrico. Por lo tanto, entender su fisiopatología y diagnóstico así como su manejo tanto no farmacológico como farmacológico es una tarea de gran importancia. El problema al abordar este fenotipo surge del manejo tradicional de la sarcopenia y la osteoporosis por separado. También existe una falta de consenso en cómo denominarla (sarco-osteopenia, sarco-osteoporosis, osteosarcopenia). Con esta revisión queremos resumir la epidemiología, fisiopatología, diagnósticos, eventos adversos y manejo de la osteosarcopenia.
Osteosarcopenia is a phenotype resulting from the combination of sarcopenia and low bone mineral density. Based on the relationship between bone and muscle, this phenotype is associated with a higher risk of falls, fractures, dependence, and health care costs than its individual components. Given its characteristics, it can be considered as a new geriatric syndrome. Therefore, understanding its pathophysiology and diagnosis, as well as its non-pharmacological and pharmacological management is a task of great importance. The problem in addressing this phenotype arises from the tradition of managing sarcopenia and osteoporosis separately. There is also a lack of consensus on what to call it (sarco-osteopenia, sarco-osteoporosis, osteosarcopenia). The aim of this review is to outline the epidemiology, pathophysiology, diagnoses, adverse events, and management of osteosarcopenia.
Dentro de los cambios fisiológicos asociados al envejecimiento se incluyen diferentes a nivel de la composición corporal, como son la pérdida de músculo esquelético y masa ósea. A partir de los 50 años, la masa muscular disminuye un 0,5-2% anualmente (tanto fibras tipo i como tipo ii) y la fuerza muscular un 1,5-3% a partir de los 60 años. Esta disminución es mayor en población sedentaria y en varones, donde se encuentra una prevalencia del doble respecto a mujeres1. Asimismo, la masa ósea empieza a disminuir un 0,5% a partir de los 30 años con una rápida disminución puntual en la mujer posmenopáusica, siendo esta disminución estable en los hombres2. Estos cambios, unidos a múltiples factores contribuyentes (tales como sedentarismo, malnutrición, enfermedades crónicas y algunos tratamientos farmacológicos), acaban produciendo osteoporosis3 y sarcopenia4.
Tradicionalmente estos procesos se han estudiado por separado, aunque cada vez es más evidente la existencia de una estrecha relación entre hueso y músculo5. También se ha observado una relación entre una baja densidad mineral ósea (DMO) y la sarcopenia6. Por este motivo se ha sugerido la existencia de un diagnóstico único para los pacientes que padezcan ambas enfermedades y cuya denominación más aceptada actualmente es la de osteosarcopenia7–10. La osteosarcopenia ha sido objeto de estudio reciente dada su alta prevalencia y su relación con el aumento del riesgo de eventos adversos en las personas mayores. Esta combinación de sarcopenia y osteoporosis ha sido denominada por algunos autores como «el dúo peligroso»11 al conferir un mayor riesgo de caídas y fracturas óseas que en sujetos que solo presentan osteoporosis o sarcopenia. También se ha observado mayor deterioro funcional, dependencia, institucionalización, mortalidad y aumento del gasto sanitario12–14.
Todo ello justifica la necesidad de un mejor conocimiento de este síndrome geriátrico que permita su identificación en la práctica clínica con el objetivo de diseñar un plan de tratamiento apropiado7.
EpidemiologíaAunque la prevalencia de la osteosarcopenia es uno de los temas de estudio en la actualidad, sigue habiendo mayor información sobre la prevalencia de la osteoporosis y de la sarcopenia.
Respecto a la osteoporosis, un estudio europeo sitúa su prevalencia (medida según criterios densitométricos de la Organización Mundial de la Salud) en mayores de 50 años en torno al 22,1% en mujeres y al 6,6% en varones15. Al asociarse la osteoporosis de manera progresiva con la edad, se calcula un incremento de hasta el 30% en mujeres y el 8% en varones para el año 2025. Igualmente se calcula un gran aumento de la incidencia de fracturas y del coste sanitario atribuible a la osteoporosis. Esta misma fuente establece una prevalencia de osteoporosis en la población española similar (en 22,6% en mujeres y en 5,4% en varones)15. Si se consideran los criterios para osteopenia, estas cifras se elevan al 80%en mujeres mayores de 7016.
Respecto a la sarcopenia, su prevalencia en la población europea mayor de 65 años oscila entre el 9,25 y el 18% (dependiendo de la definición y del instrumento de medida utilizados). Se espera un aumento hasta alcanzar entre el 12,9 y el 22,3% para 204517. La prevalencia en la población española mayor de 70 años difiere según el tipo de población estudiada, siendo más alta en sujetos institucionalizados (15,1 y 46,3% para varones y mujeres, respectivamente)18 que en aquellos que viven en la comunidad (10 y 32,7%)19 o que acuden a una consulta de Geriatría (12,7 y 22,9%)20.
Respecto a la osteosarcopenia, su prevalencia varía según los criterios elegidos para el diagnóstico de sarcopenia y la población de estudio. En un reciente metaanálisis, esta prevalencia variaba entre el 5-37%, siendo más frecuente en mujeres que en hombres21. Es más frecuente en sujetos con fragilidad, comorbilidad y edad≥80 años10,22,23 y con historia de caídas8,24.
Tanto la sarcopenia como una baja DMO se asocian a eventos adversos de salud, deterioro de la calidad de vida y aumento del coste sanitario. Respecto a la sarcopenia, en un metaanálisis sobre sus consecuencias se ha observado que los sujetos con sarcopenia presentan una mayor tasa de mortalidad y de deterioro funcional. Además la revisión sistemática realizada vincula la presencia de sarcopenia con una mayor incidencia de caídas y de hospitalización, siendo menos clara la relación con la incidencia de fracturas y la duración de la hospitalización12. La sarcopenia también se asocia con fragilidad, institucionalización y baja calidad de vida14. Respecto a la baja DMO, además de favorecer las fracturas por fragilidad, se asocia a un aumento del gasto sanitario, mortalidad, deterioro funcional, depresión y baja calidad de vida13,15. En general, las enfermedades musculoesqueléticas se consideran el segundo factor contribuyente a los años de vida con discapacidad, explicando el 21,3% de los mismos25.
Los estudios específicos del fenotipo de osteosarcopenia objetivan una mayor incidencia de caídas y fracturas, tanto en poblaciones con antecedentes de caídas26 como en las personas mayores de la comunidad22, asociando una mayor prevalencia de fragilidad, depresión y movilidad limitada8,22,26. Asimismo, tras una fractura de cadera, la mortalidad al año de los pacientes con osteosarcopenia es 1,8 veces mayor que la de los no-osteosarcopénicos27. A estas complicaciones habría que añadir los mencionados eventos adversos vinculados a la sarcopenia y a la baja DMO.
FisiopatologíaEl hueso y el músculo son tejidos integrados con funciones compartidas cuyo desarrollo y mantenimiento habitualmente discurren de forma paralela. Mientras que el ejercicio físico puede incrementar la fuerza y la masa muscular y ósea, ambas se ven comprometidas con el envejecimiento o en situaciones de desuso (como la inmovilidad o tras un ictus). Existe una sofisticada regulación del equilibrio entre los procesos de síntesis y degradación/reabsorción de ambos tejidos cuya alteración daría lugar al desarrollo de osteoporosis y/o sarcopenia28. En dicha regulación participan tanto factores genéticos como ambientales, bien a través de mecanismos de control compartidos (endocrino, sistema nervioso), bien mediante la intercomunicación hueso-músculo a nivel de órganos (señales biomecánicas de la actividad física), celular y molecular (miocinas, citocinas y factores de crecimiento)5.
Sarcopenia y osteoporosis tienen un origen multifactorial y comparten vías fisiopatológicas. Los cambios en el sistema musculoesquelético relacionados con el envejecimiento (como son la disminución del número y tamaño de fibras musculares o la disminución del número de osteoblastos en las unidades de recambio óseo) explican solo una parte del desarrollo de la osteosarcopenia1,2. El hueso es un tejido biomecánico que adapta su estructura de forma eficiente a las diferentes fuerzas a que es sometido (contracción muscular y cargas gravitacionales) y que estimulan una respuesta osteogénica. Por su parte, el tejido muscular experimenta una hipertrofia y un incremento de la síntesis proteica con el ejercicio. Ambas respuestas anabólicas parecen disminuir con el envejecimiento por mecanismos poco conocidos hasta la fecha5. Por otra parte, la inactividad física favorecería la degradación muscular y la reabsorción ósea29. Los factores genéticos afectarían de forma simultánea a ambos tejidos al derivar de una misma célula madre mesenquimal. Polimorfismos de los genes para los receptores de vitamina D, estrógenos y andrógenos estarían involucrados en la pérdida de masa ósea y muscular. También parecen estar involucrados otros genes como GLYAT, miostatina o actinina-alpha-330. Otros factores relacionados con el desarrollo de la osteosarcopenia serían ciertas enfermedades endocrinas (diabetes, hipovitaminosis D31, déficit de hormona de crecimiento y de factor insulínico de crecimiento-1 e hipogonadismo), malnutrición, obesidad y tratamiento con corticoides30. Destaca la asociación entre niveles elevados de PTH como factor independiente de osteosarcopenia32 en una cohorte específica de pacientes con historia de caídas.
Un tercer participante en la relación hueso-músculo es el tejido adiposo. La infiltración grasa del tejido muscular y óseo que se observa con el envejecimiento contribuiría a la osteosarcopenia a través de la secreción de ácidos grasos y citocinas inflamatorias (proceso conocido como lipotoxicidad)33. Los sujetos con osteoporosis y sarcopenia presentan niveles elevados de citocinas inflamatorias, especialmente de interleucina-6 y factor de necrosis tumoral alfa33. Por otro lado, se ha observado una asociación entre la obesidad y la presencia de osteosarcopenia. Dado que las 3 estirpes celulares derivan de una misma línea mesenquimal, es posible que la osteosarcopenia derive de un mecanismo celular por el cual hubiese un exceso de diferenciación adipogénica y un defecto de diferenciación osteogénica y miogénica5.
Más reciente es el estudio de las alteraciones en la regulación paracrina hueso-músculo involucradas en el desarrollo de osteosarcopenia. Las células musculares secretan diferentes moléculas (miocinas) que afectan al hueso. Estas serían los factores de crecimiento insulínico 1 y 2, factor de crecimiento fibroblástico 2, interleucinas 6, 7 y 15, miostatina, folistatina, osteoglicina, irisina y osteoactivina (REF). También se han identificado varias osteocinas con efecto sobre las células musculares y esqueléticas: prostaglandina E2 y la proteína Wnt3a sintetizadas por los osteocitos, osteocalcina y factor de crecimiento insulínico 1 sintetizados por los osteoblastos, y la esclerostina, secretada por ambos tipos celulares5,30. El papel de estas miocinas y osteocinas en la aparición y progresión de la osteosarcopenia está aún por dilucidar.
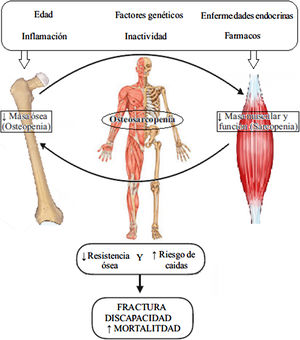
En conclusión, existe una estrecha interrelación entre hueso y músculo de forma que cambios en la masa ósea afectan a la masa muscular y viceversa (tanto en sentido positivo como negativo). Su desequilibrio induciría el desarrollo de osteosarcopenia (fig. 1)6. No está totalmente claro si dichos cambios se inician en el hueso o en el músculo. Un reciente estudio apunta a la osteoporosis como factor de riesgo para el desarrollo de sarcopenia en la población mayor japonesa, no habiéndose observado la relación opuesta34. Sin embargo otros estudios concluyen que es la pérdida de músculo la que reduce la DMO a través de una disminución de la carga mecánica por fuerzas gravitacionales35,36.
Fisiopatología de la osteosarcopenia. Adaptada de Kawao et al.30.
Se caracteriza por una disminución de la densidad y calidad de la microarquitectura ósea, favoreciendo un mayor riesgo de fractura. Clásicamente se ha diagnosticado a través de la medición de la masa ósea. El gold-stantard para ello es la absorciometría radiológica de doble energía (DEXA)37. Los puntos de corte para su diagnóstico fueron establecidos por la Organización Mundial de la Salud38: osteopenia a valores entre −1,0 y −2,49 desviaciones estándar respecto a la población joven sana (T-score); osteoporosis a valores≤−2,5 desviaciones estándar. Actualmente existe una gran variabilidad sobre las indicaciones para la realización de una DEXA en el mayor, tanto a nivel nacional como internacional39. En la tabla 1 se muestra una síntesis de las situaciones más comúnmente aceptadas de las guías y consensos nacionales e internacionales.
Indicaciones de la densitometría ósea en el cribado de la osteoporosis en las personas mayores
| Mujeres y hombres con sospecha o actual fractura por fragilidada | |
|---|---|
| Mujeres posmenopáusicas>65 años y hombre>70 años con algún/os de los factores de riesgo asociadosb | |
| Factores de riesgo mayores Tratamiento con prednisona a dosis>7,5mg/día durante más de 3 meses Antecedentes familiares de fractura de cadera IMC<20kg/m2 Menopausia precoz<45 años no tratada Caídas (>2 en el último año) | Factores de riesgo menores Tabaquismo activo Ingesta enólica>20U/semana en hombres y 13U/semana en mujeres Enfermedades crónicas que disminuyan la DMO (p. ej. artritis reumatoide, hiperparatiroidismo, síndromes malabsortivos…) Tratamiento con fármacos que disminuyan la DMO (p. ej. anticonvulsivantes, heparina, inhibidores de la aromatasa…) |
DMO: densidad mineral ósea; IMC: índice de masa corporal.
Aunque no es necesaria la DEXA para inicio del tratamiento, sí se considera aconsejable realizarla para evaluar la eficacia del mismo.
Falta de consenso entre 1-2 mayores, un mayor y un menor, 2 menores o ninguna si se cumple el criterio de edad.
Adaptada de Sanfélix-Genovés et al.39.
Sin embargo, aparte de la densidad ósea, cada vez se ve que son más importantes los factores que afectan a la calidad ósea. Estos factores, que no se tienen en cuenta con los criterios previos, se deben de tener en consideración a la hora del diagnóstico y manejo de la osteoporosis y, por consiguiente, de la osteosarcopenia. Estos factores pueden usarse incluso para evaluar el riesgo de fractura en ausencia de DEXA. Entre las herramientas utilizadas para predecir dicho riesgo se encuentran el FRAX®40, herramienta que combina factores de riesgo y la DMO para estimar el riesgo de fracturas a 10 años (encontrándose validada para población española41). Dado que el FRAX subestima el riesgo de fractura en la población española se han establecido como puntos de corte para riesgo de fractura mayor bajo (<5%), intermedio (5-7,5%) y alto (>7,5%) respectivamente42. Sin embargo, dadas las limitaciones de esta herramienta y que no considera un gran número de factores relacionados con el riesgo de fractura (incluyendo la presencia de sarcopenia), han surgido nuevas herramientas como el Q-Fracture43. Esta herramienta, que tiene en cuenta un mayor número de factores de riesgo, está validada para una población hasta los 99 años. Además no necesita la medida de la DMO para tener la misma capacidad predictiva que el FRAX® y estima el riesgo de fracturas en intervalos de 1-10 años. Sin embargo, no se encuentra validado para población española.
SarcopeniaLa sarcopenia es un síndrome que se caracteriza por una pérdida gradual de masa muscular esquelética, fuerza y/o función con riesgo de presentar resultados adversos como discapacidad física, pérdida de calidad de vida y mortalidad44. Aunque hoy en día no existe consenso sobre una definición operativa de la sarcopenia45, la más utilizada es la propuesta por el Grupo Europeo de Trabajo sobre la Sarcopenia en Personas de Edad Avanzada (EWGSOP, European Working Group on Sarcopenia in Older People), que incluye la presencia de baja masa muscular y una función muscular deficiente (fuerza muscular o rendimiento físico)4.
Entre las técnicas para el diagnóstico de la masa muscular se encuentran la resonancia magnética, la tomografía computarizada, la DEXA, el análisis de la bioimpedancia (BIA) y medidas antropométricas4,37. La DEXA es la técnica más aceptada para evaluar la masa muscular tanto en la práctica clínica como en la investigación, siendo más precisa y menos costosa que las otras técnicas de imagen37. La BIA es una alternativa a la DEXA barata, reproducible y disponible con equipos portátiles con una alta fiabilidad y concordancia con las mediciones realizadas con DEXA46. Las principales sociedades científicas han propuesto una serie de valores límites para la valoración de la baja masa muscular. Los más difundidos y utilizados en la valoración de la osteosarcopenia se muestran en la tabla 2 (entre ellos se encuentran los de Masanes, realizados en población mayor española19). Las medidas antropométricas son poco fiables y no se recomiendan su uso para la valoración de la sarcopenia.
Comparación de diferentes definiciones operativas de Sarcopenia4,19,45
| IMA | IMA/IMC | IME | FP | V6M | |||||
|---|---|---|---|---|---|---|---|---|---|
| Hombre | Mujer | Hombre | Mujer | Hombre | Mujer | Hombre | Mujer | ||
| AWGS | <7 | <5,4 | <8,87 | <6,42 | <26 | <18 | <0,8 | ||
| EWGSOP | <7,26 | <5,5 | <8,50 | <5,75 | <28 | <18 | <0,8 | ||
| FNIH | <0,789 | <0,512 | <26 | <16 | <0,8 | ||||
| IWGS | ≤7,23 | ≤5,67 | <1 | ||||||
| Masanes et al. | <8,31 | <6,68 | |||||||
AWGS: Grupo Asiático de Trabajo sobre la Sarcopenia (Asian Working Group for Sarcopenia); EWGSOP: Grupo Europeo de Trabajo sobre la Sarcopenia en Personas de Edad Avanzada (European Working Group on Sarcopenia in Older People); FNIH: Fundación para los Institutos Nacionales de Salud de los Estados Unidos (Foundation for the [US] National Institutes of Health); FP: fuerza de prensión manual (kg); IMA: índice de músculo apendicular (masa muscular esquelética de las extremidades/talla2; kg/m2). Obtenido mediante DEXA; IMC: índice de masa corporal (kg/m2); IME: índice de músculo esquelético (masa muscular esquelética/talla2; kg/m2). Obtenido mediante BIA; IWGS: Grupo Internacional de Trabajo sobre la Sarcopenia (International Working Group on Sarcopenia); V6M: velocidad de la marcha sobre 6metros (m/s).
La fuerza muscular puede evaluarse midiendo la fuerza de prensión manual (sencilla, aplicable a la práctica clínica y con buena correlación con la fuerza en los miembros inferiores), de flexoextensión de la rodilla (uso limitado por la necesidad de un equipo especial y de formación) y el flujo espiratorio máximo4.
Entre las pruebas de rendimiento físico utilizadas figuran la batería corta de rendimiento físico (SPPB, Short Physical Performance Battery), la velocidad de la marcha y el test cronometrado de levantarse y andar (Timed Get Up and Go test)4.
Los algoritmos para identificar a pacientes con sarcopenia también varían entre sociedades, aunque suele basarse en la valoración de la fuerza muscular o del rendimiento físico previo a la realización de pruebas para evaluar la masa muscular. Ante las limitaciones de realizar este abordaje en atención primaria o en entornos con limitación de medios, han surgido una serie de escalas destinas al cribado del paciente sarcopénico. Destaca el SARC-F, cuestionario auto-administrado de 5 preguntas sobre las características o consecuencias de la sarcopenia como paso previo a una valoración más exhaustiva47.
OsteosarcopeniaLa osteosarcopenia define a los sujetos que presentan sarcopenia y baja DMO, entendiendo la relación entre ambas como un continuum de la enfermedad musculoesquelética. Huo et al. proponen unos criterios de osteosarcopenia que aparecen en la tabla 324, siendo mayor la incidencia de caídas y antecedentes de fractura respecto a los otros grupos por separado26. Otros criterios se han definido según diferentes puntos de corte para el diagnóstico de la sarcopenia o de la baja DMO22,34, motivo por lo que es importante conocer la valoración de ambas.
Criterios diagnósticos de osteosarcopenia
| Baja densidad mineral ósea |
| T-score<1 desviación estándar |
| Sarcopenia (al menos 2 de los siguientes criterios) |
| Velocidad de la marcha<0,8m/s |
| Fuerza de prensión manual<20kg en mujeres o<30kg en varones |
| Masa muscular apendicular ajustada por altura<5,5 kg/m2 en mujeres o<7,26 kg/m2 en varones (DEXA) |
Fuente: Huo et al.24.
La osteosarcopenia cumple los criterios para ser considerada un síndrome geriátrico, dada su prevalencia en las personas mayores21–24, su relación con múltiples factores de riesgo5,30 y ser capaz de provocar diversas enfermedades con múltiples eventos adversos4,38. Además su tratamiento requiere un abordaje integral de un equipo multidisciplinar. Por ello el manejo de la osteosarcopenia debería entrar dentro de los síndromes geriátricos ya que un fallo en su prevención y/o tratamiento traería consigo un grave perjuicio a los pacientes con un aumento de la dependencia, mortalidad y coste sanitario48.
TratamientoLa osteosarcopenia es potencialmente tratable en prevención primaria y secundaria. A falta de estudios específicos sobre tratamiento en osteosarcopenia nos basamos en tratamientos dirigidos a la sarcopenia y/o baja DMO ya que, dada la interrelación entre hueso y músculo, este abordaje integral es el más probablemente efectivo.
La prevención y tratamiento de los factores de riesgo modificables, especialmente las alteraciones endocrinas y la toma de corticoides, son fundamentales en el manejo de la sarcopenia, la osteoporosis y la osteosarcopenia2,4,49.
El estilo de vida del paciente se ha relacionado con la salud del sistema musculoesquelético. Las intervenciones nutricionales que aseguran una ingesta proteica de 1,0-1,2mg/kg/día, 1.000mg/día de calcio y 800-1.000UI/día de vitamina D3,31,49,50 y las basadas en el ejercicio 3 días a la semana (mínimo de 30min y que incluya ejercicios de fuerza y resistencia progresivas)49–52 contribuyen a mejorar la masa muscular y ósea, aumentan la fuerza muscular, reducen o retrasan las limitaciones funcionales, y previenen caídas y fracturas en las personas mayores. Actualmente existen múltiples proyectos para acercar el ejercicio físico a las personas mayores como el Programa de Ejercicio Físico Multicomponente ViviFrail, el Programa de Educación Nutricional y Actividad Física en el Anciano R+ACTIVA y el programa de ejercicios Otago entre otros. Dentro de los aportes minerales, el magnesio, el selenio y el calcio podrían, entre otros minerales, incrementar el rendimiento físico53. No obstante, estos hallazgos no son definitivos al basarse en estudios observacionales. También debemos considerar el cese del hábito tabáquico y la limitación en el consumo enólico.
Dentro de los tratamientos farmacológicos encontramos extensa evidencia en la prevención y tratamiento de la osteoporosis. Actualmente podemos dividir los fármacos para la osteoporosis en antirreabsortivos (bifosfonatos, denosumab) y anabólicos (teriparatida). Los tratamientos que han demostrado eficacia en las personas mayores y su número necesario a tratar (NNT) son: alendronato (NNT fractura vertebral 15, NNT fractura cadera 91), risedronato (NNT fractura vertebral 10, NNT fractura cadera 91), zoledronato (NNT fractura vertebral 14, NNT fractura cadera 91), denosumab (NNT fractura vertebral 21, NNT fractura cadera 334), teriparatida (NNT fractura vertebral 12) y ranelato de estroncio (NNT fractura vertebral 9, NNT fractura cadera 48) para prevención de fractura3,54,55. Dada la alerta sanitaria en relación con el ranelato de estroncio por el aumento de enfermedad cerebrovascular y tromboembólica, no lo consideramos de primera elección en pacientes mayores. Sin embargo, no hay actualmente evidencia de su efecto en el músculo ni del beneficio de tratar a pacientes con osteopenia.
Nuevos tratamientos farmacológicos se están desarrollando para el manejo de la baja DMO y la sarcopenia45. Entre ellos la miostatina (inhibidor del desarrollo muscular) es una de las dianas terapéuticas que se estudian en la actualidad56. La administración de ACVR2B-Fc (proteína recombinante del receptor de miostatina) dio como resultado un aumento de la masa corporal magra y los marcadores de formación ósea en un estudio en mujeres posmenopáusicas57. El anticuerpo de miostatina LY2495655 se ha relacionado con un moderado incremento de la masa y fuerza muscular58. Otras terapias farmacológicas como la testosterona59, los inhibidores de la enzima convertidora de angiotensina, ghrelina56, la hormona del crecimiento y el factor 1 de tipo insulínico también han sido evaluadas tanto para tratar la osteoporosis como la sarcopenia, pero hasta el momento no se han encontrado evidencias claras de sus beneficios60.
ConclusionesCon esta revisión intentamos resumir la evidencia existente sobre la diversidad de aspectos de la osteosarcopenia. Aunque nos encontramos con una limitación, al estar la literatura centrada en la sarcopenia o la osteoporosis por separado, cada vez surgen más artículos que estudian ambas enfermedades en su conjunto. Aun con ello se requiere investigación a múltiples niveles para acabar de definir completamente este fenotipo.
La osteosarcopenia es un síndrome que cada vez será más frecuente en una población más envejecida, con una serie de eventos adversos y coste sanitario elevados. Conocer su epidemiología, fisiopatología y diagnóstico es fundamental de cara a un correcto diagnóstico y manejo.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses ni financiación en la realización de este artículo.
El Dr. Cedeno-Veloz escribe este artículo como parte de su Observership Program en el Australian Institute for Musculoskeletal Science (AIMSS) patrocinado por la Sociedad Española de Medicina Geriátrica (SEMEG).