La demencia es una de las enfermedades más frecuentes en el adulto mayor, siendo su prevalencia de hasta el 64% en institucionalizados. En esta población, además de fármacos antidemencia, es común prescribir fármacos con carga anticolinérgica/sedante que, por sus efectos adversos, podrían empeorar su funcionalidad y estado cognitivo.
El objetivo es conocer la prevalencia de uso de fármacos con carga anticolinérgica/sedante en mayores institucionalizados con demencia y analizar factores asociados.
Materiales y métodosEstudio transversal en centros residenciales en mayores con demencia. Se estimó la prevalencia de prescripción de fármacos con carga anticolinérgica/sedante según el Drug Burden Index (DBI). Se realizó un análisis comparativo de la puntuación DBI entre diferentes tipos de demencia, así como entre diversos factores y según el riesgo anticolinérgico/sedante, estableciendo como punto de corte un DBI ≥ 1 (alto riesgo).
ResultadosDe los 178 residentes analizados, el 83,7% presentó algún fármaco con carga anticolinérgica/sedante según DBI. Un 50% tuvo una puntuación DBI ≥ 1. Los residentes con demencia vascular presentaron un DBI medio de 1,34 (desviación estándar 0,84), puntuación significativamente mayor que los residentes con enfermedad de Alzheimer (0,41; IC del 95%, 0,04-0,78). Igualmente, se asoció un DBI superior con más polifarmacia (3,36; IC del 95% 2,64-4,08), más caídas, ingresos hospitalarios y consultas a urgencias (p < 0,05).
ConclusionesLa polifarmacia y la prescripción de fármacos con carga anticolinérgica/sedante son frecuentes en el adulto mayor institucionalizado con demencia, encontrándose una asociación entre el DBI, las caídas y la frecuentación sanitaria. Por ello, es necesario plantear estrategias de optimización farmacoterapéutica interdisciplinares.
Dementia is one of the most frequent diseases in the elderly, being its prevalence of up to 64% in institutionalized people. In this population, in addition to antidementia drugs, it is common to prescribe drugs with anticholinergic/sedative burden that, due to their adverse effects, could worsen their functionality and cognitive status.
The objective is to estimate the prevalence of the use of drugs with anticholinergic/ sedative burden in institutionalized older adults with dementia and to assess the associated factors.
Materials and methodsA cross-sectional study developed in older with dementia living in nursing homes. The prevalence of prescription of anticholinergic/sedative drugs was estimated according to the Drug Burden Index (DBI). A comparative analysis of the DBI score was performed between different types of dementia as well as among various factors and according to the anticholinergic/sedative risk, establishing as a cut-off point of DBI≥1 (high anticholinergic/sedative risk).
Results178 residents were included. 83.7% had some drug with anticholinergic/sedative burden according to DBI. 50% had a DBI≥1 score. Residents with vascular dementia had a mean DBI of 1.34 (SD 0.84), a significantly higher score than residents with Alzheimer's disease (0.41, 95% CI 0.04-0.78).). Likewise, a higher DBI was associated with more polypharmacy (3.36; 95% CI 2.64-4.08), more falls, hospital admissions and emergency room visits (P<.05).
ConclusionsPolypharmacy and prescription of anticholinergic/sedative drugs is frequent among institutionalized older adults with dementia, finding an association between DBI, falls and hospital admissions or emergency department visits. Therefore, it is necessary to propose interdisciplinary pharmacotherapeutic optimization strategies.
El incremento en la esperanza de vida está originando un crecimiento acelerado en el porcentaje de personas mayores, aumentando, por tanto, el envejecimiento de la población1. Paralelamente, aumentan las enfermedades crónicas, siendo común entre la población anciana la multimorbilidad que, frecuentemente, deriva en una prescripción múltiple de medicamentos2.
La polifarmacia afecta al 40-50% de los mayores3. Entre los no institucionalizados de España la prevalencia de la misma alcanza hasta un 27,3%2, siendo los mayores de 80 años el grupo de edad con un mayor porcentaje de incremento de la polifarmacia (3,4%) en un periodo de estudio de 10 años4. En otros países, como Estados Unidos, esta prevalencia oscila del 25 al 40%5. Bien es conocido que la polifarmacia en los mayores institucionalizados es aún más prevalente. Así, hasta un 91, un 74 y un 65% de los institucionalizados mayores de 65 años toman más de 5, 9 y 10 medicamentos respectivamente, margen ampliamente variable entre los diferentes estudios en función del tipo de centro y definición de polifarmacia6. A nivel europeo, casi un 25% de los institucionalizados toma 10 o más fármacos de manera diaria7. El manejo de esta polifarmacia en el anciano es todo un reto para el profesional sanitario ya que, por sus cambios farmacocinéticos/farmacodinámicos y el aumento del riesgo de interacciones fármaco-fármaco y fármaco-enfermedad son más susceptibles de presentar reacciones adversas derivadas de la misma8.
Además, hasta un 50% de los mayores tiene prescrito algún fármaco con carga anticolinérgica/sedante, pudiendo, en consecuencia, empeorar su capacidad funcional o cognitiva9-11, entre otros. Estos son fármacos que se emplean habitualmente para tratar la depresión, la incontinencia urinaria, el insomnio, el temblor, los trastornos de conducta, etc. Sin embargo, los efectos adversos que pueden provocar tanto a nivel periférico (estreñimiento, visión borrosa, sequedad de boca, retención urinaria, etc.) como a nivel central (deterioro cognitivo, mareo, sedación, delirio, alteración funcional, etc.) en muchas ocasiones superan los posibles beneficios, resultando aún más problemático dicho balance en mayores de 80 años por su vulnerabilidad y mayor riesgo de presentar reacciones adversas12. Son varias las escalas que miden la exposición a estos fármacos, cada una con sus propias ventajas e inconvenientes, existiendo una falta de consenso respecto a la más idónea.
La demencia, altamente prevalente en la persona mayor, afecta a unos 50 millones de personas a nivel mundial. El riesgo de presentarla aumenta netamente con la edad y se calcula que entre un 25 y un 30% de las personas de 85 años o más presentan cierto grado de deterioro cognitivo13. Entre las personas institucionalizadas se estima que la prevalencia de demencia oscila entre el 50 y el 64%14-16. En esta población, además de la prescripción de fármacos antidemencia, es frecuente prescribir fármacos con carga anticolinérgica/sedante que pueden incluso exacerbar los síntomas relacionados con la propia enfermedad (confusión, delirios, incremento de la fragilidad, caídas, etc.). Hasta un 77% de los institucionalizados con demencia tiene prescrito algún fármaco con estas propiedades14, que al tener un efecto opuesto a los fármacos antidemencia podrían disminuir sus posibles beneficios a nivel cognitivo17,18.
El objetivo principal de este estudio es conocer la prevalencia de uso de fármacos con propiedades anticolinérgicas/sedantes en mayores institucionalizados con demencia. Secundariamente, se plantea medir la frecuencia de caídas, la utilización de recursos asistenciales como ingresos hospitalarios y llamadas o visitas al servicio de urgencias con el fin de establecer alguna relación con la carga anticolinérgica/sedante.
Material y métodosEstudio transversal en personas mayores con diagnóstico de demencia institucionalizadas en centros residenciales (CR) para personas dependientes.
El presente trabajo se llevó a cabo en una fundación que presta servicios sociosanitarios a alrededor de 850 personas institucionalizadas distribuidas en 7 centros. Este estudio se enmarca dentro de otro de mayor alcance, un estudio multicéntrico antes-después denominado proyecto Red-COLINA, cuyo objetivo principal es la evaluación de la efectividad de la revisión de tratamientos farmacológicos, aplicados por equipos asistenciales independientes y liderados por farmacéuticos hospitalarios, en la reducción de la carga anticolinérgica/sedante, medida mediante la escala Drug Burden Index (DBI), en mayores institucionalizados con demencia. De manera secundaria, además de medir la prevalencia de prescripción de fármacos anticolinérgicos/sedantes, se compara, en función de la magnitud de carga anticolinérgica/sedante, medida en 3tiempos diferentes durante un año, la prevalencia de caídas, el posible deterioro o no de la funcionalidad y estado cognitivo, y la frecuentación sanitaria.
La recogida de datos se llevó a cabo en 2periodos. Inicialmente, a fecha de 31 de octubre del 2017, se midió la prevalencia de prescripción de fármacos con propiedades anticolinérgicas/sedantes de todos los residentes con diagnóstico de demencia y tratamiento activo de 2CR para realizar un análisis situacional. Se excluyó a aquellos que se encontraban en situación de últimos días. A continuación, a lo largo del 2019, enfocado como la primera fase del estudio Red-COLINA, se recogió la información de los residentes de los 7 CR de la fundación con diagnóstico de demencia, tratamiento activo y un año de institucionalización; excluyéndose, nuevamente, aquellos que se encontraban en situación de últimos días y siendo diferentes de los reclutados en 2017. Debido a la capacidad de revisión por parte de los farmacéuticos hospitalarios, que exige la segunda fase del Red-COLINA, en este segundo periodo, se seleccionó únicamente a aquellos residentes cuya valoración geriátrica integral (VGI) quedaba próxima a la fecha de revisión del tratamiento farmacológico y cumplían los criterios de inclusión establecidos. Se reclutó el número de residentes necesario fijado por el tamaño de muestra calculado por otro centro partícipe del estudio. Todos los CR incluidos en el trabajo disponen de médico propio con una atención sanitaria homogénea, aunque con variabilidades estructurales en cuanto a tamaño (capacidad desde 59 a 145 residentes). Tres farmacéuticos hospitalarios son los responsables de la validación de las órdenes médicas de los CR que, a su vez, son los investigadores del estudio.
Las variables analizadas fueron las siguientes: edad y sexo, tiempo de institucionalización, tipo de demencia, índice de Barthel (IB)19, Miniexamen cognoscitivo de 35 puntos (MEC-35)20, escala de deterioro global (GDS-FAST)21, índice de fragilidad basado en la VGI (IF-VIG)22, test de cribado de NECesidades PALiativas (NECPAL)23, número de medicamentos (sin contabilizar tratamientos agudos ni a demanda), número de medicamentos con carga anticolinérgica/sedante, puntuación de carga anticolinérgica/sedante según DBI24,25, prescripción de inhibidores de la acetilcolinesterasa (IACE) o memantina, número de caídas en el año anterior, número de ingresos hospitalarios y de consultas a urgencias (llamada o visita al servicio de urgencias) durante el año anterior a la fecha de la recogida de los datos. El IF-VIG y el test NECPAL es información que se incluyó en la historia clínica informatizada a partir del año 2018, por lo que estos datos se disponen únicamente para los residentes reclutados en el año 2019. Además, en estos residentes recopilados en el 2019, se recogieron otras variables, aparte de las citadas, con proyección a la segunda fase del Red-COLINA.
Para estudiar las correlaciones entre DBI y las diferentes variables, se fijó, arbitrariamente, como punto de corte DBI ≥ 1, considerado como riesgo alto, y DBI < 1, riesgo bajo-moderado (DBI < 0,5 riesgo bajo y DBI 0,5-0,99 riesgo moderado). La puntuación en la escala DBI ≥ 2 se consideró como riesgo muy alto.
La información fue recogida por un farmacéutico hospitalario a partir del sistema electrónico de gestión sociosanitario propio (sistema de gestión de centros asistenciales [SIGECA]).
Se realizó un análisis descriptivo de medidas de tendencia central (media, mediana) y de dispersión (desviación típica y amplitud intercuartílica) para variables cuantitativas, y frecuencias y porcentajes para variables cualitativas. Se aplicó un análisis estadístico ANOVA con prueba post hoc de Bonferroni para comparar los valores medios de DBI entre los diferentes tipos de demencia. Para la comparación entre los pacientes con DBI < 1 y DBI ≥ 1 se empleó la prueba de la t de Student para variables cuantitativas que seguían una distribución normal y, en caso contrario, la prueba U de Mann-Whitney. Para las variables categóricas se realizó el test de la χ2, calculando las odds ratio (OR) y los intervalos de confianza (IC) del 95%, salvo para la variable número de medicamentos categorizada en 3 grupos (< 5 medicamentos, 5-9 medicamentos, ≥ 10 medicamentos), para la que, en este caso, se realizó una regresión logística simple. Los datos se analizaron con el software estadístico IBM SPSS Statistics for Windows, version 20.0; se definió la significación estadística para una p < 0,05 con contraste bilateral.
Consideraciones éticas: la recogida de datos de la historia clínica para fines de investigación fue realizada por los investigadores, quienes también fueron encargados de la anonimización de los datos. El trabajo ha sido evaluado y aprobado por el Comité de Ética correspondiente (número de identificación PI2019009) y se han seguido las recomendaciones de la Declaración STROBE26.
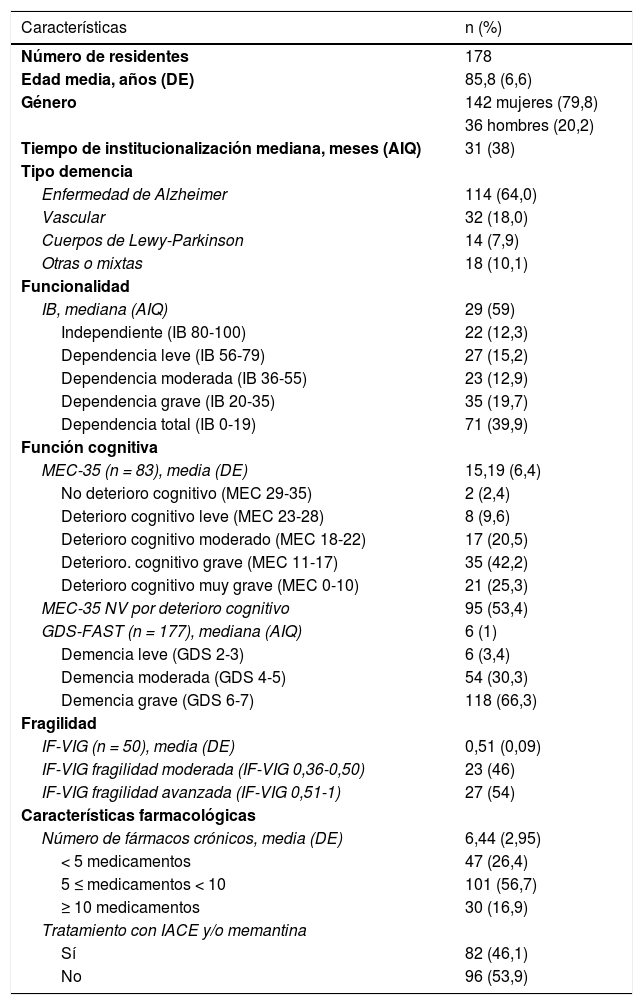
ResultadosEl número total de residentes evaluados fue 178 (127 se reclutaron en 2017 y 51 en 2019), de los que el 79,8% fueron mujeres.
El 72,5% del total de la población estudiada presentó una dependencia moderada-severa (IB < 55) y el 66,3% presentó un deterioro cognitivo grave o muy grave (GDS ≥ 6). Se registraron el IF-VIG y el test NECPAL de 50 residentes, siendo el valor medio del IF-VIG 0,51 (desviación estándar [DE] 0,09). De estos 50, 18 (35,3%) presentaron un resultado NECPAL positivo. En cuanto al tratamiento farmacológico, el número medio de fármacos/residente fue 6,44 (DE 2,95) presentando hasta un 16,9% de los residentes hiperpolifarmacia (≥ 10 fármacos). El 46,1% (n = 82) presentó fármacos antidemencia en su tratamiento. En la tabla 1 se describen los datos demográficos y clínicos de la población estudiada.
Características generales y descripción de la muestra
| Características | n (%) |
|---|---|
| Número de residentes | 178 |
| Edad media, años (DE) | 85,8 (6,6) |
| Género | 142 mujeres (79,8) |
| 36 hombres (20,2) | |
| Tiempo de institucionalización mediana, meses (AIQ) | 31 (38) |
| Tipo demencia | |
| Enfermedad de Alzheimer | 114 (64,0) |
| Vascular | 32 (18,0) |
| Cuerpos de Lewy-Parkinson | 14 (7,9) |
| Otras o mixtas | 18 (10,1) |
| Funcionalidad | |
| IB, mediana (AIQ) | 29 (59) |
| Independiente (IB 80-100) | 22 (12,3) |
| Dependencia leve (IB 56-79) | 27 (15,2) |
| Dependencia moderada (IB 36-55) | 23 (12,9) |
| Dependencia grave (IB 20-35) | 35 (19,7) |
| Dependencia total (IB 0-19) | 71 (39,9) |
| Función cognitiva | |
| MEC-35 (n = 83), media (DE) | 15,19 (6,4) |
| No deterioro cognitivo (MEC 29-35) | 2 (2,4) |
| Deterioro cognitivo leve (MEC 23-28) | 8 (9,6) |
| Deterioro cognitivo moderado (MEC 18-22) | 17 (20,5) |
| Deterioro. cognitivo grave (MEC 11-17) | 35 (42,2) |
| Deterioro cognitivo muy grave (MEC 0-10) | 21 (25,3) |
| MEC-35 NV por deterioro cognitivo | 95 (53,4) |
| GDS-FAST (n = 177), mediana (AIQ) | 6 (1) |
| Demencia leve (GDS 2-3) | 6 (3,4) |
| Demencia moderada (GDS 4-5) | 54 (30,3) |
| Demencia grave (GDS 6-7) | 118 (66,3) |
| Fragilidad | |
| IF-VIG (n = 50), media (DE) | 0,51 (0,09) |
| IF-VIG fragilidad moderada (IF-VIG 0,36-0,50) | 23 (46) |
| IF-VIG fragilidad avanzada (IF-VIG 0,51-1) | 27 (54) |
| Características farmacológicas | |
| Número de fármacos crónicos, media (DE) | 6,44 (2,95) |
| < 5 medicamentos | 47 (26,4) |
| 5 ≤ medicamentos < 10 | 101 (56,7) |
| ≥ 10 medicamentos | 30 (16,9) |
| Tratamiento con IACE y/o memantina | |
| Sí | 82 (46,1) |
| No | 96 (53,9) |
AIQ: amplitud intercuartílica; DE: desviación estándar; IACE: inhibidor de la acetilcolinesterasa; IB: índice de Barthel; IF-VIG: índice de fragilidad basado en la valoración geriátrica integral; GDS-FAST: escala de deterioro global; MEC-35: Miniexamen cognoscitivo de 35 puntos; NV: no valorable.
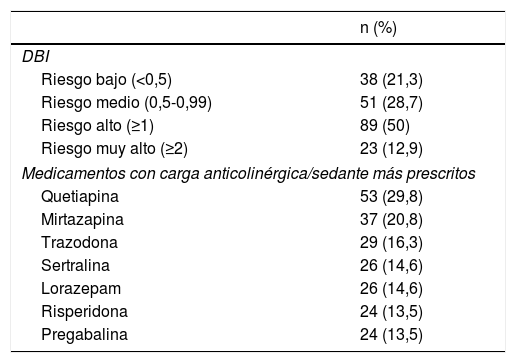
Respecto a la prescripción de fármacos con propiedades anticolinérgicas/sedantes según la escala DBI, el 83,7% de los institucionalizados presentó al menos un fármaco de estas características en su tratamiento farmacológico. El número medio de fármacos con carga anticolinérgica/sedante prescrito por residente fue 1,85 (DE 1,28) con una puntuación media de 1,02 (DE 0,77) según la escala DBI. El 21,3% de los usuarios presentó un riesgo bajo (DBI < 0,5), un 50% presentó un riesgo alto (DBI ≥ 1) y hasta un 12,9% presentó un riesgo muy alto (DBI ≥ 2). El fármaco con carga anticolinérgica/sedante según DBI más prescrito fue la quetiapina (29,8%) (tabla 2). Hasta un 57,9% (n = 103) presentó en su tratamiento 2 o más fármacos con propiedades anticolinérgicas/sedantes, de los que un 50,5% (n = 52) tuvo prescrito de manera concomitante un IACE o memantina y de los que un 9,6% (n = 5) estaban diagnosticados de demencia vascular. En la tabla 3 se describe el porcentaje de población en tratamiento con IACE o memantina distribuidos según el tipo de demencia.
Distribución de residentes según el DBI de su tratamiento y fármacos con carga anticolinérgica sedante más prescritos
| n (%) | |
|---|---|
| DBI | |
| Riesgo bajo (<0,5) | 38 (21,3) |
| Riesgo medio (0,5-0,99) | 51 (28,7) |
| Riesgo alto (≥1) | 89 (50) |
| Riesgo muy alto (≥2) | 23 (12,9) |
| Medicamentos con carga anticolinérgica/sedante más prescritos | |
| Quetiapina | 53 (29,8) |
| Mirtazapina | 37 (20,8) |
| Trazodona | 29 (16,3) |
| Sertralina | 26 (14,6) |
| Lorazepam | 26 (14,6) |
| Risperidona | 24 (13,5) |
| Pregabalina | 24 (13,5) |
DBI: Drug Burden Index.
Prescripción de fármacos antidemencia según el tipo de demencia
| Tipo de Demencia | IACE o memantina sín (%) | IACE o memantina non (%) |
|---|---|---|
| Enfermedad de Alzheimer | 60 (52,6) | 54 (47,4) |
| Vascular | 8 (25) | 24 (75) |
| Cuerpos de Lewy-Parkinson | 10 (71,4) | 4 (28,6) |
| Otras o mixtas | 4 (22,2) | 14 (77,8) |
IACE: inhibidor de la acetilcolinesterasa.
Comparando las medias de la puntuación DBI con los diferentes tipos de demencia, se observó que los residentes con demencia vascular presentaron una mayor carga anticolinérgica/sedante, encontrándose una diferencia estadísticamente significativa con los pacientes con enfermedad de Alzheimer (0,41; IC del 95%, 0,04-0,78; p < 0,05) (tabla 4). Igualmente, se observó una diferencia estadísticamente significativa en la media del número de medicamentos entre los pacientes con DBI < 1 y DBI ≥ 1 (3,36; IC del 95%, 2,64-4,08; p < 0,05) (tabla 5).
DBI según el tipo de demencia
| Tipo demencia (n = 160) | Media DBI (DE) | Diferencia en las medias (IC del 95%) | p |
|---|---|---|---|
| Enfermedad de Alzheimer | 0,93 (0,74) | Referencia | Referencia |
| Lewy – Parkinson | 0,99 (0,70) | 0,06 (-0,45 - 0,58) | p=1,00 |
| Vascular | 1,34 (0,84) | 0,41 (0,04 - 0,78) | p=0,02 |
DBI: Drug Burden Index; DE: desviación estándar; IC: intervalo de confianza.
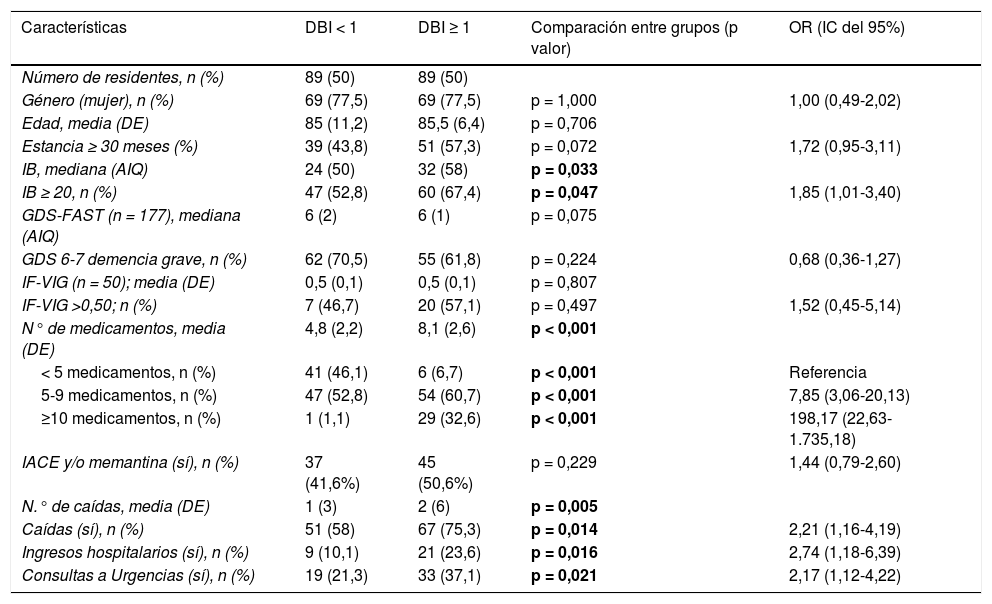
Factores sociodemográficos, clínicos y farmacológicos asociados al índice DBI
| Características | DBI < 1 | DBI ≥ 1 | Comparación entre grupos (p valor) | OR (IC del 95%) |
|---|---|---|---|---|
| Número de residentes, n (%) | 89 (50) | 89 (50) | ||
| Género (mujer), n (%) | 69 (77,5) | 69 (77,5) | p = 1,000 | 1,00 (0,49-2,02) |
| Edad, media (DE) | 85 (11,2) | 85,5 (6,4) | p = 0,706 | |
| Estancia ≥ 30 meses (%) | 39 (43,8) | 51 (57,3) | p = 0,072 | 1,72 (0,95-3,11) |
| IB, mediana (AIQ) | 24 (50) | 32 (58) | p = 0,033 | |
| IB ≥ 20, n (%) | 47 (52,8) | 60 (67,4) | p = 0,047 | 1,85 (1,01-3,40) |
| GDS-FAST (n = 177), mediana (AIQ) | 6 (2) | 6 (1) | p = 0,075 | |
| GDS 6-7 demencia grave, n (%) | 62 (70,5) | 55 (61,8) | p = 0,224 | 0,68 (0,36-1,27) |
| IF-VIG (n = 50); media (DE) | 0,5 (0,1) | 0,5 (0,1) | p = 0,807 | |
| IF-VIG >0,50; n (%) | 7 (46,7) | 20 (57,1) | p = 0,497 | 1,52 (0,45-5,14) |
| N° de medicamentos, media (DE) | 4,8 (2,2) | 8,1 (2,6) | p < 0,001 | |
| < 5 medicamentos, n (%) | 41 (46,1) | 6 (6,7) | p < 0,001 | Referencia |
| 5-9 medicamentos, n (%) | 47 (52,8) | 54 (60,7) | p < 0,001 | 7,85 (3,06-20,13) |
| ≥10 medicamentos, n (%) | 1 (1,1) | 29 (32,6) | p < 0,001 | 198,17 (22,63-1.735,18) |
| IACE y/o memantina (sí), n (%) | 37 (41,6%) | 45 (50,6%) | p = 0,229 | 1,44 (0,79-2,60) |
| N.° de caídas, media (DE) | 1 (3) | 2 (6) | p = 0,005 | |
| Caídas (sí), n (%) | 51 (58) | 67 (75,3) | p = 0,014 | 2,21 (1,16-4,19) |
| Ingresos hospitalarios (sí), n (%) | 9 (10,1) | 21 (23,6) | p = 0,016 | 2,74 (1,18-6,39) |
| Consultas a Urgencias (sí), n (%) | 19 (21,3) | 33 (37,1) | p = 0,021 | 2,17 (1,12-4,22) |
AIQ: amplitud intercuartílica; DBI: Drug Burden Index; DE: desviación estándar; IACE: inhibidor de la acetilcolisterasa; IB: índice de Barthel; GDS-FAST: Escala de deterioro global; IC: intervalo de confianza; IF-VIG: índice de fragilidad basado en la valoración geriátrica integral; OR: odds ratio.
El 66,3% (n = 118) de los residentes presentó alguna caída durante el año anterior al momento de la recogida de los datos y hasta un 22% presentó 5 o más caídas. El 16,9% tuvo algún ingreso hospitalario y en casi un 30% de los residentes fue necesario consultar al servicio de Urgencias. Analizando estas variables según DBI, comparando DBI < 1 con DBI ≥ 1, se observó de manera estadísticamente significativa una asociación entre la puntuación DBI y las caídas, los ingresos hospitalarios y las consultas a urgencias en el periodo del año anterior. A su vez, los residentes con IB ≥ 20 se asociaron a puntuaciones DBI más altas (DBI ≥ 1). En la tabla 5 se describe la relación del DBI con otras variables.
DiscusiónEntre nuestros residentes es destacable la polifarmacia. Un 73,6% de los usuarios están polimedicados, de los que un 16,9% presentan 10o más fármacos en su prescripción. La prevalencia de uso de fármacos con carga anticolinérgica/sedante también es elevada (83,7%), incluso superior a lo descrito en la bibliografía, pues la prevalencia de uso de fármacos con estas propiedades en mayores de 65 años oscila del 21 al 63%8,10,27,28, hasta un 43 y un 60% en personas con demencia18,29 y hasta un 77% en mayores institucionalizados con demencia14. Son varios los trabajos que indican que el empleo de fármacos anticolinérgicos es más frecuente en institucionalizados que en personas que viven en la comunidad; sin embargo, los datos de prevalencia son ampliamente variables en función de la metodología del estudio y la escala anticolinérgica utilizada para la detección y la medición del riesgo anticolinérgico8,18.
Atendemos a una población con fragilidad moderada-avanzada, con un grado de dependencia moderado-severo y con una demencia avanzada, siendo la enfermedad de Alzheimer la más prevalente. Estas características son frecuentes en la población anciana institucionalizada que, asociadas a sus comorbilidades, pueden derivar en una polifarmacia que incrementa el riesgo de prescripciones de fármacos potencialmente inapropiados para este grupo poblacional, aumentando, en consecuencia, los problemas relacionados con los medicamentos30. Entre ellos, los fármacos con propiedades anticolinérgicas/sedantes merecen una especial mención. Antidepresivos, benzodiacepinas, antipsicóticos, estabilizadores del ánimo, etc. son fármacos frecuentemente prescritos entre la población institucionalizada con demencia, ya que permiten aliviar la sintomatología psicoconductual derivada de la propia enfermedad; sin embargo, estos medicamentos suelen presentar una elevada carga anticolinérgica/sedante, cuyo efecto acumulativo puede empeorar la funcionalidad y el estado cognitivo de los residentes24,31.
La puntuación DBI en nuestros usuarios varía en función del tipo de demencia. Los residentes con demencia vascular tienen de manera estadísticamente significativa un DBI superior que aquellos que presentan enfermedad de Alzheimer. Este resultado puede plantearnos la cuestión de si los residentes con demencia vascular presentan mayor sintomatología psicoconductual derivada de la enfermedad o un peor control de la misma. Según Anor et al.32, los mayores con demencia vascular sufren más agitación, depresión, alteraciones motoras y trastornos del sueño que los de enfermedad de Alzheimer, lo que podría explicar la diferencia observada en nuestra población. También se debería considerar el tratamiento con IACE o memantina. Estos no tienen indicación para tratar la demencia vascular, por el contrario, sí la enfermedad de Alzheimer, pudiendo favorecer el alivio de la sintomatología psicoconductual derivada de la enfermedad y, por tanto, el uso de fármacos anticolinérgicos/sedantes. Por el contrario, para evaluar esta asociación sería interesante un estudio de mayor alcance, pues con los resultados obtenidos no se ha hallado relación.
Del mismo modo, bien es conocida la prescripción en cascada que puede provocar el tratamiento con IACE. Muchas veces causan incontinencia urinaria, prescribiéndose fármacos con alta carga anticolinérgica para su tratamiento17, factor que debe considerarse al evaluar los resultados, a pesar de que en nuestra población no se ha observado asociación estadísticamente significativa entre el DBI y el tratamiento con fármacos antidemencia.
Anor et al.32 reportan también que para el tratamiento de los trastornos psicoconductuales los antipsicóticos son los fármacos más prescritos en la enfermedad de Alzheimer. En nuestra población, la quetiapina es el fármaco anticolinérgico/sedante más prescrito y la enfermedad de Alzheimer la más común; sin embargo, si se considera la gran discrepancia y la falta de consenso entre las diferentes herramientas para la medición del riesgo anticolinérgico, es probable que tanto el dato de prevalencia como el listado de fármacos con carga anticolinérgica/sedante más prescritos variaran en nuestra población, pues entre las propias escalas no existe si quiera concordancia entre los principios activos incluidos y la puntuación del riesgo asociada a cada fármaco. Esto implica que si se hubiera empleado otra escala para la medición del riesgo, tal vez no se hubiese obtenido un antipsicótico como el fármaco más prescrito, obteniendo unos datos de prevalencia y fármacos diferentes de los hallados.
Son varios los trabajos que demuestran que una alta carga anticolinérgica/sedante (medida por la escala DBI) incrementa el riesgo de presentar caídas, aumentando, por tanto, el riesgo de fracturas, especialmente de cadera, y en consecuencia las hospitalizaciones18,24,30,33,34. En nuestro estudio, más del 20% de los residentes han sufrido 5 o más caídas durante el año anterior, observándose de manera significativa un mayor número de caídas en aquellos con un índice DBI ≥ 1. El motivo de caída puede ser multifactorial, pero la posible sensación de mareo, inestabilidad, somnolencia, etc., provocada por estos medicamentos podría ser un factor contribuyente. Igualmente, los residentes que presentaron hospitalizaciones y consultas a Urgencias el año previo al estudio se asociaron a un índice DBI superior. Sin embargo, sería interesante conocer la variación de la carga anticolinérgica/sedante tras una estancia hospitalaria o derivación a Urgencias para intentar clarificar si aquellos residentes con mayor DBI reingresan más o, por el contrario, es la frecuentación sanitaria la causa del incremento del DBI. Sería recomendable desarrollar un estudio de seguimiento prospectivo para determinar la direccionalidad entre DBI, caídas y frecuentación sanitaria; con un estudio transversal resulta aventurado sacar conclusiones.
Al mismo tiempo, la bibliografía refiere que a mayor puntuación de carga anticolinérgica las personas presentan una menor funcionalidad, menor actividad física diaria y un empeoramiento del estado cognitivo9,30,33,35. En nuestra población, no se ha evaluado si al modificar la carga anticolinérgica/sedante del tratamiento hay variación en el IB o del MEC-35. Sin embargo, observamos que los residentes con mejor funcionalidad, según el IB, presentan un DBI mayor (OR 1,85, IC del 95%, 1,01-3,40; p = 0,047). Debido a que es amplia la bibliografía que describe los resultados negativos asociados a elevadas cargas anticolinérgicas/sedantes, es deseable la implantación de estrategias interdisciplinares de optimización farmacoterapéutica con el objetivo de aliviar esa carga anticolinérgica, plan diseñado para la segunda fase del proyecto Red-COLINA.
Entre las múltiples escalas que permiten medir la carga anticolinérgica, la DBI y la Anticholinergic Risk Scale (ARS) se han relacionado con deterioro tanto funcional como cognitivo36. La escala DBI se caracteriza por una mayor sensibilidad en el cálculo de la carga anticolinérgica, al ponderarla según la dosis del medicamento y su dosis mínima efectiva, por ello ha sido la seleccionada para la medición de la carga anticolinérgica/sedante36,37. Además, una revisión sistemática reciente determina que es la herramienta más apropiada para emplear en octogenarios12,30. El punto de corte para establecer las asociaciones (DBI ≥ 1), al no existir un consenso, se ha establecido de manera arbitraria, en función, también, de trabajos publicados37-40. Esto implica que se habrían obtenido unos resultados diferentes si se hubieran considerado otros rangos.
Este trabajo resulta novedoso en cuanto a que la medida de la carga anticolinérgica/sedante ha sido poco estudiada en personas institucionalizadas con demencia, en las que el uso de estos medicamentos es muy prevalente y puede ser especialmente problemático. Además, estando relacionada la carga anticolinérgica/sedante con la funcionalidad, el estado cognitivo y la polifarmacia de los mayores, conocerla de manera cuantitativa nos permite plantear estrategias para mejorar, en la medida de lo posible, la calidad de vida y seguridad de los residentes con demencia.
Paralelamente, este estudio no está exento de limitaciones. La población estudiada es pequeña e institucionalizada, por lo que los resultados no pueden extrapolarse a la población general. Además, no se han registrado comorbilidades, síndromes geriátricos ni tipo de síntomas psicoconductuales que pueden influir en la prescripción medicamentosa y en la farmacocinética/farmacodinamia del fármaco, mostrando la gran heterogeneidad de este grupo poblacional. También en el año 2019 solo se evaluó a aquellos residentes que tenían próxima su VGI y que cumplían los criterios de inclusión establecidos. Igualmente, solo se ha empleado una herramienta para medir el riesgo anticolinérgico, seleccionando además el punto de corte para la categorización del riesgo de forma arbitraria. Probablemente, se hubiesen obtenido resultados diferentes si también se hubieran empleado otras herramientas para la medición del riesgo anticolinérgico.
ConclusiónLa polifarmacia y la prescripción de fármacos con carga anticolinérgica/sedante es altamente frecuente entre las personas institucionalizadas con demencia, encontrándose una asociación entre la carga anticolinérgica/sedante, medida por DBI, y las caídas, los ingresos hospitalarios y las consultas al servicio de Urgencias. Además, se observan diferencias en el patrón de carga anticolinérgica/sedante en función del tipo de demencia. Por ello, es necesario implementar y evaluar el rendimiento de estrategias interdisciplinares de optimización farmacoterapéutica que permitan disminuir la carga anticolinérgica/sedante en la población estudiada.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNinguno.