El desarrollo de vacunas es un proceso multifactorial que ha evolucionado especialmente en las últimas décadas. La búsqueda de vacunas inmunógenas que resulten suficientemente seguras y tolerables ha dado lugar a sucesivos avances tecnológicos en este campo. Históricamente la tecnología aplicada a las vacunas puede dividirse en 3 aproximaciones: la empírica, la moderna y la nueva oleada tecnológica. Dentro de la primera se encuentran las vacunas basadas en microorganismos enteros, las técnicas de atenuación, inactivación, los cultivos celulares y las vacunas de subunidades. En la época moderna destacan los avances relacionados con la conjugación química, así como la tecnología de ADN recombinante y la vacunología inversa. Finalmente, en la nueva oleada tecnológica se incluye, entre otros, la bioconjugación, los vectores virales, la biología sintética, la autoamplificación del ARN mensajero, los módulos generalizados para antígenos de membrana, la vacunología estructural y los nuevos adyuvantes.
The development of vaccines is a multifactorial process that has evolved and expanded, particularly over the last decades. The search for immunogenic vaccines that are also acceptably safe and tolerable enacted continuous technological advances in this field. In this regard, the technology applied to vaccines can historically be divided into 3 approaches: the empirical approach, the modern approach, and the new technological wave. The empirical approach for vaccine development includes whole micro-organisms, attenuation, inactivation, cell cultures and sub-unit vaccines. The modern approach contributed to leaps and bounds to vaccine development using chemical conjugation, as well as recombinant protein DNA technology and reverse vaccinology. Lastly, the new technological wave includes, among others, bioconjugation, viral vectors, synthetic biology, self-amplification of messenger RNA, generalized modules for membrane antigens, structural vaccinology and the new adjuvants.
Tras la depuración y potabilización del agua las campañas de vacunación para prevenir enfermedades infectocontagiosas constituyen la estrategia de salud pública que más ha contribuido a alargar la esperanza de vida de la población1,2. Los avances en el conocimiento del sistema inmune durante los 2 últimos siglos, y su aplicación a la vacunología, han conseguido disminuir significativamente la incidencia de numerosas enfermedades infecciosas discapacitantes y mortales1,3–5.
Actualmente las personas viven más tiempo, y pese a las enfermedades crónicas o graves gozan de más salud gracias a los tratamientos y medidas preventivas. Esto, entre otros motivos, explica el mayor porcentaje de adultos mayores que en décadas anteriores6,7. Asimismo, los avances sanitarios y tecnológicos en torno al período pre y posnatal han permitido reducir la mortalidad antes y después del parto. Un ejemplo son los prematuros sanos, una población vulnerable con mayor riesgo de complicaciones infecciosas debido a su inmadurez inmunitaria8. Por ello, la investigación de vacunas más seguras e inmunógenas resulta de gran interés para estos grupos.
El desarrollo de vacunas es un proceso que ha progresado en las últimas décadas y cuya evolución está condicionada por diversos factores. Por un lado, por el impacto de las enfermedades en la población, los cambios epidemiológicos, la carga de la enfermedad en cuestión, el volumen de población afectada y el gasto sanitario asociado; y, por otro, por un mejor conocimiento del patógeno y su interacción con el sistema inmune y por la tecnología disponible9.
En esta revisión se aborda la evolución a lo largo de la historia de la vacunología, dividiéndola en 3 etapas: empírica, moderna y nueva oleada tecnológica. Estas etapas se fundamentan en los hitos que marcaron cambios de estrategia en el diseño de vacunas. Se pone especial énfasis en las nuevas tecnologías, al ser las más complejas e innovadoras, al tiempo que fundamentales para afrontar los retos tanto presentes como futuros.
Aproximación empírica (1796-1980)Se considera a Edward Jenner como el padre de la vacunología gracias al primer intento científico de vacunación que llevó a cabo en 1796 por medio de la variolización, si bien esta ya había sido practicada anteriormente10. Por entonces se desconocían los agentes causales de las enfermedades infecciosas y las técnicas de inmunización se basaban en la observación empírica. Posteriormente, se descubrió que los patógenos con virulencia reducida, e incluso aquellos muertos, podían actuar como vacunas. Entre los siglos xix y xx se supo que las toxinas y sus derivados inactivados (toxoides) podían actuar como antígenos, lo que supuso una mejora en la seguridad y eficacia de las vacunas11.
Las primeras vacunas se basaban en microorganismos enteros, y su principal ventaja era su gran inmunogenicidad y la capacidad de estimular una respuesta similar a la producida por la infección natural. Sin embargo, estas vacunas podían provocar una enfermedad similar a la que se pretende evitar12.
Gracias a los estudios de Louis Pasteur se sentaron las bases de la atenuación como procedimiento para reducir la virulencia de los microorganismos, primero aplicado a Pasteurella multocida y después al ántrax y al virus de la rabia13. Casi en paralelo se puso en práctica la inactivación de patógenos mediante tratamientos químicos o térmicos, evitando su capacidad replicativa. Ambas técnicas mejoraron la calidad y seguridad de las vacunas, estimulando la inmunidad de manera efectiva, duradera y segura11,14.
Durante esta etapa se produjo una auténtica revolución científica que marcó un antes y un después en la vacunología con el desarrollo de vacunas mediante cultivos celulares. El descubrimiento de los virus y la posibilidad de replicarlos en cultivos celulares, al principio en células animales y luego en humanas, facilitó la capacidad para producir vacunas, mejorando su perfil de seguridad13,14.
En la década de 1970 tuvieron lugar 2 grandes descubrimientos en el campo de la biología molecular: la expresión de proteínas en plásmidos y la posibilidad de secuenciar el ADN15. Esto permitió el desarrollo de vacunas de subunidades, formuladas con proteínas purificadas o polisacáridos. Se denominaron así, ya que no contenían células o microorganismos completos, sino solo un fragmento de estos, suficiente para estimular el sistema inmune. Estos avances dieron paso a la era moderna en el desarrollo de vacunas14,16.
Aproximación moderna (1980-2010)En este período la tecnología aplicada a las vacunas experimentó grandes avances que permitieron desarrollar vacunas más eficaces y seguras. En este sentido, el reordenamiento hizo posible desarrollar vacunas con material genético de 2 cepas distintas del mismo patógeno, de una especie idéntica o diferente, expresando proteínas de dichas cepas. Esta técnica permitió desarrollar una vacuna pentavalente frente al rotavirus basada en un rotavirus bovino atenuado reordenado con segmentos de rotavirus humanos11,14.
Las limitaciones de las vacunas de polisacáridos capsulares se superaron, en parte, gracias al descubrimiento de la conjugación química, que consiste en la unión del polisacárido a una proteína transportadora (p. ej. toxoide tetánico o diftérico modificado). El efecto sobre el sistema inmune es una respuesta más potente llamada T-dependiente, en la que las células B son estimuladas por las células T, produciéndose un cambio en el predominio del isotipo IgG sobre IgM e induciendo memoria inmune16. La vacuna frente a Haemophilus influenzae b fue la primera desarrollada con esta técnica. Posteriormente se diseñaron vacunas conjugadas frente a Streptococcus pneumoniae y Neisseria meningitidis A, C, W e Y.
La tecnología del ADN recombinante alcanzó su máximo desarrollo en la década de 1980. La elaboración de estas vacunas se basó en la inserción de un gen que codifica la proteína antigénica en un sistema de expresión, como el genoma de células de levadura, con capacidad para producir grandes cantidades del antígeno específico in vitro16,17.
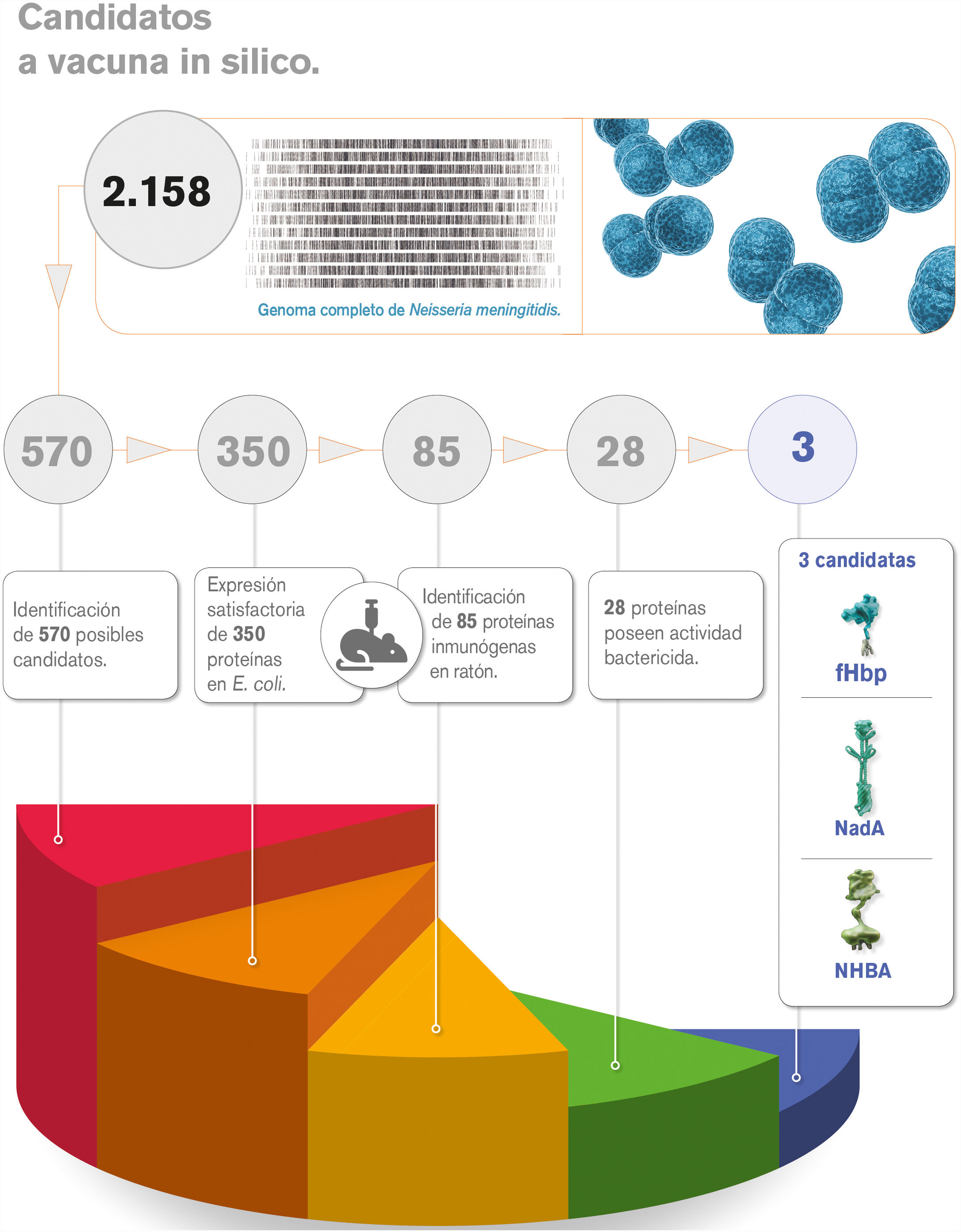
Pese a los avances logrados por las técnicas anteriores, algunos patógenos, como Neisseria meningitidis B, todavía suponían un reto. Este patógeno presenta en su cápsula un antígeno compuesto de polisacáridos con una estructura idéntica a la de las moléculas de ácido N-acetilneuramínico del tejido neuronal humano, lo cual permite al patógeno eludir su reconocimiento por parte del sistema inmune como agente extraño18. La vacunología inversa supuso un hito para superar este desafío. Tras secuenciar por completo el genoma de una cepa virulenta de Neisseria meningitidis B se aplicaron nuevas técnicas para identificar los posibles antígenos y vacunas candidatas. Gracias a la bioinformática no solo se identificaron los genes, sino que se logró filtrarlos y reconocer los candidatos vacunales adecuados (fig. 1) (anexo 1 [vídeo 1])18–22.
Aplicación de la vacunología inversa en el diseño de la vacuna frente a Neisseria meningitidis B. Tras secuenciar todo el genoma del meningococo B se identificaron 570 secuencias génicas de ARN correspondientes a proteínas secretadas o de membrana. El número de candidatos vacunales se redujo, ya que solo 350 se expresaron satisfactoriamente en E. coli. Se inmunizó a ratones con estas proteínas y se observó que solo 85 de ellas inducían una respuesta inmune, 28 de las cuales además dieron positivo en ensayos bactericidas, ELISA y análisis FACS. Por último, se compararon las secuencias de estas proteínas con las de organismos relacionados filogenéticamente y finalmente se diseñó la vacuna con las 3 secuencias más estables y conservadas, con el objetivo de proteger frente a un mayor número de cepas patógenas.
La vacunología clásica se basa en el estudio detallado del propio patógeno y su relación con el huésped, identificando algunos de los antígenos expuestos y utilizándolos como candidatos vacunales. En cambio, la vacunología inversa parte del genoma del patógeno, por lo que no es necesario cultivarlo. Como el genoma codifica todas las proteínas que expresa el patógeno, esta técnica permite trabajar con casi todos los antígenos del patógeno. Esto implicó un cambio de paradigma en la vacunología, ya que se predicen los antígenos que podrían representar candidatos vacunales y que no se habrían descubierto por las vías tradicionales21,23,24. Los genes predichos se seleccionan según su localización celular u homología con los genes humanos, de manera que se escogen aquellos con escasa similitud para garantizar que sean reconocidos como antígenos extraños y generen una mayor inmunogenicidad21.
La nueva oleada tecnológica (desde 2010 hasta la actualidad)Con el aumento de la esperanza de vida logrado en las últimas décadas, la vacunología del siglo xxi se ha enfrentado a un doble reto. Por una parte, el abordaje de la vacunación en todas las etapas de la vida, y por otra, cubrir las necesidades de vacunación de diferentes grupos de riesgo25.
El objetivo de la nueva oleada tecnológica es facilitar la selección de dianas de nuevos patógenos, mejorar la tolerabilidad y la eficacia de las vacunas actuales, optimizar los procesos de producción e impulsar la investigación sobre el uso de vacunas en otras áreas, como las enfermedades crónicas no transmisibles25.
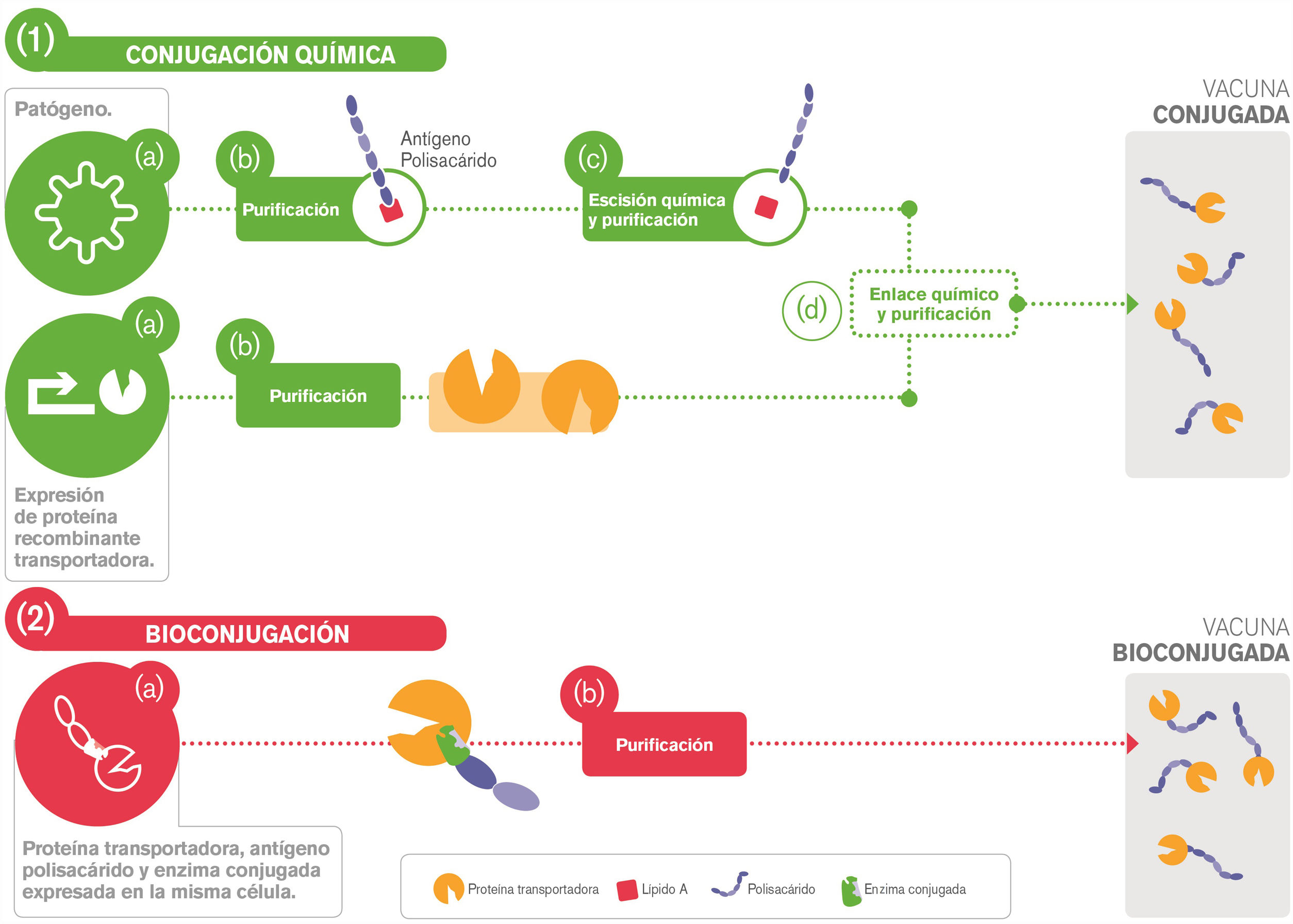
BioconjugaciónDescripciónEs un método alternativo a la conjugación química, desarrollado en células bacterianas modificadas, que se basa en un proceso biológico y no químico26. Actualmente Escherichia coli es la bacteria con la que se han obtenido los resultados más satisfactorios26,27. A diferencia de la conjugación química, en la bioconjugación se utiliza un único sistema de cultivo que consta de varias etapas (fig. 2)28.
Diferencias entre el proceso de conjugación química (1) y bioconjugación (2). (1) El proceso de conjugación química consta de varias etapas: a) cultivo por separado de las cepas bacterianas que producen el polisacárido y las proteínas transportadoras; b) purificación por separado de ambos componentes; c) escisión química del polisacárido del lípido A y posterior purificación; d) ensamblaje químico del polisacárido y la proteína transportadora y purificación final del producto. (2) El proceso de bioconjugación se lleva a cabo en un único sistema de cultivo, la célula bacteriana. Aquí se sintetiza el propio polisacárido y se expresan los genes que codifican la enzima encargada de ensamblar dicho polisacárido y la proteína transportadora. Tras ello, hay una etapa final de purificación del producto conjugado.
- •
Mayor reproducibilidad, puesto que el proceso enzimático es más específico y selectivo que el químico28,29.
- •
Permite el desarrollo de una mayor variedad de vacunas.
- •
Procedimiento más sencillo que posibilita una producción más rápida y eficiente.
- •
No requiere procesos químicos, por lo que se espera que la estructura del antígeno nativo se conserve mejor en su conformación natural27,28.
Esta tecnología se está utilizando en una vacuna frente a Shigella flexneri para adultos y frente a infecciones extraintestinales por E. coli en mujeres con antecedentes de infección urinaria recurrente30,31. También se ha utilizado para desarrollar una nueva vacuna neumocócica para adultos de edad avanzada32.
Vectores viralesDescripciónLos virus son vehículos óptimos para la transferencia de genes debido a su capacidad para infectar las células del huésped33. No todos ellos reúnen las propiedades ideales para el desarrollo de vacunas, y actualmente los vectores adenovirales son los más prometedores y utilizados.
Los adenovirus son virus de ADN bicatenario con un genoma conocido y fácil de manipular34. Las características principales que los convierten en candidatos ideales para el desarrollo de vacunas son: 1) infectar tanto a las células en división como en reposo; 2) crecer hasta alcanzar títulos altos en cultivos tisulares; 3) administrarse a través de las mucosas o por vía sistémica; 4) inducir una potente respuesta de las células T CD8+; y 5) su capacidad de replicación desaparece introduciendo mutaciones específicas en su ADN34,35.
La cascada de actuación del vector viral comienza con su captación por parte de la célula dendrítica a través de endocitosis mediada por receptores. Después, el genoma viral se libera en el endosoma o en el citoplasma, induciendo una activación de vías proinflamatorias innatas. Así, el genoma del virus genera proteínas que se descomponen en fragmentos peptídicos que se unen a moléculas MHC de tipo i y son presentados a las células T CD8+ para inducir una respuesta inmune celular36.
Aunque los adenovirus humanos reúnen las características requeridas para el desarrollo de vacunas, tienen ciertas limitaciones. Los tipos 5 y 6 son los adenovirus humanos mejor estudiados y, si bien constituyen un buen sistema inmunógeno para la liberación de vacunas, la mayoría de las personas presentan anticuerpos frente a ellos. Por eso, se ha propuesto como alternativa los adenovirus de chimpancés ya que hay muchas menos personas con anticuerpos preexistentes, aumentando la probabilidad de inducir una elevada respuesta inmune35–37.
Ventajas potenciales- •
Mayor capacidad para inducir respuestas de células T CD8+.
- •
Mayor actividad adyuvante intrínseca debido a su capacidad para desencadenar respuestas inmunes innatas36,37.
Se están evaluando en ensayos clínicos vacunas frente al virus del Ébola, la leishmaniosis y la malaria38. También se han realizado ensayos con vacunas frente a la hepatitis C y frente al virus respiratorio sincitial en lactantes39,40.
Biología sintética: autoamplificación del ARN mensajeroDescripciónEsta disciplina ha surgido gracias al uso de datos biológicos y análisis computacionales para crear o rediseñar sistemas biológicos y mejorar sus funciones naturales.
En 1990 Wolff et al. demostraron que la inyección de ARN mensajero (ARNm) o ADN plasmídico (ADNp) en el músculo esquelético del ratón determinaba la expresión de la proteína codificada41. En la actualidad, mediante la técnica de autoamplificación del ARNm (SAM), las vacunas se producen con métodos sintéticos y se basan en un virus alfa genéticamente modificado42. El ARNm contiene los mecanismos necesarios para autoamplificarse por sí solo; sin embargo, carece de los genes necesarios para producir partículas infecciosas. Para evitar que las enzimas degraden el material genético se presenta envuelto en liposomas, polímeros catiónicos o nanoemulsiones de origen sintético43.
Ventajas potenciales- •
Método de producción rápido al no requerir cultivos celulares42.
- •
Mayor seguridad, ya que el SAM se libera en el citoplasma y no se inserta en el genoma del huésped42,44.
- •
Fabricación acelerada de vacunas en brotes epidémicos y pandémicos al poner a disposición de los países las secuencias génicas45.
- •
Inducción de una respuesta de células T CD8+44.
Se encuentra en marcha el desarrollo preclínico de vacunas frente al virus del Zika, Ébola, gripe y virus de la inmunodeficiencia humana (VIH)46.
Módulos generalizados para antígenos de membranaDescripciónDe manera natural las bacterias gramnegativas desprenden vesículas de membrana externa (OMV) que contienen potentes ligandos, como lipopolisacáridos, capaces de activar la inmunidad innata y adaptativa.
No obstante, la capacidad limitada de producción de OMV por las bacterias, así como la alta reactogenicidad de estas vacunas constituyen una barrera. Así pues, se requieren mejoras en el rendimiento productivo de las bacterias, junto con técnicas adecuadas de purificación antigénica47.
Los módulos generalizados para antígenos de membrana (GMMA) representan las vesículas creadas a partir de bacterias gramnegativas modificadas, es decir, son una versión mejorada de las OMV de bacterias naturales. Esta tecnología permite aumentar la producción de GMMA y ajustar la reactogenicidad e inmunogenicidad para que resulten tolerables47,48.
Ventajas potenciales- •
Evitan los inconvenientes de las vacunas de células enteras.
- •
Liberan moléculas con patrones moleculares asociados a patógenos (función autoadyuvante)49.
- •
Producción a gran escala debido a que los procesos son relativamente sencillos47,49.
- •
Mejora la producción gracias a una metodología y procesos de fabricación eficientes48.
- •
Niveles aceptables de seguridad y reactogenicidad según los estudios preclínicos y clínicos48,50.
Actualmente se utiliza en el desarrollo de una vacuna frente a Shigella y para la salmonelosis invasiva no tifoidea49,51.
Vacunología estructuralDescripciónEsta estrategia se basa en el empleo de la información sobre las estructuras proteicas para diseñar inmunógenos útiles para el desarrollo de vacunas.
El punto de partida son las estructuras cristalinas de antígenos que contienen uno o más epítopos protectores, entendiéndose por epítopo el sitio de contacto entre el antígeno y el anticuerpo neutralizante. Mediante la aplicación de diferentes métodos se consigue una mayor estabilidad estructural (que origina una mayor respuesta inmune), así como el diseño de antígenos que contienen únicamente epítopos clave, eliminando las regiones variables52,53.
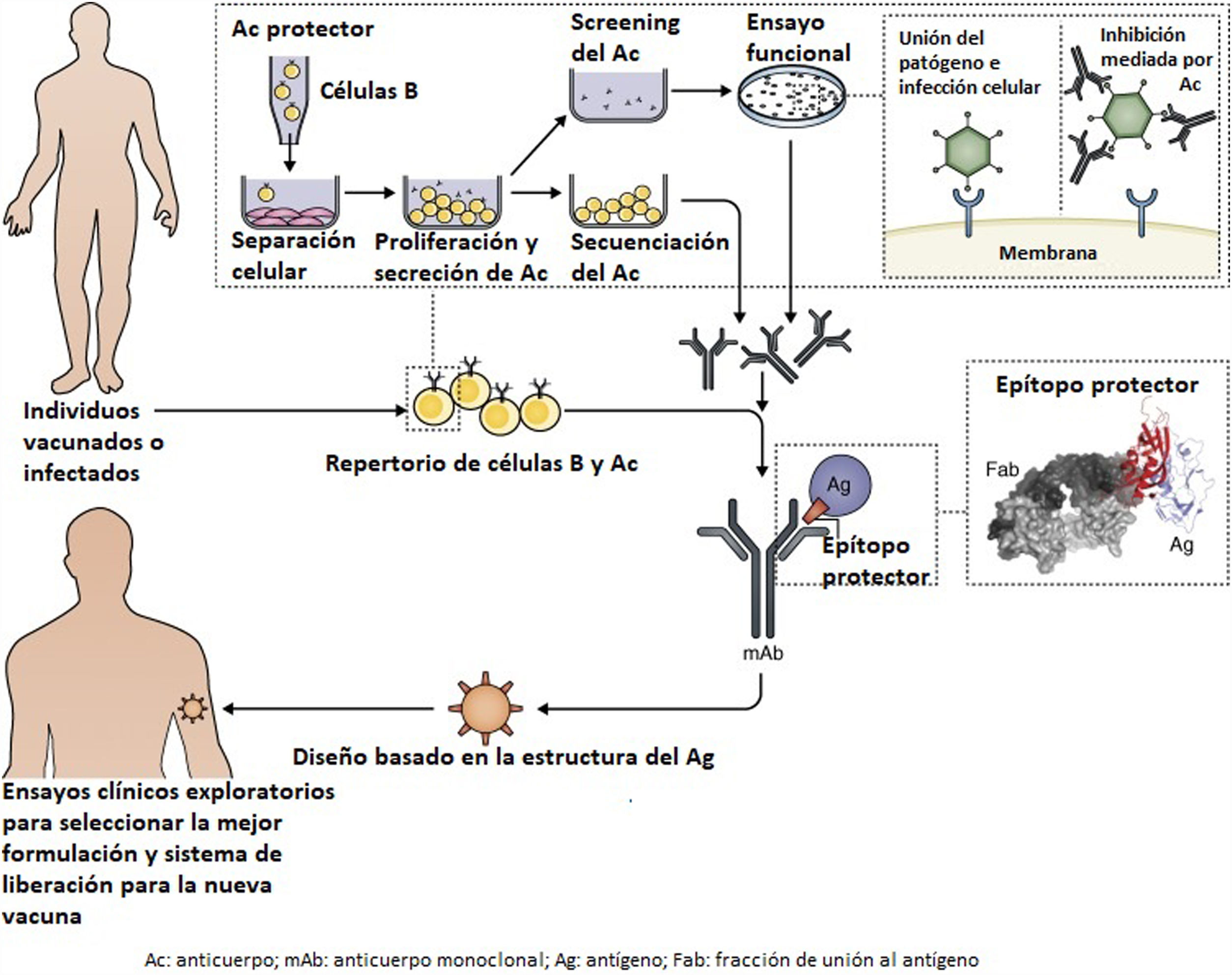
El éxito de esta técnica requiere la aplicación de métodos de alto rendimiento que permitan identificar un gran número de estructuras antigénicas, así como ensayos clínicos que predigan su efectividad como inmunógenos (fig. 3).
Relación entre la tecnología de células B y la vacunología estructural53. En primer lugar se extraen y se cultivan las células B de los individuos vacunados o infectados, lo cual permite hacer un screening y seleccionar de manera natural los anticuerpos producidos que presenten la funcionalidad deseada. Esto también ayuda a identificar la secuencia genética específica del anticuerpo, seleccionando así sus propiedades. Al establecer la base estructural del reconocimiento entre el antígeno y el anticuerpo se define el epítopo protector. Dicho epítopo puede ser diseñado después mediante el desarrollo de un inmunógeno optimizado en un sistema de liberación adecuado, con el objetivo de conseguir el mejor candidato vacunal.Fuente: Rappuoli et al53. Reproducida con permiso de Rockefeller University Press.
- •
Optimización de la producción, pues los antígenos se producen de forma más eficiente y son más estables que las proteínas nativas.
- •
Los antígenos de las vacunas se pueden modificar más rápidamente en respuesta a los cambios epidemiológicos gracias a la identificación de sus partes clave y aquellas que se pueden alterar.
- •
Diseño de antígenos clave que generen vacunas combinadas con mejor perfil de seguridad y mayor simplificación de administración54.
Se ha utilizado en el desarrollo de vacunas frente a Neisseria meningitidis y frente al virus respiratorio sincitial en adultos16,55.
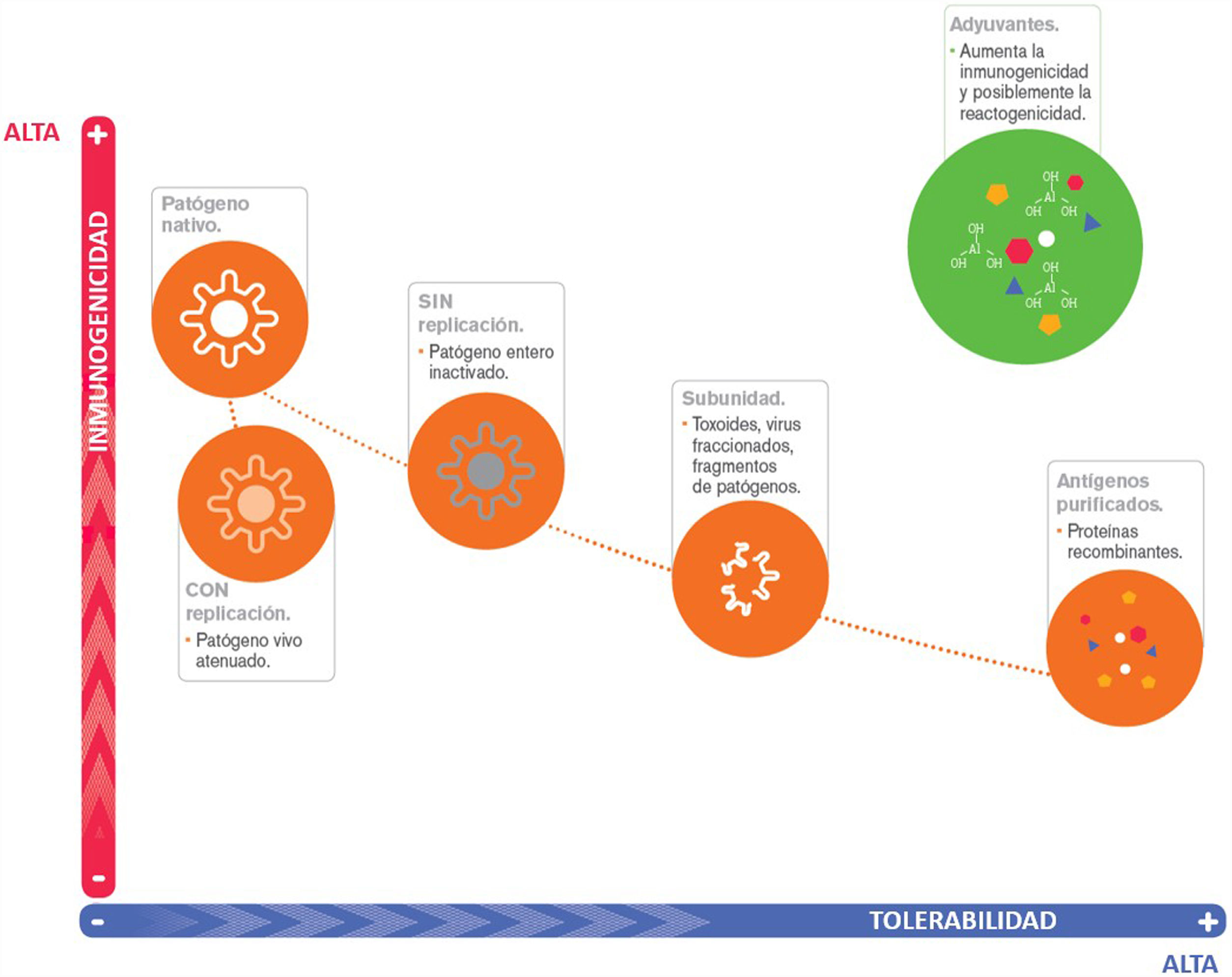
Nuevos adyuvantesDescripciónA medida que se han producido vacunas más tolerables se ha perdido parte de su inmunogenicidad. Por ello, la adición de componentes que simulan los desencadenantes de la respuesta inmune cobra mucho interés, pues permite desarrollar vacunas con una tolerabilidad aceptable y mayor inmunogenicidad56 (fig. 4) (anexo 1 [vídeo 2]).
Evolución de las vacunas en términos de tolerabilidad e inmunogenicidad. Las vacunas de subunidades y las basadas en antígenos purificados permiten alcanzar una mejor tolerabilidad en detrimento de la inmunogenicidad. La presencia de adyuvantes en la composición de las vacunas induce una mayor inmunogenicidad manteniendo un perfil adecuado de tolerabilidad.
El objetivo de las vacunas modernas es modular las interacciones entre los diferentes componentes del sistema inmune, actuando sobre las células presentadoras de antígenos y la inmunidad innata. Así se mejora y modula la interconexión entre el sistema inmune innato y adaptativo56. El sistema inmune innato se activa mediante el reconocimiento de los patrones moleculares asociados a patógenos. Estos provocan una cascada de señales en las células inmunes innatas actuando como señales de alarma que alertan, estimulan y dirigen la respuesta inmune. Los adyuvantes (del latín adjuvare, favorecer o ayudar), incluidos en la composición de algunas vacunas, son compuestos no tóxicos que imitan a los patrones moleculares asociados a patógenos y potencian la respuesta inmune inducida por la vacuna. Son sustancias que pueden acelerar, prolongar, ampliar o aumentar la respuesta inmune a un antígeno57,58. La mayoría de ellos actúan activando las células presentadoras de antígenos, como las células dendríticas, aumentando su capacidad para procesar y presentar antígenos. Asimismo, aumentan la activación de los linfocitos y su migración al lugar de inyección59.
Los adyuvantes constituyen una de las estrategias de mayor éxito para afrontar algunos de los retos de la vacunología moderna56. Han sido muy útiles para el desarrollo de vacunas inactivadas o de antígenos purificados debido a la escasez de desencadenantes naturales de la inmunidad innata en estas vacunas60.
Ventajas potenciales- •
Aumentan la amplitud y duración de la respuesta inmune.
- •
Mejoran el reconocimiento antigénico e inducen una respuesta similar a la respuesta inmune innata natural.
- •
Permiten reducir la cantidad de antígeno en cada dosis de vacuna y el número de dosis.
- •
Resultan muy útiles en poblaciones con una respuesta vacunal disminuida: lactantes, personas mayores o inmunodeprimidos61.
Hasta casi el año 2000 los únicos adyuvantes disponibles eran las sales de aluminio, los virosomas y MF59 (Novartis), incluido este último en una vacuna frente a la gripe y en vacunas actualmente en desarrollo frente a la infección por el VIH y el citomegalovirus11,61,62.
Desde entonces ha sido necesario desarrollar productos más avanzados, adaptados a las nuevas vacunas y expectativas clínicas. Así, se han combinado los adyuvantes clásicos con otras sustancias más modernas denominadas inmunoestimulantes para crear los llamados sistemas adyuvantes (Adjuvant Systems [AS]) patentados por GSK63. Actualmente hay 3 tipos de AS empleados en vacunas comercializadas:
- (1)
AS04 (GSK), compuesto por sales clásicas de aluminio y 3-O-desacil-4′-monofosforil lípido A, utilizado en una vacuna frente al virus de la hepatitis B para pacientes en pre/hemodiálisis y en otra frente al virus del papiloma humano64,65.
- (2)
AS03 (GSK), que contiene una emulsión de aceite en agua y α-tocoferol, empleado en una vacuna frente a la gripe prepandémica H5N164.
- (3)
AS01 (GSK), que contiene liposomas, 3-O-desacil-4′-monofosforil lípido A y Quillaja saponaria Molina, se utiliza en la vacuna de subunidades frente al herpes zóster y frente a la malaria y en vacunas en desarrollo frente a la tuberculosis64,65.
Asimismo, se están empleando otros adyuvantes en vacunas en desarrollo:
- •
Lípidos: glucopiranosil lípido A GLA-SE, empleado en vacunas frente a la malaria y el virus de la gripe64.
- •
Emulsiones: ISA51 (Seppic), presente en vacunas frente a la malaria y el virus de la gripe64.
- •
Citoquinas: IL-12, IL-15 y GM-CSF, utilizados en vacunas frente al VIH64.
- •
Otros, como la toxina de Vibrio cholerae, la toxina lábil de E. coli enterotoxigénica (LT-K63) o la flagelina, que actúan estimulando la respuesta inmune de las mucosas59,64.
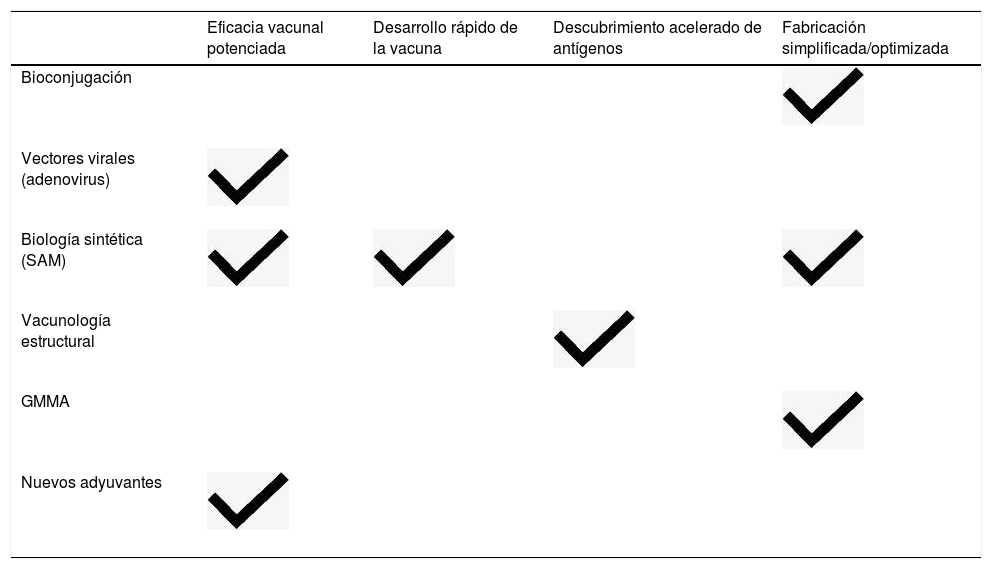
La complejidad de las nuevas tecnologías mencionadas da lugar a ciertas limitaciones al requerir una elevada inversión en recursos humanos especializados, en bioinformática y en infraestructuras. Por otro lado, los ensayos clínicos asociados a estas vacunas podrían exigir un mayor control por parte de las agencias reguladoras al no disponer de antecedentes similares a este tipo de tecnologías. No obstante, estas nuevas técnicas poseen numerosas ventajas potenciales (tabla 1) y pueden coexistir con las más tradicionales, ofreciendo un abanico más amplio de posibilidades a la hora de diseñar vacunas adecuadas para cada situación. En la figura 5 se recogen los mensajes clave de esta publicación para la comunicación con el paciente.
Potenciales ventajas de las nuevas tecnologías en el desarrollo de vacunas
| Eficacia vacunal potenciada | Desarrollo rápido de la vacuna | Descubrimiento acelerado de antígenos | Fabricación simplificada/optimizada | |
|---|---|---|---|---|
| Bioconjugación | ||||
| Vectores virales (adenovirus) | ||||
| Biología sintética (SAM) | ||||
| Vacunología estructural | ||||
| GMMA | ||||
| Nuevos adyuvantes |
GMMA: módulos generalizados para antígenos de membrana; SAM: autoamplificación de ARNm
A pesar del gran arsenal de vacunas disponibles en la actualidad, el aumento de la esperanza de vida y los movimientos de la población han generado una clara demanda de nuevas vacunas. La inmunosupresión e inmunosenescencia, la inmadurez del sistema inmune de los lactantes y las enfermedades emergentes requieren del diseño de nuevas vacunas profilácticas. En este sentido, las nuevas tecnologías aplicadas al desarrollo de las vacunas implican una mejora cualitativa y cuantitativa que contribuye a atender estas necesidades.
Con la incorporación de la tecnología del siglo xxi se contempla la posibilidad de disponer de un mayor número de vacunas que optimicen la producción. Mientras que la vacunología clásica se centraba en la relación entre el patógeno y el huésped, estas nuevas tecnologías se basan en la aplicación de herramientas bioinformáticas, expandidas enormemente en las últimas décadas.
Cada una de las técnicas descritas en la nueva oleada ofrece ventajas para la elaboración de las vacunas actuales o futuras que no se habían explorado anteriormente. Las características del patógeno, el grado deseado de inmunogenicidad y tolerabilidad y la población diana serán los principales factores que determinen el uso de uno u otro método.
FinanciaciónGlaxoSmithKline Biologicals S.A. financió esta publicación.
AutoríaTodos los autores participaron en la elaboración de este manuscrito. MFP es responsable del diseño del proyecto, de la búsqueda bibliográfica y de la redacción del borrador inicial y la versión final del manuscrito. JALT, JMB y MDR revisaron la bibliografía científica y colaboraron en el desarrollo del proyecto y del manuscrito. Todos los autores dieron su aprobación final antes de su envío.
Conflicto de interesesLa Dra. Fernández-Prada declara no tener ningún conflicto de intereses relacionado con la elaboración de este artículo.
El Dr. López Trigo declara no tener ningún conflicto de intereses relacionado con la elaboración de este artículo.
El Dr. Bayas es empleado del grupo de compañías GSK.
La Dra. Cambronero es empleada del grupo de compañías GSK y tiene acciones en el mismo.
Los autores desean agradecer a Irene Montoro, Javier Pareja y Béatrice Laupèze (grupo de compañías GSK) sus aportaciones científicas y editoriales durante la elaboración del manuscrito y de las videopublicaciones. Azul Marino Producciones proporcionó soporte para la elaboración de las videopublicaciones. Los autores también agradecen a la plataforma Business & Decision Life Sciences la asistencia editorial y la coordinación del manuscrito, en nombre de GSK. Matthieu Depuydt y Lyes Derouiche coordinaron la elaboración del manuscrito y el soporte editorial.
Transcripciones de los vídeos
Vídeo 1: de la conjugación a la vacunología inversa
Las tecnologías aplicadas al desarrollo de vacunas han experimentado grandes avances que han hecho posible el desarrollo de vacunas con mayor eficacia y seguridad.
Por ejemplo, el desarrollo de las vacunas conjugadas ha posibilitado superar las limitaciones de las vacunas de polisacáridos capsulares. La conjugación del polisacárido a una proteína transportadora induce una respuesta inmune T-dependiente que resulta mucho más eficaz que la respuesta inducida por las vacunas polisacarídicas no conjugadas.
Algunas de las vacunas desarrolladas con esta técnica son la vacuna frente a Haemophilus influenzae b, la vacuna frente a Streptococcus pneumoniae y la vacuna frente a Neisseria meningitidis A, C, W, Y.
Pese a los avances logrados por las técnicas anteriores, algunos patógenos como Neisseria meningitidis B todavía suponían un reto. Su cápsula está constituida por polisacáridos estructuralmente similares a las moléculas del ácido N-acetilneuramínico, presente en el tejido neuronal humano. Por tanto, es capaz de eludir el reconocimiento por parte del sistema inmune y apenas induce síntesis de anticuerpos protectores.
Este reto se superó con la vacunología inversa, un nuevo tipo de vacunología que fue posible gracias a las nuevas tecnologías basadas en la secuenciación del genoma completo de organismos vivos.
La vacunología inversa parte del genoma del patógeno para determinar los posibles antígenos sin necesidad de cultivar el microorganismo. Esta tecnología predice, mediante métodos bioinformáticos, los antígenos que pueden representar candidatos vacunales y que no se habrían descubierto por las vías tradicionales.
La primera aplicación de la vacunología inversa fue para el diseño de la vacuna frente a Neisseria meningitidis B. A partir del genoma del meningococo B se aplicó la tecnología de vacunología inversa. Se identificaron en primer lugar 570 secuencias génicas de ARN correspondientes a proteínas secretadas o de membrana, de las cuales solo 350 fueron expresadas con éxito en E. coli. De aquí, solo 85 proteínas indujeron una respuesta inmune en el ratón, de las cuales 28 dieron positivo en los ensayos bactericidas. En último lugar, se compararon las secuencias de estas proteínas con las de organismos relacionados filogenéticamente. La vacuna se diseñó con las 3 secuencias más estables y conservadas con el objetivo de proteger frente a un mayor número de cepas patógenas.
Vídeo 2: adyuvantes
Los orígenes de la vacunología se remontan a 1796 de la mano de Edward Jenner y la variolización.
Las primeras vacunas se basaron en microorganismos enteros y su principal ventaja era la alta inmunogenicidad y la capacidad de estimular una respuesta similar a la inducida tras una infección natural.
Sin embargo, estas podían provocar una enfermedad parecida a la infección natural, lo que resulta en una menor tolerabilidad.
Así pues, las técnicas de atenuación e inactivación y purificación antigénica han llevado al desarrollo de vacunas más tolerables, aunque con menor inmunogenicidad.
Para superar este reto, se han utilizado nuevos componentes, llamados adyuvantes, que imitan a los desencadenantes de la respuesta inmune y potencian la inmunogenicidad de la vacuna manteniendo un perfil de seguridad aceptable. Estas sustancias aceleran, prolongan, amplían o aumentan la respuesta inmunitaria frente a un antígeno.
La mayoría de ellos actúan activando transitoriamente la primera línea de defensa (el sistema inmune innato). Esto puede contribuir a la amplificación de las respuestas de linfocitos B y T.
Los adyuvantes constituyen una de las estrategias que han conseguido un mayor número de logros a la hora de afrontar los retos de la vacunología moderna. Así pues, se han considerado a menudo para el desarrollo de vacunas de antígenos purificados y algunas inactivadas debido a la ausencia de desencadenantes naturales de la inmunidad innata en este tipo de vacunas.
Las principales ventajas potenciales son:
Aumentan la amplitud y duración de la respuesta inmune.
Mejoran el reconocimiento de los antígenos para inducir una respuesta similar a la respuesta inmune innata natural.
Permiten reducir la cantidad de antígeno en cada dosis de vacuna y el número de dosis.
Especialmente útil en poblaciones cuya respuesta vacunal está disminuida: lactantes, personas de edad avanzada o inmunodeprimidos.
Hasta el año 2000 los únicos adyuvantes disponibles eran las sales de aluminio, los virosomas y el MF59. La combinación de estos adyuvantes clásicos con otros de desarrollo más reciente, llamados inmunoestimulantes, ha dado lugar a los Sistemas Adyuvantes. Los utilizados a día de hoy en vacunas comercializadas son:
- (1)
AS04, compuesto por las sales de aluminio clásicas y el MPL, y empleado en la elaboración de una vacuna frente al virus de la hepatitis B y otra frente al virus del papiloma humano.
- (2)
AS03, compuesto por una emulsión de aceite en agua y la vitamina E utilizado en una vacuna antigripal pre-pandémica H5N1.
- (3)
AS01, compuesto por liposomas, MPL y Quillaja saponaria Molina, y empleado en la vacuna de subunidades frente a herpes zoster y malaria, y en vacunas en desarrollo frente a tuberculosis.
Existen otros adyuvantes incluidos en varias vacunas en desarrollo, como el ISA51, el GLA-SE, la toxina del Vibrio cholerae, la toxina lábil de E. coli enterotoxigénica y la flagelina.