La mayoría de las enfermedades renales asociadas con gammapatías monoclonales resultan del depósito de inmunoglobulinas monoclonales o de sus fragmentos en distintos compartimentos del riñón1. La enfermedad por depósitos de inmunoglobulinas monoclonales (EDIM) no amiloide se define por depósitos de cadenas ligeras y/o pesadas monoclonales en membranas basales de glomérulos, túbulos y vasos2. Se conocen 3 subtipos de EDIM, la enfermedad por depósitos de cadenas ligeras (EDCL), la enfermedad por depósitos de cadenas pesadas (EDCP) y la enfermedad por depósitos de cadenas ligeras y pesadas (EDCLP)3. Dentro de las EDIM, la EDCL es la más prevalente4 y es la cadena kappa la que se deposita con mayor frecuencia5. Su expresión clínica se caracteriza por insuficiencia renal con proteinuria, tiene un pronóstico grave y suelen acompañarse de un mieloma múltiple u otro proceso linfoproliferativo6. A continuación describimos el caso de un anciano con una EDCL tipo lambda cuya manifestación clínica fue un síndrome nefrótico severo.
Se trataba de un varón de 84 años con antecedentes personales de hipertensión arterial sin tratamiento, estenosis del canal cervical y lumbar, coxartrosis, crisis de ausencia diagnosticada en 1992 en tratamiento con lamotrigina, colelitiasis múltiple asintomática, aneurisma de aorta abdominal infrarrenal, adenoma de próstata, hiperparatiroidismo por adenoma intervenido en 2002, herniorrafia inguinal bilateral en 2005, y apendicectomizado. No tenía alergias a medicamentos y era independiente para actividades básicas de la vida diaria, sin antecedentes de deterioro cognitivo (puntuación en las escalas de Cruz Roja funcional y mental de 0/0).
El paciente fue remitido por su médico de cabecera a la consulta de Nefrología por el hallazgo de una proteinuria de 3,84g/día. Diez meses antes había estado ingresado en el Servicio de Medicina Interna, por aumento de tamaño de miembro inferior derecho y fue etiquetado de linfedema, recibiendo tratamiento con furosemida y heparina de bajo peso molecular. Revisada la historia de ese ingreso en el sistemático de orina ya se constató la presencia de una proteinuria.
En la exploración física en la consulta externa destacaba: peso 68kg, talla 176cm, presión arterial 120/60mmHg, frecuencia cardíaca 68lpm. En la auscultación cardiopulmonar presentaba un soplo sistólico i/iv localizado en foco mitroaórtico e hipoventilación en ambas bases pulmonares. Tenía edemas con fóvea en miembros inferiores, más en la extremidad derecha, siendo el resto de la exploración anodina.
En la analítica en sangre destacaba: glucosa: 83mg/dl; creatinina: 1mg/dl; urea: 44mg/dl; ácido úrico: 6,4mg/dl; colesterol: 260mg/dl; triglicéridos: 105mg/dl; albúmina: 3,2g/dl; proteínas totales: 5g/dl; calcio: 9mg/dl; fósforo: 3,6mg/dl; y LDH: 427 U/L (VR: 240-500). Hemograma y coagulación dentro de los valores normales. El estudio inmunológico incluyendo proteína C reactiva, factor reumatoide, ASLO, complemento, IgG e IgM: dentro de los valores normales. IgA: 54mg/dl (valor de referencia: 82-453). ANCAS negativo. La electroforesis en sangre mostró un aumento de alfa2 globulinas y disminución de gammaglobulinas (sin picos monoclonales). Marcadores tumorales (CEA, CA19-9, alfa feto-proteína y PSA) se encontraban dentro de los valores normales. La beta-2-microglobulina fue de 2,88mg/l (valor de referencia: 0,60-2,16).
La cuantificación de proteínas en orina recogida de 24h fue de 3,84g/24h y en la electroforesis se trataba de una proteinuria no selectiva, siendo la proteína de Bence Jones negativa. En la ecografía abdominal ambos riñones presentaban un aumento de la ecogenicidad sin apreciar dilatación y el tamaño era normal.
Se instauraron medidas sintomáticas para tratamiento del síndrome nefrótico: restricción de líquidos y de sal, diuréticos del asa, inhibidor del enzima de conversión de angiotensina ii (que se retiró por hipotensión) y heparina de bajo peso molecular. Para estudiar la etiología del síndrome nefrótico se realizó una biopsia renal percutánea ecodirigida con los hallazgos de: «6 glomérulos por plano de corte, ninguno de ellos esclerosado. Todos los glomérulos presentaban una imagen histológica similar, con una ampliación del ovillo glomerular a expensas de un material eosinofilico y acelular rojo Congo negativo. Con las técnicas de inmunofluorescencia se demostró la presencia de depósitos glomerulares y tubulares para cadenas Lambda, resultando negativos Kappa, IgA, IgG, IgM y C3. En el intersticio no se observó infiltrado inflamatorio», siendo el diagnóstico final de enfermedad por depósitos de cadenas ligeras Lambda.
Se realizó un estudio de médula ósea: en la zona puncionada se apreciaba una celularidad con un porcentaje de células plasmáticas normal.
Los hallazgos patológicos de la serie ósea fueron moderada hiperinsuflación pulmonar y signos degenerativos severos de las últimas vertebras lumbares, siendo el resto de la serie ósea normal.
Con los resultados de la biopsia renal se instauró tratamiento con ciclofosfamida oral y dexametasona con pobre respuesta, presentando nueva descompensación nefrótica que precisó ingreso hospitalario para hacer balances negativos. Tras repetir 3 ciclos más de ciclofosfamida y dexametasona, ante la persistencia de proteinuria nefrótica se indicó tratamiento con bortezomib con un esquema terapéutico a dosis iniciales de 1,3mg/m2/d iv días 1, 4, 8 y 11 y dexametasona: 40mg/d po días 1-4 cada 21 días.
En el segundo ciclo de bortezomib con dexametasona el paciente volvió a ingresar por nueva descompensación nefrótica con evolución clínica favorable con el tratamiento deplectivo con diuréticos. En la última revisión tras el segundo ciclo de bortezomib y dexametasona la función renal permanece estable con creatinina sérica de 0,9mg/dl y la proteinuria estabilizada en 2,86g/24h.
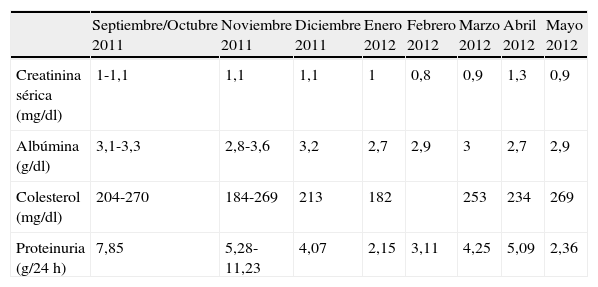
En la tabla 1 se recoge la evolución de función renal, albúmina, lípidos y proteinuria.
Evolución de parámetros analíticos durante el tratamiento establecido
| Septiembre/Octubre 2011 | Noviembre 2011 | Diciembre 2011 | Enero 2012 | Febrero 2012 | Marzo 2012 | Abril 2012 | Mayo 2012 | |
| Creatinina sérica (mg/dl) | 1-1,1 | 1,1 | 1,1 | 1 | 0,8 | 0,9 | 1,3 | 0,9 |
| Albúmina (g/dl) | 3,1-3,3 | 2,8-3,6 | 3,2 | 2,7 | 2,9 | 3 | 2,7 | 2,9 |
| Colesterol (mg/dl) | 204-270 | 184-269 | 213 | 182 | 253 | 234 | 269 | |
| Proteinuria (g/24h) | 7,85 | 5,28-11,23 | 4,07 | 2,15 | 3,11 | 4,25 | 5,09 | 2,36 |
La EDIM suele presentarse típicamente en la sexta década de la vida, e incluso más precoz en las formas de EDIM puras. En cambio, las combinaciones de EDCL con nefropatía por cilindros del riñón del mieloma se diagnostican con más frecuencia en población más envejecida y se suelen manifestar estos casos por presentar una insuficiencia renal severa, más que por aparición de una proteinuria severa5. Nuestro caso tiene varias peculiaridades: en primer lugar, la edad de presentación poco habitual de una EDCL pura al tratarse de un persona octogenaria; en segundo lugar, el tipo de depósito de cadena ligera (Lambda) que tampoco es la más frecuente. En el caso que comunicamos la única manifestación renal fue la presencia de un síndrome nefrótico severo, pero sin insuficiencia renal, cuya explicación pueda radicar en tratarse de una EDCL pura sin coexistencia de otros procesos linfoproliferativos ni mieloma múltiple.
Respecto al tratamiento de la EDCL los datos son limitados e incluyen medidas para tratar de preservar la función renal y mejorar la supervivencia del paciente. En general, los regímenes terapéuticos son parecidos a los empleados en el mieloma múltiple7. En nuestro caso ante la escasa respuesta al tratamiento con ciclofosfamida más dexametasona se decidió probar tratamiento con bortezomib dados los resultados de experiencias con este fármaco8.
En conclusión, describimos una presentación atípica de una EDCL en un paciente octogenario, manifestado por un síndrome nefrótico como única forma de afectación renal.