El carcinoma de células grandes de pulmón con inmunofenotipo nulo (LCC-NI) constituye una entidad diagnóstica que hoy en día es especialmente infrecuente ya que no cuenta con ningún tipo de diferenciación celular o alteraciones moleculares propias. Representa un reto diagnóstico excepcional, el cual solo es posible realizar por exclusión contando con la resección quirúrgica, estudios de inmunohistoquímica y moleculares adecuados. Presentamos el caso de un varón de 69años de edad, con antecedente de alto índice tabáquico, que debuta con dolor pleurítico y tumor en el lóbulo pulmonar superior derecho, el cual se retira mediante lobectomía. A la evaluación patológica muestra una morfología de células grandes sin ningún inmunofenotipo, alteraciones moleculares o genómicas mediante estudios de secuenciación de siguiente generación (NGS), diagnosticándose como un LCC-NI.
Large cell carcinoma of the lung with null-immunophenotype (LCC-NI) is a diagnostic entity that is especially uncommon now as it does not have any type of cell differentiation or its own molecular alterations. It presents an exceptional diagnostic challenge; indeed, the diagnosis is only possible with complete surgical excision and adequate immunohistochemical and molecular studies. We report the case of a 69-year-old male, with a history of long-term smoking who presented with pleuritic pain. A tumor in the upper lobe of the right lung was detected and removed by lobectomy. Histopathology revealed a neoplasm with large cell morphology without any specific immunophenotype, molecular or genomic rearrangements through next-generation sequencing (NGS) studies, which was diagnosed as LCC-NI.
Dentro de las causas de muerte por cáncer, el de pulmón se posiciona en el primer lugar, constituyendo el 25% de ellas, con aproximadamente 1,5 millones de muertes anuales. Aunado a lo anterior, el cáncer pulmonar tiene aproximadamente el 17,7% de supervivencia global a los 5años, constituyendo la peor tasa de supervivencia si se la compara con otras neoplasias, y en gran parte esto es debido a que hasta el 57% de las neoplasias malignas pulmonares se diagnostican en la etapaIV, que solamente tiene un rango de supervivencia a 5años del 8%1.
De acuerdo con la quinta edición de la clasificación de la Organización Mundial de la Salud (OMS) para tumores torácicos, el carcinoma de células grandes (LCC) con inmunofenotipo nulo (LCC-NI) de pulmón es un tumor de células no pequeñas indiferenciado que no cuenta con distintivos citológicos, histológicos, arquitecturales e inmunofenotípicos de un carcinoma de células no pequeñas de células escamosas (SCC), neuroendocrino o adenocarcinoma (ADC)2.
Históricamente, en la década de los noventa los LCC comprendían alrededor del 10% de todos los carcinomas pulmonares; sin embargo, de acuerdo con los datos del programa SEER del Instituto Nacional de Cáncer (NIH), en Estados Unidos la frecuencia del LCC ha disminuido de forma importante en los últimos años, hasta comprender alrededor del 1,5% de todos los carcinomas de pulmón en las últimas 2 a 3décadas, lo que podría ser atribuido a la redefinición de criterios, a la implementación seriada de marcadores diagnósticos por inmunohistoquímica, como TTF-1, P40, y a los estudios moleculares2-4.
Actualmente el LCC es una neoplasia sumamente infrecuente de pulmón, debido a la mejor comprensión del comportamiento biológico de los LCC y a que diversas variedades incluidas en este espectro han sido recategorizadas en otros grupos4. Previo a la actualización de la clasificación de tumores pulmonares publicada en el año 2015 por la OMS, esta neoplasia compartía la misma categoría diagnóstica con otras variedades histológicas2,4. El carcinoma neuroendocrino de células grandes (LCNEC) se incluyó en el grupo de tumores neuroendocrinos, los carcinomas basaloides se incluyeron en el grupo de los SCC, y el carcinoma tipo linfoepitelioma, en el grupo de misceláneos. Las variedades de células claras y rabdoide se degradaron a componentes que pueden estar presentes en cualquier categoría y confieren un peor pronóstico; sin embargo, la presencia de un componente rabdoide se ha relacionado con los tumores indiferenciados deficientes de SMARCA4/BRG12,4,5.
Los pacientes afectados suelen ser de edad avanzada, entre la sexta y la séptima décadas de la vida, y la gran mayoría con antecedente de exposición al tabaco de larga evolución. Los LCC de pulmón tienen predilección por regiones periféricas, y el sitio de presentación más frecuente es el pulmón derecho —atribuido al mayor volumen con respecto al pulmón izquierdo—, específicamente en el lóbulo superior2,6. Los sitios de metástasis más frecuentes son el cerebro, el hueso y el hígado6,7. Macroscópicamente son tumores de gran tamaño al momento del diagnóstico, variablemente circunscritos y sólidos, y es frecuente que presenten necrosis2.
Tratándose de un diagnóstico de exclusión, que solo es posible realizar con la resección quirúrgica, los criterios necesarios para su diagnóstico requieren demostrar la ausencia de diferenciación hacia las líneas de ADC y SCC2. Esto se puede lograr por medio de la identificación de morfología incompatible con estos diagnósticos o mediante el empleo de técnicas de inmunohistoquímica para TTF-1, Napsina A y/o demostración de mucina intracelular por medio de tinciones de histoquímica para ADC, además de p40, p63 y/o CK5/6 para SCC, específicamente para las variante sólida y no queratinizante, respectivamente2,4,5,8,9. Mediante el empleo de estas tinciones es posible categorizar hasta el 90% de los tumores con morfología de LCC como ADC o SCC9,10. Los casos sin expresión de estos marcadores, pero con positividad para citoqueratinas de amplio espectro, representan la gran minoría de los casos y corresponden a los LCC-NI2,10.
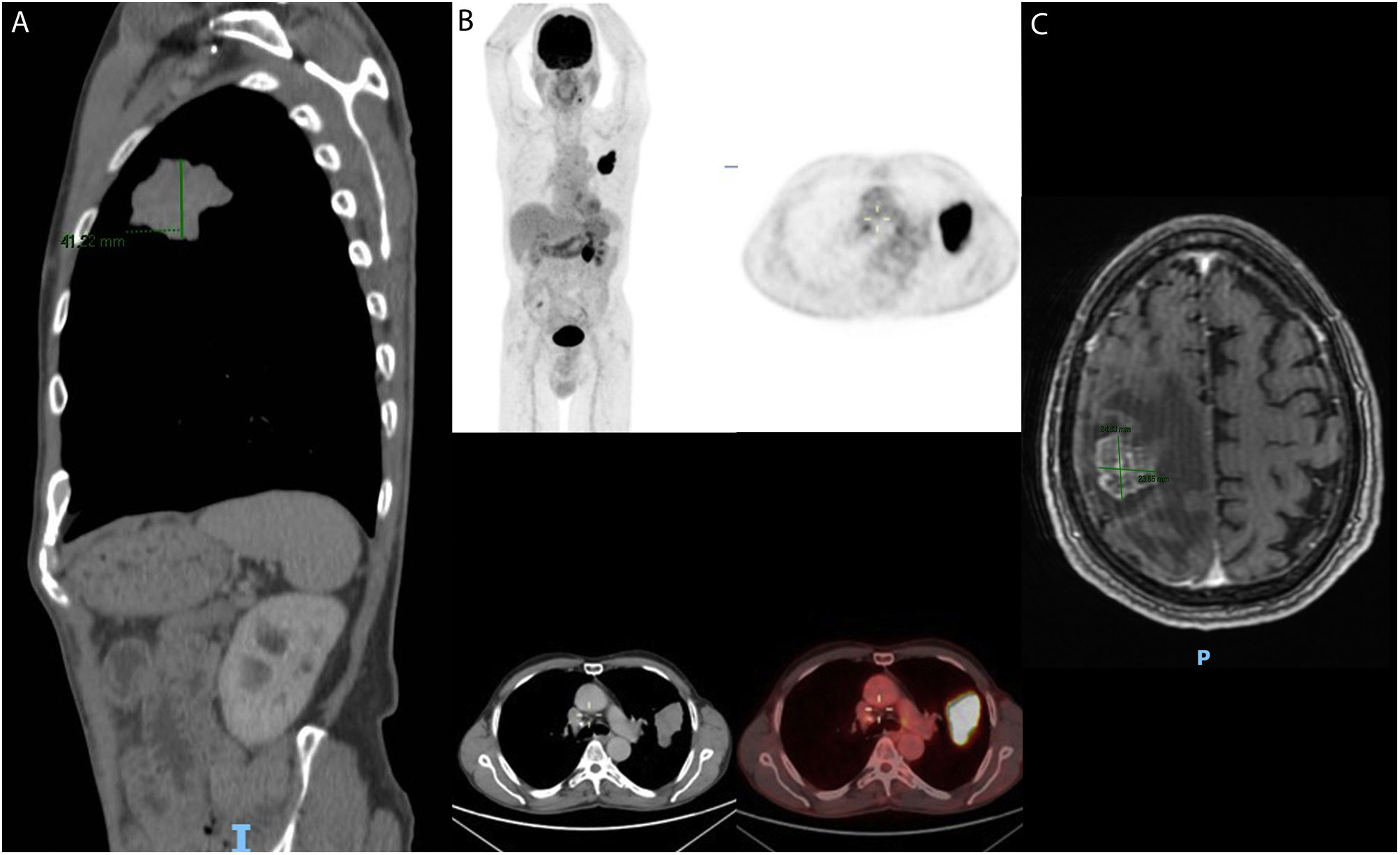
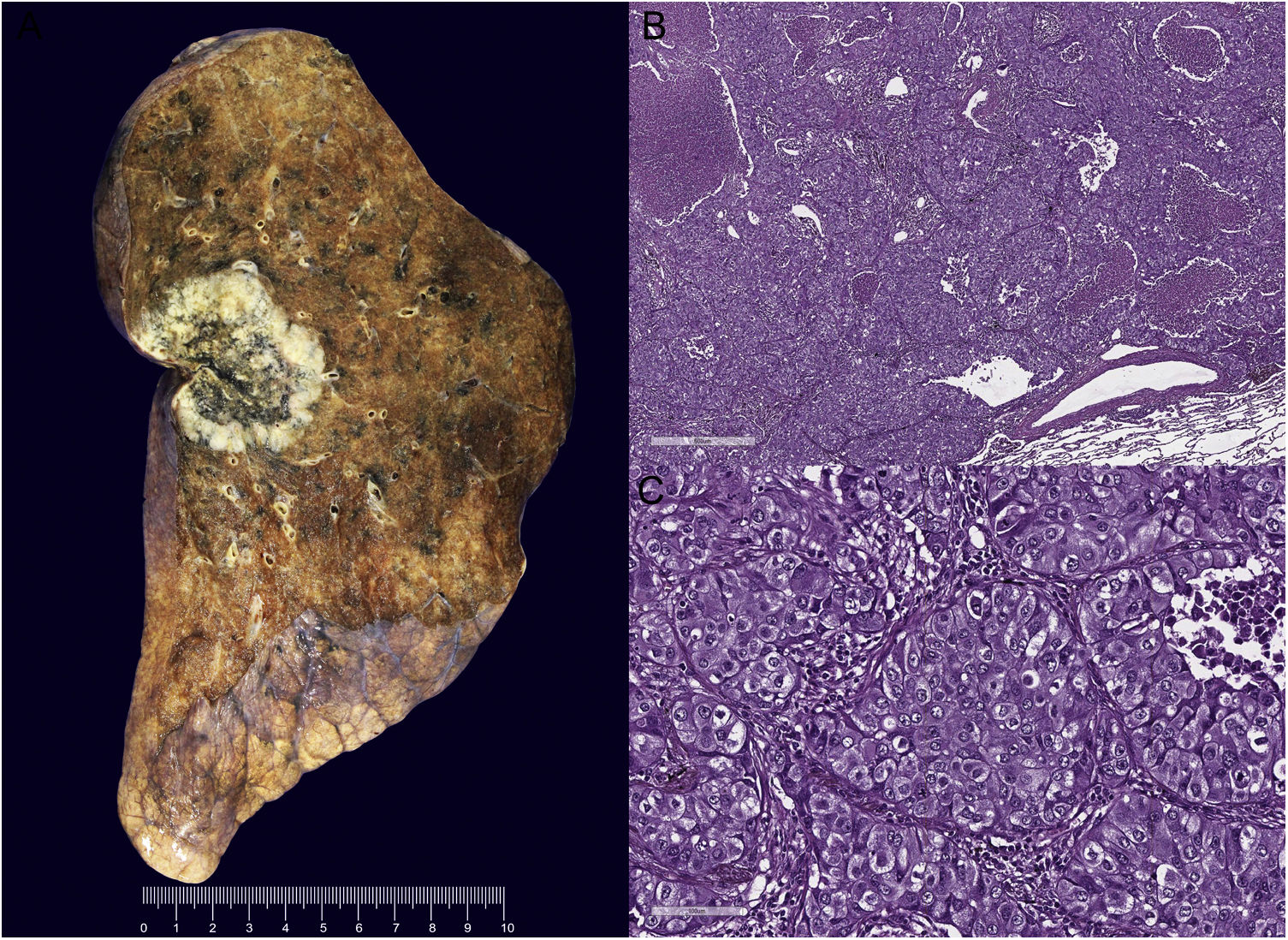
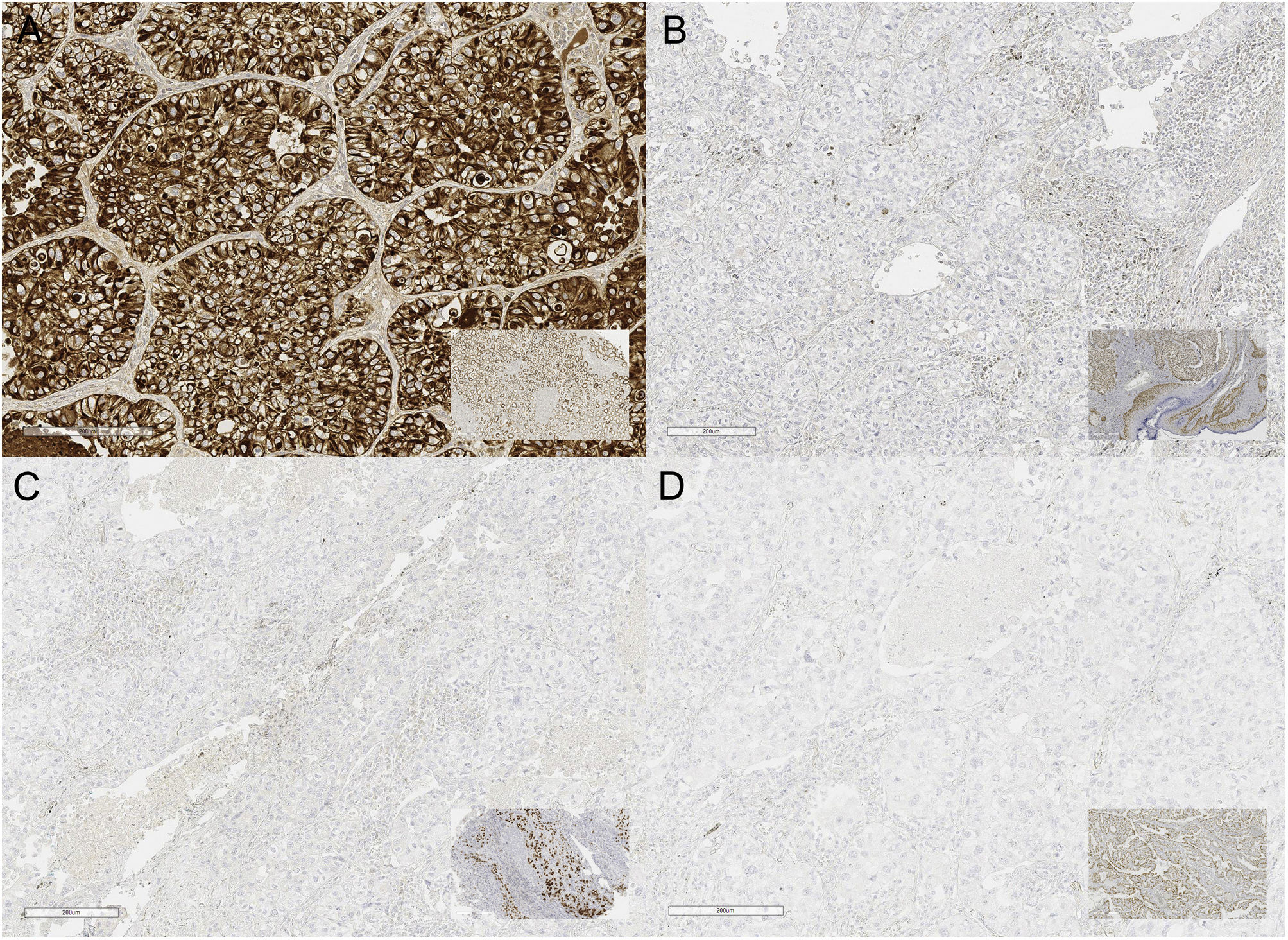
Presentación de casoPaciente varón en la séptima década de la vida. Agricultor, sin antecedentes patológicos. Tabaquismo activo durante 40años con índice tabáquico mayor a 40, exposición al humo de leña y minería. Debuta en agosto de 2021 con dolor torácico de tipo pleurítico asociado a inspiración, motivo por el cual acude a valoración. Durante el abordaje inicial se evidencia la presencia de un tumor en el hemitórax izquierdo a través de una radiografía de tórax, por lo que es referido a un hospital de tercer nivel para continuar el abordaje diagnóstico. En la tomografía axial computarizada (TAC) se identifica un tumor pulmonar localizado en el segmento apicoposterior del lóbulo superior izquierdo que retrae la cisura mayor, multilobulada, de bordes espiculados, heterogénea con áreas hipodensas sugestivas de necrosis, con medidas de 54,9 ×30,1 ×41,2mm y extensión a la pleura (fig. 1A). No se evidencia la presencia de tumor en otro sitio anatómico. Se realiza biopsia por trucut, que se reporta en el servicio de patología del hospital como un carcinoma de células no pequeñas (NOS) con invasión angiolinfática y necrosis, la cual resulta negativa para marcadores de inmunohistoquímica TTF-1, P40, ALK-1 (Clona D5F3 Ventana), PDL-1 (Clona SP263 Ventana) y ROS-1. Además, se realiza PCR en tiempo real para mutaciones en los genes K-RAS y EGFR, las cuales resultan negativas. Posteriormente se realiza PET/TC, en la cual se observa hipermetabolismo glucolítico en tumor (SUVmax de 12,1) y ganglios linfáticos de las estaciones 4L, 4R y 10R (fig. 1B). Al contar con un ECOG0, EVA0, al no mostrar alteraciones blanco moleculares y al descartar otro sitio primario y/o metastásico, se decide realizar lobectomía superior izquierda con linfadenectomía para una adecuada clasificación (TNM). El producto de la resección quirúrgica mide 22 ×13,5 ×4cm, y el tumor, 6 ×5,4 ×4,8cm (fig. 2A). Histológicamente la neoplasia tiene morfología de células grandes, poco diferenciada, con comedonecrosis e invasión angiolinfática (fig. 2B,C). En este escenario diagnóstico, y al contar con la biopsia previa no concluyente, se decide realizar un panel por inmunohistoquímica para determinar el origen mesenquimal como vimentina, la cual es negativa; epitelial como citoqueratina OSCAR, que resulta positivo difuso, y un panel de diferenciación constituido por TTF-1, P40, Napsina A, CD56, Sinaptofisina e INSM1, resultando todos negativos, además de SMARCA4/BRG1, el cual se encuentra preservado, además se descartan metástasis en los ganglios linfáticos disecados, confirmado con inmunohistoquímica (fig. 3).
Estudios de imagenología y medicina nuclear. A)TAC: proyección sagital en la cual se identifica un tumor de bordes irregulares con discreto realce periférico y áreas hipodensas centrales sugestivas de necrosis. B)PET/CT (Discovery Elite 690, PET de alta resolución de cristal LYSO y CT de 16 detectores) en la cual se observa hipermetabolismo glucolítico en tumor (Im: 187; Se: 6) (Im: 187; Se: 6) con SUVmax de 12,1. C)MRI: corte axial secuenciada en T1 con realce heterogéneo a la administración de gadolinio en lesión metastásica a nivel de lóbulo parietal derecho con medidas de 24,6 ×23,85mm.
Producto de resección quirúrgica y características morfológicas del LCC-NI. A)Macroscópicamente el tumor es sólido, heterogéneo, con una región periférica blanquecina y área central necrótica, de bordes expansivos e infiltrativos, que involucra y retrae la pleura visceral, sin lesiones satélite. B)Histológicamente la neoplasia es poco diferenciada, con arquitectura sólida y en nidos con comedonecrosis, e invade los espacios aéreos. C)Células grandes, con formación de pseudoluces, citoplasma amplio, núcleos de alto grado con cromatina vesicular y antracosis. Hematoxilina y eosina. Aumento original, 200x (B); aumento original, 100x (C).
Al no poder determinar un linaje de diferenciación celular a través de estudios por inmunohistoquímica y PCR en tiempo real, se decide realizar pruebas de secuenciación integrada de próxima generación (NGS) para ADN y ARN en tejido parafinizado con el equipo Ion Torrent Genexus™ (ThermoFisher Scientific), el cual no arrojó mutaciones para el panel de 50 genes analizados. Dada la evidencia histológica, inmunofenotípica y molecular, se determina el diagnóstico de un LCC-NI.
Tres meses tras la intervención quirúrgica el paciente presenta parestesias y movimientos tónico-clónicos en el antebrazo izquierdo, además de disminución de la fuerza de la extremidad inferior izquierda que imposibilita la marcha, por lo que se toma MRI, en donde se reporta lesión metastásica en el lóbulo parietal derecho que posteriormente se confirma por medio de biopsia (fig. 1C).
Análisis y discusiónActualmente las terapias con blancos terapéuticos accionables constituyen un campo de investigación que está avanzando de forma exponencial como nunca antes se había visto8. Las guías propuestas por el Colegio Americano de Patólogos (CAP), la Asociación Internacional para el Estudio de Cáncer de Pulmón (IASCL) y la Asociación de Patología Molecular (AMP) recomiendan la búsqueda de alteraciones EGFR, ALK, ROS-1 como mínimo para todos los pacientes con cáncer de pulmón11. Sin embargo, debido a la poca incidencia y a la inconsistencia de blancos terapéuticos accionables en estos tumores, a diferencia de otros como ADC y SCC que presentan alteraciones de forma persistente en EGFR, ALK y ROS-1, actualmente no hay un consenso para el abordaje terapéutico8,11.
La información disponible en la literatura actual acerca del perfil genético y molecular del LCC es escasa y los estudios encaminados a dilucidar esta información han producido información discordante o no concluyente. La gran heterogeneidad en los resultados no permite afirmar con claridad un plan terapéutico específico para estos pacientes4,6. La implementación de técnicas de diagnóstico molecular como la secuenciación de próxima generación ha facilitado esta problemática, especialmente para ADC y SCC. Asimismo, se ha logrado identificar subtipos moleculares basándose en el análisis de los patrones de metilación, aunque no ha resultado de gran utilidad en la identificación de blancos terapéuticos accionables3,12.
Hay otras entidades a considerar en el diagnóstico diferencial, como el LCNEC, un tumor que se caracteriza por demostrar evidencia morfológica e inmunohistoquímica para al menos un marcador de diferenciación neuroendocrina como CD56, sinaptofisina y/o cromogranina2,10. El tumor indiferenciado deficiente en SMARCA4/BRG1, un tumor de alto grado que suele afectar la pared torácica o el mediastino de adultos jóvenes asociados a la deficiencia de BRG1, un complejo de remodelación de cromatina, suele demostrar una morfología epitelioide o rabdoide con expresión débil o ausente para citoqueratinas y positividad para marcadores de células progenitoras, como CD34, SOX2 y/o SALL42,4,10.
Si bien los LCC muestran perfiles genómicos similares a los ADC o SCC, los LCC-NI frecuentemente albergan alteraciones en genes asociados a WNT (48%). La expresión de PD-L1 —una proteína expresada en diversos tipos celulares que funciona como factor coinhibidor y punto de control para la respuesta inmune— ha sido identificada en una cantidad considerable de casos de LCC-NI, los cuales resultan candidatos para inmunoterapia dirigida; sin embargo, la dificultad técnica en la interpretación y en la estimación de su expresión, la alta heterogeneidad celular intratumoral y la variabilidad en la respuesta al tratamiento han presentado retos en su implementación rutinaria4,8,11,13.
Resulta importante reconocer la utilidad de la NGS como herramienta para la caracterización molecular de los carcinomas de células no pequeñas de pulmón y la correcta interpretación de los resultados para ofrecer medicina de precisión. No obstante, la gran versatilidad en la identificación de una amplia gama de alteraciones, no solo con fines terapéuticos, sino también con la posibilidad de estratificar pacientes en grupos con utilidad pronóstica, la hace una opción altamente atractiva en relación con otras técnicas con menor alcance y mayor coste1,3,14.
La presentación clínica de nuestro caso es similar a lo descrito en la literatura, tratándose de un paciente con las características clínicas y factores de riesgo asociados al LCC. Resulta de interés el hecho de que el paciente en el momento de la resección de la neoplasia se encontraba neurológicamente íntegro y en un estadio clínicoII-B; sin embargo, en los primeros 3meses subsecuentes presentó metástasis única cerebral, evolucionando a un estadio clínicoIV-A, lo cual remarca la agresividad asociada a esta entidad aun en el contexto de una cirugía exitosa con bordes negativos y ganglios linfáticos sin metástasis. En un reporte de caso sobre un LCC altamente agresivo, Rajdev et al.7 estimaron el tiempo de duplicación del tamaño tumoral (14,1días), demostrando deterioro clínico en un lapso de tiempo corto, lo cual contrasta con lo reportado en la literatura, donde se estima que el tiempo de duplicación del tamaño tumoral promedio del LCC es de aproximadamente 60-130días11.
Aun tras la implementación de técnicas moleculares especializadas, como la NGS, no fue posible detectar una alteración con significancia pronóstica y/o terapéutica para nuestro paciente, el cual pudo haberse visto beneficiado con un tratamiento dirigido en un inicio. Sin embargo, la evidencia de enfermedad metastásica a distancia le confiere un pronóstico sombrío inherente a la neoplasia, independientemente de las posibles vías moleculares alteradas.
ConclusiónEn la actualidad la importancia de la aplicación y la correcta interpretación de las nuevas herramientas diagnósticas moleculares disponibles nos ayudan a abrir distintos panoramas al abordar neoplasias que antes se consideraban comunes, como lo es el LCC de pulmón, en donde el techo diagnóstico, pronóstico y terapéutico era limitado, convirtiéndose en entidades sumamente excepcionales (LCC-NI), en las cuales el patólogo quirúrgico, de la mano de las herramientas adecuadas, juega un papel invaluable para dilucidarlas.
FinanciaciónNo existe una beca u organización financiadora que declarar para la realización de este articulo. Este fue realizado con recursos propios de los autores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.