de leflunomida-metotrexato, debido al mayor coste de adquisición de infliximab. Además, según estudios recientes, la combinación leflunomida-metotrexato demuestra que en pacientes con artritis reumatoide resistente a la monoterapia con metotrexato las tasas de respuesta clínica son similares a las observadas con infliximab-metotrexato.
Introducción
La artritis reumatoide (AR) tiene una prevalencia en la población española (según los resultados del estudio EPISER 2000) del 0,5% (IC del 95%, 0,2-0,8) y un considerable impacto sobre la calidad de vida y la capacidad funcional de los pacientes afectados1. El coste anual de la artritis reumatoide en España se ha estimado en 1.262 millones de € (210.000 millones de pesetas)2. Esta cifra indica el importante consumo de recursos sanitarios que genera la enfermedad3 y podría verse incrementada con la incorporación de nuevos fármacos, principalmente de biotecnología, que tienen un alto coste de adquisición. Este hecho, así como la creciente preocupación por la contención del gasto sanitario, justifica la realización de análisis farmacoeconómicos que evalúen la eficiencia de los diferentes tratamientos de la AR4.
Los objetivos finales del tratamiento de la AR deben ser la prevención o el control del daño articular, preservar la capacidad funcional y la disminución del dolor. Una actividad persistente de la enfermedad, las exacerbaciones repetitivas o la aparición de toxicidades asociadas al tratamiento farmacológico pueden aconsejar un cambio del tratamiento. Un elevado porcentaje de pacientes no responde adecuadamente a la monoterapia, por lo que, para alcanzar un control satisfactorio de la enfermedad, frecuentemente se utilizan tratamientos combinados con fármacos antirreumáticos modificadores de la enfermedad (FAME)5. Metotrexato (MTX) en monoterapia o en combinación es uno de los fármacos más utilizado en pacientes con enfermedad muy activa o con factores de mal pronóstico.
Recientemente se ha comercializado en España leflunomida (LEF), un nuevo inmunomodulador y FAME, indicado en el tratamiento de la AR activa6. También se ha demostrado el beneficio de LEF en combinación con MTX en pacientes con respuesta insuficiente a éste7-9. Infliximab (INF) es un anticuerpo monoclonal que inhibe la actividad del factor de necrosis tumoral (TNF)10, indicado, en combinación con MTX, en la reducción de los signos y síntomas de la AR en los pacientes que respondieron inadecuadamente a los FAME, incluido el MTX en monoterapia10,11.
En 2001 se publicó un análisis farmacoeconómico español en el que se compararon la monoterapia con LEF y la combinación de INF y MTX (INF+MTX), confirmándose mayores costes de la enfermedad con esta última12. Actualmente se dispone de un ensayo clínico aleatorizado, controlado con placebo, de la combinación de LEF y MTX (LEF+MTX)13.
En el presente estudio se estimó la eficiencia (la eficacia en relación con los costes) del tratamiento en segunda línea de la AR con LEF+MTX o INF+MTX en pacientes en los que fracasó el tratamiento previo con MTX solo.
Método
Modelo farmacoeconómico
El estudio consistió en un modelo farmacoeconómico, entendido éste como un esquema teórico que permite hacer simulaciones de procesos sanitarios complejos relacionados con medicamentos y que es construido, siguiendo un protocolo previamente establecido, mediante estimaciones obtenidas a partir de los datos disponibles o publicados de eficacia, toxicidad y costes de las alternativas comparadas14. Se utilizó un árbol de decisiones de la AR empleado en otros estudios previamente publicados15,16 (fig. 1).
Figura 1. Árbol de decisiones de pacientes con artritis reumatoide activa resistente a metotrexato (MTX), tratada con leflunomida-metotrexato o infliximab-metotrexato. Respuesta ACR: respuesta clínica según los criterios ACR20 del American College of Rheu-matology.
Estimación de la eficacia y la toxicidad
No se dispone de ensayos clínicos que comparen directamente ambos tratamientos, por lo que se utilizaron los resultados de dos ensayos aleatorizados, controlados con placebo, con 6 meses de tratamiento13,17.
La eficacia de los tratamientos se valoró mediante el criterio de respuesta ACR20 del American College of Rheumatology (ACR), según el cual se considera que un paciente con AR responde significativamente a un tratamiento cuando mejora al menos un 20% en el recuento de las articulaciones dolorosas e inflamadas y, en el mismo porcentaje, como mínimo en 3 de los 5 parámetros restantes (dolor evaluado por el paciente, evaluación global de la enfermedad efectuada de forma independiente por el paciente y por el médico, función física percibida por el paciente y, por último, los reactantes de la fase aguda: velocidad de sedimentación o proteína C reactiva)18-20. Se decidió valorar, en el caso básico del estudio, la eficacia mediante el criterio de respuesta ACR20 y no mediante ACR50 o ACR70 (50 y 70% de mejoría, respectivamente) por dos motivos: porque el criterio ACR20 se considera el estándar en los ensayos clínicos de eficacia19, y debido a la dificultad de encontrar diferencias estadísticamente significativas con los criterios ACR50 y ACR70, por precisar mayores poderes estadísticos20.
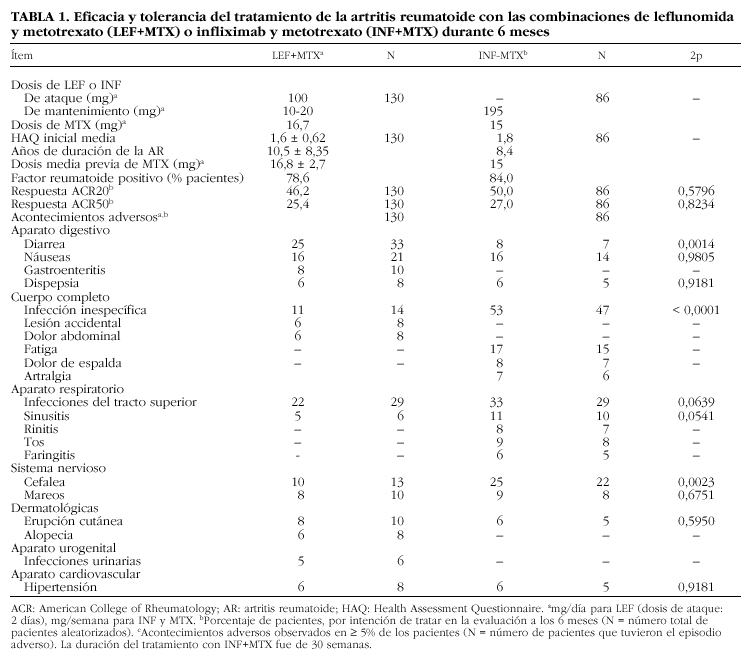
También se valoraron los acontecimientos adversos (AA) de los dos tratamientos comparados, con el objetivo de establecer los costes originados por ese concepto en cada caso (tabla 1).
El análisis de la eficacia y la toxicidad se hizo por intención de tratar (es decir, dividiendo los episodios entre todos los pacientes incluidos inicialmente en los estudios) a los 6 meses de tratamiento.
Tipo de análisis
De acuerdo con las respuestas ACR20 obtenidas con LEF+MTX e INF+MTX, del 46,2 y el 50,0% respectivamente (2p = 0,57), en un hipotético ensayo clínico que comparase directamente ambos tratamientos se necesitarían miles de pacientes para poder demostrar pequeñas diferencias de eficacia. Dado que no se dispone de tales resultados, se asumió que no existen diferencias demostradas en la eficacia clínica (tabla 1), por lo que se hizo un análisis de los costes de las alternativas comparadas, según el modelo farmacoeconómico del análisis de minimización de costes (AMC). Éste se llevó a cabo siguiendo las directrices generales para la realización de análisis farmacoeconómicos en España21, así como las directrices particulares para los AMC publicadas por la Oficina Canadiense de Coordinación de la Evaluación de las Tecnologías Sanitarias22 y la Universidad de Butler (Indianápolis, EE.UU.)23.
Finalmente, para construir el modelo se tuvo en cuenta algunos de los análisis de los costes del tratamiento de la AR previamente publicados15,16, así como una revisión de LEF del Instituto Wessex del Reino Unido24.
Perspectiva del estudio
En España, LEF, INF y MTX comprimidos son especialidades farmacéuticas que se dispensan con receta médica y son reembolsables por la Seguridad Social. Siguiendo las recomendaciones españolas para la realización de análisis farmacoeconómicos, el presente estudio se hizo desde la perspectiva de la sociedad21.
Horizonte temporal del estudio
El ensayo clínico con LEF+MTX tuvo dos períodos diferenciados a lo largo de 12 meses: en el primer semestre fue un estudio aleatorizado y controlado en el que se compararon LEF+MTX con placebo+MTX; en el segundo semestre fue un estudio abierto en el que los pacientes de uno y otro grupo pudieron seguir un tratamiento con LEF+MTX13,25. Sin embargo, el estudio ATTRACT17,26, realizado con INF+MTX, fue controlado durante los 12 meses de su duración. Debido a esta diferencia en los diseños de los ensayos clínicos, a efectos del modelo, la comparación de la eficacia y la toxicidad se limitó a un período de 6 meses13,17,25, haciéndose una estimación de los costes para un tratamiento anual. En consecuencia, no fue necesario aplicar ningún descuento a los costes o beneficios futuros, ya que la comparación no superó el año de tratamiento.
Estimación de los costes
La estimación de los costes de una enfermedad tratada con un determinado fármaco se hace mediante la identificación y la cuantificación de los recursos sanitarios que conlleva y asignando a los recursos unos determinados costes unitarios. De este modo, se estimaron los costes medios para un paciente tipo con AR activa que recibiera un tratamiento con LEF+MTX o INF+MTX. Los costes de los recursos sanitarios utilizados en el modelo se presentan en euros (€)del año 2001.
Recursos sanitarios. En primer lugar, se valoraron los costes del primer semestre, por los siguientes conceptos: adquisición del fármaco en origen, material fungible y tiempo del personal de enfermería necesario para la administración del medicamento, estancias hospitalarias y consultas, así como los costes del tiempo dedicado por los facultativos y los debidos a la necesidad de monitorización y pruebas de laboratorio. Finalmente, se valoraron los costes debidos a las reacciones adversas ocasionadas con los diferentes tratamientos y los costes indirectos (por pérdidas de jornadas laborales) estimados según el método del capital humano12. Los costes originados en el segundo semestre de tratamiento se estimaron asumiendo que en los pacientes con fracaso terapéutico en el primer semestre (debido a la ausencia de respuesta ACR o a la aparición de AA graves que obligaran a interrumpir el tratamiento) se cambiaría el tratamiento, mientras que los pacientes con respuesta ACR seguirían con el mismo tratamiento durante el segundo período. Este supuesto fue conservador para el tratamiento LEF+MTX, dado el alto coste de adquisición del tratamiento INF+MTX.
Las pautas de dosificación de los tratamientos se determinaron a partir de las recomendadas en las fichas técnicas de las especialidades farmacéuticas6,10,27, aunque ajustadas con las dosis medias utilizadas en los ensayos clínicos (tabla 1). La utilización de los demás recursos sanitarios se estimó a partir de las recomendaciones de las fichas técnicas6,10,27 y de estudios anteriormente publicados12,28-33.
Para desagregar los costes de enfermería, pruebas de laboratorio y radiodiagnóstico, éstos se excluyeron del coste hotelero de la estancia hospitalaria, con el fin de evitar en lo posible el doble recuento de gastos. Como tales costes hoteleros solamente se consideraron los gastos por personal no sanitario, mantenimiento, suministros y otros (p. ej., los de amortización del edificio del hospital), estimándose éstos en un 75% del coste de la estancia en el hospital de día34. Se contabilizaron aparte los costes médicos propiamente dichos, los generados por el personal facultativo y por la adquisición de productos farmacéuticos.
Los costes de la aguja y el filtro para la infusión intravenosa de INF, así como los debidos a su conservación y almacenamiento (en refrigeración), no se tuvieron en cuenta por ser, respectivamente, despreciables y difíciles de estimar28.
La estimación del coste de los AA se hizo mediante probabilidades obtenidas a partir de los ensayos clínicos13,17. La mayoría (diarrea, náuseas, gastroenteritis, dispepsia, dolor abdominal, fatiga, dolor de espalda, artralgia, rinitis, faringitis, cefalea, mareos, erupción cutánea, alopecia, hipertensión arterial, y aumento de la concentración de enzimas hepáticas) sería leve, su tratamiento conllevaría costes insignificantes por cada paciente tratado (analgésicos, antihistamínicos o antieméticos administrados durante períodos breves) o consistiría simplemente en la interrupción del tratamiento35. No obstante, estos pequeños costes se contabilizaron, al igual que los debidos al tratamiento de las infecciones respiratorias y urinarias. A este respecto, se estimó que una infección respiratoria conllevaría la realización de una radiografía de tórax, un hemocultivo, dos consultas en atención primaria y un tratamiento ambulatorio con 1 g de amoxicilina, cada 8 h, durante 10 días36. Asimismo, se estimó que una infección urinaria requeriría realizar un cultivo de orina, dos consultas en atención primaria y un tratamiento ambulatorio con 250 mg de ciprofloxacina, cada 12 h, durante 3 días37.
Costes unitarios. Los costes unitarios empleados en el análisis farmacoeconómico se detallan en la tabla 2. Los costes de adquisición de los medicamentos y de los diluyentes y sueros se obtuvieron del Catálogo de Especialidades Farmacéuticas11 y de una base de datos27. Los costes medios del tiempo dedicado por los profesionales sanitarios y los costes de los demás recursos sanitarios se estimaron a partir de una base de datos de costes sanitarios españoles29.
Análisis de sensibilidad
Todas las estimaciones consideradas en los epígrafes anteriores constituyeron el caso básico del estudio. Para comprobar la consistencia de sus resultados y de las estimaciones efectuadas, se hizo un análisis de sensibilidad simple univariante en el que se consideraron los siguientes escenarios: a) una respuesta ACR con INF+MTX ± 20% la observada en el ensayo clínico; b) efectuar el análisis según la respuesta ACR50 observada en los ensayos clínicos, y c) considerar la perspectiva del Sistema Nacional de Salud (SNS), excluyendo, por tanto, los costes indirectos. Finalmente, se hizo un análisis de sensibilidad umbral para establecer el coste de adquisición hipotético que debería tener INF para que se igualaran los costes de tratamiento de las combinaciones comparadas.
Resultados
Eficacia y toxicidad
En la tabla 1 se resumen los resultados de eficacia y toxicidad obtenidos en los ensayos clínicos, así como las principales características iniciales de los pacientes tratados con LEF+MTX o con INF+MTX.
La puntuación inicial de discapacidad obtenida con el cuestionario HAQ (Health Assessment Questionnaire) estuvo comprendida, con ambos tratamientos, dentro de los límites del mismo nivel de salud15,38. No hubo diferencias importantes en los años de duración de la AR, la dosis previa de MTX o el porcentaje de pacientes con factor reumatoide positivo (tabla 1).
La tasa de respuestas ACR20 y ACR50, a los 6 meses, fue del 46,2 y el 25,4%, respectivamente, con leflunomida-metotrexato, y del 50,0 y el 27,0%, respectivamente, con infliximab-metotrexato (2p = 0,57 y 2p = 0,82, respectivamente). Hubo menos infecciones y cefaleas con leflunomida-metotrexato y menos diarreas con infliximab-metotrexato.
Análisis farmacoeconómico
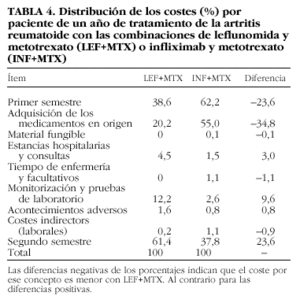
Caso básico. El coste por paciente de un tratamiento anual con LEF+MTX o con INF+MTX se estima en 2.823 y 11.489 €, respectivamente. En consecuencia, el coste incremental del tratamiento con INF+MTX sería de 8.666 € (tabla 3). En la tabla 4 se expone la distribución de los costes por paciente de un año de tratamiento. En el primer semestre, los costes por adquisición de los medicamentos en origen serían un 35% mayores en el caso de la combinación de INF+MTX, debido al elevado coste de adquisición de INF. En el segundo semestre, paradójicamente, los costes de INF+MTX serían menores debido a que los fracasos con esta combinación pasarían a ser tratados con medicamentos más baratos.
Análisis de sensibilidad. Todos los escenarios considerados en el análisis de sensibilidad confirmaron la consistencia del caso básico, con costes incrementales de la combinación de INF que oscilaron entre 7.500 y 9.500 € (tabla 3). Por tanto, el caso básico se puede considerar consistente en relación con dichas variables.
Respecto al análisis de sensibilidad umbral, para que los costes por paciente de las alternativas se igualaran, el coste de adquisición de infliximab por envase debería bajar desde los 637,59 € actuales hasta un coste hipotético de 33,10 € (tabla 3).
Discusión
De acuerdo con los resultados del estudio, LEF+MTX e INF+MTX tienen una eficacia y tolerancia similares al cabo de 6 meses de tratamiento de la AR activa. En el caso básico, el coste incremental anual de la combinación con INF+MTX sería de 8.666 € en comparación con LEF+MTX.
Se han realizado otros estudios modelizados de farmacoeconomía en pacientes con AR resistente a MTX. Choi et al15 hicieron un análisis coste-efectividad con un horizonte temporal de 6 meses en el que se compararon MTX, ciclosporina y etanercept (ETN) en monoterapia, un tratamiento triple con hidroxicloroquina, sulfasalazina y MTX y la combinación de ciclosporina o ETN con MTX. El tratamiento más eficaz fue la combinación de ETN+MTX, pero con un coste por ACR20 de 42.600 dólares (unos 43.500 €) en el período indicado. En un análisis de coste-efectividad realizado en España39, se compararon ETN+MTX o INF+MTX con placebo+MTX, obteniéndose un cociente para los dos primeros tratamientos de 8.536 y 18.607 € por éxito terapéutico, respectivamente, en un período de 4 meses. Estos resultados no son comparables con los del presente estudio por los siguientes motivos: el primer modelo utilizó costes de los Estados Unidos, que no son válidos en el sistema sanitario español; ambos estudios asumieron diferencias de eficacia entre los tratamientos, por lo que fueron análisis de coste-efectividad y no análisis de minimización de costes; el período de comparación en el estudio español abarcó sólo 4 meses, mientras que en éste se hizo una proyección anual. No obstante, de acuerdo con los resultados obtenidos en el modelo de Choi et al15, sería de interés comparar en futuros estudios la eficiencia de las combinaciones de LEF+MTX y ETN+MTX.
En la valoración de los resultados del presente estudio debemos tener en cuenta una serie de limitaciones del mismo. En primer lugar, se trata de un modelo teórico (que es, por definición, una simulación simplificada de la realidad) basado en los resultados de ensayos clínicos no pragmáticos que no compararon directamente los tratamientos, por lo que sus resultados deben considerarse como estimaciones para un paciente tipo, que pueden ser útiles como una herramienta para la toma de decisiones clínicas. A pesar de esta limitación, un dato que apoyaría la validez de la comparación de los pacientes es el hecho de que las respuestas ACR20 en el grupo placebo fueran prácticamente iguales en ambos ensayos clínicos (19,5% con LEF+MTX y 20% con INF+MTX).
Por otra parte, la estimación de la utilización de recursos no se hizo a partir de un ensayo clínico de farmacoeconomía40, sino fundamentalmente mediante las recomendaciones de las fichas técnicas de los medicamentos y la revisión sistemática de la bibliografía y de bases de datos españolas. Finalmente, se debe tener en cuenta que la corta duración de los ensayos clínicos sólo permitió una simulación de los resultados a corto plazo.
Para intentar minimizar las limitaciones del modelo, se tomaron supuestos conservadores y se hizo un análisis de sensibilidad considerando varios escenarios, produciéndose pequeñas variaciones de los costes que no modificaron el sentido de los resultados del caso básico.
Los resultados de este análisis farmacoeconómico deberían confirmarse en un ensayo clínico pragmático y aleatorizado, en el que se comparasen la eficacia, la tolerancia y la utilización de recursos sanitarios con ambas alternativas terapéuticas.
Agradecimientos
Los autores agradecen al Dr. Federico Navarro, del Servicio de Reumatología del Hospital Virgen Macarena de Sevilla, la revisión del manuscrito y sus importantes aportaciones al mismo.
Correspondencia: C. Rubio-Terrés. Aventis Pharma, SA. Martínez Villergas, 52. 28027 Madrid. España. Manuscrito recibido el 17-05-2002 y aceptado el 27-11-2002.