Introducción
Los mecanismos que contribuyen al inicio y perpetuación de la inflamación sinovial en la artritis reumatoide (AR) son múltiples, e incluyen la activación de células T, el desarrollo de autoanticuerpos por células B, la activación de macrófagos y creación de redes de citocinas proinflamatorias, la destrucción ósea (mediada por ligando del receptor activador del factor nuclear *ß [RANK]) y del cartílago (mediada por metaloproteasas [MMP])1. La comprensión de estos mecanismos patogénicos ha conducido a tratamientos novedosos, específicos y a veces muy eficaces, como los antagonistas del factor de necrosis tumoral alfa (TNF-*), aunque también ha revelado la complejidad que entraña el tratamiento curativo de la AR. Idealmente, tendríamos que combinar varias terapias para inhibir varios mecanismos patogénicos simultáneamente. Por ejemplo, terapias dirigidas a inhibir las células T (CTLA-4Ig), las células B (rituximab), las citocinas proinflamatorias (etanercept, infliximab, adalimumab, anakinra) o el desarrollo de erosiones óseas (osteoprotegerina)2.
Un enfoque distinto es contemplar la membrana sinovial de la AR como un tumor multicéntrico que invade y destruye localmente. De hecho, los fibroblastos sinoviales de la AR exhiben fenotipo de células tumorales, con mutaciones somáticas en genes reguladores clave como H-ras y p533. Este enfoque permite ensayar tratamientos dirigidos específicamente contra las células endoteliales en proliferación, generadoras de los nuevos vasos que nutrirán la hiperplasia sinovial reumatoide.
La angiogénesis es la formación de nuevos vasos a partir de vasos preexistentes, un mecanismo crucial en la patogenia de la AR. Puesto que la angiogénesis fisiológica del adulto se limita al ciclo menstrual, la reproducción y la cicatrización de las heridas, se espera que su inhibición no se acompañe de efectos secundarios graves.
La angiogénesis consta de varias etapas: activación de células endoteliales, secreción de proteasas que degradan la membrana basal, migración de las células endoteliales a través de la fibrina (formación y crecimiento de brotes capilares), formación del lumen y de una nueva membrana basal en los nuevos vasos, y unión de brotes capilares para formar lazos o bucles vasculares. Durante este proceso se expresan diversas moléculas importantes para la angiogénesis, como MMP-2 y MMP-9 e integrinas *vß.
Angiogénesis en la sinovitis reumatoide
La sinovitis de la AR se caracteriza por un crecimiento incontrolado de los vasos debido a un desequilibrio entre factores activadores e inhibidores de la angiogénesis. La diferencia entre sinovitis subclínica y sinovitis activa en un paciente con AR puede estar en el aumento de la expresión de ciertos inductores angiogénicos, uno de los cuales podría ser la interleucina (IL) 84, que además tiene efectos quimiotácticos.
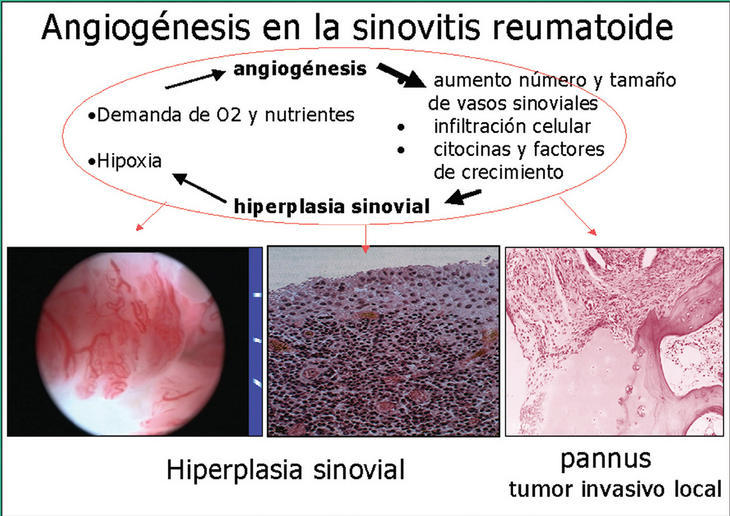
Se ha demostrado que, a pesar de la angiogénesis compensatoria, la sinovial inflamada de la AR es hipóxica5. La hipoxia también induce angiogénesis a través del factor inductor de hipoxia (HIF), que induce la expresión de factor de crecimiento vasculoendotelial (VEGF). Los nuevos vasos permiten la llegada de más leucocitos, que secretan citocinas y factores de crecimiento, estimulando con ello la hiperplasia sinovial y creando así la necesidad de más nutrientes y oxígeno, lo que induce más angiogénesis. Se crea así un círculo de retroalimentación entre angiogénesis e hiperplasia sinovial (fig. 1).
Figura 1. Esquema de la relación circular entre angiogénesis e hiperplasia sinovial (v. texto). De izquierda a derecha: imagen artroscópica de vellosidades sinoviales inflamadas; histología de sinovitis reumatoide, en la que destaca la hipertrofia de la capa de revestimiento, la abundancia de vasos y el infiltrado mononuclear, y detalle histológico del pannus sinovial de artritis reumatoide que invade el hueso.
Macroscópicamente, la sinovitis de la AR se caracteriza por la formación de vellosidades, que son prolongaciones digitiformes o en racimo, muy vascularizadas. Microscópicamente destaca la hiperplasia de la capa de revestimiento, la abundancia de vasos en el estroma sinovial y el gran infiltrado leucocitario. El pannus es una parte diferenciada de la membrana sinovial de la AR que exhibe capacidad invasiva sobre el hueso y cartílago locales.
El estudio de la angiogénesis en la sinovitis crónica, a través del artroscopio, ha permitido clasificar su morfología vascular y relacionarla con distintos tipos de artritis. Inicialmente se demostró que más del 80% de los pacientes con AR de inicio tenían vasos rectos y ramificados (patrón recto), mientras que alrededor del 80% de los pacientes con artritis psoriásica o artritis reactiva tenían vasos sinuosos, ingurgitados y en ovillo (patrón tortuoso)6. En un estudio posterior, hemos visto que el patrón recto es menos prevalente en la AR (49%) y que se asocia a AR seropositiva (patrón recto: 75% factor reumatoide positivo; patrón tortuoso: 25% factor reumatoide positivo)7. ¿Tienen significado patogenético o pronóstico los diferentes patrones vasculares? Después comentaremos algunos estudios que sugieren una respuesta afirmativa.
Moléculas implicadas en la angiogénesis de la AR
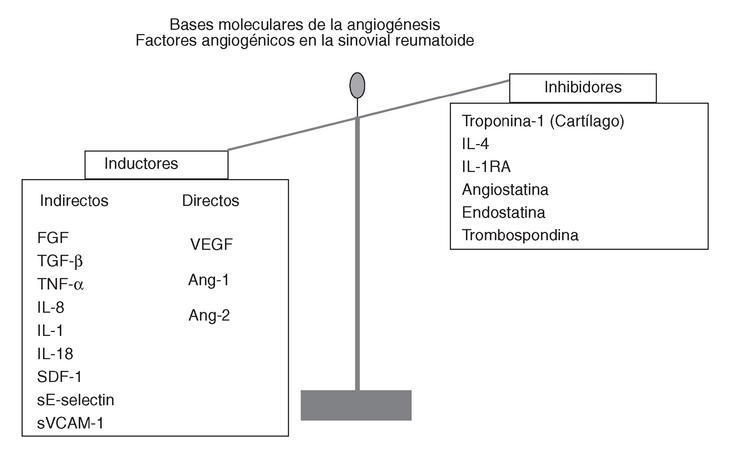
En la sinovitis reumatoide hay un aumento de la expresión de moléculas inductoras en relación a las inhibidoras de angiogénesis. Los inductores indirectos son los que no tienen una acción específica sobre la célula endotelial, sino que inducen la expresión del VEGF o de otros inductores. Entre los más importantes están: factor de crecimiento transformador ß (TGF-ß), factor de crecimiento de fibroblastos (FGF)-2, TNF-*, IL-8, IL-18, factor derivado del estroma (SDF)-1 y las moléculas de adhesión solubles (selectina E y VCAM-1).
Los inhibidores de angiogénesis endógenos son citocinas antiinflamatorias (IL-4, IL-1rA), fragmentos de proteínas de mayor tamaño, como el plasminógeno (angiostatina) o el colágeno (endostatina), o son proteínas de la matriz extracelular (trombospondina)8 (fig. 2).
Figura 2. Esquema de las moléculas que participan en la sinovitis reumatoide, clasificadas como inductoras e inhibidoras. Se representa el mayor peso de los factores inductores de angiogénesis.
Los inductores angiogénicos directos se unen a receptores específicos de la célula endotelial, modulando su proliferación. El VEGF es un factor de crecimiento endotelial selectivo que también induce permeabilidad vascular y que está elevado en el tejido sinovial, líquido sinovial y suero de pacientes con AR. Existen varias isoformas de VEGF, y la VEGF165 es la que tiene mayor actividad angiogénica. Muchos inductores angiogénicos, además del TNF-* y la IL-1, inducen la expresión de VEGF por fibroblastos y macrófagos sinoviales. El VEGF se une al receptor VEGFR2 de la célula endotelial e induce su proliferación. Esta vía de transducción también induce la expresión de la MMP-2 y de la integrina *vß3, que participan decisivamente en la degradación de la membrana basal y la migración endotelial a través de la matriz extracelular para formar nuevos vasos. El VEGF también se une a VEGFR1 e induce la activación de macrófagos y la movilización celular desde la médula ósea a la articulación. La activación de macrófagos a través de VEGFR1 induce la secreción de MMP-9 que libera el VEGF unido a la matriz extracelular, creando un círculo que amplifica dicha activación9.
Las angiopoietinas son proteínas que regulan el ensamblaje de componentes no endoteliales de la pared vascular, como el músculo liso vascular, a través de su interacción con el receptor tirosincinasa de la célula endotelial (Tie-2). La angiopoietina (Ang)-1 es un factor esencial para la maduración del vaso: los ratones deficientes en Ang-1 tienen vasos anormales por falta de músculo liso. Ang-2 contrarresta los efectos de Ang-1, por lo que aumenta la permeabilidad vascular y produce vasos inmaduros. Concentraciones elevadas de VEGF y Ang-2 inducen angiogénesis intensa, pero la reducción brusca del VEGF induce la regresión vascular por apoptosis endotelial10.
Estudios clínicos sobre angiogénesis
Los estudios sobre el significado clínico de la angiogénesis en la sinovitis reumatoide son escasos; la mayoría son transversales y describen la detección y cuantificación de diversas moléculas angiogénicas, su modulación en cultivo de fibroblastos y la comparación con otras sinovitis (artrosis [OA], espondiloartropatías [ESP]). Hay estudios que analizan la relación entre la expresión de factores angiogénicos y el patrón vascular sinovial o el significado pronóstico de factores angiogénicos. Esta escasez de proyección clínica refleja el incompleto conocimiento que se tiene actualmente de la biología de la angiogénesis y, por ello, la dificultad en identificar las moléculas angiogénicas más relevantes en la artritis. Así pues, a nivel clínico estamos todavía en una fase exploratoria. De todas formas, los factores angiogénicos más estudiados son los que actúan directamente sobre la célula endotelial.
Un estudio realizado en tejido sinovial de 17 pacientes con AR y 8 con OA demuestra que VEGF165 y su receptor VEGFR2 se expresan sólo en tejido sinovial de pacientes con AR erosiva, mientras que las isoformas VEGF121 y VEGFR1 se expresan constitutivamente, tanto en AR como en OA. Sugiere que la isoforma angiogénica y su receptor desempeñan un importante papel en la patogénesis de la AR y podrían ser marcadores de mal pronóstico11.
Los resultados de diferentes estudios permiten concluir que la expresión de Ang-1, Ang-2 y su receptor Tie-2 en tejido sinovial de pacientes con AR es superior a la de pacientes con OA y controles sanos. La expresión de Ang-1 en fibroblastos sinoviales de AR aumenta con TNF-* y TGF-ß, pero no con IL-1 ni con la hipoxia. Ang-2 aumenta notablemente su expresión en sinovitis crónica y en fibroblastos de sinovial normal tratados con TNF-* o TGF-ß, pero no en fibroblastos de AR. En conjunto, estos estudios sugieren que los fibroblastos sinoviales expresan constitutivamente Ang-1 y Ang-2 y que la regulación de la Ang-2 es compleja, y depende de la estirpe celular o del estado de activación de la célula estimulada12-14.
Otro estudio demostró que los valores de VEGF sérico a la inclusión en 44 pacientes con AR de inicio se correlacionaban con el desarrollo de erosiones óseas al año de seguimiento, sugiriendo que las concentraciones elevadas de VEGF sérico al inicio de la enfermedad podrían ser un marcador de mal pronóstico y también que su inhibición puede ser una opción terapéutica en la AR15.
Dos estudios del mismo grupo de investigadores han analizado la expresión de inductores angiogénicos en tejido sinovial y líquido sinovial de AR y artritis psoriásica de inicio con el objetivo de detectar diferencias patogénicas entre ambas enfermedades. Los hallazgos fueron que la expresión de Ang-2, MMP-9, VEGF y TGF-ß es inferior en tejido sinovial y/o líquido sinovial de AR que en artritis psoriásica. Ang-1 se expresa poco en ambas enfermedades y el grado de apoptosis endotelial es superior en la AR que en la artritis psoriásica. Se halló una estrecha correlación entre la expresión de inductores angiogénicos, el grado de apoptosis endotelial y la morfología vascular (p. ej., niveles superiores de inductores angiogénicos y un bajo grado de apoptosis se asocian al patrón tortuoso de la artritis psoriásica). Los resultados sugieren que los diferentes patrones vasculares sinoviales son reflejo de la expresión diferencial de inductores angiogénicos y también que la elevada expresión de Ang-2 y VEGF en estadios iniciales de la artritis psoriásica es una característica patogénicamente relevante de esta enfermedad. Proponen la angiogénesis como diana terapéutica en las artritis psoriásicas.
Nuestro grupo está realizando varios estudios sobre angiogénesis, de los que exponemos algunos resultados preliminares. Hemos confirmado que la expresión de VEGF en tejido sinovial es superior en pacientes con artritis psoriásica (n = 18) que en AR (n = 27), así como que una expresión elevada de VEGF se asocia al patrón vascular tortuoso. Sin embargo, no encontramos diferencias en la expresión de VEGFR1 ni VEGFR2 entre ambas enfermedades, algo que también observamos en un estudio con RT-PCR y que exponemos más adelante.
En un estudio sobre el valor pronóstico de la expresión de inductores angiogénicos en tejido sinovial (VEGF, VEGFR1, VGFR2, TGF-ß, IL-8) y suero (VEGF, TGF-ß e IL-8) de pacientes con AR (n = 27, con seguimiento radiográfico al año en n = 17), encontramos que la concentración de TGF-ß sérico a la inclusión se correlaciona con el número de erosiones y el índice de Larsen al año de seguimiento, y que la expresión de VEGF tisular tiende a correlacionarse con el número de erosiones al año. Existe también una buena correlación entre VEGF, TGF-ß e IL-8 séricos. Por otra parte, existe una buena correlación entre IL-8 y reactantes de fase aguda (proteína C reactiva y velocidad de sedimentación globular). Los resultados son consistentes con la potente acción angiogénica del TGF-ß, que induce VEGF y con cuya concentración sérica tiene una buena correlación. A destacar, la asociación entre VEGF tisular y erosiones al año (p = 0,08), que confirma indirectamente el trabajo de Ballara et al15.
Hemos analizado también, como parte de un proyecto más extenso sobre el valor pronóstico de la angiogénesis, la expresión por RT-PCR cuantitativa del patrón angiogénico (inductores directos) en tejido sinovial y líquido sinovial de pacientes con artritis de inicio. El análisis provisional (falta incluir a más pacientes, analizar las isoformas del VEGF, realizar inmunohistoquímica y correlacionar con el desenlace erosivo por resonancia magnética al año) indica que no existen diferencias significativas en la expresión de Ang-1, Ang-2, VEGF y sus receptores (VEGFR1 y VEGFR2) entre AR (n = 15) y ESP (n = 16). En las células del líquido sinovial sólo detectamos expresión de VEGF y VEGFR1, lo que refleja activación leucocitaria y ausencia de tejido endotelial o periendotelial. En tejido sinovial debe destacarse la relativa abundancia de Ang-2 respecto a Ang-1 que, junto con la elevada expresión de VEGF, expresaría angiogénesis activa. También llama la atención la expresión similar de VEGF1 y VEGFR2 en pacientes con AR, artritis psoriásica y controles, algo que contrasta con los resultados de un estudio previo que detecta VEGFR2 sólo en tejido sinovial de las AR erosivas11. Sin embargo, la relación Ang-2/Ang-1 y la expresión de VEGF son significativamente inferiores en controles. La interpretación provisional de estos resultados es que la expresión de receptores es constitutiva, y que una de las diferencias entre una membrana sinovial inflamada y otra normal sería la relativa abundancia de Ang-2 y VEGF o de las diferentes expresiones de la isoforma angiogénica del VEGF (VEGF165).
La angiogénesis como diana terapéutica
El tratamiento de la angiogénesis tiene a la célula endotelial como diana específica, y las consecuencias esperadas de su acción serían la reducción del aporte de nutrientes a la sinovial hiperplásica, la reducción de la adhesión y migración leucocitaria, y la disminución de la producción de citocinas y quimiocinas producidas por las células endoteliales activadas. El tratamiento antiangiogénico también debería, idealmente, normalizar la morfología vascular por reducir el efecto desestabilizador y permeabilizante de Ang-2 y VEGF.
La evidencia de los efectos terapéuticos de la inhibición de la angiogénesis en la artritis humana es hasta ahora indirecta. La mayoría de los fármacos antirreumáticos de acción lenta tienen efectos antiangiogénicos: el metotrexato, la salazopirina, la D-penicilamina, el aurotiomalato sódico o la ciclosporina disminuyen la expresión de VEGF en estudios in vitro, en modelos animales o en pacientes8.
El tratamiento de la AR con antagonistas del TNF-* ha demostrado que uno de sus mecanismos de acción es la inhibición de la angiogénesis. Infliximab reduce las concentraciones de VEGF sérico y la neovascularización en tejido sinovial de pacientes con AR18, y en tejido sinovial de pacientes con ESP19. Recientemente hemos demostrado que la angiogénesis es una diana terapéutica potencial en artritis psoriásica. Estudiamos a pacientes que mejoraron clínica y biológicamente con infliximab. Realizamos artroscopia con biopsia sinovial antes del tratamiento (5 mg/kg en las semanas 0, 2 y 6) y a la semana 8. Demostramos que la mejoría clínico-biológica se correlaciona con una disminución del área vascular sinovial (CD31+), de los vasos proliferantes (*vß3+), de la expresión de diversos factores angiogénicos (VEGF y SDF-1) y de los receptores del VEGF (sobre todo VEGFR2). Sorprendentemente, la Ang-2 aumentó su expresión después del tratamiento. A pesar de la mejoría clínico-biológica y de la reducción de la angiogénesis, no se modificó la morfología tortuosa de los vasos sinoviales. Los resultados son consistentes con efectos antiangiogénicos derivados de la inhibición del TNF-*, y sugieren que un posible mecanismo de acción antiangiogénico puede ser la reducción de VEGF respecto a Ang-2, induciendo la regresión vascular20.
Aunque muchos de los mecanismos implicados en la angiogénesis mediada por VEGF y angiopoietinas en la AR no han sido dilucidados todavía, la neovascularización sinovial ha sido considerada desde hace tiempo como una diana terapéutica potencial en artritis.
La eficacia de terapias biológicas dirigidas específicamente a inhibir la proliferación endotelial por el bloqueo del VEGF, de su receptor o de la integrina *vß3, se ha demostrado en múltiples estudios en modelos de artritis inducida por colágeno. Los ratones con alteración del gen VEGF (knock-out) tienen artritis más leves que los ratones controles cuando se les induce una artritis por colágeno; ratones con artritis inducida por colágeno o conejos con artritis inducida por ovoalbúmina experimentan un reducción de la artritis y, sobre todo, de la destrucción articular tras el tratamiento con anticuerpos antiintegrina *vß3 (Vitaxin®), con anti-VEGFR1 o con VEGFR1 soluble8. Ratones que no expresan el VEGFR1 no desarrollan artritis. Recientemente se ha publicado un estudio sobre la farmacocinética del Vitaxin® y esta terapia ha iniciado la fase de ensayos clínicos en AR21,22.
Estas observaciones demuestran que el tratamiento de la angiogénesis conduce a la reducción o supresión de la artritis y de la destrucción articular en modelos animales, y sugieren que el bloqueo del VEGF, o de otras moléculas cruciales para la angiogénesis, puede ser beneficioso en la AR.
La endostatina, la angiostatina y la trombospondina bloquean la proliferación endotelial y la neovascularización, y su eficacia ha sido demostrada en estudios in vitro o con modelos animales de artritis. La endostatina ha entrado en ensayos clínicos de fase II para el tratamiento del cáncer. Éstas podrían ser futuras terapias para la AR. Sin embargo, sólo una comprensión más completa de la biología de la angiogénesis y de los mecanismos de acción de estas moléculas, que requiere la estrecha colaboración de investigadores en angiogénesis y clínicos, podrá garantizar su aplicación racional al tratamiento de la AR.
Otras terapias antiangiogénicas aprobadas para el tratamiento del mieloma múltiple, y en estudio en diversas enfermedades inflamatorias crónicas, son los inhibidores reversibles del proteasoma. El proteasoma es una proteasa, compuesta de múltiples subunidades, que produce la degradación rápida de proteínas, muchas de ellas implicadas en funciones reguladoras de la célula. Nuestro grupo ha demostrado en cultivos de macrófagos humanos y de células del líquido sinovial de AR que el inhibidor reversible del proteasoma MC262 (dipéptido boronato) tiene efectos antiangiogénicos mediados a través de la inhibición selectiva del VEGF y su receptor VEGFR1, pero no de la forma soluble del VEGFR1, que tiene propiedades antiangiogénicas23.
Conclusiones
La formación de nuevos vasos es un proceso clave en la génesis y persistencia de la hiperplasia y el pannus sinovial de la AR. Aunque en la sinovitis reumatoide se expresa una multitud de inductores, los estudios sugieren que la expresión de VEGF es crítica para el desarrollo de la angiogénesis. La Ang-2 tendría, en función de las concentraciones de VEGF, un papel importante en el desarrollo de la angiogénesis o de la regresión vascular.
Sin embargo, todavía no se comprenden adecuadamente las vías de acción y la regulación de estos y otros factores implicados en la angiogénesis de la sinovitis reumatoide. Tampoco se ha estudiado sistemáticamente su posible relevancia clínica, pero algunos estudios sugieren que el VEGF y TGF-ß pueden ser marcadores pronósticos de destrucción articular. Por otro lado, se sugiere que la expresión de inductores angiogénicos se correlaciona con el tipo de patrón vascular sinovial tortuoso o recto.
Los fármacos empleados actualmente en la AR tienen efectos antiangiogénicos que pueden explicar parte de su eficacia. Las terapias antiangiogénicas específicas han resultado eficaces en modelos animales de AR, y algunas de ellas están en fase de ensayos clínicos en pacientes con AR.
Todo ello compone un escenario suficientemente atractivo como para esperar un esfuerzo conjunto de investigadores clínicos y básicos del que surjan nuevas terapias eficaces y con menos toxicidad para el tratamiento de la AR24.