Introducción
La artritis reumatoide (AR) es una enfermedad sistémica, inflamatoria y crónica, que se localiza de forma preferente en las articulaciones. Se caracteriza por la activación de diferentes poblaciones celulares sinoviales y la producción de mediadores proinflamatorios como citocinas, prostaglandinas y proteasas. En general, se considera que es una enfermedad autoinmune, aunque no se han identificado el o los antígenos desencadenantes. La alteración de los mecanismos de tolerancia inmunológica desencadena una respuesta inmune persistente y exagerada que se manifiesta por la formación de clones de células T autorreactivas y la producción espontánea de autoanticuerpos dirigidos contra estructuras celulares propias o autoantígenos.
Los sueros de los pacientes diagnosticados de AR presentan muchos autoanticuerpos, pero sólo unos pocos tienen valor patogénico, diagnóstico o pronóstico. Entre ellos (tabla 1), el único que se utiliza en la práctica diaria es el factor reumatoide (FR) de clase IgM (FR-IgM).
Factor reumatoide
Los FR son autoanticuerpos dirigidos contra epítopes localizados en el fragmento Fc de la IgG, en la unión de los dominios CH2 y CH3 de la cadena pesada gamma. Suelen ser anticuerpos de clase IgM, aunque existen isotipos IgG, IgA e IgE. Se detectan habitualmente mediante pruebas de aglutinación con látex o nefelometría. Bampton et al1 compararon las pruebas de Waaler-Rose y látex, la técnica de ELISA y la nefelometría, encontrando una buena correlación entre dichos métodos. La técnica de ELISA es más sensible que la nefelometría, pero aún no está bien estandarizada y se utiliza más en investigación que en los laboratorios clínicos.
La detección de FR continúa siendo la principal prueba de laboratorio en el diagnóstico de la AR. El isotipo IgM se detecta hasta en un 90% de los pacientes2,3 y constituye uno de los criterios de clasificación de la enfermedad propuestos por el American College of Rheumatology. La detección de concentraciones elevadas de FR sérico en pacientes con clínica compatible es muy indicativa de AR, pero su ausencia no excluye el diagnóstico y, de hecho, un subgrupo de pacientes presenta AR persistentemente seronegativa. El FR puede aparecer antes del inicio de la enfermedad, pero generalmente no se detecta hasta uno o dos años después de éste. Durante los dos primeros años de evolución la incidencia de FR es baja, de sólo un 30 a un 60% de los casos, y no es raro que desaparezca al remitir la enfermedad. Van Zeben et al4 utilizaron técnicas de ELISA para detectar FR-IgM en 135 mujeres con AR de menos de 5 años de evolución al inicio del estudio. Después de un seguimiento medio de 6 años encontraron persistencia del FR en el 62% de las pacientes, resultados variables en el 11% y FR persistentemente negativo en el 27%.
Valor diagnóstico del factor reumatoide
El FR-IgM no es específico de la AR, aparece en individuos aparentemente sanos y en el curso de enfermedades inflamatorias agudas y crónicas. La frecuencia depende de la técnica de detección y de las características de la población estudiada3, por lo que su utilidad real en el diagnóstico de AR depende de la sensibilidad, la especificidad y los valores predictivos. En los pacientes hospitalizados o en las consultas de reumatología, con un porcentaje importante de pacientes con AR grave, se detecta FR-IgM hasta en un 90% de los pacientes5. Sin embargo, en estudios realizados en unidades de asistencia primaria, la sensibilidad es menor y sólo entre un 21 y un 36% de los pacientes que cumplen criterios de AR presentan FR-IgM2,6,7. Las diferencias se deben al gran número de casos benignos. En series en las que se incluyen AR inactivas o un número elevado de pacientes con AR temprana, o en las que se preseleccionan casos con FR positivo y negativo o todos los pacientes con poliartritis periférica en la población general, la sensibilidad del FR es menor.
En la mayoría de los estudios la especificidad del FR-IgM en el diagnóstico de la AR oscila entre un 85 y un 98%2,6. La especificidad es mayor cuando se consideran pacientes con FR-IgM detectado por varios métodos, dos o más veces consecutivas y concentraciones elevadas. Sin embargo, la especificidad está ligada también a la presencia o ausencia de otros procesos con FR positivo en las series estudiadas. Así, el FR-IgM es poco específico en una consulta con una gran proporción de pacientes con lupus eritematoso sistémico (LES) u otras enfermedades reumáticas sistémicas, como ocurre en los hospitales generales. Shmerling y Delbanco2 analizaron 563 determinaciones de FR-IgM realizadas en el Beth Israel Hospital de Boston entre los meses de enero y junio de 1990. La sensibilidad y la especificidad para la AR fueron del 28 y el 87%, respectivamente. La especificidad del FR-IgM es mucho menor en la población general. En el estudio con la prueba de látex llevado a cabo entre 1959 y 1960 en Tecumseh (Michigan) se evaluó al 88% de los 9.794 habitantes y un 3% presentó FR-IgM. La sensibilidad y la especificidad para el diagnóstico de AR fueron del 19 y el 98%, respectivamente, pero el 74% de los pacientes no presentaba evidencias de la enfermedad cuando fueron evaluados con los mismos criterios 4 años más tarde8. En definitiva, la sensibilidad y la especificidad del FR-IgM para el diagnóstico de la AR en los estudios transversales de la población general son poco fiables con los criterios de clasificación actuales.
La utilidad diagnóstica se valora mejor calculando el valor predictivo, que depende de la prevalencia de AR en la población estudiada. En la mayoría de los estudios el valor predictivo positivo es alto, entre un 57 y un 98%5,9, pero el porcentaje de pacientes con AR en dichas series oscila entre un 36 y un 60%. En series en las que la prevalencia de AR es menor, entre un 10 y un 24%, el valor predictivo positivo también es menor y oscila entre un 30 y un 50%2,7,9-11. Cuando consideramos la prevalencia de AR en la población general, un 0,5% en nuestro país12, el valor predictivo positivo del FR-IgM es mucho menor (tabla 2). El bajo valor predictivo positivo del FR-IgM en el diagnóstico de AR hace que su detección sea poco útil en la población general, no sirve como técnica de cribado de la enfermedad2. Con frecuencia se solicita su determinación sin necesidad, por ejemplo, en pacientes con artralgias, y ello contribuye a la aparición frecuente de falsos positivos. Si bien la detección de una concentración elevada de FR-IgM es muy indicativa, el diagnóstico de la AR sigue siendo fundamentalmente clínico. Dado que el valor predictivo positivo aumenta en función de la prevalencia de la AR, la detección de FR-IgM es más útil en las consultas especializadas, con un porcentaje alto de pacientes con dicha enfermedad.
El 70% de los pacientes diagnosticados de AR en los que se detecta FR-IgM tienen dos o más isotipos. El aumento simultáneo de los isotipos IgM e IgA aparece en el 52% de los pacientes con AR y sólo en un 4% de los pacientes con FR por otras enfermedades. El aumento de FR de clase IgA combinado con el IgM parece ser más útil que otras pruebas, pero la detección de los isotipos IgG o IgA no supera a la detección del isotipo IgM en el diagnóstico de AR5,10 (tabla 3).
Valor pronóstico del factor reumatoide
Los pacientes con AR y concentraciones elevadas de FR-IgM tienen mayor riesgo de desarrollar una enfermedad articular erosiva grave, con más articulaciones inflamadas, erosiones y manifestaciones extraarticulares, en particular nódulos subcutáneos y vasculitis13. Los títulos de FR-IgM son superiores en los pacientes con vasculitis reumatoide y el mayor riesgo de erosiones radiológicas no se relaciona con la especificidad del FR, sino con su cantidad.
Jonsson et al14 encuentran que los isotipos IgA e IgG detectados por ELISA se asocian mejor con los parámetros clínicos de AR que el FR-IgM. Van Zaben et al4, en un estudio que incluía a 135 mujeres con AR y una evolución media de 6 años, observaron que los pacientes con FR positivo desde el inicio de su enfermedad presentan más lesiones radiológicas, mayores índices de actividad clínica, más manifestaciones extraarticulares y un peor estadio funcional. El aumento del isotipo IgA en los tres primeros años de evolución se asocia a un peor pronóstico. La progresión de las erosiones se relaciona con el tiempo de evolución, pero es significativamente mayor en los pacientes persistentemente seropositivos desde el inicio de su enfermedad. Otros estudios demuestran que los pacientes con FR de clase IgA presentan más manifestaciones extraarticulares y más erosiones articulares15,16. Mottonen et al17 encuentran que el principal factor de mal pronóstico en la AR es el FR positivo en el primer año de evolución, pero este hallazgo no permite establecer la evolución en un paciente determinado.
En general, la AR seropositiva clásica tiene peor pronóstico por la mayor frecuencia de manifestaciones extraarticulares y erosiones óseas, junto a una menor capacidad funcional y una mayor necesidad de tratamientos de fondo. Además, la mortalidad es mayor cuando el FR es positivo18, tal vez en relación con la menor capacidad funcional de los pacientes. La mayoría de los estudios coinciden en afirmar que las fluctuaciones en la concentración de FR-IgM no reflejan el grado de actividad clínica y no son útiles para seguir la evolución de la enfermedad8. Los fármacos inductores de remisión, como las sales de oro, la d-penicilamina o el metotrexato, pueden reducir las concentraciones séricas de FR. No obstante, la disminución no siempre se correlaciona con una mejoría o una remisión clínica de la AR y la detección del FR-IgM u otros isotipos no es útil en la monitorización de la respuesta al tratamiento.
El factor reumatoide en la patogenia de la artritis reumatoide
La AR es una enfermedad por inmunocomplejos extravasculares que afecta preferentemente al tejido sinovial. Los FR se sintetizan localmente en la membrana sinovial reumatoide, forman inmunocomplejos y se localizan en la matriz del cartílago. Es posible que sean importantes en la patogenia de la AR, pero los mecanismos son poco conocidos y aún no se ha demostrado definitivamente su participación directa en el desarrollo de las lesiones articulares. No obstante, los FR cumplen los criterios de patogenicidad de los autoanticuerpos. La detección de concentraciones elevadas de FR se asocia con una enfermedad articular grave y con manifestaciones extraarticulares, y son abundantes en el líquido sinovial. Suelen formarse en los sitios de inflamación, fundamentalmente en la membrana sinovial, los nódulos subcutáneos y los órganos linfoides, y pueden participar en la patogenia de algunos modelos murinos de enfermedad autoinmune.
Anticuerpos antinucleares
Las técnicas de inmunofluorescencia indirecta (IFI) detectan anticuerpos antinucleares (ANA) hasta en un 70% de los pacientes con AR y son más frecuentes en el síndrome de Felty. El patrón sobre monocapas de células Hep-2 suele ser homogéneo, a veces moteado. Los títulos suelen ser bajos y variables a lo largo del tiempo. La presencia de ANA se ha relacionado con enfermedad erosiva grave, aunque otros estudios no han demostrado un peor pronóstico. Además, los ANA pueden ser inducidos por diferentes fármacos, incluyendo las terapias anti-TNF (factor de necrosis tumoral) recientemente introducidas.
Se han identificado múltiples especificidades, pero la mayoría de ellas carecen de significado en la AR. En todo caso, la detección de ANA en los pacientes con AR obliga a descartar la existencia de un síndrome de Sjögren o un LES, dada la posibilidad de un síndrome de solapamiento y la dificultad de establecer uno u otro diagnóstico en algunos pacientes con enfermedad de inicio reciente.
Anticuerpos antinucleares dirigidos contra proteínas asociadas al ADN
Las reacciones cruzadas entre FR policlonales y núcleos celulares se deben a la existencia de actividad antihistona. Una pequeña proporción de los FR se une simultáneamente a la porción Fc de la IgG y a las histonas, proteínas básicas ricas en arginina y lisina que forman parte de los nucleosomas. Los anticuerpos antihistonas se detectan en la AR en un porcentaje que varía, según la técnica de detección y la selección de los pacientes, de un 5 a un 30%. En los pacientes con ANA el porcentaje suele ser mayor, entre un 24 y un 67%. La concentración de anticuerpos antihistonas suele ser baja, excepto en los pacientes con síndrome de Felty. Con frecuencia son anticuerpos de clase IgM y pueden reaccionar con el cuerpo histona, la fracción H1 u otras fracciones aisladas. Se ha comunicado un predominio de anticuerpos anti-H1 o anti-H2A-H2B en la AR y de anticuerpos anti-H2A/ anti-H3-H4 en el síndrome de Felty. Los anticuerpos antihistonas se han asociado con manifestaciones articulares y extraarticulares graves, en particular vasculitis, nódulos subcutáneos y toxicidad por d-penicilamina, aunque no se ha confirmado en todos los estudios18.
El fenómeno LE se debe a la presencia de anticuerpos dirigidos contra complejos ADN-histona y se detecta hasta en un 46% de los pacientes con AR. Se relaciona con una mayor frecuencia de nódulos subcutáneos, síndrome de Sjögren, adenopatías, esplenomegalia, anemia, leucopenia y toxicidad por sales de oro. En algunos casos se trata realmente de formas iniciales de LES, pero en general son AR de más de 10 años de evolución con manifestaciones articulares graves.
Algunos pacientes diagnosticados de AR presentan anticuerpos dirigidos contra el ADN de doble cadena, tanto con la técnica de Farr como con la IFI sobre Crithidia lucilliae o la fijación de complemento, aunque la frecuencia es siempre inferior a un 5%. Es posible que se trate realmente de anticuerpos anti-ADN nativo, por lo que debe plantearse la posibilidad de un síndrome de solapamiento AR-LES, pero en la mayoría de los casos son falsos positivos. La concentración es baja y suelen ser anticuerpos de baja avidez o a reacciones cruzadas con ADN monocatenario. Su implicación clínica es nula. Los anticuerpos anti-ADN de una sola cadena aparecen con una frecuencia variable en la AR, los presentan entre un 1 y un 50% de los pacientes según la técnica utilizada en su detección. Aparecen en la mayoría de los pacientes con síndrome de Felty. En general, son anticuerpos de escasa avidez, los títulos son bajos y carecen de interés clínico.
Se han identificado anticuerpos dirigidos contra proteínas nucleosómicas no histonas de gran movilidad (anti-HMG 17) y anticuerpos anticentrómero, con una frecuencia inferior a un 5%. Estos últimos pueden corresponder a síndromes de solapamiento AR-esclerodermia, pero algunos pacientes no presentan rasgos de esclerodermia. No suelen detectarse anticuerpos anti-Scl 70 (antitopoisomerasa I) o anticuerpos anti-Ku y, cuando aparecen, debe descartarse un síndrome de solapamiento de AR con esclerodermia o LES, respectivamente.
Anticuerpos antinucleares dirigidos contra proteínas asociadas al ARN
Los anticuerpos dirigidos contra las proteínas A1 y A2 asociadas al ARN nuclear heterogéneo en los complejos hnRNP de los gránulos de pericromatina son frecuentes en la AR. Los anticuerpos anti-A1-hnRNP se detectan por immunoblotting (IB) en el 47% de los pacientes (20) y los anticuerpos anti-A2-hnRNP (anti-RA 33) de clase IgG en el 35%21. Cuando se consideran también los anticuerpos de clase IgM, aparecen hasta en un 70% de los casos, pero en otros estudios sólo se identifican en un 6% de los pacientes con AR22. Los anticuerpos anti-RA 33 pueden detectarse desde el inicio de la enfermedad, incluso antes, pero no se relacionan con el tiempo de evolución, con la actividad inflamatoria ni con las remisiones terapéuticas21. No son específicos de la AR, ya que se detectan también en sueros de pacientes con enfermedad mixta del tejido conjuntivo (EMTC), LES y otras conectivopatías.
Los anticuerpos dirigidos contra proteínas asociadas a ARN nuclear o citoplasmático de pequeño tamaño, en su mayoría incluidos en el grupo de anticuerpos anti-ENA (extractable nuclear antigens), se detectan en un número variable de pacientes diagnosticados de AR. La frecuencia oscila entre un 4 y un 18% con técnicas de inmunodifusión (ID), contrainmunoelectroforesis (CIE) o IB, y entre un 30 y un 60% con técnicas de ELISA o precipitación inmune. Se han relacionado con el desarrollo de manifestaciones extraarticulares, en particular vasculitis, así como con una mayor mortalidad. Otros estudios no confirman estas observaciones23.
Los anticuerpos anti-U1-RNP son poco frecuentes. En la mayoría de los estudios no se detectan o aparecen en menos de un 10% de los pacientes, independientemente de la técnica utilizada. Suelen reaccionar con los polipéptidos 70 kD y BB'. Puede que se trate de falsos positivos, pero pueden aparecer en pacientes con síndromes de solapamiento con AR. Finalmente, algunos pacientes con LES o EMTC presentan manifestaciones articulares similares a las observadas en los primeros meses de evolución de la AR, por lo que la detección de estos anticuerpos obliga a descartar dichos diagnósticos. Habitualmente no se encuentran anticuerpos anti-Sm, aunque Barakat et al24 demuestran anticuerpos dirigidos contra un fragmento del polipéptido D en un 5,7% de los pacientes con AR. Estos hallazgos se deben probablemente a la sensibilidad excesiva de la técnica de ELISA y a la existencia de reacciones cruzadas con otras proteínas, por lo que son falsos positivos. En todo caso, la aparición de anticuerpos anti-Sm en un paciente diagnosticado de AR apunta al diagnóstico de LES o de un síndrome de solapamiento AR-LES.
Los anticuerpos anti-Ro/SS-A son los anticuerpos anti-ENA más frecuentes en la AR y esta enfermedad supone entre un 2 y un 12% de los diagnósticos en series de sueros anti-Ro/SS-A24. La frecuencia de anticuerpos anti-Ro/SS-A en la AR oscila entre un 3 y un 40% cuando se utilizan técnicas de ID, CIE o IB, pero con técnicas más sensibles el número de sueros anti-Ro/SS-A es mayor. Además, estos anticuerpos pueden reaccionar con las proteínas Ro/SS-A de 60 kD y de 52 kD25,26. Las técnicas de ELISA y la precipitación inmune demuestran anticuerpos anti-Ro/SS-A hasta en un 36 y un 50% de los pacientes, respectivamente25. Las diferencias observadas en los diferentes estudios se deben a los criterios de selección de los pacientes, a la técnica utilizada y a variaciones geográficas y étnicas entre las poblaciones estudiadas. Los anticuerpos anti-Ro/SS-A son más frecuentes en Asia, especialmente en Japón, y los pacientes griegos con AR presentan una frecuencia significativamente mayor que los británicos. Los pacientes con AR y anticuerpos anti-Ro/SS-A presentan artritis grave y una mayor frecuencia de manifestaciones extraarticulares, en particular anemia, leucopenia, hipocomplementemia, síndrome de Sjögren, fotosensibilidad, vasculitis o manifestaciones pulmonares27. Algunos estudios demuestran un mayor riesgo de toxicidad por sales de oro o d-penicilamina en AR con anticuerpos anti-Ro/SS-A, otros no lo confirman.
Los anticuerpos anti-La/SS-B son menos frecuentes en la AR. Se detectan mediante ID o CIE hasta en un 8% de los pacientes y con otras técnicas la frecuencia es similar, si bien el método de ELISA los identifica hasta en un 22%. Suelen encontrarse en los pacientes con síndrome de Sjögren asociado a la AR. En pacientes tratados con d-penicilamina puede desarrollarse polimiositis inducida con anticuerpos antihistidil-t-RNA sintetasa (anti-Jo1).
Otros anticuerpos antinucleares en la artritis reumatoide
Se han descrito anticuerpos anti-ARN, anticuerpos dirigidos contra el huso del aparato mitótico (anti-NuMa) y anticuerpos antinucleolares, como los dirigidos contra las proteínas ARN-polimerasa I, NOR-90, fibrilarina/U3 RNP o 7-RNP. En caso de identificarse anticuerpos antinucleolares, deben descartarse los diagnósticos de LES y esclerodermia, pero pueden aparecer en pacientes cuyo único diagnóstico es la AR.
Los ANA específicos de granulocitos de clase IgG o IgM aparecen hasta en un 74% de los sueros y un 69% de los líquidos sinoviales de pacientes con AR. La frecuencia aumenta hasta casi el 100% de los pacientes con síndrome de Felty. Se asocian con AR activa, especialmente con vasculitis, neutropenia, FR, inmunocomplejos circulantes e hipocomplementemia. En realidad, muchos de los ANA específicos de granulocitos son anticuerpos anticitoplasma de neutrófilo (ANCA) y producen un patrón perinuclear similar al de los anticuerpos antimieloperoxidasa o antielastasa. Sin embargo, no existe una correlación exacta entre los ANA específicos de granulocitos y los ANCA28.
En la AR pueden detectarse anticuerpos anti-RANA (rheumatoid arthritis nuclear antigen) que reaccionan con antígenos de células infectadas por el virus de Epstein-Barr. El péptido sintético p62-EBNA contiene el epítope mayor del antígeno RANA y los anticuerpos anti-p62 de clase IgG tienen reacción cruzada con el colágeno, la actina y la queratina epidérmica humanas. Existen homologías entre el antígeno p62-EBNA y proteínas de los queratinocitos humanos. Los anticuerpos anti-RANA aparecen en un 90% de los pacientes con AR seropositiva y se detectan por ELISA con el péptido sintético p62 en un 60% de los pacientes29. Se desconoce su significado.
Anticuerpos anticitoplasmáticos
Los anticuerpos antirribosomales, antifilamentos intermedios, antivimentina, antineurofilamentos y antimúsculo liso detectados por IFI en la AR carecen de significado clínico. En algunos pacientes se detectan anticuerpos antimitocondriales, pero no se relacionan con la cirrosis biliar primaria. Los principales anticuerpos anticitoplasmáticos en la AR son los dirigidos contra la filagrina (factores antiperinucleares y anticuerpos antiqueratina) y los anticuerpos anti-Sa.
Anticuerpos antifilagrina
Los factores antiperinucleares reaccionan con gránulos queratohialinos citoplasmáticos en IFI sobre células epiteliales de la mucosa oral humana. El número de células positivas varía de un suero a otro y no todas las células tienen las mismas manchas fluorescentes. Las células portadoras del antígeno perinuclear se encuentran principalmente en el estrato intermedio y van desapareciendo a medida que nos acercamos a la superficie. El número de donantes sanos que tienen la cantidad suficiente de células positivas oscila entre un 10 y un 15%30,31. Los anticuerpos antiqueratina reaccionan con un grupo heterogéneo de proteínas fibrilares solubles de la epidermis denominadas queratinas. En IFI producen un patrón lineal laminar sobre el estrato córneo del esófago de rata. Los factores antiperinucleares y los anticuerpos antiqueratina suelen aparecer simultáneamente en los pacientes con AR y reaccionan en realidad con dos proteínas epidérmicas ricas en citrulina que intervienen en la agregación de filamentos, la profilagrina y la filagrina.
Los factores antiperinucleares se han relacionado con la AR. Generalmente son anticuerpos de clase IgG y se detectan hasta en un 90% de los pacientes. Los porcentajes varían según la dilución de los sueros, hay más positivos con diluciones 1:10 que con sueros sin diluir. Son menos frecuentes en la AR seronegativa, se identifican en el líquido sinovial y pueden detectarse antes del desarrollo de la enfermedad. No son específicos de la AR. Se han detectado en pacientes con otras enfermedades reumáticas y autoinmunes, en infecciones o neoplasias, y hasta en un 20% de individuos sanos. Los pacientes con AR y factor antiperinuclear presentan una enfermedad articular más grave, con más manifestaciones extraarticulares, mayor frecuencia de HLA-DR4, actividad inflamatoria intensa, más erosiones y peor evolución funcional, aunque otros estudios no encuentran correlación con la actividad clínica32. La presencia de factor antiperinuclear no indica, en general, mayor actividad inflamatoria33.
Los anticuerpos antiqueratina se detectan, tanto en el suero como en el líquido sinovial, hasta en un 60% de los pacientes con AR. Tampoco son específicos, ya que aparecen en individuos sanos y en sueros de pacientes con LES, síndrome de Sjögren, esclerodermia, espondilitis anquilosante, artritis reactiva, enfermedades cutáneas, hepatopatías y procesos linfoproliferativos. Pueden detectarse tempranamente, antes del desarrollo de la enfermedad, y se han relacionado con una mayor frecuencia de nódulos reumatoides, FR, ANA y enfermedad articular grave34, pero ni estos anticuerpos ni los factores antiperinucleares son capaces de diferenciar las formas graves y progresivas de la AR. Los anticuerpos antiqueratina tienen una especificidad del 95 al 99% y, en el caso de los factores antiperinucleares, es del 73 al 93%33, pero el valor predictivo positivo es de sólo un 50%7 y no se utilizan en la práctica clínica diaria.
Los anticuerpos anticitrulina se detectan en un 76% de los pacientes con AR, con una especificidad del 96%, y pueden aparecer tempranamente35. En conjunto, los pacientes con anticuerpos antifilagrina presentan una enfermedad más grave, con nódulos reumatoides, ANA y FR. Estos anticuerpos se asocian con la presencia del epítope compartido (HLA-DRB1*0401/*0101)36. Pueden aparecer antes del inicio de la enfermedad37 y se ha propuesto que son útiles en el diagnóstico de AR, aunque la sensibilidad oscila entre el 30 y el 50%, y la especificidad entre un 70 y un 100%38. Los anticuerpos antifilagrina, como las concentraciones elevadas de FR-IgM o IgA, son factores de mal pronóstico38. Ninguno de estos anticuerpos ha alcanzado por el momento un uso clínico generalizado.
Anticuerpos anti-Sa
El antígeno Sa fue descubierto en extractos salinos de bazo humano preparados para la detección de anticuerpos anti-Ro/SS-A mediante la técnica de IB39. Després et al40 identificaron una proteína que reaccionaba en IB con sueros de pacientes diagnosticados de AR. El antígeno se denominó Sa en referencia a las iniciales de la primera paciente en la que fueron detectados (Savoie). Los anticuerpos anti-Sa son generalmente de clase IgG y reconocen en IB tres polipéptidos de peso molecular entre 36 y 48 kD9,40. Estas proteínas aparecen en las fracciones citoplasmática y mitocondrial de la placenta humana9. Los anticuerpos anti-Sa producen un patrón citoplasmático en IFI sobre cortes congelados de placenta humana. La tinción se distribuye en la zona periférica de las vellosidades coriónicas, correspondiente al sincitiotrofoblasto, y respeta los núcleos (patrón anular sincitial placentario)41. Se ha demostrado antígeno Sa en el líquido sinovial y en extractos de membrana sinovial de pacientes con AR42.
El antígeno Sa puede purificarse en columnas de cromatografía de afinidad. Utilizando el extracto salino de placenta humana se obtienen dos polipéptidos, de peso molecular 46-48 kD. Cuando se purifica el antígeno Sa a partir del extracto de mitocondrias de placenta humana, se obtienen polipéptidos de peso molecular 46, 50 y 68 kD. Tanto los polipéptidos de 46/50 kD como el de 68 kD reaccionan con los anticuerpos anti-Sa en IB y ELISA, aunque en el caso de los anticuerpos dirigidos contra el antígeno de 68 kD la reacción es débil9. Es posible que los epítopes reconocidos por los anticuerpos anti-Sa 46/50 kD sean diferentes de los reconocidos por los anticuerpos anti-Sa 68 kD. El antígeno Sa copurifica con la vimentina y la proteína disulfido-isomerasa, con las que se han demostrado homologías en fragmentos N-terminales, pero no existe identidad inmunológica. Lapointe et al43 postulan que los sueros de los pacientes con AR reaccionan con proteínas citrulinadas, incluyendo el antígeno Sa y la filagrina. El antígeno Sa puede ser un complejo hapteno-transportador en el cual la vimentina es el transportador y la citrulina el hapteno42. Los anticuerpos dirigidos contra filagrina, queratina o proteína Sa pueden reconocer preferentemente antígenos citrulinados, pero el escaso grado de concordancia de estos anticuerpos en los sueros de los pacientes con AR induce a pensar que es poco probable que exista un único antígeno en la génesis de estas respuestas36. Recientemente, hemos secuenciado el terminal amino de la proteína Sa de 68 kD y dicha secuencia no corresponde a ninguna proteína conocida. La proteína Sa de 50 kD es una proteína ligada a la apolipoproteína A144.
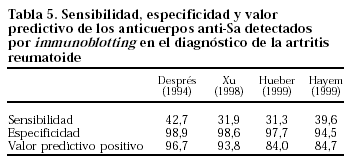
Los anticuerpos anti-Sa se detectan por IB hasta en un 40% de los pacientes con AR9,40,45-48. Aparecen también en algunos pacientes con artritis crónica juvenil9,45, pero no en otras enfermedades (tabla 4). Los pacientes diagnosticados de LES o de EMTC en los que Hueber et al47 detectan anticuerpos anti-Sa cumplían criterios de AR. En el estudio de Sánchez-Atrio45, la sensibilidad o probabilidad de que se detecten anticuerpos anti-Sa en pacientes con AR es de un 32,7% y la especificidad o probabilidad de que la prueba sea negativa si no existe la enfermedad es de un 99,8%. El valor predictivo positivo o probabilidad de presentar AR cuando se detectan los anticuerpos anti-Sa es de un 99,1%, y el valor predictivo negativo o probabilidad de que no exista dicha enfermedad cuando los anticuerpos son negativos es de un 75%. Estudios posteriores encuentran valores similares (tabla 5). En un estudio de 2.737 sueros de pacientes con enfermedades reumáticas (957 con AR) y controles sanos, procedentes de Canadá, España, Francia, Austria y China, los anticuerpos anti-Sa detectados por IB tienen una sensibilidad del 37%, una especificidad del 98% y un valor predictivo positivo de un 97%42. La detección de anticuerpos anti-Sa supera al FR en términos de sensibilidad, especificidad y valor predictivo positivo9,36, como puede verse en la tabla 6. Los anticuerpos anti-Sa son más frecuentes en los pacientes de larga evolución, aunque pueden detectarse en el primer año de evolución hasta en un 30% de los pacientes40. En artritis prematura, Goldbach-Mansky et al36 los detectan en el 26% de los pacientes con FR y en el 14% de los pacientes seronegativos. Vittecoq et al49 los detectan en un 7% de 32 pacientes con AR de 4 meses de evolución.
Los anticuerpos anti-Sa detectados por IB se asocian en la AR con un aumento significativo de la frecuencia de nódulos subcutáneos, síndrome de Sjögren, manifestaciones pulmonares, amiloidosis, insuficiencia renal, FR y títulos elevados de ANA. Estos pacientes presentan peor evolución radiológica y funcional9,45,46. Los anticuerpos anti-Sa son un marcador temprano de destrucción articular grave46. Utilizando la técnica de IFI se obtienen resultados similares41. Hayem et al46 encuentran una asociación significativa entre los anticuerpos anti-Sa detectados por IB y la presencia de FR, anticuerpos antiqueratina, factor antiperinuclear y alelos DRB1*04 y 01. No se asocian con los anticuerpos anti-RA 33. En el estudio de Goldbach-Mansky et al36 los anticuerpos anti-Sa son más frecuentes en varones con AR de menos de un año de evolución y este subgrupo de pacientes presenta más articulaciones inflamadas, mayor concentración de proteína C reactiva (PCR) y enfermedad más erosiva.
El 60% de los pacientes con AR de menos de tres meses de evolución y prácticamente todos los pacientes con enfermedad evolucionada presentan anticuerpos anti-Sa, FR o anticuerpos anti-RA 3347. Hayem et al46 detectan FR, anticuerpos antiqueratina, factor antiperinuclear o anticuerpos anti-RA 33 en el 72,4% de los pacientes diagnosticados de AR con una evolución inferior a un año, pero sólo los anticuerpos anti-Sa parecen tener valor diagnóstico y pronóstico en la AR.
Anticuerpos anticitoplasma de neutrófilo en la artritis reumatoide
La mayoría de los estudios no encuentran C-ANCA en sueros de pacientes con AR, aunque se han detectado hasta en un 6% de los pacientes con AR y vasculitis. Entre un 7 y un 48% de los pacientes con AR presentan P-ANCA o A-ANCA, especialmente en pacientes con vasculitis o síndrome de Felty. En general, son pacientes con enfermedad articular erosiva grave, pero los ANCA no se correlacionan con la actividad de la AR. De un 1 a un 12% de los pacientes presentan anticuerpos antimieloperoxidasa por ELISA y se han relacionado con vasculitis y, en algunos casos, con glomerulonefritis rápidamente progresiva. Se han detectado anticuerpos anticatepsina G hasta en un 6% de casos, de un 8 a un 17% presentan anticuerpos antielastasa y de un 10 a un 20% anticuerpos antilactoferrina, también relacionados con vasculitis50-52.
Otros autoanticuerpos en la artritis reumatoide
Los anticuerpos anticardiolipina se detectan hasta en un 32% de los pacientes con AR. No se relacionan con trombosis, pero sí con abortos de repetición. Aproximadamente el 1% de los pacientes tratados con d-penicilamina desarrollan anticuerpos contra el receptor acetilcolina. Pueden detectarse anticuerpos dirigidos contra β2-microglobulina, proteínas de choque de micobacterias, células parietales gástricas, células endoteliales, calpastatina, anhidrasa carbónica y colágenos de tipos I, II, III, IX y XI. En la AR se detectan anticuerpos anticolágeno II en el suero, en el líquido sinovial y en el cartílago. Entre un 63 y un 70% de los pacientes presentan anticuerpos anticolágeno II nativo y se mantienen al menos dos años. Los anticuerpos dirigidos contra la región similar al colágeno en C1q se detectan en un 77% de los pacientes con vasculitis reumatoide y en un 5% de los pacientes con AR sin vasculitis53.