Introducción
El tratamiento actual de la artrosis tiene como objetivo obtener una mejoría en la capacidad funcional del paciente, aliviar el dolor y retrasar el proceso destructivo articular. El tratamiento farmacológico se ha mostrado eficaz y se basa en la administración de analgésicos, antiinflamatorios no esteroi-deos (AINE) y la inyección intraarticular de glucocorticoides1-3. En los últimos años se han incorporado un grupo de fármacos denominados SYSADOA (symptomatic slow action drug osteoarthritis), que tienen un acción lenta, mejorando los síntomas, con efecto remanente y carecen de los efectos adversos de los AINE. Dentro de este grupo se pueden incluir el sulfato de glucosamina (SG), el condroitín sulfato (CS) y la diacereina. También se pueden incluir en este grupo las tetraciclinas, si bien su utilidad está aún por definir, y el ácido hialurónico, administrado mediante inyección intraarticular. El uso de los SYSADOA se ha generalizado y se administran como monoterapia o asociados a analgésicos y AINE. Su capacidad analgésica y de mejorar la limitación funcional se ha demostrado4. Varios estudios sugieren que estos fármacos pueden retardar el proceso destructivo articular de la artrosis. Si esta capacidad se demostrara plenamente, estos fármacos se podrían incluir dentro de otro grupo terapéutico denominado DMOAD (diseases modifyng osteoarthritis drug) cuya característica fundamental es la capacidad de interferir en la progresión de los cambios articulares. Hasta el momento no ha sido posible incluir a ningún fármaco en este grupo.
Métodos de medida del proceso de destrucción articular en la artrosis
Para poder incluir a un fármaco en el grupo DMOA es preciso demostrar que el proceso de degradación del cartílago se ve interrumpido o retardado por la administración del fármaco. Esto se debe demostrar no sólo en animales de experimentación, sino también en humanos. La observación directa del cartílago mediante artroscopia es sin duda útil, con la ventaja de poder realizar biopsia dirigida del cartílago con estudio histológico. Sin embargo, en la práctica clínica, incluso en la investigación, no resulta práctico, por tratarse de una técnica intervensionista y cara. Dentro de los estudios de imagen tenemos la ecografía, la resonancia nuclear magnética (RNM) y la radiología simple. La ecografía es muy útil para la valoración de partes blandas, pero el estudio del cartílago presenta muchas dificultades. La RNM permite estudiar el cartílago articular, pero la técnica no ha sido validada y es cara. La radiología simple midiendo el espacio articular es el método más aceptado en el momento actual.
Para valorar el efecto modificador de la estructura articular de un fármaco se ha recomendado un estudio radiológico de rodilla y cadera en bipedestación. Se debe tomar todo tipo de precauciones para estandarizar correctamente la técnica. La lectura de las radiografías debe ser ciega.
Para medir la anchura del espacio articular (AEA), fundamentalmente se pueden utilizar 2 métodos: mediante una lupa de aumento con graduaciones de 0,1 mm, midiendo generalmente el punto más estrecho de la articulación, y mediante una lectura con ordenador de radiografías digitalizadas. Ambos métodos se han mostrado útiles, si bien el método más recomendado es la medición del AEA mediante lupa5,6. La progresión anual del estrechamiento de la AEA oscila entre 0,06 y 0,6 mm/año7. Sin embargo la cifra más aceptada es 0,1 mm/año8. La progresión puede no ser lineal.
La AEA es una variable continua y muy útil desde el punto de vista estadístico en los ensayos clínicos, pero resulta más difícil de interpretar que las variables dicotómicas (porcentaje de pacientes que presentan un determinado acontecimiento), además de no permitir calcular el número de pacientes necesarios a tratar (NNT) para obtener dicho acontecimiento. Para poder convertir la variable continua como la AEA en una variable dicotómica, se ha establecido un punto de corte que se considera relevante. Se ha definido como disminución significativa de la AEA (Ds AEA) una variación de la AEA de 0,5 mm9. En este sentido, se ha recomendado, para valorar la relevancia clínica de la progresión radiológica, calcular el porcentaje de pacientes que tienen una Ds AEA (> 0,5 mm) durante los estudios. Los pacientes que presentan esta Ds AEA pueden tener un peor pronóstico. Además, calculando el porcentaje de pacientes que experimentan una Ds AEA, es posible calcular el riesgo relativo (RR) y el NNT.
La incidencia de artroplastia de cadera o de rodilla se ha propuesto como un parámetro de medida de la eficacia del tratamiento en la artrosis. La práctica de una artroplastia (sí/no) puede ser una excelente variable dicotómica. Sin embargo, existen varias limitaciones para el uso de esta variable: necesidad de estudios de larga duración para obtener significación estadística y una alta variabilidad en la decisión de realizar artroplastia.
Sulfato de glucosamina
La glucosamina es un componente de los glucosaminoglicanos de la matriz del cartílago. El SG tiene actividad anabólica (aumenta la síntesis de proteinoglicanos) y disminuye la actividad catabólica (inhibe las metaloproteinasas, la agrecanasa y los radicales superóxido), por lo que puede tener un efecto en la reparación y en el mantenimiento de la estructura del cartílago. En animales de experimentación se ha observado que el SG puede enlentecer el proceso de destrucción del cartílago.
Un metaanálisis10 encuentra un efecto significativo en el dolor, si bien los ensayos son de baja calidad. Otro metaanálisis, publicado posteriormente11, demuestra eficacia del SG en el tratamiento del dolor y limitación funcional.
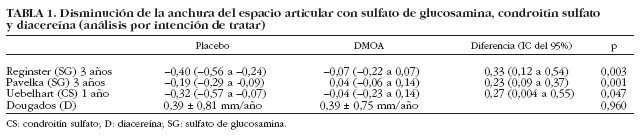
La capacidad del SG para reducir la pérdida de cartílago articular se demuestra en 2 ensayos aleatorios y controlados12,13. El estudio de Reginster et al12 es un ensayo aleatorio, doble ciego y controlado con placebo en el que se incluyen 212 pacientes con artrosis de rodilla, que son asignados de forma aleatoria a administrar 1.500 mg/día de SG y placebo. La duración del ensayo fue de 3 años. Se rea-lizó un estudio radiológico de las rodillas en extensión completa, de pie, antes de comenzar el tratamiento, al año y a los 3 años. Se valoró el estrechamiento medio del espacio articular de los compartimientos medial y lateral. También se determinó la AEA mediante una lupa de aumento con graduaciones de 0,1 mm. Mediante los 2 tipos de medida se apreció una menor disminución de la AEA del espacio articular (con significación estadística) en los pacientes tratados con SG respecto al grupo control con placebo (tabla 1). A los 3 años, 32 (30%) de los 106 pacientes con placebo, y sólo 16 (15%) de los 106 del grupo glucosamina, habían experimentado una pérdida superior a 0,5 mm. El NNT fue de 7.
El estudio de Pavelka et al13 es también un ensayo aleatorizado, doble ciego y controlado con placebo, en el que se incluye a 202 pacientes a los cuales se administra 1.500 mg de SG o placebo durante 3 años. Se realizó un estudio radiológico de las rodillas antes de comenzar el tratamiento, al primer, segundo y tercer años, en proyección anteroposterior y en carga. Se mide el estrechamiento del compartimento tibiofemoral interno mediante una lupa de aumento con graduaciones de 0,1 mm. Después de 3 años se observó en el grupo placebo una pérdida de la AEA de 0,19 mm (intervalo de confianza [IC] del 95%, 0,29 a 0,09). En el grupo tratado con SG se apreció un aumento de la AEA de 0,04 (IC del 95%, 0,09 a 0,14) con una diferencia de 0,23 (IC del 95%, 0,09-0,37; p = 0,001) (tabla 1). El porcentaje de pacientes que experimentaron una pérdida del espacio articular superior a 0,5 mm fue de 14 (13,9%) en el grupo placebo y de 5 (4,9%) en el grupo de SG. El NNT fue de 11.
Un estudio posterior14 confirma estos datos en las 319 mujeres posmenopáusicas de estos 2 ensayos12,13. La hipótesis de que el efecto en el espacio articular podría estar en relación con el efecto analgésico del SG, al disminuir la flexión antiálgica de la rodilla, fue rebatida posteriormente15.
Condroitín sulfato
El CS es un compuesto de sulfato de galactosamina y ácido glucurónico. Tiene un efecto anabólico (estimula la síntesis de los proteoglicanos) e inhibidor de las colagenasas y radicales libres.
El metaanálisis de Richy et al11 demuestra una eficacia del CS similar a la del SG en parámetros de dolor e incapacidad funcional, si bien no encuentra datos para analizar la capacidad del CS en disminuir la pérdida de la AEA.
El estudio de Uebelhart et al16 es un ensayo con 120 pacientes que se asignaron de forma aleatoria a CS (800 mg/día durante 2 períodos de 3 meses en un año) y placebo. Se realizó un estudio radiológico de rodillas anteroposterior en carga y extensión completa antes de comenzar el tratamiento y al año. Se realizó una medición digitalizada. Se realizaron 3 medidas: área de superficie articular, media del espacio articular y AEA mínima. En las 3 variables se observó al año una disminución significativa del espacio articular en el grupo placebo frente al grupo tratado con CS (tabla 1). En este estudio no se analiza la Ds AEA.
Se ha estudiado el efecto modificador de estructura del CS en la artrosis de manos. En un ensayo controlado y doble ciego a 3 años, en el que se incluyeron 119 pacientes (34 con CS y 85 con placebo), se demostró que la administración de CS protegía de la evolución a artrosis erosiva de interfalángicas (IF). En el estudio se describe escasamente la metodología y es difícil de analizar17. En otro ensayo, también controlado con placebo, se incluyeron 165 pacientes durante 3 años, y se apreció una menor progresión de la artrosis de IF de manos18. De los 165 pacientes, en el grupo de tratamiento 46 recibieron condroitín polifosfato y 34 CS; los 85 pacientes restantes recibieron placebo. El estudio está orientado fundamentalmente a describir sistemas de medición radiológica de la evolución de la artrosis.
Diacereína
La diacereína es un metabolito de la reína con propiedades antiinflamatorias y analgésicas, que inhibe la síntesis de interleucina-1 (IL-1) y de metaloproteinasas. En modelos animales se ha demostrado la capacidad de la diacereína de mejorar la evolución de la artrosis19.
Su eficacia en mejorar la sintomatología de la artrosis de rodilla se ha demostrado en un ensayo aleatorizado, doble ciego y controlado con placebo20.
La capacidad de la diacereína de enlentecer la pérdida de cartílago en la artrosis de cadera se ha estudiado en un ensayo aleatorio, doble ciego y controlado con placebo21, en el que 507 pacientes con artrosis de cadera fueron asignados a diacereína o placebo. El ensayo tuvo una duración de 3 años. Se obtuvieron radiografías pélvicas en bipedestación previamente a comenzar el tratamiento y posteriormente de forma anual. Se midió el punto más estrecho de la articulación y se utilizó una lupa con 0,1 mm de graduación. Para el análisis se valoró el porcentaje de pacientes con Ds AEA (método de Kaplan-Meier) que fue significativamente inferior en el grupo de los pacientes que recibieron diacereína frente al grupo placebo en el análisis por intención de tratar: 112 (50,7%) de 221 pacientes en el grupo diacereína frente a 136 (60,4%) de 225 pacientes del grupo placebo (p = 0,036). También en el análisis de la población que completó el estudio la diferencia fue significativa: 62 (47,3%) de 131 pacientes con diacereína frente a 86 (62,3%) de 138 pacientes del grupo placebo (p = 0,007). El NNT fue de 13.
Cuando se analizó los valores medios de la disminución de la AEA en la población por intención de tratar, se observó un valor de 0,39 ± 0,81 mm/año en el grupo placebo, frente a 0,39 ± 0,75 mm/año en el de diacereína, que no alcanzó la diferencia significación estadística. Cuando se analizó la población que completó el estudio se obtuvo una diferencia significativa (p = 0,042), con 0,18 ± 0,25 mm/año en el grupo de diacereína y 0,23 ± 0,23 mm/año en el grupo placebo.
Se realizó artroplastia de cadera en 37 (14,5%) pacientes del grupo de diacereína y 50 (19,8%) del grupo placebo, que no alcanzó significación estadística.
Discusión
Los 3 fármacos (SG, CS y diacereína) han demostrado en ensayos controlados, aleatorios y doble ciego que son capaces de retardar la pérdida de cartílago articular frente a un placebo. Sin embargo, el análisis detallado y comparativo sólo parece posible con la artrosis de rodilla y de cadera, puesto que sólo existen ensayos de tratamiento con artrosis de manos con CS, y además son ensayos de difícil interpretación.
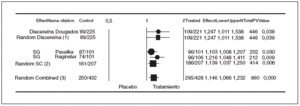
Con artrosis de rodilla y de cadera los ensayos están mejor diseñados, utilizan parámetros similares y son parcialmente comparables; el SG en 2 ensayos a 3 años en artrosis de rodilla12,13, el CS en un ensayo a un año en artrosis de rodilla16 y la diacereína en un ensayo a 3 años en la artrosis de cadera21 (tabla 2). En los 2 ensayos de SG y en el de CS se utiliza la diferencia de AEA mínimo entre el grupo de tratamiento y el grupo placebo en un análisis por intención de tratar (tabla 1). En el ensayo de la diacereína se presenta la velocidad de disminución anual de la AEA que no alcanza significación en el análisis por intención de tratar, pero sí en el análisis de los pacientes que completaron el estudio. En el metaanálisis de Richy et al11 se demuestra un efecto combinado en la capacidad del SG de disminuir la pérdida de la AEA frente a placebo (p < 0,001). En éste no se incluye el ensayo del CS16 ni el ensayo de la diacereína21 por no haber sido publicados. En el ensayo de la dicereína21 se utiliza el porcentaje de pacientes con disminución de la AEA significativa (> 0,5 mm), así como en los 2 ensayos de SG12,13. Teniendo en cuenta que en estos ensayos12,13,21 se facilita el número de pacientes y que tienen una AEA significativa (> 0,5 mm), introducimos en un programa de metaanálisis (fig. 1) el número de pacientes que no alcanzaron una disminución de la AEA significativa (> 0,5 mm), que es el objetivo positivo que se pretende obtener. Se obtienen estimadores combinados de eficacia dicotómicos (RR) calculando el efecto beneficioso del SG y de la diacereína frente a placebo mediante el número de pacientes que no alcanzaron una disminución de la AEA significativa (> 0,5 mm). Utilizamos el método de DerSimonian-Laird para efectos aleatorios. La heterogeneidad se evaluó mediante el estadístico Q de Cochran. Se utilizó el software específico «Comprehensive Metaanalysis for Windows». En los 3 ensayos se observó un efecto positivo estadísticamente significativo (p < 0,05) a favor del tratamiento. Se apreció un efecto combinado de 1,14 (IC del 95%, 1,06-1,23). Así pues, se demuestra la eficacia de SG y diacereína. No se apreció heterogeneidad significativa entre los ensayos (Q = 1,42; p = 0,49). Es decir, que se puede considerar similar la magnitud del efecto entre los 2 fármacos. De esta forma, utilizando este tipo de variable cuantitativa también se confirma el efecto de enlentecimiento de la disminución de la AEA.
Figura 1. Metaanálisis del efecto de la diacereína y del sulfato de glucosamina (SG) en la disminución de la anchura del espacio articular en la artrosis.
Así pues, en varios ensayos y metaanálisis se demuestra de forma clara la capacidad del SG, el CS y la diacereína para disminuir la pérdida de la AEA. Por tanto, estos fármacos son capaces de modificar la estructura además de obtener una mejoría sintomática. ¿Por qué no se incluyen dentro del grupo denominado DMOA? Podemos comparar este problema con el que existe en otro tipo de enfermedades reumáticas: osteoporosis y artritis reumatoide (AR) (tabla 3). En cualquiera de estas enfermedades existen 2 objetivos diferentes y relacionados: mejoría de la sintomatología y alteración de la estructura (retardar o evitar el proceso destructivo óseo o articular). Dentro del objetivo de modificar la estructura, existen objetivos intermedios (cuantificar la capacidad de retardar la alteración de la estructura que caracteriza la enfermedad) y objetivos finales (demostrar que el fármaco es capaz de reducir el número de episodios finales de la enfermedad: fracturas, artroplastia).
En la osteoporosis, los fármacos antirresortivos se consideran modificadores de la estructura, son capaces de detener la pérdida de masa ósea (medición mediante densitometría) y de reducir el nú-mero de fracturas (radiología). Además, existe evidencia de la relación entre masa ósea (objetivo intermedio) y el desarrollo de fracturas (objetivo final). No está claro que con estos fármacos se obtenga una mejoría sintomática, por lo que fundamentalmente serían fármacos modificadores de la estructura.
En la AR existen fármacos que mejoran la sintomatología (alivian el dolor, disminuyen la limitación funcional y los signos inflamatorios) exclusivamente (AINE, analgésico) y modificadores de la estructura: disease modifying antirheumatic drugs (DMARD) y biológicos. Los DMARD y biológicos dan lugar también a una mejoría sintomática, pero además son capaces de disminuir el proceso inflamatorio (normalización de los reactantes de fase aguda) y frenar el desarrollo de erosiones y pérdida del cartílago articular22-24. Es posible cuantificar la alteración radiológica mediante al índice de Sharp25. El objetivo final en la AR sería demostrar que no se produce la destrucción articular que ocasiona deformidad y necesidad de cirugía (artroplastia). Este objetivo final no está claramente demostrado hasta el momento.
En la artrosis los fármacos disponibles mejoran la sintomatología (AINE, analgésicos, SYSADOA). La capacidad de modificar la estructura se puede demostrar alcanzando objetivos intermedios, demostrando la capacidad del fármaco para retardar la pérdida de cartílago articular que se desarrolla durante la enfermedad artrósica. Los SYSADOA (SG, CS y diacereína) han demostrado esta capacidad en ensayos clínicos controlados mediante técnicas de cuantificación del daño radiológico, de forma similar a la AR con DMARD y biológicos mediante el índice de Sharp. El objetivo final de evitar el proceso destructivo con deformidad y necesidad de artroplastia no se ha demostrado plenamente.
En el caso de la osteoporosis no hay duda de que los antirresortivos han demostrado su eficacia como fármacos modificadores de la estructura, existiendo una herramienta de medida (densitometría) muy precisa para demostrar la capacidad de alcanzar objetivos intermedios. La fractura ósea es el efecto final de la osteoporosis y resulta fácilmente demostrable y cuantificable.
En el caso de la AR y la artrosis, aparentemente la situación sería similar con la demostración de que los DMARD y los SYSADOA pueden alcanzar objetivos intermedios del proceso modificador de la estructura, sin demostrarse los objetivos finales. En la AR se acepta plenamente que muchos fármacos (DMARD y biológicos) tienen esta capacidad modificadora, mientras que en la artrosis no se acepta plenamente la capacidad DMOAD de los llamados SYSADOA. Existen varios aspectos diferenciales que pueden justificar una cierta reticencia en admitir este efecto e introducir SG, CS y diacereína en el grupo DMOAD. En la AR (y en otras enfermedades inflamatorias) existe métodos de laboratorio plenamente validados como la proteína C reactiva (PCR) que permiten medir el grado de inflamación, y existe evidencia de que los fármacos con acción puramente sintomática (AINE) no modifican los valores séricos de PCR, y los DAMARD y los biológicos sí son capaces de normalizar este parámetro. Además, existe evidencia de la relación entre el proceso de destrucción articular y los valores de PCR. Aunque en el momento actual disponemos de biomarcadores capaces de medir la degradación del cartílago en la artrosis26, estos métodos no están completamente validados ni su relación con el proceso destructivo completamente demostrada. Por otra parte, las técnicas de cuantificación radiológica del proceso destructivo son más precisas en la AR, puesto que el índice de Sharp mide, además del estrechamiento del espacio articular, la presencia de erosiones, dicha presencia es fácilmente identificable y demostrable. En la medición radiológica de la AEA pueden influir muchos factores que dificultan la estandarización de la técnica27. El porcentaje de pacientes en los que se realiza una artroplastia podría ser un buen parámetro final de eficacia, similar a la fractura en la osteoporosis. Sin embargo, al igual que en la AR, la necesidad de desarrollar ensayos de muy larga evolución y la alta variabilidad de las decisiones quirúrgicas hacen que sea un parámetro de difícil uso y muy difícil variación28.
Conclusiones
Varios fármacos incluidos dentro del grupo SYSADOA han demostrado reducir la pérdida de AEA de la artrosis, de forma similar a los DMARD en la AR. Sin embargo, la necesidad de basar este efecto exclusivamente en la medición de la AEA (a diferencia de la AR en que se contabilizan la erosiones), la ausencia de validación clínica de los biomarcadores y la dificultad de usar la artroplastia como parámetro de objetivo final han retardado la inclusión de estos fármacos en un nuevo grupo denominado DMOA.
Probablemente, el desarrollo de técnicas de mayor precisión para medir la AEA, la validación de los marcadores para el uso clínico y el desarrollo y aplicación de unas indicaciones estrictas para la realización de artroplastia, junto con ensayos de mayor duración, permitirán en un futuro cercano incluir alguno o todos los SYSADOA dentro del grupo de los DMOA.