Introducción
La apoptosis, o muerte programada, es un proceso fisiológico que tiene como función mantener la homeostasis del tejido embrionario y adulto1, pero que puede tener relevancia en la fisiopatogenia de las enfermedades en las que se produce una degeneración del cartílago articular, como son la artritis reumatoide y la artrosis. Es importante la diferenciación entre necrosis y apoptosis. La necrosis, a diferencia de la apoptosis, es un proceso patológico que tiene lugar cuando las células están expuestas a un daño físico o químico.
El condrocito es el único elemento celular en el cartílago y, por tanto, de él depende la síntesis y la integridad de la matriz extracelular, que es la que confiere al tejido sus propiedades fisicoquímicas. La muerte del condrocito tiene una significación patogénica tanto en el desarrollo de la artrosis como en el proceso de reparación de la pérdida de matriz extracelular2. En el cartílago artrósico los condrocitos pierden su fenotipo diferenciado, dejando de sintetizar colágeno tipo II y agrecano, y se encaminan hacia un proceso de muerte celular. La matriz extracelular es una fuente de señales tróficas y, por tanto, su alteración produce un cambio en las señales que regulan la apoptosis del condrocito3.
Las cargas mecánicas sobre las articulaciones son necesarias para que la matriz extracelular mantenga su metabolismo. Sin embargo, se ha comprobado que las cargas mecánicas de elevada frecuencia e intensidad son un factor de primer orden en la patogenia de la artrosis4. Las fuerzas biomecánicas locales condicionan cambios en la estructura del condrocito, observándose que los situados en las zonas de mayor carga tienen un tamaño superior y mayor volumen de organelas intracelulares5, así como una mayor composición de proteoglicanos y un mayor grado de deformidad de las fibras de colágeno6. Existen evidencias ex vivo de que las cargas articulares pueden modificar la composición y la función del sistema de metaloproteasas y citocinas proinflamatorias.
Por otro lado, algunos estudios han tratado de demostrar la relación entre la muerte celular por apoptosis y las diferentes cargas a las que se ve sometida una misma articulación. En este sentido, el trabajo publicado por Kim et al7 demuestra, en la gonartrosis, un mayor grado de apoptosis y relaciona la gravedad de la artrosis con el porcentaje de células apoptóticas observado.
A pesar de que la coxartrosis constituye un problema epidemiológico de enorme magnitud, existen pocos estudios que, utilizando modelos similares a los de Kim et al7, intenten relacionar en esta articulación el grado de apoptosis con las zonas de diferente carga. El objetivo de nuestro trabajo es cuantificar el número de condrocitos apoptóticos en el cartílago articular de la cabeza femoral artrósica en las zonas de carga y no carga.
Material y métodos
Obtención de las muestras
Las muestras de cartílago se obtuvieron a partir de cabezas femorales de pacientes afectados de coxartrosis primaria y sometidos a intervención quirúrgica programada para artroplastia total (n = 10). Se excluyeron aquellos pacientes con patología inflamatoria, microcristalina, osteonecrosis, displasias de cadera, trastornos de la alineación e hiperostosis vertebral anquilosante senil, así como aquellos tratados con corticoides y fármacos de acción lenta modificadores de los síntomas (SYSADOA). Previamente a la intervención, un reumatólogo examinaba la última radiografía de cada paciente practicada antes de la artroplastia y comprobaba que se tratara de una coxartrosis polar superior; se excluyeron, por tanto, las formas con afección concéntrica y del polo inferior.
En la cabeza femoral se distinguió el polo superior del inferior (zona de máxima y mínima carga, respectivamente) y se realizó una extracción del tejido cartilaginoso de cada una de estas dos zonas. Se consideró como zona de máxima carga la región superior y como zona de mínima carga la región inferior, según la división topográfica descrita por Li4, a excepción de un paciente en el que la zona de máxima carga se correspondía con la región inferior.
Las muestras de cartílago se dividieron y se fijaron en glutaraldehído al 2,5%, para su estudio mediante microscopia electrónica, o bien en formaldehído al 4% para su estudio mediante la técnica de TUNEL.
Estudio de la apoptosis mediante TUNEL
Las muestras de cartílago se fijaron en formalina y fueron incluidas en parafina. De cada bloque se realizaron dos cortes de 4 µm, que fueron utilizados para la técnica de TUNEL (TdT-mediated dUTP nick end labelling) (Roche Diagnostics GMBH, Mannheim, Germany). Las muestras se rehidrataron e incubaron con 20 µg/ml de proteinasa K durante 10 min a temperatura ambiente. La peroxidasa endógena fue inhibida mediante incubación con peróxido de hidrógeno al 0,3% y las células fueron permeabilizadas con un 0,1% de Tritón X-100 durante 2 minutos a 4 oC. Las secciones fueron incubadas con la mezcla de reacción de TUNEL siguiendo el protocolo estandarizado por Roche. El marcaje se detectó mediante incubación con un anticuerpo conjugado con peroxidasa, y el revelado se llevó a cabo mediante incubación con el sustrato DAB (diaminobencidina). En cada muestra se analizó un mínimo de 100 células.
Estudio de la apoptosis mediante microscopia electrónica
Las muestras se fijaron durante 24 h en glutaraldehído al 2,5% en tampón cacodilato, y se lavaron dos veces en tampón cacodilato 0,2 M durante 10 min. A continuación, fueron fijadas en tetraóxido de osmio 0,2 M pH 7,4 durante 1 h y, posteriormente, fueron lavadas dos veces en tampón cacodilato durante 10 min. Tras ello, fueron deshidratadas en etanol al 96%, y finalmente incluidas en resina epoxídica. Para el examen ultraestructural, se efectuó un estudio preliminar de cortes semifinos al microscopio óptico, con el objetivo de seleccionar los bloques más adecuados para el estudio. Además de la comprobación de la calidad técnica del material, el único criterio de selección fue que existiera una buena representación numérica de condrocitos. Se cortaron secciones finas que fueron teñidas con acetato de uranilo y citrato de plomo, y estudiadas mediante un microscopio electrónico Phillips CM100. Para el estudio de la apoptosis se obtuvieron fotografías de las diferentes muestras de tejido, sobre las cuales se aplicó un método de recuento semicuantitativo8. Para la evaluación de la apoptosis se valoró desde una ligera condensación nuclear hasta cambios apoptóticos evidentes en el citoplasma y en el núcleo (acumulaciones de cromatina en la periferia de la membrana nuclear y pérdida de heterocromatina). Los cambios estructurales apoptóticos se expresaron como porcentaje de aparición en cada grupo de muestras. Se analizó un mínimo de 100 condrocitos en cada muestra.
Figura 1. A) Células apoptóticas con el núcleo intensamente teñido (marrón) mediante la técnica de TUNEL (×800). B) Se pueden observar las células apoptóticas con el núcleo teñido conjuntamente con otras que son negativas para TUNEL (×800).
La hipótesis principal de nuestro estudio fue que la apoptosis cuantificada por TUNEL era mayor en el polo superior que en el inferior. No se encontraron estudios en la bibliografía que compararan datos similares en la cadera que permitieran realizar una estimación del tamaño de la muestra. Sin embargo, con 10 pacientes, y basándonos en los resultados obtenidos en nuestro estudio, se tenía una potencia estadística del 80% para detectar como significativa una diferencia media entre la apoptosis de ambos polos de, al menos, un 10%.
Para la realización del análisis estadístico de los resultados se empleó el test de la t de Student para datos apareados. Los resultados se expresaron como media aritmética ± desviación estándar.
Resultados
Estudio histológico mediante TUNEL
Utilizando la técnica de TUNEL, la media de los porcentajes obtenidos fue de 11,9 ± 17,6 y 10,6 ± 9,1 en zonas de máxima y mínima carga, respectivamente. Las diferencias entre ambas zonas se hallaron lejos de la significación estadística. Los intervalos de confianza demostraron que estas diferencias no serían superiores al ± 10%, aproximadamente (tabla 1).
Estudio ultraestructural
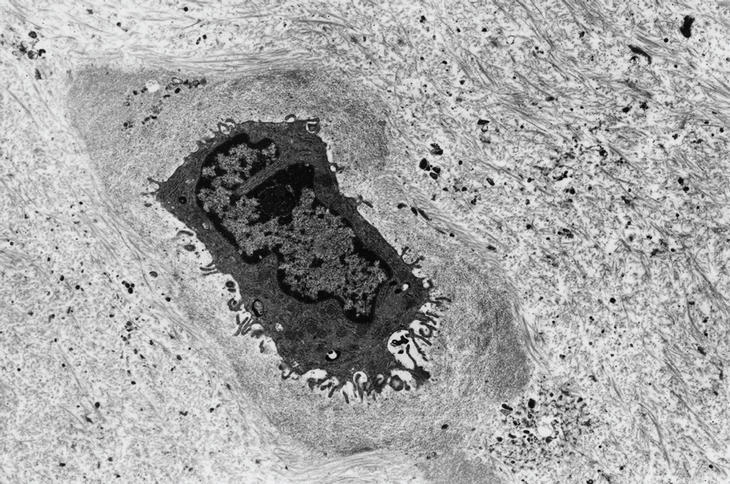
En el examen ultraestructural se observó un rango de alteraciones de la morfología condrocitaria, desde condrocitos prácticamente normales dentro de su laguna y rodeados por su matriz territorial, con cromatina y nucléolo conservados (fig. 2 A), hasta imágenes típicas de apoptosis, con condensación homogénea de la cromatina nuclear en agregados esféricos o semicirculares. Estos cambios se acompañaban a menudo de alteraciones de tipo apoptótico en el citoplasma, con condensación de orgánulos y fragmentación focal (fig. 2 B).
Figura 2. A) Condrocito normal y matriz territorial. B) Condrocito con características apoptóticas en el núcleo y en algunos de los componentes del citoplasma (microscopio electrónico de transmisión).
Mediante microscopia electrónica, el 13,6 ± 7,7% y el 16,7 ± 12,0% de los condrocitos obtenidos de cartílago de zonas de máxima carga y mínima carga, respectivamente, presentaban cambios apoptóticos. Tampoco en este caso se obtuvieron diferencias estadísticamente significativas (tabla 1) y los intervalos de confianza demuestran que estas diferencias no serían superiores al ± 15%, aproximadamente.
Discusión
A finales de la década de los setenta se empezó a utilizar el término «apoptosis» con el fin de describir un tipo de muerte celular diferenciada, histológica y biológicamente, de la ya conocida necrosis. Las células apoptóticas presentan características morfológicas y bioquímicas entre las que se incluyen la agregación de la cromatina, la condensación nuclear y citoplásmática, y la división del citoplasma y del núcleo en cuerpos apoptóticos (vesículas delimitadas por membrana y que contienen ribosomas y mitocondrias morfológicamente conservadas y material nuclear).
Es un hecho conocido que en el cartílago articular humano adulto la pérdida de células se incrementa con la edad9, y también se ha observado una pérdida de la celularidad en el cartílago humano artrósico respecto al cartílago normal9,10. Fruto de un mayor conocimiento de los tipos de muerte celular y de las técnicas de detección de la apoptosis surgió la pregunta de si la hipocelularidad observada en el cartílago artrósico estaba relacionada con el proceso apoptótico. En estudios llevados a cabo por diversos autores se observó que el porcentaje de células apoptóticas es mayor en la artrosis que en el cartílago normal, tanto en humanos11 como en modelos de experimentación animal12,13. Posteriormente, Heraud et al14 aportaron nuevos datos al realizar en cartílago humano un estudio comparativo entre el porcentaje de apoptosis obtenido en secciones de cartílago y en cultivo de condrocitos. En ambos casos se obtuvo un mayor porcentaje de células apoptóticas en cartílago artrósico respecto al normal.
Una vez demostrada la participación de la apoptosis en el proceso artrósico, y conociendo la relación de las cargas mecánicas con la artrosis, es fácil preguntarse si las diferentes cargas mecánicas de una articulación pueden o no inducir el proceso apoptótico. Mediante un modelo de experimentación animal se demostró que la sección del ligamento cruzado anterior inducía un aumento del porcentaje de condrocitos apoptóticos y que éste era proporcional a la gravedad de la artrosis12. Más recientemente, en un estudio comparativo entre muestras de cartílago de rodilla de pacientes artrósicos y no artrósicos, Kim et al7 demuestran una mayor proporción de células apoptóticas en el cartílago artrósico respecto a las muestras normales, así como un mayor porcentaje de condrocitos apoptóticos en zonas lesionadas respecto a las no lesionadas de una misma rodilla artrósica.
No existen apenas trabajos que hayan relacionado, en caderas procedentes de pacientes artrósicos, las zonas de distinta carga con el grado de apoptosis. A este respecto, cabe mencionar el estudio llevado a cabo por Vignon15 en 1976, en el cual, al estudiar cabezas femorales de individuos sin artrosis, se observó una disminución en el número de condrocitos y en la densidad celular al aumentar la edad de los sujetos. De todos modos, dicha hipocelularidad era similar en los polos superior e inferior y, por tanto, parecía ser independiente de factores ambientales locales, como la presión en un área determinada. Aunque el trabajo de Vignon se centraba en individuos no artrósicos, podemos considerar que en nuestro estudio hemos hallado resultados concordantes, ya que no hemos encontrado diferencias en el porcentaje de células apoptóticas entre zonas de máxima y mínima presión (polo superior y polo inferior) en caderas artrósicas.
Nuestros resultados son, por otro lado, discordantes con los obtenidos por Kim et al7 en que, utilizando también técnicas de microscopia electrónica y TUNEL, se describió un aumento del porcentaje de condrocitos apoptóticos en las zonas lesionadas de rodillas de pacientes con artrosis respecto a las no lesionadas. Sin embargo, en este estudio la selección de muestras de cartílago para su evaluación ultraestructural no se realizaba al azar, sino que para efectuar los cortes finos se preseleccionaban en los cortes semifinos los campos en los que se visualizaba un número de células con cambios apoptóticos, lo cual quizás podría alterar el porcentaje final de condrocitos que se hallaban en apoptosis. Por otro lado, no se especifica el número de células evaluadas para el cálculo del porcentaje de células apoptóticas. Es posible que, de forma ultraestructural, las diferencias encontradas entre el trabajo de Kim y el nuestro sean debidas a una distinta evaluación de las muestras de cartílago.
La microscopia electrónica es el patrón de referencia que permite la identificación de células apoptóticas. La técnica de TUNEL, aunque ha demostrado ser una valiosa herramienta para la cuantificación de apoptosis, ofrece una mayor variabilidad (especialmente en lo que se refiere a la detección de falsos positivos). Esto podría explicar en parte las diferencias númericas (no estadísticamente significativas) obtenidas entre ambas técnicas utilizadas en nuestro estudio.
Sería plausible pensar que en la cabeza femoral el comportamiento de los condrocitos es diferente al de otras articulaciones, como la rodilla. De hecho, basándose en estudios previos y en los suyos propios, Vignon15 ya sugirió que el comportamiento de los condrocitos es distinto en la cabeza femoral respecto al cóndilo femoral y que, por tanto, dicho comportamiento puede ser diferente en función de la articulación que se evalúe. En nuestro modelo, los distintos grados de lesión del cartílago podrían estar directamente relacionados con un incremento de la degradación de la matriz extracelular por parte de metaloproteasas y/o con una disminución de la síntesis de proteínas por parte de los condrocitos. La apoptosis quizás no tenga un papel tan predominante como desencadenante de las lesiones artrósicas en la cabeza femoral respecto al encontrado en rodilla en los diversos trabajos publicados7.
En conclusión, los resultados de este estudio no apoyan la existencia de una relación directa entre el porcentaje de condrocitos apoptóticos y las zonas de máxima y mínima carga de la articulación coxofemoral de pacientes artrósicos, a pesar de que se sabe que las fuerzas físicas están relacionadas con la apoptosis. Los diferentes grados de lesión cartilaginosa en esta articulación podrían ser consecuencia de procesos apoptóticos sumados a otros mecanismos diferentes a los de la muerte celular programada y relacionados con el sistema enzimático responsable de la degradación de la matriz extracelular. Sería necesario realizar posteriores estudios con el fin de corroborar esta hipótesis y demostrar cuáles son los mecanismos implicados en la destrucción de la matriz extracelular. Por otro lado, nuestros resultados, en comparación con los obtenidos en otros estudios, podrían reabrir el debate sobre si los condrocitos se comportan de forma distinta en las distintas articulaciones y áreas de presión.
Correspondencia: Dr. J. Monfort. Servicio de Reumatología. Hospital del Mar. Passeig Marítim, 25-29. 08003 Barcelona. España.
Correo electrónico: jmonfort@imas.imim.es
Manuscrito recibido el 21-5-2002 y aceptado el 18-3-2003.