Introducción
En la artritis reumatoide (AR), la valoración de la actividad y del daño es de crucial importancia tanto en los ensayos clínicos como en la práctica diaria. Las variables que se utilizan en la evaluación de la AR se dividen en dos tipos: variables de proceso y variables de resultado (outcome en inglés)1. Las variables de proceso miden la actividad de la enfermedad en un momento dado y representan el grado de inflamación o intensidad del proceso fisiopatológico subyacente; por ejemplo, los reactantes de fase aguda, la rigidez matutina, el dolor o la extensión de la afectación articular. Las variables de desenlace o de resultado miden la consecuencia de la actividad inflamatoria durante un período de tiempo, que se refleja en la pérdida de salud del paciente2. Dentro de estas variables figuran, entre otras, el daño radiológico y la alteración de la capacidad funcional. La distinción entre estos tipos de variables no siempre está claramente diferenciada; por ejemplo, la capacidad funcional puede reflejar tanto la cantidad de inflamación subyacente (proceso) como la destrucción articular debida a la enfermedad (resultado).
En 1992 y 1993, la reunión del OMERACT3, la EULAR4 y finalmente el American College of Rheumatology (ACR)5 propusieron un grupo de variables que debían ser usadas para medir la actividad de la AR y valorar la eficacia de los tratamientos en los ensayos clínicos. Se propusieron 7 variables de proceso, que son la medida del dolor, la valoración de la actividad por el paciente y el médico, el número de articulaciones dolorosas y tumefactas, la capacidad funcional y un reactante de fase aguda.
La medida de estas variables debería ser una disciplina lo más exacta posible. Los reactantes de fase, las escalas analógicas y los cuestionarios de discapacidad han demostrado que son medidas reproducibles y precisas, por lo que sus resultados son utilizados con gran confianza por el médico. Sin embargo, variables clínicas como los recuentos articulares, a pesar de la gran importancia que tienen, son en general poco precisas y reproducibles, por lo que la variabilidad entre distintos observadores es grande6.
Hay una gran diferencia en cómo los médicos organizan y asimilan la información que obtienen de los pacientes y sobre la que se basa su decisión clínica y terapéutica, y esto es especialmente verdad en el caso de pacientes con enfermedades reumáticas, en los que se puede obtener un gran número de variables clínicas, algunas directamente derivadas de la observación y exploración del paciente, como los recuentos articulares, y otras obtenidas del paciente, como la valoración del dolor o la capacidad funcional. Se ha demostrado que muy pocas variables, no más de tres, que además son diferentes entre los reumatólogos, explican la mayor parte de las decisiones clínicas7. La mayoría de los reumatólogos son conscientes de las variables que para ellos son más importantes a la hora de valorar a un paciente, pero desconocen la contribución relativa que esas y otras variables tienen en sus decisiones terapéuticas. Las variables que un médico utiliza no tienen que ser necesariamente similares a las de otro, y su peso relativo puede ser distinto, por lo que puede haber importantes diferencias entre observadores al estimar la actividad de una enfermedad8.
Índices articulares
En la exploración de un paciente con artritis debería evaluarse la presencia de tumefacción, dolor a la palpación y con el movimiento, limitación de la movilidad y deformidad6. Cada uno de estos parámetros representa procesos ligeramente diferentes y no son necesariamente redundantes. La inflamación y el dolor en una articulación varían con el tiempo, pero los cambios destructivos que provocan la limitación y la deformidad son acumulativos. Sin embargo, no es práctico registrar todos estos valores debido al gran tiempo que se consumiría y a las dificultades de interpretación y manejo de todos esos datos.
El dolor a la palpación se obtiene presionando directamente los márgenes de la articulación y las estructuras periarticulares, por lo que su resultado es bastante subjetivo y el grado de dolor varía considerablemente entre diferentes observadores. En la mayoría de los trabajos realizados existe una aceptable concordancia entre exploradores en la presencia o ausencia de dolor a la palpación, pero hay una gran variación en la magnitud del dolor, lo que hace menos reproducibles las medidas articulares que valoran diferencias en la intensidad del dolor. Se han realizado intentos para reducir las variaciones interobservador del dolor, pero son poco útiles en la clínica.
La tumefacción articular es siempre patológica, pero puede no ser fácil de objetivar debido a proliferaciones óseas como los osteófitos, deformaciones articulares, presencia de edema o en articulaciones poco accesibles. El dolor a la movilidad se utiliza como un marcador subrogado del dolor a la palpación, sobre todo en articulaciones que son difíciles de explorar como el hombro, la cadera o la columna cervical. La limitación de la movilidad y la deformidad se correlacionan entre sí y con la capacidad funcional, y se valoran como presentes o ausentes aunque no se utilizan habitualmente.
Todavía no existe consenso en cómo hay que determinar el compromiso articular en la AR. En la práctica existen dos clases de índices articulares, los binarios, en los que la existencia de dolor y tumefacción se recoge como presente o ausente y se clasifican según el número de articulaciones que incluyen (tabla 1), y los que valoran la intensidad del dolor o la extensión articular9. Entre estos últimos están el de Lansbury y Haut10, el de Thomson et al11 y el de Ritchie et al12 (tabla 1). Los índices binarios tienen mayor reproducibilidad inter e intra observador sin perder la capacidad de discriminar entre pacientes. El índice reducido de 28 articulaciones13 es capaz de detectar cambios en el dolor y la tumefacción en el tiempo de manera similar a los índices más extensos como el de 3614 o 68/66 articulaciones5, a pesar de que excluyen las articulaciones del tobillo y el pie debido a la dificultad de su exploración, y es el recomendado por la EULAR debido a su facilidad y rapidez de realización.
Índices de actividad
A principios de la década de los noventa se utilizaban muchas variables clínicas y biológicas para valorar la eficacia del tratamiento en la AR. En ese momento los clínicos eran partidarios de emplear multitud de variables para poder recoger los posibles cambios en el curso de la enfermedad; sin embargo, la interpretación de los resultados en ocasiones era difícil debido a que no todas las variables usadas reflejaban cambios similares y en la misma dirección. Una solución a este problema es el desarrollo de índices que combinen las variables individuales en una única medida15. A favor del uso de índices está el que evitan la duplicación de variables y mejoran la utilidad clínica y la sensibilidad, y en contra están su composición o, lo que es lo mismo, las variables que lo componen, el peso relativo de cada una en el resultado final y su dificultad de cálculo15.
Igual que pasa con las variables aisladas, para que un índice se acepte como alternativa al uso de múltiples variables debe ser válido16. Según la manera de agrupar y ponderar variables los índices pueden ser el resultados de criterios prospectivos (decisión de los autores según su experiencia y opinión), o retrospectivos (como resultado de análisis estadísticos en los que se identifican las variables que mejor se correlacionan con un determinado patrón oro)17.
El índice sistémico de Lansbury18 fue desarrollado en 1956 y combina rigidez, fatiga, consumo de aspirina, fuerza de prensión y velocidad de sedimentación (VSG), y a pesar de que fue el primero que se propuso, se ha usado en pocas ocasiones. El pooled index se describió en 1977 y combina una medida articular, la fuerza de prensión, la rigidez matutina, la VSG y un índice funcional19, e igual que el anterior, se ha usado en escasas ocasiones. Mallya y Mace20 propusieron un índice con 6 variables: la rigidez matutina, el dolor, la fuerza de prensión, el índice de Ritchie, la hemoglobina y la VSG. Cada variable se divide en 4 intervalos que se numeran del 1 al 4 y los resultados parciales se suman y al final se divide entre 6. Existen dos variaciones de este índice, la de Van Riel et al21, en la que se suprimen el dolor y la rigidez matutina y el índice de Ritchie se sustituye por el número de articulaciones dolorosas, y el IDA22, en el que la rigidez matutina se sustituye por el Health Assessment Questionnaire (HAQ). El índice de Stoke23 se compone de 5 variables: la sinovitis en articulaciones interfalángicas proximales, la rigidez matutina, el índice de Ritchie, la VSG y la proteína C reactiva (PCR). El índice de Scott24 incorpora 4 variables: el índice de Ritchie, la rigidez matutina, el dolor y la VSG y por último se desarrolló el Disease Activity Score (DAS)25 (tabla 2). Usando datos de un estudio prospectivo de pacientes con AR se obtuvo, por métodos estadísticos, la combinación de variables que se asociaban mejor con las situaciones de alta o baja actividad, según la opinión del médico encargado del tratamiento, siendo éstas el índice de Ritchie, el número de articulaciones tumefactas (sobre 44 articulaciones) y la VSG. Existen dos variantes de este índice (tabla 2), una primera con 4 variables que incorpora la valoración de la actividad por el paciente26, y otra que utiliza medidas articulares de 28 articulaciones27. Aunque para determinar este índice se necesita la ayuda de una calculadora (tabla 3), su uso una vez habituados es fácil y ha demostrado en diversos estudios que es más válido que otras medidas aisladas y ligeramente mejor que el resto de los índices28,29. Mediante este índice se puede diferenciar situaciones clínicas de alta o baja actividad e incluso la presencia de remisión30.
Índices de mejoría
La dificultad de interpretación de los ensayos clínicos no sólo radica en la elección de las variables que se determinan y el modo de combinarlas, sino en la importancia de los cambios obtenidos. Una diferencia estadísticamente significativa no implica necesariamente que sea clínicamente relevante. La relevancia clínica implica una diferencia apreciable en relación con la magnitud del cambio, mientras que la significación estadística indica que la hipótesis nula, que consiste en que no hay diferencias, puede ser rechazada. La distinción entre diferencias estadísticamente significativas y clínicamente relevantes es fundamental a la hora de interpretar ensayos clínicos; sin embargo, la identificación del límite que separa ambas situaciones no está clara31.
En 1990 Paulus et al describieron el desarrollo de un índice para detectar mejorías clínicamente significativas mediante el análisis de la respuesta de pacientes con AR tratados con placebo en ensayos clínicos32. Si se interpreta que la respuesta de los pacientes tratados con placebo representa la progresión natural de la enfermedad, se definió como una mejoría clínicamente significativa aquella que cumplían menos de un 5% de los pacientes, y resultó ser una mejoría de al menos un 20% en al menos 4 de las siguientes 6 variables, que se escogieron arbitrariamente: rigidez matutina, VSG, número de articulaciones dolorosas y tumefactas y valoración de la actividad por el paciente y el médico.
El índice de Paulus, aunque útil clínicamente, presenta el problema de que no se basa en las medidas recomendadas ni por la ACR ni por la EULAR para la valoración de pacientes con AR, por lo que en 1995 la ACR propuso los criterios de mejoría conocidos como ACR20. Se definió la mejoría del paciente como una mejoría igual o superior al 20% en el número de articulaciones dolorosas y tumefactas, y un 20% de mejoría en al menos tres de las restantes 5 variables: el dolor, la valoración del paciente y el médico, la capacidad funcional y un reactante de fase33.
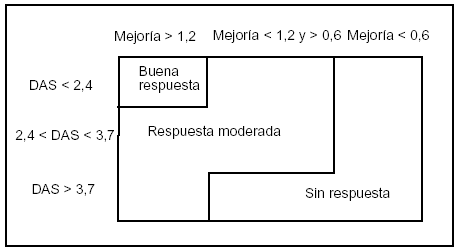
Debido a su dificultad de cálculo, los criterios de mejoría de la ACR sólo se emplean en ensayos clínicos, por lo que no son útiles en la practica clínica. En 1996, la EULAR propuso otro índice de mejoría que se basaba en el DAS y tenía la ventaja de que clasificaba la mejoría en tres situaciones: ausente, moderada y buena, dependiendo no sólo de la magnitud del cambio obtenido sino también en la actividad final (fig. 1)34. Este índice se comporta clínicamente de manera similar al de la ACR29,35.
Figura 1. Criterios de mejoría de la EULAR basados en el Disease Activity Score (DAS).
Estos dos índices se han usado utilizando los índices articulares reducidos y son igualmente válidos29,36, lo que mejora su aplicación práctica.
Conclusiones
Las enfermedades autoinmunes en general son procesos patológicos muy heterogéneos con gran variación entre su curso clínico y sus consecuencias finales. En la AR concretamente, y a pesar de todas las recomendaciones y de la existencia de suficientes índices validados para medir la actividad de la enfermedad, su uso fuera de ensayos clínicos sigue siendo escaso, por lo que es más que posible que en muchos de los pacientes con AR la enfermedad siga estando no suficientemente bien valorada y, por consiguiente, insuficientemente tratada. La construcción de índices proporciona variables convenientes y eficaces, pero se pierde el detalle de las medidas usadas para su construcción, lo que origina en algunas personas cierta resistencia a su uso. Sólo la aceptación de que esos índices predecirán las consecuencias finales de la enfermedad podrá extender su uso de manera universal.