Introducción
El TNF-α derivado de los macrófagos es reconocido como un mediador clave en numerosas funciones inmunes y fisiológicas1. La actividad biológica del TNF-α explica diversos procesos patológicos que son fundamentales en la fisiopatogenia de la artritis reumatoide (AR)2,3. Al mismo tiempo, el TNF-α desempeña un papel fundamental en la respuesta del organismo humano frente a las infecciones y en otros procesos biológicos importantes. Actualmente existen dos agentes anti-TNF-α aprobados para su utilización clínica en la AR: el infliximab y el etanercept.
Aunque el mecanismo completo de acción de estas terapias biológicas anti-TNF-α se desconoce, sabemos que disminuyen la producción de otras citocinas inflamatorias, como la IL-1 y la IL-6, disminuyen la activación endotelial y la expresión de moléculas de adhesión y la entrada de células en la sinovial reumatoide4.
Los efectos secundarios que se pueden esperar de su utilización son: un aumento en el riesgo de infecciones y el desarrollo de enfermedades autoinmunes o tumores, en relación con la inhibición de las actividades fisiológicas del TNF-α.
En la AR se ha postulado que existe un riesgo mayor de infecciones, sobre todo en casos de enfermedad avanzada y/o uso concomitante de inmunosupresores, aunque separar estas situaciones no sea fácil. En este artículo vamos a revisar los mecanismos de defensa del organismo ante la infección, la potencial predisposición de la AR a la infección, y cuál es la experiencia hasta la fecha con el uso de estas terapias biológicas.
Respuesta del organismo a las infecciones: mecanismos moleculares y celulares
El organismo humano, mediante su sistema inmune, se defiende de los agentes patógenos a través de dos mecanismos, uno inespecífico, llamado también resistencia natural o inmunidad innata, de carácter congénito; y otro específico, adquirido por infección o vacunación, denominado también inmunidad adquirida o adaptativa.
La defensa contra las infecciones incluye el reconocimiento de los microorganismos y la respuesta mediante mecanismos efectores, tanto de la inmunidad innata como de la adquirida, que controlan o eliminan a los gérmenes. Esta respuesta puede resultar lesiva también para el huésped. De hecho, en muchas infecciones, la lesión tisular y la enfermedad son debidas más a la respuesta del huésped que al microorganismo en sí5.
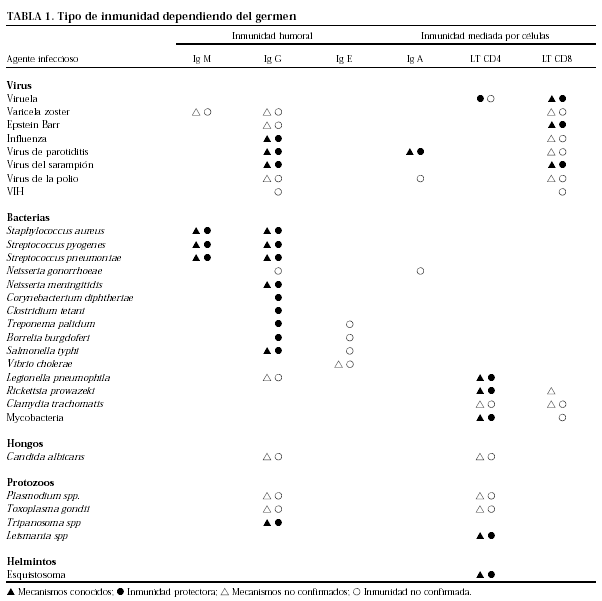
El sistema inmune responde de manera distinta y especializada frente a los diferentes tipos de agentes microbianos para combatir de la manera más eficaz posible a cada agente infeccioso (tabla 1).
Inmunidad frente a bacterias extracelulares
Los principales mecanismos de la inmunidad innata frente a bacterias extracelulares son: la activación de complemento, la inflamación y la fagocitosis (polimorfonucleares y monocitos/macrófagos)6. Sin embargo, la respuesta protectora principal corresponde a la inmunidad adquirida y su mecanismo es a través de la inmunidad humoral (anticuerpos), cuya función es eliminar a los agentes microbianos y a sus toxinas. Los mecanismos efectores de los anticuerpos incluyen la neutralización por opsonización y la fagocitosis. Las principales consecuencias patológicas de la respuesta del huésped a las bacterias extracelulares son la inflamación y el shock séptico, mediados por citocinas producidas por los macrófagos activados5,6.
El TNF-α desempeña un papel fundamental en ambos procesos. Es el principal mediador de la respuesta inflamatoria aguda frente a bacterias gramnegativas. Su función fisiológica más importante es estimular la migración y reclutamiento de neutrófilos y monocitos hacia el foco de infección, mediante la estimulación de moléculas de adhesión y liberación de quimiocinas y la activación de estas células5.
El TNF-α actúa sobre el hipotálamo produciendo fiebre (mecanismo de defensa frente a organismos microbianos que se desarrollan mejor a temperaturas más bajas), y estimula la síntesis de ciertas proteínas (amiloide A sérica, PCR y fibrinógeno) que constituyen la respuesta de fase aguda. La producción prolongada de TNF-α produce caquexia5.
En infecciones graves, el TNF-α se produce en grandes cantidades y provoca alteraciones clínicas y patológicas sistémicas. El papel del TNF-α en el shock séptico es fundamental. La concentración en suero del TNF-α es predictivo del resultado de las infecciones graves por gérmenes gramnegativos7. El shock séptico se puede reproducir en animales de experimentación mediante la administración de lipopolisacárido (LPS) bacteriano o TNF-α8. La administración de sustancias inhibidoras del TNF-α puede prevenir la mortalidad del shock séptico en modelos animales9, aunque los ensayos clínicos con anticuerpos anti-TNF-α o receptores solubles no han mostrado beneficios en humanos10.
Inmunidad frente a bacterias intracelulares
Las bacterias intracelulares facultativas tienen la capacidad de sobrevivir y multiplicarse dentro de los fagocitos. La respuesta de la inmunidad innata frente a bacterias intracelulares consiste fundamentalmente en la inflamación, y en la acción de fagocitos residentes y células NK, que limitan durante un cierto tiempo el crecimiento bacteriano, aunque normalmente no son capaces de erradicar el germen. Su eliminación requiere mecanismos de inmunidad mediada por células (inmunidad celular). Las respuestas no específicas de la inmunidad innata son necesarias para que se inicie la respuesta humoral11. Las citocinas liberadas durante la fase temprana de la infección influencian el tipo de diferenciación de los linfocitos T CD4+.
La inmunidad celular actúa mediante dos mecanismos: activación de macrófagos por células T (CD4+) e IFN-Υ, que producen la fagocitosis bacteriana por los macrófagos y la lisis de las células infectadas por los lifocitos T citolíticos (CD8+). Tanto las células T CD4+ como las CD8+ responden a antígenos proteicos microbianos que son presentados como péptidos a moléculas de clase I y II del sistema mayor de histocompatibilidad (MHC)6.
Las células T activadas expresan CD4+ y secretan IFN-Υ, los cuales estimulan la actividad de los macrófagos induciendo la liberación de diversas sustancias microbicidas: intermediarios del oxígeno reactivo, óxido nítrico y enzimas lisosómicas5.
Si las bacterias intracelulares escapan a la acción de los macrófagos, las células CD8+ intervienen lisando a las células infectadas y erradicando la infección. La activación de los macrófagos que ocurre en respuesta a las infecciones bacterianas intracelulares puede causar también lesión tisular. Dado que ciertas bacterias intracelulares han evolucionado para resistir su lisis dentro de los macrófagos, pueden sobrevivir durante extensos períodos de tiempo, causando estimulación antigénica y activación crónica de células T y macrófagos que dan como resultado la formación de granulomas. Este tipo de respuesta inflamatoria sirve para localizar y prevenir la propagación microbiana, pero también es la causa de lesión, necrosis tisular, y fibrosis5.
El concepto de que la actividad inmunitaria protectora contra las infecciones puede coexistir con los efectos patológicos colaterales es importante a la hora de valorar estrategias que modifiquen el balance entre las acciones del germen y la respuesta del huésped.
El TNF-α tiene un papel destacado en la respuesta a las infecciones por bacterias intracelulares interveniendo en múltiples mecanismos: migración y atracción de células inflamatorias al foco infeccioso en la respuesta inflamatoria, estimulación de los macrófagos para formar granulomas y control de la liberación de sustancias efectoras por los macrófagos (óxido nítrico). Estas acciones han sido puestas de relieve en estudios experimentales con numerosos gérmenes intracelulares facultativos: salmonela12,13, legionella14,15, leishmania16, tripanosoma17 y micobacterias.
Infecciones por micobacterias. Papel del TNF-α
Los mecanismos inmunitarios y la patogénesis de la tuberculosis han sido estudiados con cierto detalle. Se ha propuesto un modelo en cuatro fases18:
Fase 1 (transmisión). Los bacilos tuberculosos se transmiten a partir de personas enfermas por un mecanismo de aerosol. En el pulmón son fagocitados por macrófagos alveolares residentes no-inmunes.
Fase 2 (proliferación). El bacilo sobrevive dentro de los macrófagos y prolifera intracelularmente. Se segregan quimiocinas que atraen nuevas células: células NK y linfocitos T. Los bacilos continúan proliferando, matando células del huésped y diseminándose localmente hacia los nódulos linfáticos hiliares y sistémicamente.
Fase 3 (evolución de la respuesta inmune del huésped). Los macrófagos presentan los antígenos tuberculosos a células T (CD4) que liberan citocinas (INF-γ y TNF-α). Se produce una respuesta inmunitaria celular. La inmunidad humoral parece que desempeña un papel secundario. Las citocinas reclutan y activan a nuevos mácrófagos, que forman pequeños granulomas constituidos por células epiteliodes y células gigantes.
Esta respuesta destruye a los bacilos o limita su proliferación, dando como resultado una involución de la lesión pulmonar primaria y de las localizaciones extrapulmonares. Sin embargo, en algunos granulomas, el bacilo puede mantenerse vivo dentro de los macrófagos durante toda la vida, produciéndose un equilibrio inestable entre la respuesta inmune del huésped y la proliferación bacilar.
Fase 4 (reactivación). Los focos pulmonares o sistémicos latentes se reactivan provocando liquefacción y formación de cavidades o diseminándose (tuberculosis miliar). Esto ocurre en estados de inmunodepresión adquiridos, o a través de otras infecciones (p. ej. el sida), o por tratamientos inmunodepresores (quimioterapia, corticoides). En esta fase los bacilos pueden sobrevivir en un medio extracelular multiplicándose exponencialmente19.
Los macrófagos infectados por el bacilo tuberculoso elaboran y liberan TNF-α. El lipoarabinomannan, constituyente de la pared celular de M. tuberculosis, es un lipopolisacárido que tiene propiedades similares al lipopolisacárido de las bacterias gramnegativas en términos de inducción de liberación de TNF-α20.
La importancia del TNF-α en la respuesta inmune efectiva contra el bacilo tuberculoso se ha demostrado en diversos estudios experimentales in vitro21, y con animales.
En modelos murinos, el tratamiento con anticuerpos anti-TNF-α o por deficiencia génetica (líneas knockout) de receptores del TNF, bloquea la formación de granulomas y la actividad bactericida de los macrófagos mediada por óxido nítrico22,23 provocando un aumento de la vulnerabilidad a la infección por M. Tuberculosis24.
La inhibición del TNF-α (utilizando adenovirus recombinantes productores de receptores del TNF) produce un empeoramiento sustancial tanto de la tuberculosis aguda como crónica en ratones25.
En modelos murinos de tuberculosis persistente, la inhibición del TNF-α produce una reactivación fatal de la tuberculosis26, por un mecanismo relacionado con la pérdida de migración de células inflamatorias y de la actividad microbicida del óxido nítrico27.
Los efectos inmunopatológicos del TNF-α son dosis-dependientes28, y se ha comprobado un empeoramiento clínico en humanos tras el inicio del tratamiento específico coincidiendo con una elevación del TNF-α en suero29.
En humanos, en otro estudio se encontraron valores elevados de TNF-α en el BAL de pacientes de sida con infección tuberculosa, en los lóbulos infectados pero no en lóbulos afectados por tuberculosis miliar, ni en los voluntarios sanos. Particularmente interesante es su observación de que la presencia de niveles muy altos en pacientes con cavitación, es consistente con la noción de la lesividad del TNF-α en grandes cantidades, mientras que su ausencia en los lóbulos de pacientes con tuberculosis miliar sugeriría la existencia de una respuesta inmune deprimida.
La artritis reumatoide como factor predisponente ante la infección
Los pacientes con artritis reumatoide presentan infecciones con una frecuencia y localización parecidas a la población general: infecciones genitourinarias, respiratorias y cutáneas. Sin embargo, suelen ocurrir con mayor frecuencia en enfermedad más grave, en estadios avanzados de la enfermedad (clase funcional III y IV) y se acompañan de mayor gravedad y aumento de mortalidad31-33.
No está establecido que la AR por sí misma aumente la incidencia de enfermedades infecciosas. En estudios controlados en pacientes con AR no se observa un aumento significativo del riesgo de infecciones, en comparación con pacientes con artrosis34,35.
El uso generalizado de fármacos antiinflamatorios e inductores de remisión dificulta el conocimiento del curso natural de la enfermedad y de la incidencia de infecciones, y su uso continuado se asocia a una aumento de infecciones.
Corticoides
El riesgo de infección depende de las dosis y duración del tratamiento con corticoides. Dosis diarias ¾ 10 mg de prednisona, o acumuladas menores de 700 mg no parecen aumentar el riesgo de infección36,37.
A dosis más altas los corticoides poseen actividad antiinflamatoria e inmunosupresora debido a los profundos cambios que provocan en la función de neutrófilos, monocitos y linfocitos.
Los corticoides producen una alteración cualitativa en la función fagocítica y alteran la inmunidad mediada por células (disminuyen la actividad bactericida de los monocitos, alteran la quimiotaxis y disminuyen la producción de TNF-α y de IL-138 provocando un aumento de infecciones por gérmenes intracelulares facultativos, listeria, salmonella, nocardia, histoplasma, pneumocystis, toxoplasma, citomegalovirus, y varicela zoster36,38.
A dosis altas, también son capaces de inhibir la producción de inmunoglobulinas por los linfocitos B, aumentando las infecciones por estafilococos, estreptococos y haemofilus39.
Fármacos inductores de remisión
Los fármacos inductores de remisión se asocian a un mayor riesgo de infecciones. Éste es más elevado con tratamientos inmunosupresores como la ciclofosfamida40, moderado con metotrexato y más bajo con el resto: hidroxiclorocina, oro intramuscular, D-penicilamina, oro oral y azatioprina41.
En los pacientes con AR tratados fármacos inductores de remisión se pueden producir infecciones oportunistas: neumonía por Pneumocistis carinii, infección por Histoplasma capsulatum, Cryptococus neoformans, Nocardia asteroides, Nocardia brasiliensis, Listeria monocyogenes, aspergilosis, neumonía por citomegalovirus, hepatitis por herpes simple e infecciones fúngicas sistémicas42.
Las infecciones oportunistas pueden ocurrir en presencia o ausencia de tratamiento con corticoides. El herpes simple y el herpes zoster también ocurren con mayor frecuencia en pacientes con AR que reciben tratamiento de fondo, especialmente cuando se asocia a dosis medianas y altas de corticoides. Ocurren generalmente en forma metamérica y raramente de forma diseminada42.
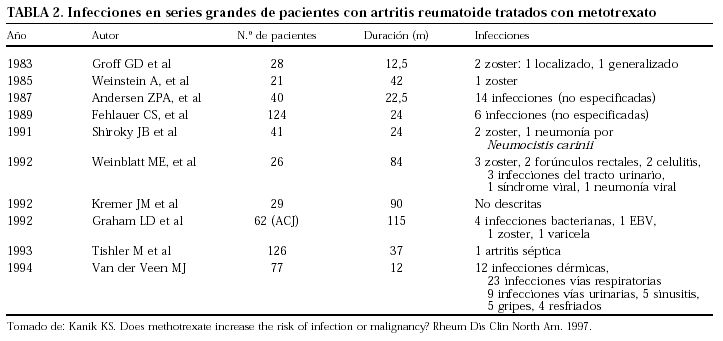
En el caso del metotrexato a dosis bajas existen numerosos trabajos, en amplias series de pacientes con AR, en los que se describe la incidencia de infecciones43 (tabla 2).
En relación con la tuberculosis (TB) hasta este momento, dada la baja incidencia en EE.UU. y algunos países de Europa, había pocas comunicaciones y en su mayor parte se atribuían a los tratamientos: dosis altas de corticoides36, ciclofosfamida40 y casos esporádicos en relación con fármacos inductores de remisión44,45.
Datos recientes de vigilancia poscomercialización de la FDA (Federal Drug Administration)46 han revelado diversos casos de tuberculosis, la mayor parte reactivaciones y en pacientes europeos, entre los pacientes tratados con infliximab.
En relación con la predisposición de la AR a sufrir TB existen trabajos contradictorios. Un estudio reciente realizado por Carmona et al47 presenta un aumento de la incidencia de TB en pacientes con AR. Antes del diagnóstico de AR la densidad de incidencia es de 33/100.000 pacientes/año, y después del diagnóstico ésta aumenta a 115/100.000 pacientes/año. La incidencia anual en la población española la refieren de 27/100.000 personas/año, por lo que los autores calculan que el riesgo relativo de la TB antes del diagnóstico de AR es de 1,2 y después del diagnóstico aumenta a 4,26.
Por otra parte, y a través de los resultados del PMIT (Proyecto Multicéntrico de Investigación de TB)48, la incidencia global de TB en España sería de 38,51/100.000 habitantes, con variaciones muy importantes dependiendo de la comunidad autónoma (16,22/100.000 habitantes en Castilla-La Mancha a 70,75/100.000 habitantes en Galicia). Estos resultados estarían en concordancia con los obtenidos en 1995 por el TIR (Grupo de Tuberculosis e Infecciones Respiratorias)49. De ser así, la incidencia de TB no estaría aumentada en la población que posteriormente es diagnosticada de AR.
En cuanto a la incidencia de TB en pacientes afectados de AR, Vadillo et al50, la cifran en un 3,3/1.000 personas/año, pero que ésta varía en función del fármaco inductor de remisión utilizado, así, la incidencia de TB en los pacientes tratados con MTX es de 2,03/1.000 personas/año, de 43,5/1.000 personas/año con azatioprina, 156/1.000 personas-año con ciclofosfamida y 49,2/1.000 personas/año con tratamiento con anti-TNF.
Además, estudian las formas de presentación de la TB y encuentran también una mayor afectación extrapulmonar (14 extrapulmonares/1 pulmonar).
Por otro lado, estudios realizados en EE.UU. por Wolfe et al51 no muestran un aumento de la incidencia de TB en los pacientes con AR, hallando una incidencia anual en los pacientes con AR del 6,2/100.000 pacientes, siendo de 6,8/100.000 en la población general.
Parece pues probable que la incidencia de TB en la AR pueda estar relacionada con la gravedad de la propia enfermedad y más aún con las terapias utilizadas. También, es posible que el mayor control sobre los efectos adversos, a los que nos han obligado las "terapias agresivas", haya dado lugar a una mayor comunicación de casos. De todas maneras, sólo por ello ya estaría justificado el estricto control de estos pacientes.
Frecuencia de infecciones con la terapia anti-TNF
El infliximab es un anticuerpo monoclonal anti-TNF-α quimérico de ratón/humano. El estudio ATTRACT, que comparó el metotrexato con el infliximab más metotrexato, a las 54 semanas de tratamiento no mostró diferencias entre el número de infecciones tratadas con antibióticos, en ambos grupos (44% frente al 35%), ni tampoco existió diferencia en el número de infecciones graves, 6% frente al 8% del grupo control con metotrexato (infecciones bacterianas, bronquitis, celulitis, infecciones fúngicas, herpes zoster, peritonitis, neumonía, pielonefritis, infecciones del tracto urinario, sepsis y tuberculosis)52.
Kavanaugh et al53, en un programa de seguimiento a tres años, en casi 2.000 pacientes con AR o enfermedad de Crohn, en tratamiento con infliximab en ensayos clínicos, no encuentran diferencias en cuanto al número de infecciones graves, siendo el 7% de los pacientes que recibieron placebo (13/192) y el 4% (83/1897) con infliximab. Tampoco encuentra diferencias entre el número de defunciones (2% placebo frente al 1%). Estos resultados son similares a los presentados con anterioridad por el mismo autor sobre 770 pacientes tratados con infliximab54.
Antoni et al55, en una serie de 263 pacientes con AR activa, de 50 centros de Alemania, que fueron tratados con infliximab a dosis de 3 mg/kg más metotrexato (≥ 15 mg/semana), durante 30 semanas, observaron 6 casos de infecciones severas (2,28%) que se resolvieron con tratamiento antibiótico y no se detectó ningún caso de tuberculosis.
En cambio, Maksymowych56, en una serie de 95 pacientes afectos de AR activa en tratamiento con 3 mg/kg de infliximab presentó un 11,6% de infecciones consideradas severas como neumonía, listeriosis sistemica y celulitis grave.
En España se lleva a cabo un registro estatal de pacientes tratados con infliximab y etanercept (BIOBADASER)57.
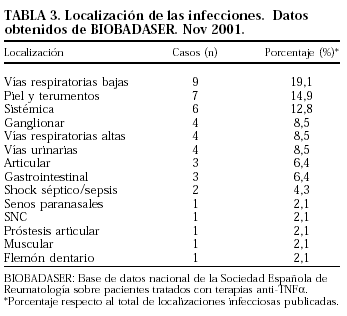
Hasta el día 10 de noviembre del 2001 había un total de 1029 pacientes registrados (907 con infliximab y 122 con etanercept). Se habían comunicado un total de 132 efectos adversos, de los cuales 47 eran infecciones (4,56%), 3 en pacientes con etanercept y 44 en pacientes con infliximab. En las tablas 3 y 4, podemos ver la localización de estas infecciones y los gérmenes patógenos en orden de frecuencia. Próximamente se espera una actualización de estos datos en la RER.
Como se puede observar, la tuberculosis (TB) ha visto aumentada su incidencia en los pacientes con AR, en tratamiento con infliximab, en nuestro entorno. Maini, en el estudio fase III solo hace referencia a un caso de tuberculosis58, pero con datos hasta el 29 de mayo del 2001, Keane et al muestran que en un total de 147.000 pacientes que están en tratamiento con infliximab, se han detectado 70 casos de TB59; la mayoría de estos casos en Europa. En la web de la Agencia Española del Medicamento aparecen 23 casos de TB en España asociados al tratamiento con infliximab60.
El 71% de los casos de TB mundial reportados, este apareció en pacientes con artritis reumatoide y el 96% de las infecciones aparecieron en las 6 primeras infusiones de infliximab. El 31% presentó afectación pulmonar y el 56% presentó manifestaciones clínicas extrapulmonares como enfermedad ganglionar (11 casos), peritoneal (4), pleural (2), meníngea (1), localización paravertebral (1), ósea (1), genital (1) y en vejiga urinaria (1). De los 70 casos, se han declarado 11 muertes. En los casos en que existía una radiografía previa y la prueba de la tuberculina, pocas veces resultó sugestiva de TB.
Teniendo en cuenta estos datos, y que la incidencia de tuberculosis en EEUU en los pacientes con AR y tratamiento con infliximab es de 24.4/ 100.000 pacientes, y que la incidencia de TB en pacientes con AR es de 6.2/100.000 ésta se ve aumentada claramente en los pacientes en tratamiento con infliximab59,61.
En una comunicación urgente de Centocor62, informan de que hasta mediados del 2001, se han comunicado aproximadamente 130 casos de TB activa , incluida TB miliar y TB de localización extrapulmonar en pacientes tratados con infliximab. Algunos de estos casos tuvieron un desenlace fatal. Este aumento de riesgo de padecer TB en los pacientes en tratamiento con infliximab, ha obligado a los médicos a extremar las medidas de seguridad antes de iniciar el tratamiento, tal y como queda recogido en la nota informativa de la Agencia Española del Medicamento (véase ficha técnica al final de la revista).
Otras de las infecciones que han aparecido asociadas con el tratamiento con infliximab son las infecciones por hongos. Keenan63 refiere que hasta el 31 de marzo de 2001 en un total de 147.000 pacientes en tratamiento con infliximab se han diagnosticado un total de 34 infecciones por hongos, 10 casos de histoplasmosis, 9 de neumonía por Pneumocystis carinii, 6 casos de aspergilosis, 6 candidiasis sistémicas y 3 casos de coccidioidomicosis (pulmonar, diseminada y articular).
En la misma comunicación de Centocor62, se comunican un total de 202 fallecimientos, de los que aproximadamente un 50% está asociado con las infecciones.
El etanercept es una molécula de ingeniería genética anti-TNF-α idéntica a su receptor soluble, indicada para el tratamiento de la AR y de la artritis crónica juvenil, aunque su uso en Europa es más limitado que el infliximab.
Moreland et al64, en un estudio de seguimiento a largo plazo de 628 pacientes con AR (media de 25 meses), no observa ningún incremento de infecciones graves (aunque 43 pacientes requirieron hospitalización o antibióticos endovenosos). No observó ninguna infección oportunista. Los resultados confirman estudios previos, controlados con placebo, en los que no hubo diferencias en el número de infecciones entre el placebo y etanercept, excepto en la infecciones de vías respiratorias altas que fueron más frecuentes en los pacientes con etanercept (29%) que en el grupo control (16%) y en los que las infecciones graves aparecieron sólo en el 0,9% de los pacientes tratados con etanercept frente al 1,3% en placebo.
Belostocki et al65, en un reciente estudio observaron un aumento de infecciones con etanercept. La mayoría de infecciones fueron respiratorias y banales. Sólo 3 infecciones fueron graves y requirieron ingreso hospitalario y tratamiento con antibiótico. No se relacionó el incremento de infecciones con el uso de corticoides o con otras enfermedades concomitantes. Tampoco existió un aumento significativo de las infecciones herpéticas ni ningún caso de tuberculosis.
Recientemente se ha comunicado un caso de fascitis necrotizante y sepsis por Streptococcus pneumaniae en un paciente con artritis reumatoide en tratamiento con etanercept con desenlace fatal66.
El etanercept es el tratamiento anti TNF-α más utilizado en los niños con artritis reumatoide juvenil. Brunner et al67 mostraron que a corto plazo, el etanercept era un tratamiento que presentaba un perfil de seguridad aceptable para este tipo de pacientes. En un estudio reciente del mismo grupo se objetivo que en 55 niños seguidos durante una media de 12 meses (1-27 meses) 5 infecciones graves que obligaron a hospitalización, 2 casos de herpes, 1 meningitis viral y un absceso en un nódulo reumatoide. Aparecieron un 30% de infecciones respiratorias no complicadas
En cuanto a la TB se han descrito 9 casos de 103.000 pacientes en tratamiento con etanercept, hasta abril de 2001 (incluyendo los estudios americanos y europeos, los registros europeos y el control poscomercialización), y 19 pacientes con historia de TB y 7 con la prueba de la tuberculina positiva fueron incluidos en ensayos clínicos con etanercept, y no se ha desarrollado ningún caso de reactivación de tuberculosis en 22 meses de seguimiento68.
Esta diferencia en la incidencia de TB con los dos agentes biológicos puede deberse a las diferencias en la forma por las que estas terapias inhiben el TNF y a la diferente utilización geográfica58, siendo más utilizado el infliximab en Europa, donde la incidencia de TB es mayor.
En conclusión, el TNF-α desempeña un importante papel tanto en la inmunidad innata como en la adquirida. Es el principal mediador de la respuesta inflamatoria aguda frente a bacterias gramnegativas y en la respuesta a las infecciones por bacterias intracelulares a través de distintos mecanismos. En las infecciones por micobacterias la importancia del TNF-α en la respuesta inmune efectiva se ha demostrado en diversos estudios experimentales. La inhibición del TNF-α bloquea la formación de granulomas y la actividad bactericida de los macrófagos, aumentando la vulnerabilidad a la infección por M. tuberculosis. Los efectos inmunopatológicos del TNF-α son dosis dependientes comprobándose un empeoramiento clínico en humanos, tras el inicio del tratamiento específico, coincidiendo con una elevación del TNF.
No está bien establecido que los pacientes con AR tengan un riesgo global de sufrir un mayor número de infecciones debido a la enfermedad por sí misma. Sin embargo, la AR presenta un incremento de infecciones graves y un subsiguiente aumento de la mortalidad debido fundamentalmente a los tratamientos utilizados. Los corticoides disminuyen la producción de TNF-( e IL-1 y los fármacos inductores de remisión facilitan las infecciones, en mayor o menor grado, en función del fármaco.
El infliximab parece aumentar la incidencia de infecciones y su utilización estar asociada con un aumento del riesgo de padecer tuberculosis. El mejor conocimiento de sus vías de actuación y de las potenciales poblaciones de riesgo puede ayudarnos en el futuro.