Antes de pasar a exponer directamente el tratamiento de estas enfermedades, creo interesante, para una mejor comprensión de la organización de este artículo, situar al lector en el espectro clínico en el que nos moveremos y describir algunas particularidades clínicas y pronósticas del grupo de enfermedades que vamos a tratar.
Espectro clínico de la familia de las espondiloartropatías
La familia de las espondiloartropatías constituye un grupo heterogéneo de enfermedades que comparten numerosas características clínicas y etiopatogénicas. Los pacientes de este grupo de enfermedades suelen presentar una oligoartritis seronegativa de predominio en extremidades inferiores, con o sin sintomatología pelvirraquídea asociada. La entesitis es una característica clínica de todo el grupo y, para diversos autores, el origen de la posterior inflamación articular1. Desde el punto de vista etiopatogénico, todas estas enfermedades muestran una fuerte asociación al antígeno de histocompatibilidad HLA-B27, así como una frecuente participación de la barrera mucosa intestinal, posiblemente interviniendo en la propia fisiopatología de la enfermedad al actuar como puerta de entrada de diversos antígenos responsables del proceso inflamatorio. A pesar de todas estas similitudes, las diferencias clínicas entre los pacientes incluidos en este grupo de enfermedades son evidentes y van desde la existencia de cuadros clínicos de oligo-poliartritis periféricas hasta cuadros exclusivamente axiales. Esta diversidad fenotípica comporta problemas no sólo en la valoración de la actividad inflamatoria, sino incluso en la detección y posible clasificación de los pacientes. En este sentido, recientemente se han establecido unas normas mínimas para el seguimiento y valoración de estas enfermedades2 y se han elaborado unos criterios generales de clasificación3,4. Siguiendo estos criterios, en la familia de las espondiloartropatías se incluirían las siguientes enfermedades: la espondilartritis anquilosante (EA), la artritis psoriásica (AP), la artritis asociada a enfermedad inflamatoria intestinal (Crohn y colitis ulcerosa), las artritis reactivas (AR), las espondilartitis indiferenciadas (EI) y la espondilartitis juvenil, si bien es necesario realizar algunas matizaciones en las AP y AR. La AP es una enfermedad pleomórfica con una gran variabilidad fenotípica; en este sentido, sólo las formas axiales y algunas formas oligoarticulares cumplirían los criterios de clasificación de las espondiloartropatías. En cuanto a las AR, sólo las asociadas al HLA-B27 formarían parte de la familia de las espondiloartropatías. Cabe destacar que la asociación al HLA-B27 no es del 100%, pero todas las que constituyen este subgrupo presentan unas características clínicas comunes que permiten clasificarlas en el grupo de las espondiloartropatías y las diferencian de otros tipos de AR (tabla 1).
Finalmente, las enfermedades que se incluyen en esta familia presentan, de forma frecuente y característica, una serie de manifestaciones extraarticulares entre las que deberíamos destacar las intestinales, las oculares, las cardiovasculares y las entesíticas. Además, y como secuelas clínicas en los procesos crónicos, se pueden hallar diversas manifestaciones pulmonares, renales y la presencia de osteoporosis y amiloidosis secundarias.
Evolución clínica y factores pronósticos
La evolución clínica de estas enfermedades es muy variable; mientras que en algunas de ellas, como la EA y la AP, el paso a la cronicidad es una norma, en otras sólo una pequeña proporción de pacientes desarrollará un reumatismo crónico. En este sentido, en las AR, dependiendo del agente infeccioso desencadenante y del tiempo de seguimiento, el paso a la cronicidad oscila aproximadamente entre un 4-20%5,6, mientras que en las oligoartritis indiferenciadas que se incluyen en el grupo de las EI entre un 30 y un 40% pueden desarrollar un proceso crónico7. Aunque no se conocen con exactitud los mecanismos implicados en la evolución hacia la cronicidad, sí se han identificado diversos factores de mal pronóstico en estas enfermedades. Así, una historia familiar de espondiloartropatía, la presencia del HLA-B27 positivo, el sexo masculino, el inicio de la enfermedad en edad juvenil (menor de 16 años) y la presencia de coxitis son, entre otros, factores de mal pronóstico clínico. El conocimiento de los factores pronósticos y los mecanismos implicados en el desarrollo de la cronicidad y severidad de estas enfermedades es esencial a la hora de establecer, con la mayor diligencia posible, el tratamiento más adecuado en cada caso. Por tanto, estudios como el de Amor et al8 son de gran importancia.
Tratamiento
En este artículo discutiremos las distintas opciones terapéuticas de las espondiloartropatías en sus fases aguda y crónica, así como las diferentes manifestaciones extraarticulares y las principales complicaciones. Sin embargo, es necesario especificar que no se hablará de la AP, ni de los nuevos tratamientos dirigidos contra el TNF-α, de la misma manera que sólo se citará de forma sucinta el tratamiento con antiinflamatorios no esteroides (AINE), ya que todos estos temas se desarrollan ampliamente en otros artículos de este monográfico.
Tratamiento de las espondiloartropatías en las fases agudas
El tratamiento en esta fase se sustenta en reducir el dolor y la inflamación y evitar, además, el sobreuso articular. Los AINE constituyen el pilar fundamental del tratamiento farmacológico. En la bibliografía existen unas 600 referencias sobre el tratamiento con AINE en las espondiloartropatías, que incluyen numerosos estudios controlados, y existe, además, un metaanálisis9; todo ello configura una clara evidencia científica de la utilidad de estos fármacos en el tratamiento de las manifestaciones clínicas de estas enfermedades en esta fase. Suelen utilizarse los de gran potencia antiinflamatoria y a altas dosis, que muestran una respuesta buena o aceptable en el 70-80% de los casos, especialmente en las formas de predominio axial. Existe una gran variedad de AINE, y aunque la indometacina (al igual que sucede en otros reumatismos crónicos) sigue siendo el AINE de referencia, usados a dosis equipotenciales ninguno de ellos ha mostrado en estudios controlados ser significativamente mejor que los otros. En los procesos con predominio de artritis periférica suelen usarse AINE de vida media corta, mientras que en las formas axiales se prefiere los de vida media algo más larga, aunque no existe ninguna norma establecida al respecto. El uso de AINE debe ser cuidadosamente controlado en aquellos pacientes con artritis asociada a enfermedad inflamatoria intestinal, por la posibilidad de que éstos desencadenen o agraven un brote intestinal de la enfermedad de base. En nuestra experiencia en estos casos la sustitución del AINE por bajas dosis de corticoides y su asociación a sulfasalacina (2-3 g/día, repartidos en dos tomas), consigue muy buenos resultados.
El uso de corticoides suele limitarse a los corticoides de depósito administrados de forma intraarticular (acetato de triamcinolona). Dado que en muchos casos estas enfermedades suelen expresarse como oligoartritis y afectan a las grandes y accesibles articulaciones de las extremidades inferiores (rodillas, tobillos, caderas), este tratamiento puede ser un arma fundamental para el control de la enfermedad en esta fase. La administración de corticoides sistémicos (≤ 10 mg/día de prednisona base) es poco frecuente, y suele limitarse en esta fase a cuadros de grave poliartritis periférica.
La aplicación de frío local en las articulaciones inflamadas y el reposo articular pueden ser buenas medidas coadyuvantes del tratamiento farmacológico descrito. Como en estas enfermedades suelen afectarse preferentemente las articulaciones de las extremidades inferiores, en ocasiones es necesario sugerir cortos períodos de reposo en cama y/o facilitar al paciente muletas para el movimiento.
Finalmente, una buena información médica sobre el pronóstico y las posibilidades terapéuticas del proceso que padece el paciente es importante para reducir su ansiedad y la de su entorno, que tanto dificultan el tratamiento de cualquier reumatismo. Esta información es especialmente necesaria en aquellos procesos cuya evolución a la cronicidad sólo se da en algunas ocasiones.
Tratamiento de las espondiloartropatías en las fases crónicas
Una vez se ha cronificado el proceso, el tratamiento farmacológico de base aplicado en la fase anterior debe ampliarse con la introducción, entre otros, de los llamados fármacos modificadores de enfermedad (FAME) y complementarse con un intenso programa de fisioterapia y educación sanitaria, reservando las indicaciones quirúrgicas para algunas situaciones muy concretas.
1. Tratamiento farmacológico. El tratamiento con AINE sigue constituyendo la base terapéutica sobre la cual se añaden los restantes fármacos en más del 70% de estos pacientes. En la fase crónica se acostumbra a usar AINE de vida media intermedia o larga para facilitar su prescripción durante largos períodos de tiempo. En cuanto a las particularidades del tratamiento, debemos decir que son las mismas que ya se han comentado en la fase aguda. Destacar sólo que en esta fase debe ponerse especial atención a las posibles complicaciones asociadas al uso crónico de estos fármacos, complicaciones que se comentan en otros artículos del monográfico y que obligan al médico a controlar de cerca estos tratamientos.
1.1. Fármacos modificadores de enfermedad (FAME). El nombre parece excesivamente pomposo para la eficacia que han demostrado la mayoría de estos fármacos en el tratamiento de las espondiloartropatías. En realidad, no existen estudios con suficiente número de pacientes y con un seguimiento suficientemente largo para demostrar que estos fármacos son capaces de modificar significativamente el curso evolutivo de la enfermedad y con ello prevenir sus secuelas a largo plazo. Un nombre más apropiado podría ser el de fármacos de segunda línea, si tenemos en cuenta que se utilizan para tratar el dolor y la inflamación en aquellos pacientes en que el tratamiento de base con AINE se ha mostrado ineficaz. Dentro de este grupo de fármacos se encuentran: la sulfasalacina, el metotrexato, la D-penicilamina, la ciclosporina A (CsA), la crisoterapia, los antimaláricos de síntesis y el levamisole. De todos ellos, sólo para la sulfasalacina y el metotrexato existen suficientes evidencias científicas de su utilidad terapéutica en las espondiloartropatías.
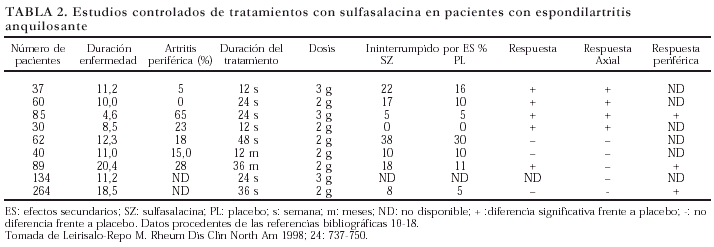
Sulfasalacina. La sulfasalacina es el fármaco que más se ha utilizado en el tratamiento de las espondiloartropatías. Revisando la bibliografía encontramos unas 98 referencias, diez de ellas10-19 corresponden a ensayos clínicos controlados (tabla 2); existe también un metaanálisis9. La mayoría de estudios son de corta duración (12-36 semanas) y se han llevado a cabo en pacientes con EA. Los resultados obtenidos en estos estudios muestran globalmente que la sulfasalacina es eficaz en el tratamiento de estos pacientes y en especial de sus manifestaciones articulares periféricas, cuestionándose su eficacia en las formas axiales puras10,14,19,20. La eficacia terapéutica suele observarse a los 2 meses de iniciado el tratamiento y persiste durante todo el período de tratamiento. El fármaco parece especialmente eficaz desde el punto de vista clínico y biológico (reducción de la VSG) cuando se administra de forma temprana y en pacientes con brotes importantes de actividad de la enfermedad. La mayoría de los estudios ponen de manifiesto que la administración de sulfasalacina en pacientes con EA muy evolucionada no parece reportar ningún beneficio terapéutico. El número de estudios dirigidos a valorar la eficacia de la sulfasalacina en otras enfermedades de la familia de las espondiloartropatías (con la excepción de la AP) es escaso; sin embargo, los resultados obtenidos en estos estudios sugieren que este fármaco es también eficaz en el tratamiento de las manifestaciones articulares periféricas de estos pacientes14,19,21. La sulfasalacina es un fármaco especialmente efectivo en los pacientes con artritis asociada a enfermedad inflamatoria intestinal (Crohn, colitis ulcerosa), tanto en el control de las manifestaciones intestinales como las articulares, aunque al igual que sucede en las otras espondiloartropatías, sólo las fórmulas farmacológicas que contienen el componente sulfamídico son eficaces en el control de las manifestaciones articulares22. La sulfasalacina suele administrarse a dosis de 2-3 g/día. Se trata de un fármaco en general bien tolerado, aunque casi un 40% de los pacientes debe abandonarlo por sus efectos secundarios, especialmente intolerancia gastrointestinal. En este sentido, las tabletas con recubrimiento de protección entérica se toleran mucho mejor, pero desgraciadamente no existen en nuestro país. Las hemopatías constituyen los efectos secundarios más graves asociados al uso de sulfasalacina, aunque afortunadamente son poco frecuentes. Suelen darse durante los tres primeros meses de tratamiento, por lo que se aconseja un control analítico estricto durante este período (cada 2-4 semanas). Finalmente, recordar que como cualquier otra sulfona, en las poblaciones con alta prevalencia del déficit de glucosa-6-fosfato deshidrogenasa, la determinación de ésta para evitar hemólisis graves es obligada antes de iniciar el tratamiento con sulfasalacina.
Metatotrexato. El metotrexato constituye el fármaco de elección en el tratamiento de la poliartritis psoriásica; sin embargo, existen pocos estudios que valoren su utilidad en el resto de enfermedades que componen la familia de las espondiloartropatías. Revisando exhaustivamente la bibliografía encontramos unas 40 referencias, relacionadas en su mayoría con el tratamiento de las formas periféricas de la EA, aunque en algunas de ellas (alrededor de 10) se habla o se incluyen, además, enfermos con otras espondiloartropatías (AR y EI). Entre todas estas referencias, no se encuentra ningún estudio controlado, y sólo tres de ellos cumplen los requisitos para ser considerados ensayos terapéuticos abiertos no controlados (tabla 3)23-25. Estos estudios sugieren que el metotrexato puede ser eficaz en el tratamiento de algunas EA refractarias a AINE y en ocasiones a sulfasalacina. El fármaco es especialmente útil en aquellos pacientes con predominio de artritis periférica. Las dosis de fármaco que se requieren son, en general, altas (12,5-15 mg/semana). Biasi et al23, sugieren que en ocasiones la combinación de metotrexato con sulfasalacina puede resultar útil en alguno de estos pacientes especialmente refractarios. En este mismo estudio, el metotrexato sería también de utilidad en el tratamiento de las manifestaciones axiales no muy evolucionadas, aunque en nuestra experiencia no hemos observado ninguna utilidad del fármaco en estas situaciones.
D-penicilamina. La D-penicilamina un fármaco que se ha utilizado ampliamente en el tratamiento de la artritis reumatoide y, ocasionalmente, en las AP. En las restantes enfermedades del grupo de las espondiloartropatías su uso es ocasional. En la bibliografía encontramos unas 34 referencias, la mayoría publicadas en la década de los ochenta. Entre ellas cabe destacar 4 ensayos clínicos26-29, uno de ellos controlado29, si bien de corta duración y con un número muy reducido de pacientes17. Los resultados obtenidos en estos estudios son controvertidos, pues si bien en algunos de ellos se sugiere una mejoría clínica, especialmente en pacientes con artritis periférica o formas axiales de inicio reciente, estos datos no se confirman en el único estudio controlado que se ha publicado sobre el tema29. Nosotros no tenemos ninguna experiencia en este tema, pues no empleamos nunca este fármaco en este grupo de enfermedades.
Ciclosporina (CsA). El uso de la CsA en este grupo de enfermedades prácticamente queda reducido al ámbito de la AP. El número de referencias bibliográficas en otras enfermedades de la familia de las espondiloartropatías es insignificante y en la mayoría de ocasiones se trata de casos aislados en los que la CsA se ha asociado al metotrexato para el tratamiento de algunas espondiloartropatías con artritis periférica refractaria a otros tratamientos30,31. Nuestra experiencia con este fármaco es muy reducida; siempre lo hemos empleado (dosis entre 2,5-5 mg/kg/día), combinado con metotrexato, en situaciones refractarias a todo tipo de tratamiento y con resultados dispares.
Crisoterapia. La crisoterapia o tratamiento con sales de oro (auronafin, aurotiomalato), constituye un clásico en los tratados terapéuticos de reumatología. En la familia de las espondiloartropatías su utilidad queda limitada al tratamiento, casi exclusivamente con aurotiomalato, de las AP. En la bibliografía se encuentran sólo unas 20 citas que hacen referencia a la crisoterapia en las espondiloartropatías, de las cuales sólo una, usando como fármaco el auronafin, puede considerarse un ensayo terapéutico, aunque no controlado32. En este estudio se sugiere una posible utilidad del fármaco sólo en los casos de EA con artritis periférica, si bien las características y poder estadístico del estudio hacen que estos resultados no puedan considerarse ni mucho menos como definitivos.
Antimaláricos. Los antimaláricos de síntesis (cloroquina, hidroxicloroquina): su uso se reduce al tratamiento ocasional en pacientes con AP. No existen datos suficientes en la bibliografía que apoyen la utilidad de estos fármacos en el tratamiento de otras enfermedades de la familia de las espondiloartropatías.
Levamisole. Es un fármaco antihelmíntico, usado en el tratamiento de las parasitosis por Ascaris, aunque también se ha empleado como estimulador inespecífico del sistema inmune en el tratamiento de las neoplasias, especialmente las de colon. Sus propiedades de estimulador del sistema inmune, especialmente de los linfocitos T, y de antiinflamatorio inespecífico al bloquear diversas funciones de las células del sistema mononuclear fagocítico, hicieron que durante la década de los setenta se publicaran 16 artículos sobre este fármaco en el tratamiento de las espondiloartropatías. Entre estos trabajos encontramos diversos ensayos clínicos33-35 en los que se incluyeron pacientes con diferentes enfermedades del grupo de las espondiloartropatías. Los resultados obtenidos en estos estudios, si bien sugerían una modesta mejoría clínica, no parecían compensar los efectos secundarios observados con este tratamiento, especialmente las alergias cutáneas y las discrasias hematológicas, por lo que se abandonó su uso.
1.2. Citostáticos. La azatioprina, la ciclofosfamida y el clorambucil son los que se han utilizado con mayor frecuencia. El uso de citostáticos en las espondiloartropatías es, sin embargo, muy escaso en relación con otros reumatismos crónicos como la artritis reumatoide. Esto probablemente es debido, al menos en parte, a que el porcentaje de pacientes con una espondiloartropatía agresiva e invalidante es menor que en la artritis reumatoide, por lo que las publicaciones al respecto son escasas y la evidencia científica de su eficacia en estas enfermedades es poco consistente.
Azatioprina. Es un citostático de uso habitual en el tratamiento de la enfermedad inflamatoria intestinal refractaria a corticoides. Existen algunos artículos y casos aislados publicados que sugieren que puede ser un fármaco eficaz también en diversas espondiloartropatías con predominio de artritis periféricas refractarias a otros tratamientos36-38.
Ciclofosfamida. Aparece referenciada en la bibliografía como tratamiento de las espondiloartropatías en 19 citas. La mayoría de estas referencias son estudios abiertos o casos aislados en los que la ciclofosfamida al parecer puede ser eficaz en el tratamiento de pacientes con espondiloartropatía, especialmente en aquellos con predominio de artritis periférica37-39, incluso en algunos con amiloidosis secundaria asociada, aunque siempre debe utilizarse en situaciones excepcionales dada su conocida toxicidad en tratamientos prolongados.
Clorambucilo. Su uso en el tratamiento de las espondiloartropatías es excepcional, y en la bibliografía se recogen sólo algunos casos aislados de buena respuesta al tratamiento en pacientes con enfermedad muy grave y amiloidosis secundaria asociada40.
1.3. Corticoides. El tratamiento con glucocorticoides queda prácticamente limitado al tratamiento local, administrado por vía intraarticular en artritis periféricas, dactilitis, entesitis o, incluso, sacroileítis. En la fase crónica de la enfermedad y en artritis de tamaño medio-grande (rodillas, caderas y, ocasionalmente, tobillos y muñecas), el hexacetónido de triamcinolona es, según nuestra experiencia, una alternativa mucho más eficaz que los restantes corticoides de depósito. Existen dudas sobre la utilidad de las infiltraciones a nivel de las articulaciones sacroilíacas. La sacroileítis es una manifestación clínica axial y, por lo comentado anteriormente, con una respuesta buena o muy buena a dosis altas de antiinflamatorios en más del 70% de los casos. Sin embargo, en la práctica clínica pueden observarse casos aislados de sacroileítis extremadamente dolorosas e invalidantes (incluso en ocasiones bilaterales), o casos aislados de sacroileítis refractarias a AINE, que pueden beneficiarse de una infiltración local de corticoides (siempre guiada por técnicas de imagen, TC o ecografía)41. Finalmente, en algunas ocasiones puede observarse pacientes que en el contexto de una clínica axial, refieren un dolor a la presión muy selectivo e intenso en algunas apófisis espinosas. Este dolor en ocasiones, y a pesar de la mejoría de la raquialgia inflamatoria general, persiste e incomoda enormemente al paciente. Suele tratarse de pequeños focos de entesitis inflamatoria que en nuestra experiencia responden, en ocasiones de forma sorprendente, a infiltraciones locales de corticoides.
Los corticoides orales a bajas dosis (< 10 mg/día de prednisona) suelen usarse en casos de oligo-poliartritis graves, como coadyuvantes del tratamiento antiinflamatorio.
En casos seleccionados de pacientes con brotes graves de enfermedad refractaria a AINE y fármacos modificadores de enfermedad, pueden ensayarse los bolos intravenosos de corticoides. Las dosis utilizadas oscilan entre 300-1.000 mg/día de prednisona, repetidos durante 3 días consecutivos. Con este tratamiento se ha observado, en algunos de estos pacientes, rápidas mejorías clínicas (axial y periférica) y biológicas (normalización de PCR y VSG)42,43. Este tipo de tratamiento debe limitarse a casos excepcionales por la frecuente recidiva de la sintomatología (alrededor de 6 meses) y por sus potenciales efectos secundarios.
1.4. Pamidronato. El pamidronato es un bifosfonato y, por tanto, un análogo sintético del pirofosfato. Administrado por vía intravenosa, esencialmente en pacientes con enfermedad de Paget grave, actúa como un potentísimo inhibidor de la resorción ósea por bloqueo de la actividad osteoclástica. Sin embargo, algunos trabajos recientes44 sugieren que este fármaco puede tener, además, una importante actividad antiinflamatoria, al suprimir la producción de citocinas proinflamatorias (IL-1, TNF-α e IL-6), e interferir la presentación de antígenos por los macrófagos. En base a estas particularidades farmacológicas, el grupo del Dr. Maksymowych ha publicado recientemente dos ensayos clínicos no controlados de tratamiento con pamidronato en pacientes con espondiloartropatías refractarias a AINE45,46. En el primer trabajo45 se incluyeron 16 pacientes con formas axiales de EA, y se observó, a partir del sexto mes de tratamiento, una significativa mejoría clínica (descenso aproximado del 30% del BASDAI) y biológica (VSG), que se mantuvo hasta el noveno mes. Aunque esta mejoría sólo se observó en el subgrupo de pacientes que habían tomado mayores dosis de fármaco (> 200 mg, dosis total de pamidronato). En un segundo trabajo publicado recientemente46, los autores incluyeron 9 pacientes con clínica axial y periférica que presentaban diferentes tipos de espondiloartropatías (5EA, 3EI, 1AR) refractarias a AINE y FAME. A todos ellos se les administraron dosis altas de pamidronato (dosis total administrada: 300 mg). Los resultados observados a los 3 meses de tratamiento muestran una espectacular mejoría clínica, especialmente de la sintomatología articular periférica (remisión en 5 de 9 pacientes y mejoría importante en otros tres) y biológica (descenso de los valores de VSG y PCR en un 40 y 60%, respectivamente). En los resultados destaca, además, una mejoría también de las supuestas lesiones entesopáticas de estos pacientes, confirmada por RM. Esta mejoría clínica se mantiene, además, en 6 de 9 pacientes durante un seguimiento de 11 meses (5-14), y en los 2 pacientes en los que se observa un rebrote clínico (4 y 6 meses) la readministración del fármaco vuelve a ser efectiva. Como efectos secundarios los autores sólo destacan la aparición temprana (a los 2 días de tratamiento), y de forma casi constante, de una linfopenia transitoria acompañada de un aumento de reactantes de fase aguda (PCR) que, sin embargo, no comporta repercusiones clínicas importantes. Además, debemos destacar que casi el 80% de los pacientes que recibieron este tratamiento presentaron un cuadro seudogripal con febrícula, mialgias e incremento, en ocasiones franco, del dolor articular. Se trata de un cuadro transitorio (4-6 días) que aparece al día siguiente de la administración del tratamiento y que, si bien no es grave, debe conocerse, pues su frecuencia e intensidad obliga a aumentar la medicación analgésica y antiinflamatoria en algunos de estos pacientes.
Los resultados presentados por el equipo del Dr. Maksymowych son, sin duda, esperanzadores; sin embargo, no se corresponden a los resultados observados en nuestra experiencia clínica ni a los del grupo de Dr. Braun, recientemente comunicados47. Por todo ello, creemos que es precisa la confirmación de estos resultados por otros grupos de trabajo, así como la realización de estudios controlados, antes de establecer de forma definitiva la utilidad del tratamiento con pamidronato como fármaco modificador de enfermedad en las espondiloartropatías.
1.5. Talidomida. La talidomida es un fármaco capaz de reducir la producción de IL-12 (RS) y especialmente la del TNF-α (probablemente aumentando la degradación de su ARN mensajero)48. Dado que existen evidencias de que el TNF-* desempeña un papel fundamental en el desarrollo del proceso inflamatorio espondilítico49, el uso de este fármaco en el tratamiento de las espondiloartropatías estaría plenamente justificado. Así, Breban et al50 publicaron, en 1999, un artículo en el que la talidomida se mostraba como un fármaco muy eficaz en el tratamiento de 2 pacientes con EA axial y periférica refractaria a AINE y FAME. El fármaco, administrado a dosis que oscilaban entre 100 y 300 mg/día, según necesidades y recuento leucocitario, conseguía reducir drásticamente la actividad clínica (axial y periférica) y normalizar los parámetros biológicos de actividad (VSG Y PCR) en un período de 3 meses. Sin embargo, la interrupción del fármaco se acompañó de rebrote clínico en un período no superior a los 6 meses. Personalmente no dispongo de experiencia con este fármaco porque, como todos sabemos, la talidomida es un medicamento de uso restringido en nuestro país. Aunque no se han publicado posteriormente otros intentos terapéuticos con talidomida en las espondiloartropatías, su uso constituyó el inicio de una nueva línea terapéutica en esta familia de enfermedades, basada en el bloqueo de la actividad del TNF-α que tantas esperanzas ha generado en estos últimos tiempos y que será motivo de otro capítulo de este monográfico.
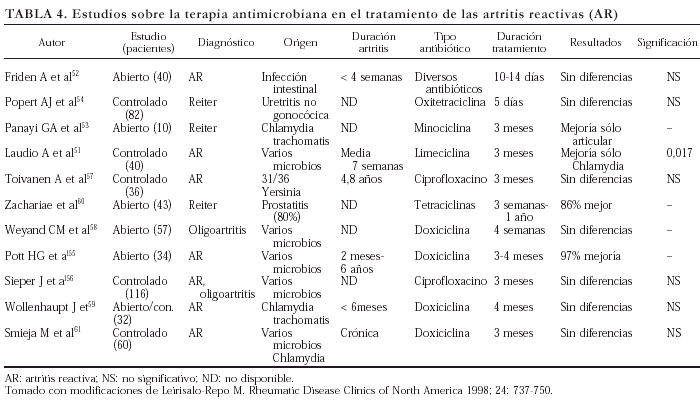
1.6. Antibioterapia. En la etiopatogenia de la AR y, en menor grado, de las oligoartritis indiferenciadas se han implicado diversos agentes bacterianos (tabla 1). Los factores responsables de la cronificación de estos procesos no se conocen con exactitud; sin embargo, la persistencia del foco inflamatorio a nivel de la puerta de entrada intestinal o urogenital parecen desempeñar un papel importante. Dado que la mayoría de las bacterias implicadas en el desarrollo de las AR son agentes intracelulares, la instauración de pautas terapéuticas largas con antibióticos activos a nivel intracelular en principio parecería ser una opción terapéutica útil en estos pacientes. Sin embargo, el número de estudios publicados hasta la fecha es escaso (tabla 4). La mayoría son estudios abiertos no controlados, en los que se administra durante un período de tiempo relativamente largo (≥ a 3 meses) ciprofloxacino y/o diferentes tipos de tetraciclinas, y se obtienen unos resultados poco esperanzadores. El trabajo más conocido es un estudio controlado del grupo de Leirisalo-Repo, publicado en 199151. En este estudio los autores administran un tratamiento de forma precoz (< 7 semanas) con tetraciclinas durante 3 meses y encuentran una significativa mejoría clínica y biológica en los pacientes con AR de origen urogenital (post-Chlamydia), pero no en otros tipos de AR. El resto de estudios publicados, con diseños y pautas terapéuticas diferentes, vienen globalmente a confirmar estos resultados, mostrando sólo mejorías en las formas post-Chlamydia y sólo cuando el tratamiento se instaura de forma precoz52-61. En este sentido, y a modo de resumen, podemos concluir que la instauración de un tratamiento antibiótico (especialmente tetraciclinas) por un período prolongado de tiempo, sólo debería considerarse en pacientes con AR de corto tiempo de evolución y de origen urogenital (post-Chlamydia trachomatis).
1.7. Otros fármacos. La bromocriptina es un fármaco que se ha utilizado, debido a sus efectos inmunomoduladores asociados a la inhibición de la prolactina, como tratamiento en diversos reumatismos crónicos. Bravo et al62 observan que el tratamiento es muy eficaz en pacientes con AR posdisentería; sin embargo, estos resultados no se confirman en otros estudios63. El uso de analgésicos, miorrelajantes y antidepresivos constituye una práctica habitual en el tratamiento de enfermedades crónicas que cursan con dolor. Existen numerosos estudios, la mayoría de ellos no controlados, que muestran grados variables de mejoría del dolor, calidad de vida y función en los pacientes tratados con estos fármacos. Koh et al64, en un estudio controlado corto, demuestran una significativa mejoría de los pacientes con EA tratados con bajas dosis de amitriptilina. Los estados de ansiedad y depresión son frecuentes en pacientes con enfermedades crónicas que cursan con dolor y discapacidad física. En mi experiencia personal, el dolor psicosomático, incluso la fibromialgia, no son infrecuentes en los pacientes con EA muy evolucionada. El reconocimiento de todos estos estados funcionales asociados, la administración moderada en estos casos de los fármacos anteriormente comentados y, de forma muy especial, la diferenciación de estos estados funcionales de los cuadros de dolor inducidos por el propio proceso inflamatorio son cualidades que deben distinguir la buena praxis de un reumatólogo basada en el conocimiento y la experiencia.
2. Tratamiento local. En la mayoría de los casos el tratamiento local se centra en las infiltraciones locales de corticoides en las articulaciones, entesis y demás puntos dolorosos ya comentados en el apartado de terapia con esteroides.
El tratamiento local (inyecciones intraarticulares) con isótopos radiactivos ha sido profusamente utilizado en la práctica reumatológica para el tratamiento de artritis resistentes a todo tipo de terapias, incluyendo los corticoides locales. Los isótopos más utilizados en la actualidad son el itrio-90, renio-186 y el herbion-169, clasificados de mayor a menor según el tamaño de la articulación que hay que infiltrar. En el contexto de las espondiloartropatías, la indicación más frecuente es la sinoviortesis de tobillos y, especialmente, de rodillas (itrio-90). Aunque existen pocos estudios al respecto, la eficacia de esta técnica parece, en estos pacientes, inferior a la observada en pacientes con artritis reumatoide65. No existen contraindicaciones especiales para la realización de sinoviortesis isotópicas, salvo las derivadas de las alteraciones cromosómicas que este tipo de tratamientos pueden ocasionar, por lo que se aconseja no efectuarlo en mujeres en edad fértil y evitar en un mismo individuo dosis excesivas (se aconseja no superar el número de 3-4 infiltraciones por paciente si se trata de grandes articulaciones y se usa el itrio).
3. Fisioterapia, terapia ocupacional y educación sanitaria. La fisioterapia constituye un pilar básico en el tratamiento de los pacientes con formas crónicas de espondiloartropatías para intentar paliar y reducir las secuelas clínicas de estas enfermedades. Aunque los estudios controlados al respecto son escasos, existe un amplio consenso sobre el efecto beneficioso de la fisioterapia en el control del dolor, la mejoría de la movilidad articular y el incremento de la capacidad funcional de estos pacientes66,67. El tratamiento debe individualizarse para cada caso en función de las características sociolaborales del paciente y de la gravedad de su enfermedad. En muchos pacientes con espondiloartropatías con escasas secuelas funcionales puede ser suficiente la práctica de ejercicios sencillos (previamente seleccionados y mostrados en varias sesiones de aprendizaje) en su propia casa durante unos minutos al día. Es importante en estos casos que las tablas de gimnasia sean sencillas y fáciles de ejecutar, y sobre todo que se acompañen de periódicas sesiones de refuerzo de los ejercicios aprendidos. No debemos olvidar que gran parte de los beneficios que pueden obtenerse de estos tratamientos dependen de la regularidad y constancia con que el paciente los desarrolle en su casa. En casos más graves, con clara tendencia a la anquilosis y deformidad, la fisioterapia debe ser más intensa. En este sentido, cabe destacar el programa intensivo de fisioterapia desarrollado por el grupo de Bath68, que combina un régimen corto de tratamiento activo hospitalario (3 semanas) con un programa muy completo de ejercicios para realizar en el domicilio; con este programa consigue significativas mejorías funcionales, incluso en pacientes con enfermedad muy grave. En estas situaciones especialmente graves suele ser fundamental la comprensión y apoyo familiar para mantener la constancia en el trabajo físico, tan necesaria en estos tratamientos. Ocasionalmente pueden ser de utilidad terapias coadyuvantes del tipo de la electroterapia, termoterapia o hidroterapia. Esta última modalidad permite, en caso de gran dolor, efectuar movimientos para mantener el tono y funcionalismo articular, y reducir drásticamente el dolor. Se aconsejan deportes que no requieran contacto físico; la natación es un deporte ideal para los pacientes con espondilitis. Finalmente, debemos comentar que actualmente el grupo ASAS está elaborando, con la colaboración del laboratorio Centocor, un programa de educación y rehabilitación para estos pacientes que esperamos esté concluido antes de un año.
La terapia ocupacional en las fases iniciales de la enfermedad puede limitarse a prestar un apoyo psicológico y facilitar la utilización de técnicas destinadas a controlar el dolor69. En fases avanzadas y con grave deformidad, se precisa, en ocasiones, de estudios complejos de las condiciones de trabajo (en los casos activos) y de las características del propio domicilio del paciente para desarrollar todo un programa de ayudas funcionales que faciliten al paciente llevar a cabo, con cierta comodidad, actividades habituales como vestirse, asearse o incluso desplazarse.
Las sesiones de educación sanitaria destinadas a explicar a los pacientes y familiares las características y el pronóstico de su enfermedad son muy importantes para ganar su confianza y asegurar el correcto tratamiento. Es muy importante explicar a los pacientes y sus familiares que la presencia de un HLA-B27 positivo no es sinónimo de enfermedad, ni tan siquiera de mala evolución clínica. Debemos hacer comprender a los pacientes que su enfermedad, aunque en ocasiones es crónica, tiene tratamiento y permite, en la mayoría de ocasiones, el desarrollo de una vida sin excesivas limitaciones. Debemos procurar reducir la ansiedad del paciente de padecer un reumatismo crónico, especialmente en aquellos procesos que sólo en ocasiones se cronifican (AR, EI). Debemos explicarle también los mecanismos de contagio y tratamiento de la enfermedad en determinados casos (AR especialmente uretral), y debemos, en definitiva, asesorar y dar apoyo moral al paciente y familiares en todas aquellas situaciones que sea necesario.
4. Indicaciones quirúrgicas. La cirugía de las espondilartritis incluye, esencialmente, las prótesis articulares y la cirugía correctora vertebral.
La mayor parte de la cirugía protésica se halla destinada a las caderas. La artroplastia de caderas está indicada en aquellas situaciones en las que el dolor y el déficit funcional no son controlables con otras medidas. Con frecuencia esta cirugía protésica debe realizarse en individuos relativamente jóvenes. A pesar de ello, y de la mayor tendencia a la osificación heterotópica de esta cirugía en estos pacientes, los resultados a largo plazo parecen buenos70.
La cirugía correctora vertebral se centra, fundamentalmente, en dos regiones: la cervical y la lumbar. A nivel cervical, en ocasiones es necesaria la fijación de C1-C2 para evitar lesiones neurológicas derivadas de la subluxación atlantoaxoidea (complicación que por otra parte es mucho menos frecuente en estas enfermedades que en la artritis reumatoide). Sólo en caso de grandes deformidades en flexión vertebral, que incluso impide la visión anterior de los pacientes, pueden estar indicadas las osteotomías correctoras vertebrales, aunque obviamente se trate de una cirugía con alto riesgo de producir lesiones neurológicas. En casos excepcionales de falta de respuesta a todo tipo de terapias, la espondilodiscitis no infecciosa que se observa en algunos pacientes con EA puede requerir, para reducir el intenso dolor, una fijación quirúrgica del segmento vertebral afectado. En pacientes con EA grave y evolucionada, en ocasiones puede desarrollarse un síndrome de la cola de caballo. Se trata de una grave complicación neurológica que, sin embargo, no debe tratarse quirúrgicamente, pues los resultados son muy malos. Es conveniente informar al paciente de que se trata de una complicación de progresión muy lenta, y prestar apoyo psicológico y funcional en aquellos pacientes que lo requieran.
Tratamiento de las manifestaciones extraarticulares
Manifestaciones intestinales. El tratamiento de base de los brotes intestinales en la enfermedad de Crohn y la colitis ulcerosa suele realizarse con corticoides y 5-ASA (2-3 g/día); sin embargo, es preciso recordar que sólo los compuestos que llevan sulfamidas, como la sulfasalacina, han mostrado ser eficaces en el tratamiento de las manifestaciones articulares de estos pacientes22.
Un 30-60% de los pacientes con espondiloartropatías presentan, en estudios isotópicos y endoscópicos71,72, lesiones inflamatorias intestinales que histológicamente son similares a las observadas en la enfermedad de Crohn. La sulfasalacina se ha mostrado como un fármaco eficaz, no sólo en el tratamiento de las manifestaciones articulares de estos pacientes, sino también en la reducción de estas lesiones intestinales72. Sin embargo, en la mayoría de los pacientes esta inflamación intestinal es subclínica (en ocasiones referenciada simplemente como episodios frecuentes de heces pastosas), por lo que no requiere ningún tratamiento sintomático específico. La importancia de estas lesiones y quizás de su posible tratamiento futuro está ligada a su implicación en la propia fisiopatología de las espondiloartropatías, aunque hasta la fecha el tratamiento de estas lesiones no ha demostrado que modifique el curso evolutivo de la enfermedad73.
Uveítis. Entre el 20 y el 40% de los pacientes desarrollan uno o más episodios de iritis aguda en el curso de la EA. Se trata de uveítis anterior aguda no granulomatosa, que en general suele presentarse de forma unilateral y recurrente, aunque es frecuente la afectación de ambos ojos en el curso de la enfermedad. El tratamiento de estos episodios de uveítis consiste, en general, en la administración de midriáticos y corticoides de forma tópica. En raras ocasiones se requiere la instilación de corticoides de depósito subconjuntivales. El pronóstico de estas uveítis suele ser bueno siempre y cuando el tratamiento se instaure de forma temprana. La aparición de secuelas residuales (cataratas, sinequias, etc.) es poco frecuente salvo en uveítis muy refractarias o en pacientes con brotes muy frecuentes. En casos de uveítis excepcionalmente refractarias al tratamiento habitual, puede valorarse la opción terapéutica de la CsA (dosis alrededor de 5 ml/kg/día) que ha mostrado muy buenos resultados en diferentes tipos de uveitís crónica74. Benítez del Castillo et al75 han publicado recientemente los resultados de un excelente estudio en el que demuestran que el tratamiento crónico con sulfasalacina (3 g/día) es capaz, en pacientes con EA, de reducir de forma significativa no sólo el número de episodios de uveítis, sino las complicaciones oculares crónicas asociadas. En este sentido, esta opción terapéutica sería especialmente interesante en pacientes con un número igual o superior a los 2 episodios anuales.
Manifestaciones cardiovasculares. Ocasionalmente puede observarse inflamación de la raíz aórtica, con fibrosis secundaria que puede conducir a dilataciones de la misma e insuficiencia valvular. Los pacientes sometidos a recambio valvular precisan de tratamiento crónico con anticoagulantes (dicumarínicos), por lo que la administración de AINE es mucho más problemática. En estos casos, la administración de un AINE COX-2 selectivo debería ser una opción especialmente valorada. Finalmente, también se han descrito, en estos pacientes, trastornos de la conducción cardíaca asociados a exceso de fibrosis miocárdica que en ocasiones requieren marcapasos.
Entesitis. Se trata de una manifestación clínica característica de todo este grupo de enfermedades. Puede presentarse en una gran variedad de territorios y se han diseñado diversos índices para su evaluación, aunque ninguno de ellos se halla suficientemente validado. En determinados pacientes y en ciertas localizaciones (especialmente cuando afecta al retropié), puede constituir la manifestación clínica más relevante. Responde moderadamente bien a altas dosis de AINE; en cambio, no parece que ningún FAME sea eficaz en su tratamiento. En los casos refractarios al tratamiento con AINE, la infiltración con esteroides de depósito, acompañado de ortesis de descarga (en patología del retropié), puede proporcionar buenos resultados. Recientemente, Macksimovich et al46 han sugerido que el pamidronato, administrado por vía intravenosa a dosis altas, puede ser eficaz en el tratamiento de entesitis que no han respondido a AINE ni a FAME. En casos excepcionales de entesitis del retropié refractaria a todo tipo de tratamientos, la administración de bajas dosis de radioterapia local76 se ha acompañado de muy buenos resultados clínicos, y sin las complicaciones oncogénicas que se habían observado en los pacientes con EA que recibían tratamiento con radioterapia vertebral. Finalmente, las terapias anti-TNF (infliximab, etanercept) parecen ser muy eficaces también en este tipo de manifestaciones.
Tratamiento de las complicaciones
Complicaciones pulmonares. Los pacientes con EA pueden presentar, en el curso evolutivo de su enfermedad, una neumopatía con reducción de volúmenes pulmonares por anquilosis de la caja torácica. Se trata de una complicación muy frecuente en pacientes con enfermedad evolucionada, aunque no suele tener trascendencia clínica a menos que se asocie a otras patologías pulmonares. El tratamiento debe consistir en fisioterapia respiratoria y en la prohibición, de forma constante y precoz, del tabaco para evitar el desarrollo de cualquier patología bronquial concomitante. De forma excepcional algunos pacientes con EA evolucionada pueden presentar una fibrosis pulmonar apical, que incluso en ocasiones es bilateral. No existe tratamiento específico para esta entidad, aunque en general no suele comportar ningún trastorno clínico destacable. La única complicación a descartar en estos pacientes es la colonización de estas cavidades apicales por aspergillomas. En estos casos un diagnóstico y tratamiento tempranos pueden ser esenciales para la recuperación del paciente.
Complicaciones renales. Las alteraciones de la función renal que pueden observarse en el curso de las espondiloartropatías pueden deberse a complicaciones asociadas al tratamiento con AINE o la presencia de depósitos de IgA o amiloide. El tratamiento crónico con AINE puede desencadenar una nefropatía tubulointersticial que obligue a la retirada de estos fármacos. En las espondiloartropatías se ha observado un aumento de la actividad del sistema inmune de las mucosas, que se traduce en elevaciones de los niveles séricos de IgA, que al menos en parte es del tipo IgA secretora (IgA de síntesis en mucosas)77,78. Esta elevación de los niveles séricos de IgA se ha asociado a depósitos de esta inmunoglobulina en diversos territorios, entre ellos el riñón. El resultado suele ser una glomerulopatía mesangial que cursa con hematuria, proteinuria (en menor grado) y progresivo deterioro de la función renal, sin que se conozca hasta la fecha ningún tratamiento eficaz en casos evolucionados79. El depósito de amiloide secundario a nivel gromerular suele manifestarse clínicamente en forma de proteinuria, que puede alcanzar valores de rango nefrótico. En algunos casos la proteinuria se acompaña de alteraciones de la función renal; una creatinina superior a los 2mg/dl es un factor de mal pronóstico a corto-medio plazo. En el tratamiento de esta complicación se ha usado en ocasiones con buenos resultados la ciclofosfamida y, especialmente, el cloranbucilo40, y de forma excepcional la colchicina80.
Amiloidosis secundaria. Un 6-8% de los pacientes con EA desarrollan una amiloidosis secundaria, que suele manifestarse en forma de nefropatía, esencialmente proteinuria. Suelen ser pacientes evolucionados, con enfermedad inflamatoria persistente y refractaria a AINE y FAME. La presencia de amiloidosis secundaria se considera clásicamente como una complicación clínica de muy mal pronóstico, que obliga de forma sistemática a la instauración de un tratamiento agresivo. El tratamiento consiste en suprimir la actividad inflamatoria de la enfermedad. En este sentido, diversos estudios han mostrado que citostáticos como la ciclofosfamida y, especialmente, el clorambucilo40 son capaces, en algunos pacientes con espondiloartropatías, de suprimir la actividad inflamatoria y hacer desaparecer los síntomas clínicos asociados a la amiloidosis secundaria. No disponemos aún de datos suficientes del efecto en esta situación de las nuevas terapias biológicas (terapias anti-TNF-*); sin embargo, si estas terapias se han mostrado eficaces en la reducción de la actividad inflamatoria en pacientes con espondiloartropatías refractarias, probablemente serán útiles también en estas situaciones. En un estudio reciente publicado por nuestro grupo de trabajo81, hemos demostrado que menos de la mitad de los pacientes con EA y amiloidosis secundaria (presencia de depósitos de amiloide en grasa subcutánea) desarrollan, en un período de seguimiento de entre 2 y 10 años, manifestaciones clínicas o progresión de su amiloidosis sistémica. Además, sólo una pequeña proporción de estos últimos presentan una mala evolución clínica a corto-medio plazo. A la luz de estos resultados, la presencia de amiloidosis secundaria, en ausencia de manifestaciones clínicas graves (especialmente insuficiencia renal), no debe conducir a la instauración de forma sistemática de un tratamiento agresivo en estos pacientes.
Osteoporosis. La osteoporosis vertebral es una complicación de la EA que se conoce desde hace mucho tiempo. La presencia de osteoporosis vertebral se ha asociado a un aumento de la gravedad de la enfermedad en forma de fracturas vertebrales, que aumentan de forma significativa la deformidad de la columna. Habitualmente se acepta que la pérdida de masa ósea vertebral de estos pacientes es una consecuencia de la limitación de la movilidad inducida por la rigidez y anquilosis vertebral secundaria al proceso espondilítico. En este contexto, el tratamiento con fisioterapia y rehabilitación funcional parecería la opción más importante. Sin embargo, recientemente hemos publicado un estudio82 en el que la pérdida de masa ósea de estos pacientes se inicia en fases precoces de la enfermedad y se asocia a la actividad inflamatoria de la misma (VSG, PCR). Los bifosfonatos son fármacos antireabsortivos óseos que además han demostrado ser eficaces en la reducción de la actividad inflamatoria en estos pacientes45,46, por lo que podrían constituir una interesante opción terapéutica. El Dr. Mitra presentó en el congreso de la ACR de 1994 una comunicación en la que pacientes con EA tratados con etidronato mostraban una mejoría clínica y de la masa ósea. A pesar de ello, no disponemos de datos suficientes para afirmar la eficacia de estos fármacos en el tratamiento de esta complicación. Recientemente, el grupo del Dr. Dougados83 ha comunicado que el tratamiento con infliximab es capaz, en pacientes con EA, no sólo de bloquear su actividad inflamatoria, sino de evitar la pérdida de masa ósea de estos pacientes. Estos resultados de hecho confirman nuestros estudios previos, que apuntaban a la actividad inflamatoria como el factor esencial en la pérdida de masa ósea que se produce en estas fases iniciales de la enfermedad.