Con la osteoporosis ha ocurrido lo que con otras enfermedades en la historia de la Medicina, ha sido ubicada en el terreno de las enfermedades del sexo femenino. Ciertamente, la enfermedad es más frecuente en la mujer; la incidencia, el coste sanitario, las fracturas que origina y la merma que esta enfermedad ocasiona en la calidad de vida en la población femenina no pueden exagerarse más. Más de veinte millones de mujeres tienen riesgo de fractura y el número de fracturas anuales supera el millón. Sin embargo, no podemos ignorar a los varones que padecen esta enfermedad y la necesidad de nuevos conocimientos en esta área. Es necesario, no sólo entender las causas de la enfermedad en el varón, sino también los agentes terapéuticos más apropiados en la osteoporosis masculina. El riesgo de fractura para un varón mayor de 50 años se sitúa entre el 13-25%, y uno de cada 8 varones mayores de 50 años tendrá una fractura osteoporótica. Aunque esta enfermedad sea menos frecuente en el varón, su morbimortalidad es el doble con respecto a la mujer1-3. Estos datos proporcionan una convincente evidencia de que la osteoporosis no es una enfermedad exclusiva de la mujer. La mortalidad se incrementa con la edad, por lo que las estrategias preventivas deben de orientarse hacia la prevención de las fracturas en varones y mujeres más jóvenes. Programas de salud equitativos y eficaces, sin desventaja de sexo en relación con los recursos sanitarios de que disponemos, nos permitirán conocer las características que definen la osteoporosis del varón, las diferencias y similitudes con la osteoporosis posmenopáusica, el mejor punto de corte densitométrico que defina la osteoporosis en el varón, así como posibilidades terapéuticas específicas de la osteoporosis masculina.
Epidemiología
Desde hace una década conocemos que la osteoporosis en el varón representa un importante problema de salud. La importancia de esta afirmación se refleja en las cifras siguientes:
El 50% de las fracturas vertebrales y el 30% de las de cadera se producen en el varón, en el que el número de fracturas vertebrales se ha incrementado en los últimos años; de una relación inicial varón:mujer de 1:7, se pasó a 1:2, y existen indicios a que en 2025 el número total de fracturas será similar en ambos sexos.
La mortalidad posfractura de cadera durante el primer año es 2-3 veces mayor en el varón que en la mujer (3,17 [intervalo de confianza IC del 95%, 2,90-3,44] respecto a 2,18 [IC del 95%, 2,03-2,32]). La mortalidad posfractura vertebral durante el primer año4 resulta igualmente superior en varones que en mujeres (2,38 para varones y 1,66 para mujeres).
Si seguimos los criterios densitométricos de la Organización Mundial de la Salud (OMS)5, la prevalencia de la osteoporosis masculina en la población española es del 4,15% (2,99-5,31%), lo que supone una población de entre 418.000 y 743.000 varones que presentan osteoporosis en nuestro país.
Según el criterio de valoración utilizado, la prevalencia de la fractura vertebral en España en el estudio EVOS6,7 fue similar en ambos sexos y osciló entre el 12 y el 20,2%. La tasa de fractura en los varones españoles fue de 572 por 100.000 habitantes. La prevalencia de la fractura de cadera en España varía, según la población estudiada, desde 27,5 a 83,6 fracturas por 100.000 habitantes/año y la relación varón:mujer oscila entre 1,9 y 4,78.
El aumento de la mortalidad masculina posfractura está en relación con la mayor edad en la que se produce esta complicación en los varones y el mayor número de enfermedades asociadas. De los que sobreviven, el 59% presenta un deterioro funcional, un 60% precisa ayuda para la deambulación, el 29% se encuentra confinado a una cama o silla y un 13% requiere analgésicos para el dolor9.
Fisiopatología
La mayor densidad mineral ósea (DMO) en el varón es debida a la suma algebraica del pico de masa ósea obtenido durante el crecimiento y la maduración y las pérdidas ocasionadas con el envejecimiento. El resultado de esta operación matemática es un menor riesgo de fractura en el varón con respecto a la mujer, su origen es:
El pico de masa ósea en el varón es entre un 8-10% mayor que en la mujer. Debido a esta ventaja se retrasa en los varones la incidencia de fracturas con respecto a las mujeres unos 10 años.
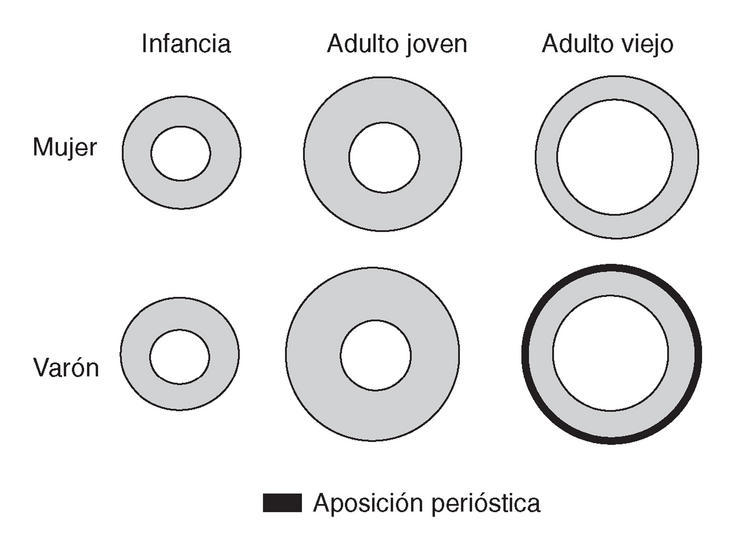
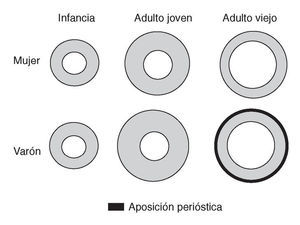
Factores geométricos. Existen diferencias en el tamaño y la forma del hueso según la edad y el sexo. Los varones tienen huesos más grandes, lo que les confiere una menor fragilidad para las fracturas. En la figura 1, se pueden observar las diferencias del hueso cortical en ambos sexos, durante el crecimiento, la maduración y la involución ósea. La cortical en el hueso de la mujer guarda proporciones similares entre la infancia y el adulto joven. En el varón la proporción de aposición perióstica durante la pubertad hace que la cortical sea más grande y compacta. En la mujer, durante el período involutivo la resorción endóstica es mayor por la pérdida brusca de los estrógenos (E2), lo que origina una mayor pérdida de hueso cortical. En el varón, la resorción endóstica es compensada parcialmente con la aposición perióstica a lo largo de la vida, cuyo resultado final es una cortical 3 veces mayor en el varón que en la mujer10,11. Curiosamente, este mecanismo de aposición perióstica es menos activo en la cadera.
Figura 1. Diferencias en la cortical durante el crecimiento, la maduración y la involución óseas en ambos sexos.
Calidad del hueso superior. La pérdida ósea trabecular que conlleva la edad en el varón, al ser más tardía y menos vivaz, además de la aposición perióstica compensatoria, ocasiona un adelgazamiento trabecular sin llegar a la rotura y perforación de las trabéculas.
Andropausia paulatina. Las mujeres tienen 2 fases de pérdida ósea involutiva, una temprana, transitoria y acelerada que empieza en la menopausia y una fase lenta y prolongada, que es común en ambos sexos. La fase temprana de pérdida ósea en la mujer, asociada a la menopausia, comienza aproximadamente a los 50 años y se prolonga entre 4-8 años. Esta fase es seguida de una fase lenta y continua en relación con las pérdidas involutivas de la edad. Durante la fase de pérdida ósea acelerada en la mujer se producen pérdidas de hueso trabecular de entre 20-30%, y entre un 5-10% de hueso cortical. Si exceptuamos a los varones en los que se ha realizado una castración (violadores de la república Checa, cáncer prostático, etc.), que tienen un modelo de pérdida ósea acelerada similar al de la mujer, los varones tan sólo presentan una fase de pérdida ósea lenta similar a la segunda fase de la mujer y que llega a ocasionar unas pérdidas de entre un 20-25% de hueso cortical y trabecular; comparado con la mujer; esto le confiere un mayor contenido mineral óseo (g/cm2) a una misma edad, aunque cuando se ajustan estos valores por unidad de volumen (g/cm3), el número y el grosor trabecular no son demasiado diferentes entre ambos sexos.
Importancia de los estrógenos en las pérdidas óseas del varón. Exceptuados los casos de castración, los valores de E2 y testosterona (T) disminuyen paulatinamente en el varón con el paso de la edad. Ocho estudios observacionales12-19 han demostrado de manera uniforme que el principal determinante y predictor de la DMO son los E2 y no la T. A través de estos estudios se infiere que los E2 son determinantes en las pérdidas óseas debidas a la resorción. Estas evidencias se apoyan en los siguientes aspectos:
1. El papel que desempeñan los estrógenos en la fisiopatología de la osteoporosis en la mujer.
2. La observación de los raros casos publicados de deficiencia de aromatasa y la resistencia del receptor estrógenico20,21. La aromatasa actúa en la conversión de androgénos a estradiol. La administración de E2 durante 3 años, incrementó significativamente los valores de la DMO en los varones con esta anomalía20. La resistencia a los E2 del receptor estrogénico está causada por una mutación. Tal deficiencia es difícil de descubrir clínicamente en el varón, pero provoca una osteoporosis y un fracaso terapéutico con la utilización de E221.
3. La inhibición del receptor androgénico produce, en el modelo del ratón masculino, un síndrome de insensibilidad a los andrógenos, con feminización y disminución de la masa ósea por un aumento de la resorción en los machos y no en las hembras, a pesar de un aumento en su formación22.
4. En contraste, las mujeres con insensibilidad para los andrógenos tienen una DMO disminuida a pesar de tener valores séricos de T elevados.
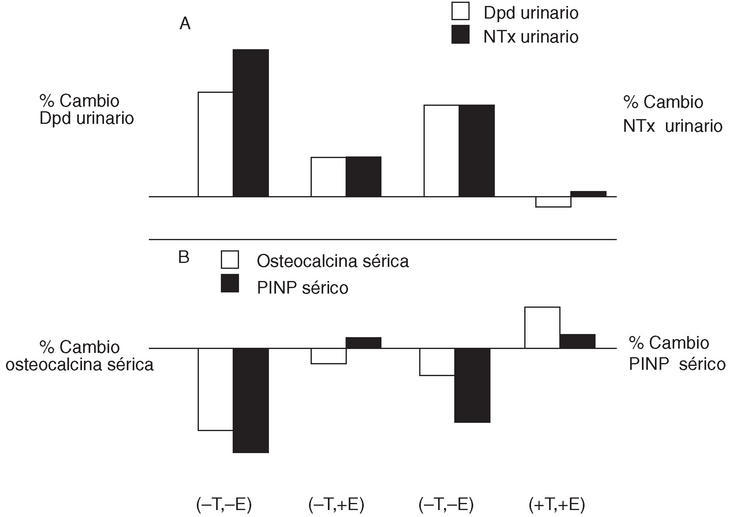
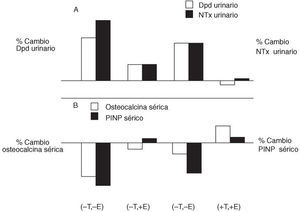
Se concluye, con todos estos ejemplos, que los andrógenos son un estimulador débil de la formación ósea; este hecho se apoya en el hallazgo de receptores androgénicos en el osteoblasto. Algunos de los efectos óseos de los E2 pueden estar mediados de forma autocrina en el microambiente óseo por el factor de crecimiento insulin like (IGF-1) y las interleucinas. El papel de cada una de estas hormonas en el metabolismo óseo puede ser inferido por los cambios en los marcadores del metabolismo óseo cuando administramos los E2 y la T aisladamente y de forma conjunta. En la figura 2 se comprueba experimentalmente la importancia de los E2 y la T en la resorción y formación óseas del varón. La administración de clomifeno (un agonista de la GnRH que impide la producción de E2) y un inhibidor de la aromatasa (impide el paso de T a E2), se asignaron aleatoriamente a grupos de pacientes tratados con T, E2, ambos, o ninguno. Se valoraron los cambios en los marcadores de resorción (deoxipiridolina y N-telopéptido) y los de formación (osteocalcina sérica y péptido N-terminal del protocolágeno). Cuando se administra sólo E2, disminuyen los marcadores de resorción ósea, mientras que los marcadores de formación no cambian. No puede excluirse la posibilidad de que la T tenga un leve efecto también en este sentido. Si se administra conjuntamente E2 y T se obtiene un aumento de los marcadores de formación23.
Figura 2. Cambios en los marcadores de resorción (deoxipiridolina [Dpd] y N-telopéptido [NTx] urinarios) y formación (osteocalcina y péptido N-terminal del protocolágeno [PINP] séricos) con la administración de testosterona (T) y estrógenos (E) aisladamente o de forma conjunta.
Los varones se caen menos. La menor incidencia de caídas en el varón es desconocida, pero puede estar en relación con su masa muscular y con una mayor actividad física y ejercicio.
Factores de riesgo
Los factores de riesgo de osteoporosis y fracturas son más numerosos en el varón que en la mujer, pero menos estudiados. El 60% de los varones con osteoporosis tiene una causa identificable o factor de riesgo, el 40% restante corresponde a las osteoporosis idiopáticas. El límite de edad asociado a esta definición son los 70 años, puesto que a partir de esta edad la pérdida ósea debida al envejecimiento, junto con otros factores de riesgo para la osteoporosis, podrían explicar la presencia de una osteoporosis en el varón. En su etiología se ha implicado a la hipercalciuria24,25 y al IGF-126. Se han encontrado unos valores disminuidos de IGF-1 en la osteoporosis idiopática del varón. Su déficit podría estar en relación con una variación en su estructura genética27,28. Estudios genéticos y su correlación clínica aclararán, en un futuro, su probable relación patofisiológica.
Las principales causas de osteoporosis secundarias en el varón son: el tratamiento con glucocorticoides, el hipogonadismo y la ingesta elevada de alcohol1-3,29. Los efectos adversos de los corticoides guardan relación directa con la duración (mayor de 6 meses) y la dosis (mayor de 5 mg de prednisona o bioequivalente). Los glucocorticoides disminuyen la absorción intestinal cálcica y la reabsorción tubular renal de calcio, e indirectamente disminuyen la testosterona sérica por supresión hipotalámica del factor liberador de gonadotropinas (GnRH). Otras causas menos frecuentes, pero a tener en cuenta son: el hiperparatiroidismo primario, el hipertiroidismo, el mieloma y las alteraciones digestivas que provoquen una disminución de la absorción de calcio y vitamina D. El antecedente de fractura previa, al igual que en la osteoporosis posmenopáusica, constituye un riesgo para la aparición de nuevas fracturas. Este riesgo resulta mayor en el varón que en la mujer cuando se relaciona la fractura distal de antebrazo o la fractura vertebral y el riesgo de padecer posteriormente fractura de cadera30. Al igual que en la mujer, también se ha planteado el debate de la influencia de la longitud del cuello femoral en la incidencia de la fractura de cadera. Pande et al31 concluyen que el mayor determinante del riesgo de fractura de cadera es la DMO y no las variaciones en la longitud del cuello femoral.
Diagnóstico
Es raro que el varón asintomático se realice una densitometría; la forma habitual de diagnóstico de osteoporosis en un varón es después de una fractura ante un traumatismo mínimo. No existe un consenso para el diagnóstico y la prevención de la osteoporosis masculina. Algunos expertos han realizado algunas recomendaciones29,32-34. Debe investigarse la presencia de osteoporosis en el varón y realizar una densitometría axial o de cadera ante cualquiera de los siguientes factores de riesgo: historia previa de fractura no traumática o con impacto mínimo, osteopenia radiológica, administración de glucocorticoides durante más de 6 meses, hipogonadismo, hiperparatiroidismo, pérdida de altura mayor de 4 cm o contacto de la arcada costal con las crestas ilíacas. Igualmente, y de forma rutinaria, se debería pedir una densitometría a los mayores de 70 años, dados la frecuencia de fracturas a estas edades y el incremento de la mortalidad.
Para descartar causas secundarias de osteoporosis en el varón se solicitará: bioquímica con calcio, fósforo y fosfatasa alcalina, hormonas (vitamina D, TSH, T, E2 totales y libres, LH y PTH) y la calciuria en orina de 24 h. Ante la sospecha de mieloma o neoplasias óseas, solicitaremos un hemograma, velocidad de sedimentación y proteinograma.
Existen dudas sobre si debemos utilizar los rangos definidos por la OMS para el diagnóstico de la osteoporosis del varón, ya que el pico de masa ósea es mayor que en la mujer (T-score), circunstancia que disminuiría el riesgo de fractura para un mismo punto de corte. Si aplicamos estos criterios establecidos en mujeres caucásicas, el número de varones con osteoporosis es 1-2 millones y el de osteopénicos 8-13 millones. Sin embargo, sabemos que el riesgo de fractura de cadera, cuando se expresa en función de la DMO y la edad, es similar en el varón que en la mujer33,34. Este hecho sería un criterio para utilizar los criterios de la OMS en el diagnóstico de la osteoporosis en el varón. En los casos sintomáticos, sería razonable utilizar el criterio de la OMS para establecer el diagnóstico, de esta forma se evitarían las previsibles complicaciones que conlleva la edad, dada la menor esperanza de vida de los varones. En los casos asintomáticos, sería conveniente revisar el criterio de 2,5 a un nivel inferior, al objeto de buscar un T-score que mejor defina el criterio de osteoporosis en el varón.
La edad, el índice de masa corporal, la historia previa de fracturas y los otros factores de riesgo conocidos para las osteoporosis secundarias podrían combinarse con los resultados densitométricos con el fin de particularizar el inicio del tratamiento de forma individualizada en cada paciente.
Tratamiento
El tratamiento dependerá de la etiología de la osteoporosis. A todos los pacientes se les recomendará una ingesta óptima de calcio y vitamina D con la dieta y, si ello no es posible, se les suplementará farmacológicamente. La ingesta de calcio dietética debe situarse entre 1.000 y 1.500 mg/día y la de vitamina D, entre 400-800 UI/día. Menos del 50% de los adultos viejos realizan estas recomendaciones. La restricción de sodio y de dietas hiperproteicas es una medida sensata en los casos que cursan con hipercalciuria. Especialmente en estos pacientes, podría estar indicado el uso de tiazidas a dosis bajas; su administración prolongada tiene un efecto aditivo sobre la DMO lumbar y de cadera. Su administración prolongada durante 10 a 20 años podría explicar el riesgo de fractura observado en estudios epidemiológicos35.
Es necesario realizar una revisión de los medicamentos que favorezcan las caídas, especialmente antidepresivos, hipnóticos y fármacos antihipertensivos. En algunos casos puede estar indicado el uso de protectores de cadera, que han demostrado prevenir la fractura de cadera en varones debilitados36. Sin embargo, menos del 50% de los varones usan estos protectores de forma prolongada. Algunos pacientes precisan que se les instruya en el uso de ayudas para la deambulación. El ejercicio regular adaptado a las enfermedades del paciente y a su estilo de vida es una de las normas básicas del tratamiento. Su finalidad es evitar la pérdida ósea, mejorar el tono muscular y evitar las caídas, pues sabemos que el aumento de la DMO con el ejercicio sólo ocurre en adolescentes y no se incrementa en otras edades, aunque continuemos haciendo ejercicio.
Andrógenos. Aunque existe una disminución de los marcadores óseos de resorción en varones eugonadales, cuando se les administra T, a través de un mecanismo dependiente de los E237, no existen datos sobre la reducción de fracturas con la terapia hormonal sustitutiva (THS) en el varón. Los pacientes que reciban suplementación de T deben tener una clara indicación para esta terapia, basada en la historia clínica, la exploración y los datos de laboratorio. Este tipo de terapia ha de ser individualizada y se debe sopesar los factores de riesgo.
Los andrógenos están indicados en el hipogonadismo. Esta situación es difícil de reconocer clínicamente, por ello es fundamental determinar la T total y libre. En el varón, la función testicular declina progresivamente con la edad y es variable de uno o a otro varón, de tal forma que con la edad algunos varones pueden tener un hipogonadismo franco y en otros estar preservada la función gonadal hasta una edad avanzada. El diagnóstico debe realizarse por los valores de T total sérica y preferentemente por la porción libre, por debajo de los límites normales. Con la edad se incrementan los valores de proteína transportadora de hormonas sexuales, lo que origina una disminución de la T total. Debe demostrarse la disminución en 2 determinaciones distintas de muestras sanguíneas matinales. Este tipo de terapia está contraindicada en el cáncer de próstata y de mama.
Los preparados más habituales son el undecanoato de T (oral), utilizado en hipogonadismos parciales; el enantato y el cipionato de T a dosis de 100-200 mg por vía intramuscular al día, que son preparados de acción prolongada y los de uso más frecuente. Las preparaciones de acción mixta (acción rápida y prolongada) como Testoviron® y Sustanon® son útiles en déficit parciales. Las preparaciones transdérmicas Androderm® y Testoderm TTS® remedan el ritmo de secreción de T fisiológica. El control terapéutico se hará clínicamente y con mediciones analíticas de la T sérica. Los valores de T son normales a las 3 h de haber administrado undecanoato, a las 5 h de las preparaciones transdérmicas y a los 3-5 días de las preparaciones parenterales.
Al implementar este tipo de tratamiento, es preciso evaluar los riesgos de hiperplasia prostática benigna mediante la práctica del tacto rectal cada 6 meses, una valoración ecográfica y flujométrica y los valores seriados de antígeno prostático específico a los 3 meses y al año. Valorar el riesgo cardiovascular con determinaciones de lipoproteínas de alta densidad, colesterol unido a lipoproteínas de alta densidad y triglicéridos cada 3 meses. Debe valorarse su uso en los pacientes obesos y con enfermedad pulmonar obstructiva crónica por el riesgo de aparición de síndrome de apnea obstructiva del sueño. Igualmente, la posibilidad de producir policitemia conlleva la evaluación del hematocrito antes de la terapia, a las 2 y 4 semanas, a los 3 meses y posteriormente cada año.
Los modulares selectivos del receptor de andrógenos tienen la ventaja de actuar sobre el hueso, y evitan los efectos adversos sobre los lípidos, la próstata y los de su administración oral. En el momento actual, se han ensayado en ratas, y existen algunas compañías farmacéuticas interesadas en el desarrollo de esta molécula en Estados Unidos (Ligan Pharmaceuticals) y Japón (Kaken Phar Co). Se han hecho ensayos con raloxifeno en el varón, sin beneficio alguno38, pues existe una relación inversa de los valores de E2 libres con los marcadores de resorción ósea. La explicación más plausible es que a los 50 años los valores medios de E2 en el varón son de 26-32 pg/ml estos valores son el umbral a partir del cual raloxifeno es capaz de desocupar los receptores estrogénicos. Estudios poblacionales muestran que sólo la mitad de los varones mayores de 70 años se encuentra debajo de estos valores, mientras que casi el 100% de las mujeres están por debajo de estas cifras.
Los ensayos realizados con calcitoninas, a pesar de incrementar la DMO en la columna, han contado con un escaso número de pacientes y no han llegado a valorar la disminución del riesgo de fractura39.
Los bisfosfonatos constituyen un tratamiento apropiado en el varón osteoporótico, por su eficacia y seguridad demostradas en numerosos y extensos estudios. El etiodronato administrado cíclicamente durante 18 meses incrementa la DMO lumbar un 3,4% anual; este incremento es escaso en la cadera, tan sólo un 0,7% anual40. El alendronato no sólo incrementó la DMO, sino que previno fracturas vertebrales41.
La hormona paratiroidea (PTH) es un potente estimulador de la formación ósea. Se ha ensayado en la osteoporosis idiopática del varón, en el que incrementa la DMO lumbar y de cadera. En el momento actual, es una posibilidad excitante, principalmente en varones con osteoporosis avanzada42,43. La combinación de alendronato con PTH no ha resultado sinérgica en el incremento de la DMO. El alendronato disminuye los efectos anabólicos de la PTH tanto en la columna como en la cadera44.
El fluoruro sódico a dosis bajas y administrado cíclicamente durante 3 años incrementa la DMO y previene la incidencia de fracturas vertebrales45.
Dos nuevos procedimientos quirúrgicos intentan disminuir la sintomatología y el daño estructural de la fractura vertebral: la vertebroplastia transcutánea (VTP) y la cifoplastia. Las expectativas iniciales creadas con la VTP no serán una garantía hasta que los resultados terapéuticos sean homogéneos en distintos grupos investigadores; muchos de los pacientes sometidos a esta intervención acaban presentando nuevas fracturas en las vértebras adyacentes en los 30 días siguientes a la vertebroplastia46. La cifoplastia es algo más complicada en su ejecución, aunque técnicamente está mejor diseñada. Esta técnica requiere que la fractura sea reciente, un máximo de 3 meses47. Ambas técnicas podrían ser útiles en pacientes seleccionados con fracturas vertebrales juntamente con la administración del tratamiento farmacológico.