Introducción
La artritis reumatoide (AR) es una enfermedad grave que en nuestro país afecta al 0,5% de la población general1. En los últimos años se acepta que el tratamiento debe tener como objetivo el control temprano y mantenido de la actividad inflamatoria2-5. Para intentar detener la progresión de la enfermedad se han utilizado los fármacos antirreumáticos de acción lenta y los inmunosupresores. Entre ellos destacan el metrotrexato, la ciclosporina, la sulfasalacina, los antipalúdicos, la azatioprina o la ciclofosfamida, solos o en combinación. Sin embargo, estos tratamientos no son capaces de controlar la actividad inflamatoria en muchos pacientes y, menos aún, detener la progresión de la enfermedad. Además, los efectos adversos pueden ser graves y, con frecuencia, los pacientes toleran mal la medicación2-11.
Actualmente disponemos de nuevos tratamientos como la leflunomida12 y los antifactor de necrosis tumoral alfa (TNF-α)13-14. Su eficacia es evidente, pero no están exentos de efectos adversos. Presentamos un paciente tratado con anti-TNF que ha desarrollado una infección sistémica atípica.
Caso clínico
Paciente de 60 años de edad, con antecedentes personales de alergia a estreptomicina y litiasis renal cálcica bilateral, en tratamiento por presentar una artritis reumatoide seronegativa desde el año 1982.
Inicialmente, se administraron indometacina y sales de oro intramusculares, pero fueron retiradas por la aparición de lesiones cutáneas y la persistencia de la sintomatología. Posteriormente, se trató con corticoides y D-penicilamina, esta última suspendida por el desarrollo de una nefropatía membranosa. En 1989 se administró azatioprina y el paciente desarrolló una pancitopenia grave acompañada de un cuadro de insuficiencia respiratoria aguda y diarrea con infiltrado alvéolo-intersticial bilateral, derrame pleural derecho y pericárdico y antígeno para Legionella en orina positivo. El paciente ingresó en la unidad de cuidados intensivos y evolucionó satisfactoriamente con tratamiento antibiótico.
Desde 1990 el paciente tomó metrotrexato oral (10-15 mg/semana) y se mantuvo estable, pero a lo largo de 1999 presentó un nuevo brote articular que no cedió al aumentar la dosis de metrotrexato oral o i.m. (15-20 mg/semana). En la exploración física realizada en el mes de diciembre de 1999 destacaba la existencia de una sinovitis crónica en las articulaciones metacarpofalángicas, interfalángicas proximales y rodillas, así como deformidad en cuello de cisne de los dedos de las manos y desviación en ráfaga cubital bilateral. Presentaba rigidez matutina de varias horas de duración, 29 articulaciones dolorosas y 29 tumefactas, una impotencia funcional grado III y un Health Assessment Questionnaire (HAQ) de 1,65. El factor reumatoide era negativo, la proteína C reactiva (PCR) de 12,6 mg/dl y la velocidad de sedimentación globular (VSG) de 40 mm/1 h.
Ante la persistencia de inflamación poliarticular, rigidez matutina y gran impotencia funcional en el mes de enero de 2000, se inició tratamiento con infliximab a dosis de 3 mg/kg, según protocolo habitual, y metotrexato a dosis de 15 mg/oral/semanal. El Mantoux previo era negativo, no presentaba efecto booster y la radiografía de tórax no mostraba alteraciones significativas. Después de la tercera infusión presentaba un HAQ de cero y no tenía articulaciones dolorosas ni tumefactas. La PCR era 3 mg/dl y la VSG de 22 mm/1 h.
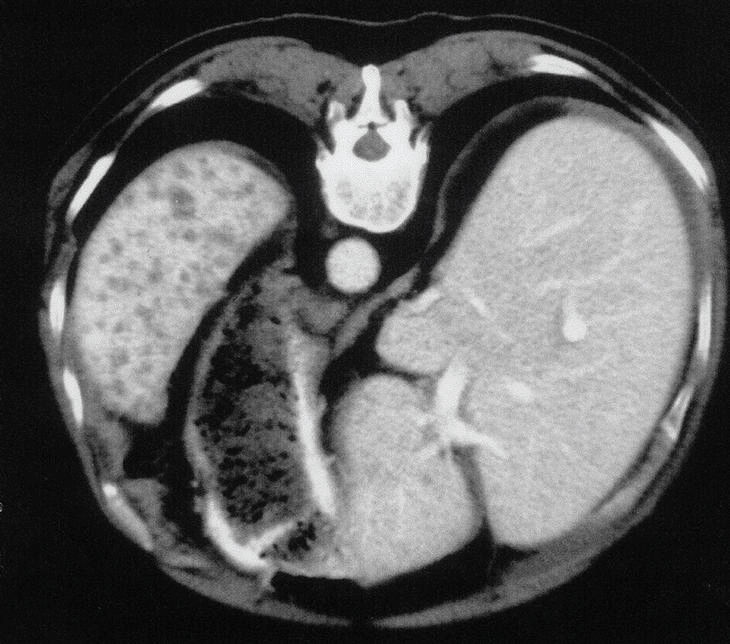
En mayo del mismo año, el paciente precisó de un nuevo ingreso hospitalario ante la presencia de un síndrome constitucional con astenia desde marzo de 2000, con pérdida de hasta 5 kg de peso, febrícula, artralgias, disnea de moderados esfuerzos y colestasis disociada. En la exploración física presentaba una hepatomegalia dolorosa. El Mantoux era negativo, no tenía efecto booster y la radiografía de tórax era normal. La tomografía axial computarizada (TAC) abdominal mostró múltiples lesiones hepatosplénicas de pequeño tamaño, una formación redondeada proyectada sobre el área suprarrenal y una pequeña cantidad de líquido libre intraabdominal (figs. 1 y 2). La biopsia hepática, realizada mediante laparoscopia, demostró la existencia de una hepatitis granulomatosa con caseum y bacilos ácido-alcohol resistentes. El cultivo del material obtenido fue positivo para Mycobacterium tuberculosis por lo que se inició tratamiento con tres fármacos tuberculostáticos. La evolución fue satisfactoria controlándose los signos y síntomas de la infección. En diciembre del año 2000 seguía con el tratamiento antituberculoso y se reintrodujo el tratamiento con infliximab a dosis de 3 mg/kg por nueva reactivación de la clínica articular, retirándose definitivamente después de la tercera infusión por intolerancia. El paciente sufría temblores y un cuadro seudogripal grave coincidiendo con la infusión del fármaco.
Figuras 1 y 2. La tomografía axial computarizada (TAC) muestra la existencia de múltiples lesiones focales hepatosplénicas (escasos milímetros e hipodensas), compatible con lesiones infecciosas de tipo tuberculosis.
Ante la situación clínica del paciente, que presentaba un nuevo brote poliarticular, se decidió administrar leflunomida (a dosis de carga de 100 mg/24 h/3 días seguido de 20 mg/24 h) y AINE. En los siguientes meses el paciente mejoró notablemente, se controlaron los signos inflamatorios, y no presentó nuevos brotes articulares con mejoría de la movilidad articular.
En el control de mayo de 2001, no presentó inflamación articular activa y la rigidez matutina era de 30 min. El EVA para el dolor era de 4, y la clase funcional era grado II, un HAQ de 1 con cero articulaciones dolorosas y cero articulaciones tumefactas. El factor reumatoide era negativo, la PCR era de 4,6 mg/dl y la VSG de 45 mm/1 h. En julio de 2001 el paciente estaba asintomático y los parámetros biológicos se habían normalizado (VSG y PCR).
Comentarios
Se presenta un paciente diagnosticado de artritis reumatoide con una historia de efectos adversos a múltiples fármacos. El interés del caso se centra en tres aspectos. Primero, los mecanismos de defensa inmunológicos de los pacientes con artritis reumatoide pueden verse mermados en el curso de la enfermedad, tanto por la propia alteración inmunológica de la AR como por los tratamientos administrados15.
Segundo, la dificultad del manejo farmacológico de estos pacientes. La artritis reumatoide es una enfermedad con daño inflamatorio crónico e hiperproducción de TNF-α y otras citocinas16. El TNF-α es una citocina proinflamatoria que actúa sobre la reparación tisular y protege contra infecciones mediadas por células T. La nueva generación de agentes terapéuticos para la AR, el infliximab y el etanercept, interfieren con el TNF-α13-14 y se asocian con una gran reducción de la actividad inflamatoria de la enfermedad con buenos resultados clínicos. Las consecuencias de la supresión del TNF-α son una predisposición a las infecciones15, tal como demuestra el estudio ATTRACT17, con un incremento en la proporción de infecciones que requieren antibioterapia en pacientes tratados con infliximab frente a pacientes tratados con placebo.
Nuestro paciente había presentado ya una infección oportunista grave, probablemente una neumonía por Legionella, cuando recibía azatioprina y posteriormente presentó una infección por M. tuberculosis con localización hepatosplénica después de la tercera dosis de infliximab. Este hecho sugiere que el tratamiento con infliximab puede reducir a corto plazo la respuesta inmunitaria en la población con riesgo de infección y permitir su desarrollo. Entre el 0,05 y el 0,99% de los pacientes con artritis reumatoide tratados con infliximab presentan tuberculosis18,19, lo cual supone un aumento significativo de esta infección. En EE.UU., la incidencia de tuberculosis en pacientes con artritis reumatoide es de 6,2/100.000, pero llega a 24,4/100.000 cuando se administra infliximab19-21. Por tanto, es indispensable evaluar el riesgo de infección por M. tuberculosis y realizar todas las pruebas y exámenes necesarios para diagnosticar una tuberculosis latente antes de iniciar el tratamiento con infliximab22-24. En particular, es obligatorio realizar una radiografía de tórax y una prueba cutánea de tuberculina o Mantoux. Según la Agencia Española del Medicamento24 se considerará que el Mantoux es positivo a partir de una induración mayor o igual a 5 mm. En caso de obtenerse un resultado negativo se repetirá la prueba transcurrida una semana (efecto booster) y se considerará válida la segunda lectura. Se administrará quimioprofilaxis cuando el Mantoux sea positivo, cuando el Mantoux sea negativo y la radiografía de tórax muestre lesiones que sugieran infección tuberculosa o cuando, a pesar de tener un Mantoux negativo y una radiografía de tórax normal, el paciente refiera un contacto estrecho con un paciente diagnosticado de infección tuberculosa. Sin embargo, estas recomendaciones no descartan el desarrollo de infecciones tuberculosas atípicas en los pacientes tratados con anti-TNF. Nuestro paciente no presentaba lesiones pulmonares y tenía Mantoux negativo sin efecto booster en el momento de la infección, tal vez por efecto del propio infliximab. Por lo tanto, debe descartarse tuberculosis en cualquier paciente tratado con infliximab que presente manifestaciones de enfermedad sistémica, aunque sean inespecíficas y leves. En este caso se trataba de un síndrome constitucional leve, con astenia, pérdida de peso, febrícula, artralgias, disnea de moderados esfuerzos y colestasis disociada.
Actualmente, se discute cuál es el tratamiento adecuado en pacientes con fracaso terapéutico o efectos adversos que obligan a suspender el tratamiento anti-TNF-α. Una posibilidad es recurrir a otros anti-TNF o a otros tratamientos biológicos.
En este caso se decidió la administración de leflunomida, un fármaco inmunorregulador que actúa inhibiendo la dihidroorotato deshidrogenasa (DHODH), enzima clave en la síntesis de pirimidinas, e inhibiendo la enzima tirosincinasa. Esta inhibición enzimática bloquea la expansión clonal de los linfocitos T activados y la producción de anticuerpos autorreactivos25-28. Por sus mecanismos de acción, la administración de leflunomida no predispone a infecciones ni se asocia a citotoxicidad29, aunque tampoco está exenta de efectos adversos12.
El tercer aspecto a señalar de este caso es la necesidad de un uso racional de los fármacos actualmente disponibles para el tratamiento de la artritis reumatoide. Debemos usarlos teniendo en cuenta las graves complicaciones que provoca la enfermedad y los efectos potencialmente nocivos del arsenal terapéutico. El equilibrio define el arte de nuestra especialidad.