Los defectos de la pared abdominal representan un reto para el cirujano por la retracción de los músculos laterales y la dificultad en la reaproximación durante la refuncionalización de la pared abdominal. El uso de la toxina botulínica serotipo A causa relajación muscular y facilita la reconstrucción quirúrgica.
Se analizaron 36 pacientes posoperados de hernia incisional gigante. A todos se les realizó una tomografía computarizada preoperatoria de abdomen, para identificar las placas musculares laterales y definir el sitio exacto de inyección del biológico. Cuatro semanas después, se realizó una tomografía para valorar la respuesta a la toxina, y fueron programados para reconstrucción de la pared abdominal.
En esta serie, con pacientes con defectos aponeuróticos de 10cm y hasta 15cm, fue posible el cierre sin tensión en 27 casos (75%), y se requirieron otras técnicas transoperatorias en el 25% de los pacientes restantes (separación de componentes y plicatura de saco peritoneal).
El 39% tuvo colocación de malla intraperitoneal; el 36%, con malla supraaponeurótica, el 13%, doble malla; el 6%, material biológico; y el 6%, técnica Rives. En 5 pacientes se efectuó restitución intestinal por estoma previo como procedimiento simultáneo. No hubo complicaciones relacionadas con la infiltración del biológico y la morbilidad posoperatoria (9 casos) tuvo relación directa con la complejidad de estas hernias.
El uso de toxina botulínica serotipo A en la pared abdominal parece ser una opción valiosa preoperatoria en los pacientes con hernias ventrales de 10-15cm, ya que permitió en la mayoría de nuestros casos (75%) el cierre primario sin tensión.
Abdominal wall defects represent a challenge for surgeons because of lateral muscle retraction and the difficulty of the reapproximation during refunctionalization of the abdominal wall. The use of botulinum toxin type A for muscle relaxation is a method that facilitates surgical reconstruction.
Thirty six patients who had undergone giant incisional hernia repair were included in the study. A preoperative abdominal computed tomography scan was performed on all of them to identify the lateral abdominal wall muscles and determine the exact point where to infiltrate the Botulinum toxin type A. Four weeks later they underwent a computed tomography scan to control toxin response and they were scheduled for surgical reconstruction of the abdominal wall.
In this series of patients with aponeurotic defects sized between 10 and 15, closure without tension was successful in 27 cases (75%), other perioperative techniques were required in 25% of the remaining patients (component separation and sac plication).
The mesh was used in different levels: 39% IPOM, 36% Onlay, 13% with 2 layers of mesh (Sandwich-technique), 6% Inlay and 6% with Rives’ technique. In 5 patients restoration of intestinal continuity due to previous stoma was performed as a simultaneous procedure. There were no complications related to the infiltration of the toxin, and postoperative morbidity (9 cases) was directly related to the complexity of those hernias.
We consider that the use of botulinum toxin type A in the abdominal wall is a useful tool for preparation for patients with 10-15 cm ventral hernias, since it allowed primary closure without tension in most (75%) of our cases.
Los defectos de la pared abdominal después de cirugía representan un reto para el cirujano por la retracción de los músculos laterales. La recurrencia en hernias con anillo de 5cm con reparación primaria puede alcanzar hasta un 43%, lo que es una cifra inaceptable; con el uso de materiales protésicos se ha disminuido la tasa de recidiva hasta el 5%.
Al efectuar una plastia dinámica de la pared abdominal se da por hecho que se efectuará un cierre del defecto, pues se refuncionalizará esta con la «medialización» de los músculos rectos abdominales. El uso de toxina botulínica serotipo A ha demostrado que produce una parálisis flácida temporal en los músculos abdominales, lo que favorece el cierre aponeurótico de la línea media sin tensión. La toxina botulínica es un producto natural del bacilo grampositivo formador de esporas: Clostridium botulinum, con 8 proteínas antigénicamente diferentes pero similares en estructura y función, que inhibe la liberación de acetilcolina y otros neurotransmisores1,2. Cada cepa de Clostridium produce un tipo de toxina, los tipos A, B, E y F, que afectan principalmente al ser humano. La toxina A fue la primera en ser aislada y purificada, y es la más comúnmente usada3,4. Se considera uno de los biológicos más potentes que afectan al ser humano. Todos los subtipos afectan el sistema nervioso central5,6.
Las hernias de la pared abdominal incrementan la morbilidad (restricción pulmonar, aerofagia, volet abdominal, estreñimiento, trastornos urinarios, lumbalgia crónica, lordosis, marcha inadecuada), con la consiguiente disminución de la calidad de vida.
El objetivo de este estudio es evaluar los resultados de la aplicación, prequirúrgicamente, de toxina botulínica serotipo A (Botox®) como alternativa para cierre de pared abdominal en hernias incisionales con defectos de 10cm y hasta 15cm.
Material y métodosEstudio descriptivo, abierto, retrospectivo y transversal, con 36 casos consecutivos de pacientes portadores de hernia incisional gigante (defectos de 10-15cm), en el periodo de 2011-2013, seleccionados para infiltración preoperatoria de toxina botulínica serotipo A (Botox®) y en los que posteriormente se realizó una plastia abdominal con colocación de material protésico.
Criterios de inclusión- 1.
Paciente de sexo indistinto, mayor de 18 años.
- 2.
Paciente sin contraindicación para ser sometido a un procedimiento anestésico.
- 3.
Paciente con hernia incisional gigante (mayor de 10cm de diámetro).
- 4.
Paciente con manejo electivo.
- 1.
Paciente con comorbilidad descontrolada.
- 1.
Los pacientes fueron seleccionados desde la consulta externa de Cirugía General, de enero de 2011 a noviembre de 2013.
- 2.
Se explicó el padecimiento, la preparación prehospitalaria, el tratamiento quirúrgico y el manejo posquirúrgico, así como el seguimiento a largo plazo (controles clínicos y fotográficos).
- 3.
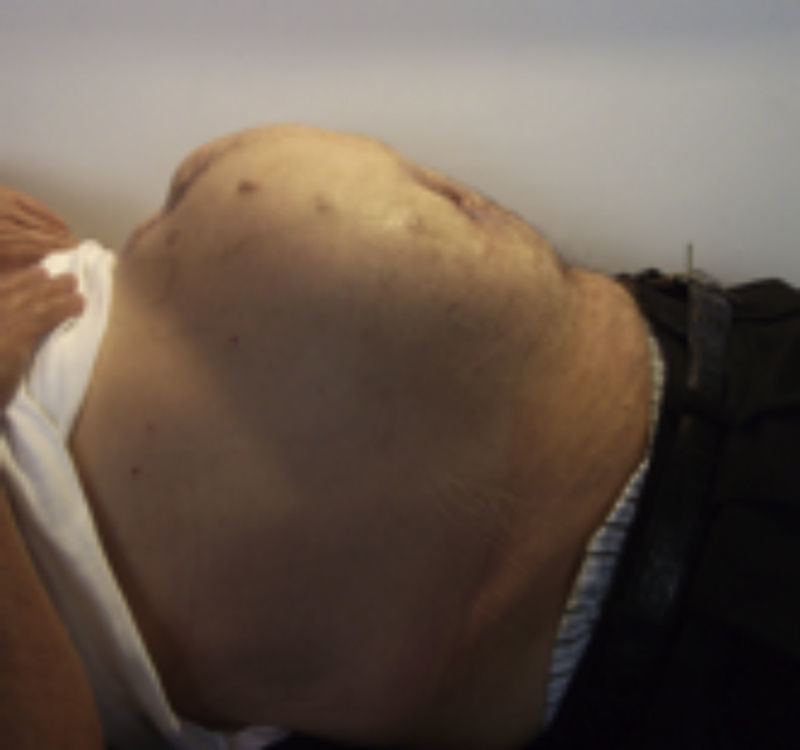
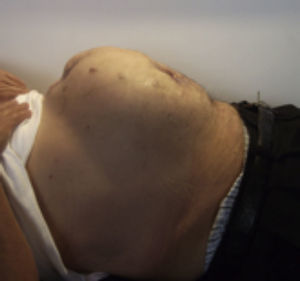
Una vez que aceptaron participar en el estudio, fueron enviados a la primera fotografía clínica (control preoperatorio) (fig. 1).
- 4.
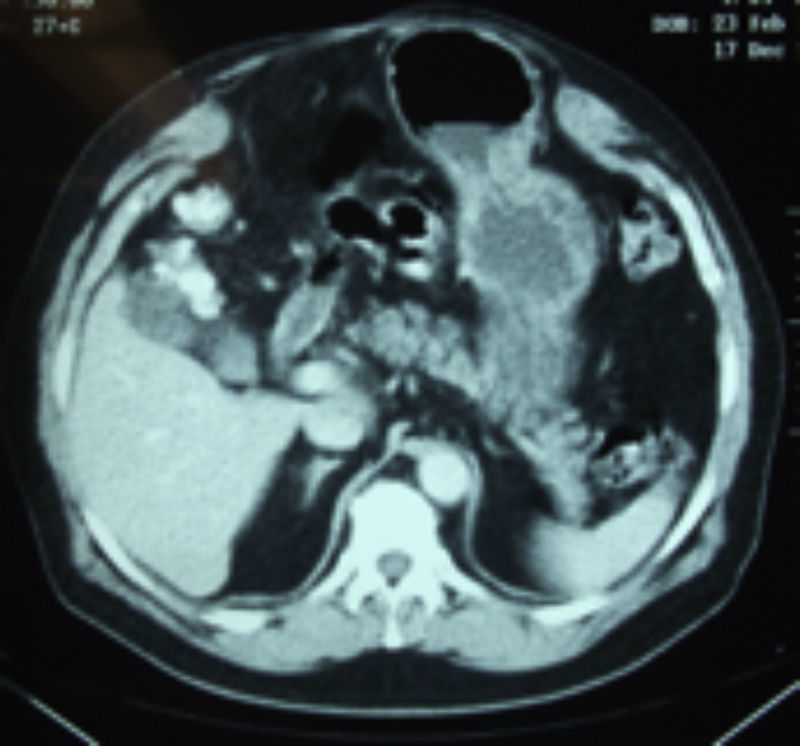
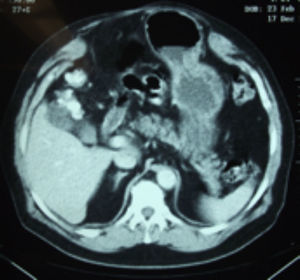
Se realizó una tomografía computarizada simple de abdomen y mediciones de músculos de pared abdominal (fig. 2).
- 5.
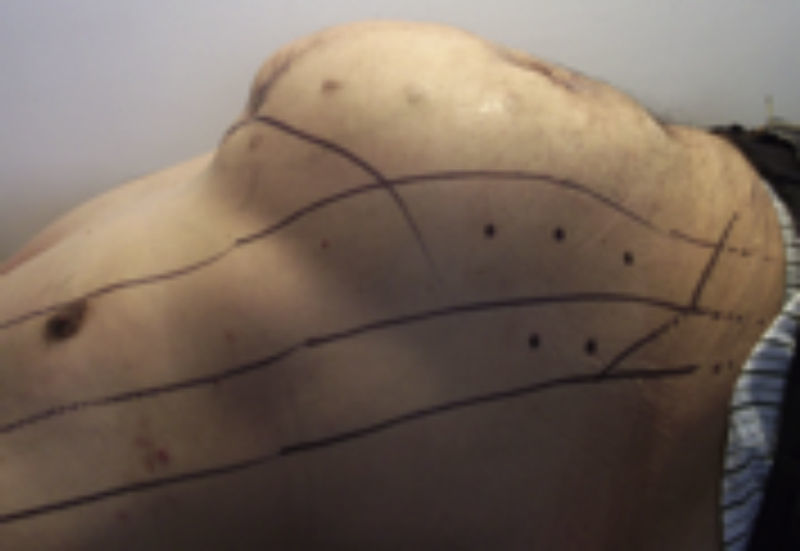
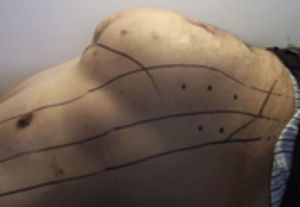
Se programó sesión de infiltración de toxina botulínica (Botox®) un mes antes de la cirugía de plastia de pared abdominal, siguiendo el mapeo ya establecido (fig. 3).
- 6.
Se realizó una nueva tomografía axial computarizada de control antes de la cirugía.
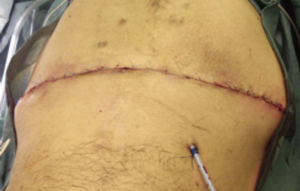
- 7.
En el posquirúrgico, se citaron para seguimiento por consulta externa en las semanas 1, 2, 4, 6, 12 y a los 6, 12 y 18 meses, para evaluación clínica y control con fotografía.
- 8.
Todos los pacientes firmaron carta de consentimiento informado para el procedimiento.
Anestesia general, asepsia y antisepsia de la pared abdominal.
Cirugía:
Paso 1. Incisión en línea media.
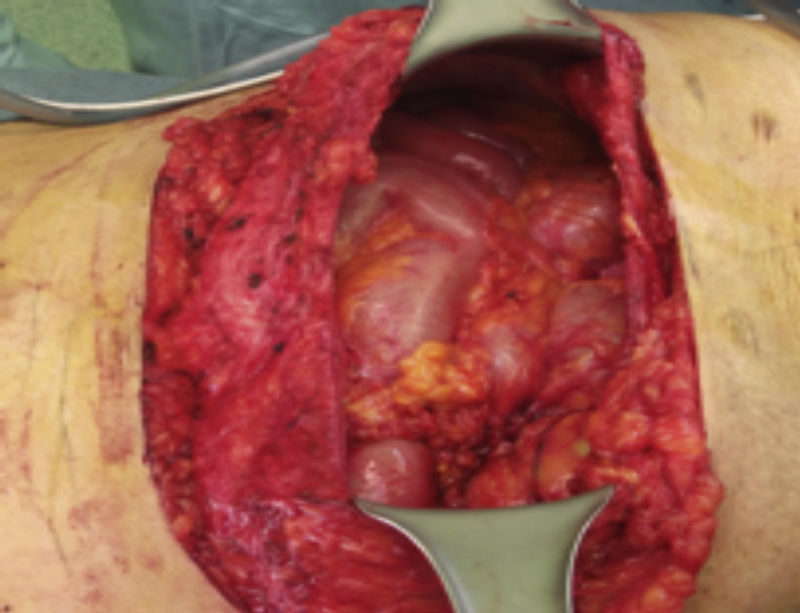
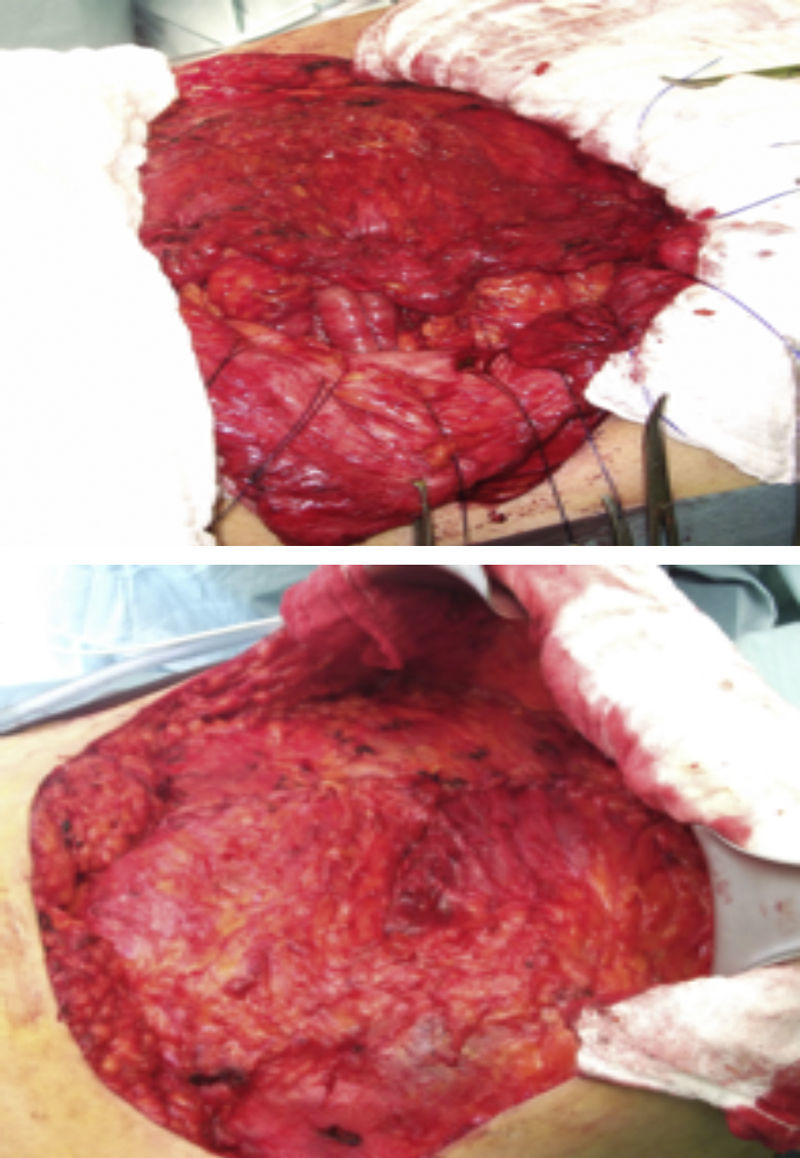
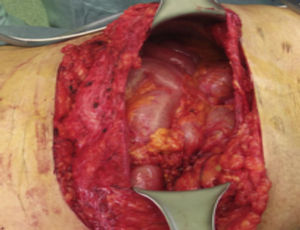
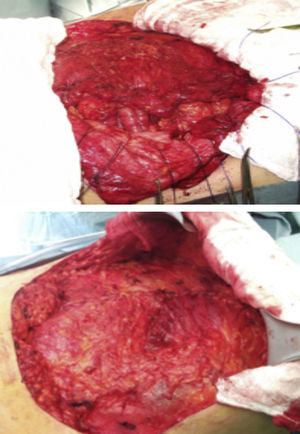
Paso 2. Identificación del defecto herniario y disección para encontrar bordes aponeuróticos sanos (fig. 4).
Paso 3. Medición del tamaño del defecto y determinación del tamaño de la malla, dejando 5cm más allá del borde del defecto.
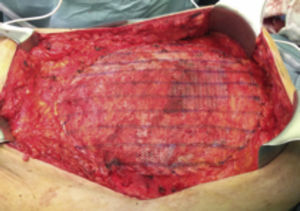
Paso 4. Colocación de la malla quirúrgica en posición intraperitoneal o preperitoneal.
Paso 5. Si es necesario, se efectúa separación de componentes o plicatura del saco herniario (figs. 5 y 6).
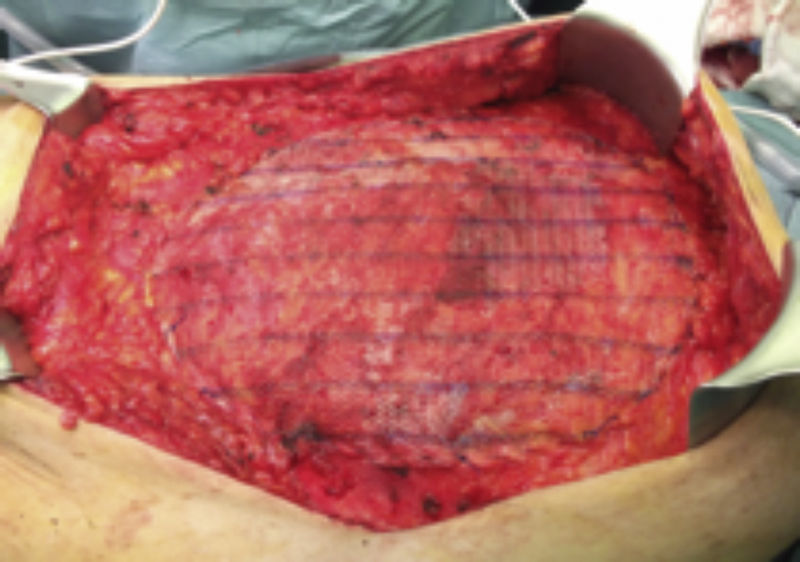
Paso 6. Cierre aponeurótico del defecto y fijación de la malla con sutura y, si es necesario, malla en posición supraaponeurótica (fig. 7).
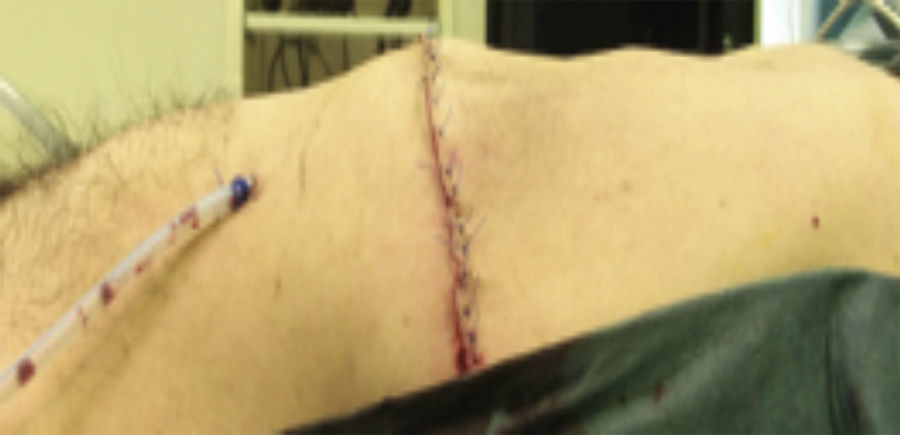
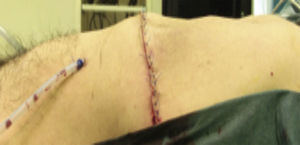
Paso 7. Colocación de drenaje, de acuerdo a cada caso (fig. 8).
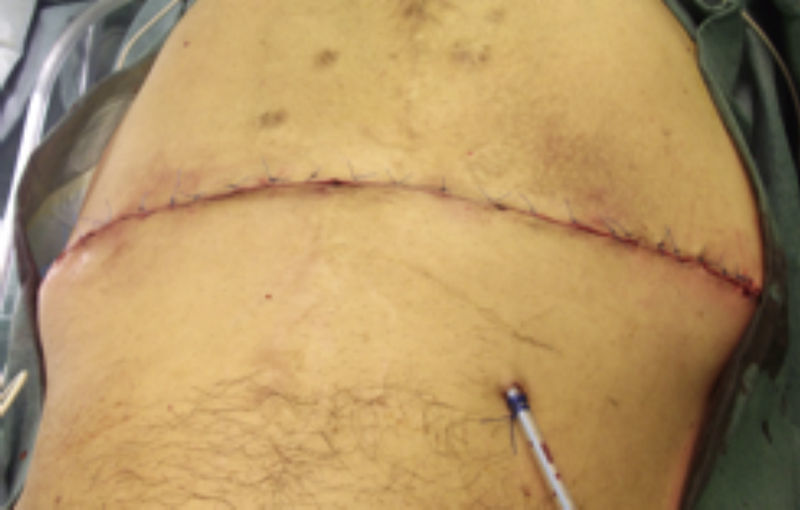
Paso 8. Colocación de puntos simples en tejido celular subcutáneo y cierre de la piel (fig. 9).
ResultadosSe analizaron 36 pacientes, con un promedio de edad de 52 años (19-84). Por sexo, el 43% eran varones, con un promedio de edad de 49 años (19-80), y el 57% mujeres, con un promedio de edad 54 años (38-84), con un promedio de IMC de 29.3 (23.5-38.7).
Los antecedentes de la cirugía abdominal previa fueron sepsis abdominal de origen diverso: apendicitis complicada, lesión intestinal inadvertida, divertículo de Meckel, pancreatitis necrótico-hemorrágica y enfermedad diverticular complicada, además de histerectomía, pacientes con estoma y evisceración (generalmente posterior a la cirugía de control de daños en abdomen catastrófico).
Se logró realizar el cierre sin tensión en 27 pacientes (75%), y se requirieron otras técnicas transoperatorias en el 25% de los casos restantes, como separación de componentes y plicatura de saco.
El 39% se manejó como plastia con colocación de malla intraperitoneal; el 36%, con colocación de malla supraaponeurótica (un 14% de ellos con reforzamiento con saco peritoneal y un 22% con cierre simple); el 13%, con técnica de sándwich o doble malla; el 6%, con material biológico con la malla suturada al borde del anillo, dada la magnitud de la pérdida fascial, y el 6%, con técnica Rives. En 5 pacientes se efectuó restitución intestinal con estoma previo como procedimiento simultáneo a la plastia de pared abdominal.
No hubo complicaciones relacionadas con la infiltración de la toxina. La tolerancia del paciente a las 10 punciones fue adecuada al procedimiento realizado en el consultorio. De forma subjetiva, todos los pacientes señalaron que tenían la percepción de un abdomen más «flojo o suelto», con menor tensión, incluso aquellos que tenían dolor de la pared abdominal refirieron franca disminución en la intensidad de este. Solo se efectuó una sesión preoperatoria de infiltración de toxina botulínica. Los estudios tomográficos pospunción, al ser comparados con los controles previos, evidenciaron la movilización de las placas laterales musculares secundarias a la relajación por la parálisis flácida secundaria.
En el posoperatorio se documentaron 9 complicaciones relacionadas con la complejidad del manejo de la pared: 2 hematomas, 3 seromas, 3 fístulas intestinales, una necrosis de colgajo; morbilidad resuelta según las guías clínicas. No hubo mortalidad.
No se documentó ningún efecto adverso colateral y/o reacción secundaria en relación con la inyección de la toxina, ni la morbilidad en el posoperatorio tuvo relación con la infiltración de esta. Todos los pacientes fueron seguidos en nuestra unidad a la semana, al mes y a los 6 y 12 meses mediante consulta y exploración física.
DiscusiónLa incidencia de la eventración posquirúrgica es del 2-20% en pacientes con antecedente de laparotomía. Además, se da en pacientes que tienen factores de riesgo como enfermedad pulmonar obstructiva crónica, desnutrición, cáncer, cirugía bariátrica, estreñimiento y tabaquismo, por lo que la reconstrucción de la pared abdominal es un reto constante para el cirujano7,8. La presentación más frecuente ocurre dentro de los 3 primeros años después de la operación inicial9,10. Una vez que la herniación a través de la pared sucede, el 30% de los pacientes que se repara sin material protésico tendrá recurrencia, debido a la excesiva tensión que condiciona tejido cicatricial desorganizado, susceptible para la recidiva.
Existe un incremento en el uso de materiales protésicos para las hernioplastias, desde<2% en la década de los noventas hasta un 60-95% en la actualidad. Hoy más del 90% de las hernias incisionales son manejadas con material protésico, ya que se acepta que los defectos mayores de 3cm de diámetro deben ser reparados con un soporte estable que favorezca la fibroplasia. En los últimos 20 años se introdujeron diversos tipos de materiales protésicos, con los cuales se ha logrado disminuir la recidiva hasta un 5% y con mejores resultados a largo plazo, ya que el material sintético utilizado será gradualmente reemplazado por fibroplasia del hospedero, lo que resultará en una estructura aponeurótica estable11,12.
La mayoría de las hernias de la pared abdominal pueden ser reparadas de forma programada y planeadas con un cierre fácil del defecto aponeurótico; sin embargo, la presencia de escenarios catastróficos o complejos (hernias complicadas que han perdido su naturaleza benigna y en las que el tratamiento no es simple) implica maniobras adicionales.
Las hernias gigantes (de más de 10cm de diámetro) o aquellas con pérdida de domicilio pueden requerir de métodos para expansión gradual de la pared abdominal mediante neumoperitoneo progresivo, expansores tisulares o de forma transoperatoria con el método de separación de componentes12–17.
El Dr. Tomás Ibarra publicó el uso de toxina botulínica tipo A antes de la realización de plastia de pared abdominal en pacientes con hernia ventral18,19. Su grupo realizó un estudio prospectivo en pacientes con hernias de pared abdominal secundarias a manejo con abdomen abierto. Se aplicó toxina botulínica serotipo A, de forma bilateral en la pared abdominal y bajo guía electromiográfica. Se realizaron mediciones semanales de los defectos de pared abdominal, tanto clínicamente como por tomografía. Se reportó una reducción en el defecto herniario del 47.2% después de la tercera semana de la aplicación de la toxina botulínica. Los pacientes tuvieron una reducción global de 5.25cm. El cierre de la pared se realizó mediante técnicas convencionales18,19.
La toxina se activa selectivamente en terminaciones nerviosas periféricas colinérgicas para inhibir la liberación de acetilcolina, por lo tanto debilita la contracción voluntaria del músculo. El efecto local, fisiológicamente, produce una denervación química y, en consecuencia, una atrofia muscular sin causar fibrosis; con el paso del tiempo el axón se regenera y emite nuevas prolongaciones que vuelven a inervar a la fibra muscular20–27.
El efecto terapéutico se da en 24h. El efecto máximo conseguido ocurre al mes de la aplicación y dura 28 semanas en un 92%28,29.
La toxina es segura y efectiva porque tiene alta especificidad al ser inyectada en un lugar específico, minimizando la exposición sistémica, y por su selectividad de acción, que se une con mayor afinidad a los receptores celulares que permiten que entre a la célula30–32.
Los factores que influyen en el efecto terapéutico son volumen, profundidad, densidad, gravedad y manipulación33,34.
Los efectos adversos (1.6%) son dosis dependientes e incluyen dolor en sitio de inyección (4%), eritema, equimosis (3%), sensación de tensión en piel (12%), parestesia temporal, náuseas (3%), influenza (3%) e hipertensión (3%). No existen efectos acumulativos35,36.
Los objetivos de la reconstrucción de la pared abdominal incluyen restaurar el soporte estructural, proveer de tejido para el cierre de la línea media y optimizar la apariencia estética. Para conseguirlo se dispone de varias técnicas quirúrgicas.
El adelgazar la pared con una separación de componentes para generar el desplazamiento que permitirá el cierre, además del recurso de una malla que lo fortalece y que favorece la cicatrización, continúa siendo un procedimiento cruento y no exento de complicaciones.
La preparación preoperatoria con la infiltración de toxina botulínica serotipo A ha demostrado causar una parálisis flácida de la pared abdominal, y permite el avance de los colgajos laterales sin debilitarlos en su conformación anatómica; por ello, no solo es una herramienta más para asegurar la refuncionalización, sino un recurso que no debilita y no genera dolor mayor al esperado de la cirugía per se.
Esta técnica permite planear en el preoperatorio la magnitud de la cirugía, y no excluye los recursos adicionales en el transoperatorio (si es que fueran necesarios) para conseguir el cierre, como sucedió en algunos pacientes de la serie.
ConclusiónNuestro estudio demostró que en los pacientes que fueron sometidos a plastia abdominal por hernia incisional gigante (con defectos de 10–15cm) la aplicación prequirúrgica de toxina botulínica tipo A (Botox®) logró la parálisis de los músculos laterales de la pared abdominal y, con ello, el cierre con menor tensión durante la cirugía de reconstrucción. El cierre sin tensión fue posible en la mayoría de ellos, mientras que en el resto fue necesario agregar al manejo transoperatorio (técnica de separación de componentes o reforzamiento con plicatura de saco).
El uso de toxina botulínica subtipo A es un recurso prequirúrgico para pacientes con hernias ventrales mayores de 10cm, ya que permite el cierre aponeurótico sin tensión en la mayoría de los casos, y en las ocasiones en las que a pesar de la infiltración con toxina tipo A no permitió el cierre, fue posible utilizar cualquier otro recurso transoperatorio, pero además, con la percepción de una manipulación mucho más ligera de los desplazamientos musculares por tratarse de músculos con parálisis fláccida.
Responsabilidades éticasProtección de personas y animalesPara esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosHemos seguido los protocolos de nuestro centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoHe leído y acepto.
Conflicto de interesesLas autoras declaran no tener ningún conflicto de intereses.