La investigación y desarrollo de materiales protésicos destinados a reparar defectos de pared abdominal ha evolucionado y progresado en los últimos años, con el fin de encontrar la «prótesis ideal». La industria ha ido incorporando nuevos diseños y nuevos materiales, lo que ha provocado cierto desconcierto en el ámbito quirúrgico, especialmente en el dedicado a la reparación de defectos en pared abdominal. El cirujano se ve obligado a saber y conocer los nuevos y diferentes materiales existentes en el mercado y, al mismo tiempo, a tener un conocimiento muy preciso sobre los «territorios» en los que pueden utilizarse. En el presente trabajo hemos procurado adecuar una clasificación de las diferentes prótesis existentes, correlacionando su comportamiento a nivel tisular con la estructura de estas. Diseñamos así una clasificación, modificada de una previa propuesta por nosotros, que cumple los requisitos en cuanto a estructura y ubicación del material protésico, anteriormente mencionados.
Research and development into prosthetic materials designed to repair abdominal wall defects has sought to create the «ideal prosthesis». Industry has been adopting new designs and new materials and this has generated confusion among surgeons, especially those working in the field of hernia repair. Thus, today's surgeon has a certain obligation to find out about these new existing materials and to acquire in-depth knowledge of the settings in which they can be used. In this study, we develop a classification system for the different prostheses available on the market by correlating their behavior regarding tissue integration with their structure. This classification scheme, which is an updated version of another scheme proposed by us, should enable the surgeon to select the best prosthetic material for a given surgical setting according to its structure.
La investigación y el desarrollo de nuevos biomateriales constituyen un área en continua y creciente expansión. La pared abdominal no ha permanecido ajena a las diferentes innovaciones en este campo, sino que además ha contribuido al diseño de nuevos materiales, dándoles nuevas aplicaciones.
En el momento actual, el empleo de materiales protésicos con fines reparativos en la patología herniaria casi se ha generalizado, dejando en un segundo plano las reparaciones con tejidos autógenos del propio paciente, debido a la alta tasa de recidivas1.
En EE. UU., más de un millón de pacientes son tratados al año por presentar defectos herniarios en la pared abdominal. Para su reparación se emplean biomateriales, y este constituye ya el segundo procedimiento quirúrgico después de la cirugía de cataratas2.
Indudablemente, a este cambio drástico en el tratamiento de los defectos herniarios en general contribuyeron los buenos resultados obtenidos por el grupo de Lichtenstein et al.3, con su propuesta de reparación «sin tensión». Previamente, Usher4 ya había publicado resultados similares en sus trabajos, en los que empleaba polipropileno (PP) para la reparación de procesos herniarios.
Desde un punto de vista clínico (e igualmente para el cirujano) es necesario familiarizarse con los diferentes tipos de materiales protésicos existentes, y conocer no solo con qué fin y para qué se han diseñado, sino también cuál es su mejor ubicación en los tejidos.
La clasificación de Amid (propuesta en 19975) ha sido siempre una referencia, y marcó las directrices de aplicación de diferentes materiales protésicos destinados a la reparación herniaria. Sin embargo, la aparición de nuevos materiales con sus modificaciones estructurales como, por ejemplo, PP de diferente porosidad, que incluyen además materiales poliméricos absorbibles (prótesis parcialmente absorbibles) y la irrupción en el mercado de las prótesis naturales o biológicas han generado nuevas expectativas e indicaciones en el ámbito de la aplicación clínica de estos. En un trabajo previo6 propusimos una clasificación que, en el momento actual, creemos que debe ser revisada, por los motivos anteriormente expuestos.
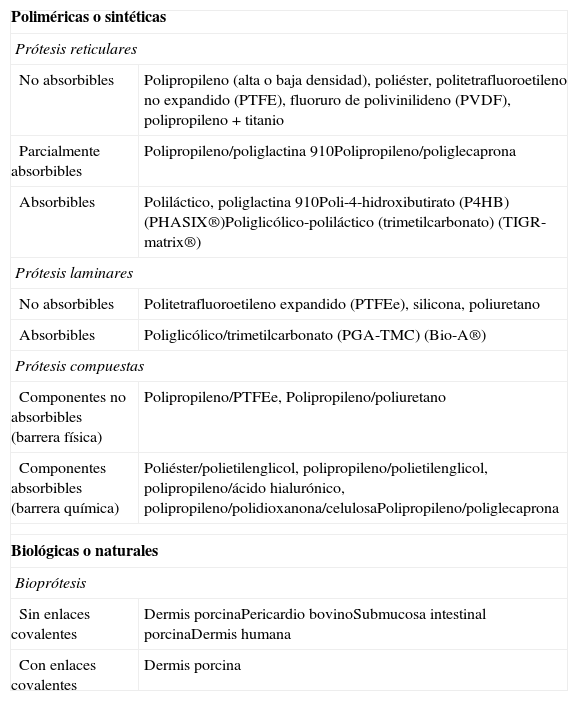
Propuesta de clasificación de las prótesis destinadas a reparar defectos de la pared abdominalLa clasificación que proponemos (tabla 1) correlaciona dos aspectos importantes de las prótesis destinadas a reparar defectos herniarios. Por una parte, la estructura de la prótesis, que de forma genérica puede ser reticular o laminar, y por otra, la ubicación del material en el tejido receptor.
Clasificación de biomateriales (reparación de pared abdominal)
| Poliméricas o sintéticas | |
| Prótesis reticulares | |
| No absorbibles | Polipropileno (alta o baja densidad), poliéster, politetrafluoroetileno no expandido (PTFE), fluoruro de polivinilideno (PVDF), polipropileno+titanio |
| Parcialmente absorbibles | Polipropileno/poliglactina 910Polipropileno/poliglecaprona |
| Absorbibles | Poliláctico, poliglactina 910Poli-4-hidroxibutirato (P4HB) (PHASIX®)Poliglicólico-poliláctico (trimetilcarbonato) (TIGR-matrix®) |
| Prótesis laminares | |
| No absorbibles | Politetrafluoroetileno expandido (PTFEe), silicona, poliuretano |
| Absorbibles | Poliglicólico/trimetilcarbonato (PGA-TMC) (Bio-A®) |
| Prótesis compuestas | |
| Componentes no absorbibles (barrera física) | Polipropileno/PTFEe, Polipropileno/poliuretano |
| Componentes absorbibles (barrera química) | Poliéster/polietilenglicol, polipropileno/polietilenglicol, polipropileno/ácido hialurónico, polipropileno/polidioxanona/celulosaPolipropileno/poliglecaprona |
| Biológicas o naturales | |
| Bioprótesis | |
| Sin enlaces covalentes | Dermis porcinaPericardio bovinoSubmucosa intestinal porcinaDermis humana |
| Con enlaces covalentes | Dermis porcina |
Atendiendo a estos parámetros, clasificamos las prótesis en dos grandes grupos: 1) poliméricas o sintéticas, y 2) biológicas o naturales. Las poliméricas o sintéticas, a su vez, las subdividimos en reticulares, laminares y compuestas, mientras que las biológicas o naturales están constituidas por el grupo de las bioprótesis.
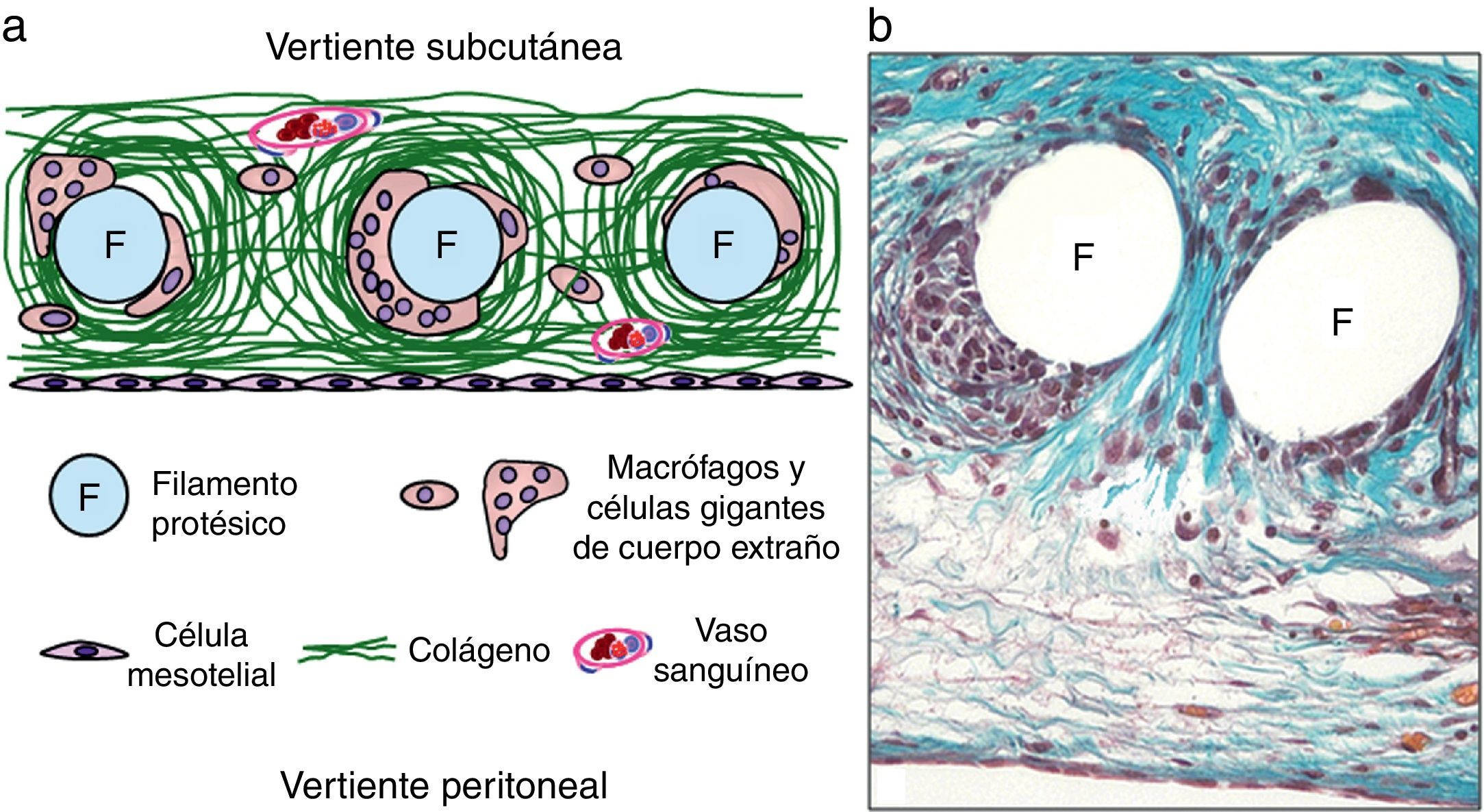
La mayoría de las prótesis reticulares (fig. 1), con poros que oscilan entre 1-4mm, son de PP, aunque también se ha empleado poliéster en su elaboración. Estas prótesis tienen una óptima integración tisular. El tejido conectivo rodea los filamentos, formando espirales sobre estos, y existe una importante angiogénesis, por lo que el anclaje al tejido receptor es excelente. Este hecho se corrobora cuando se llevan a cabo estudios de resistencia a la rotura, en los que la fuerza tensil obtenida es superior a la de otros materiales protésicos.
En los últimos años, las prótesis reticulares clásicas de poro pequeño han sufrido modificaciones, teniendo en cuenta (como parámetro fundamental) el tamaño del poro y otros aspectos, tales como el diámetro de los filamentos y la distribución espacial de estos7.
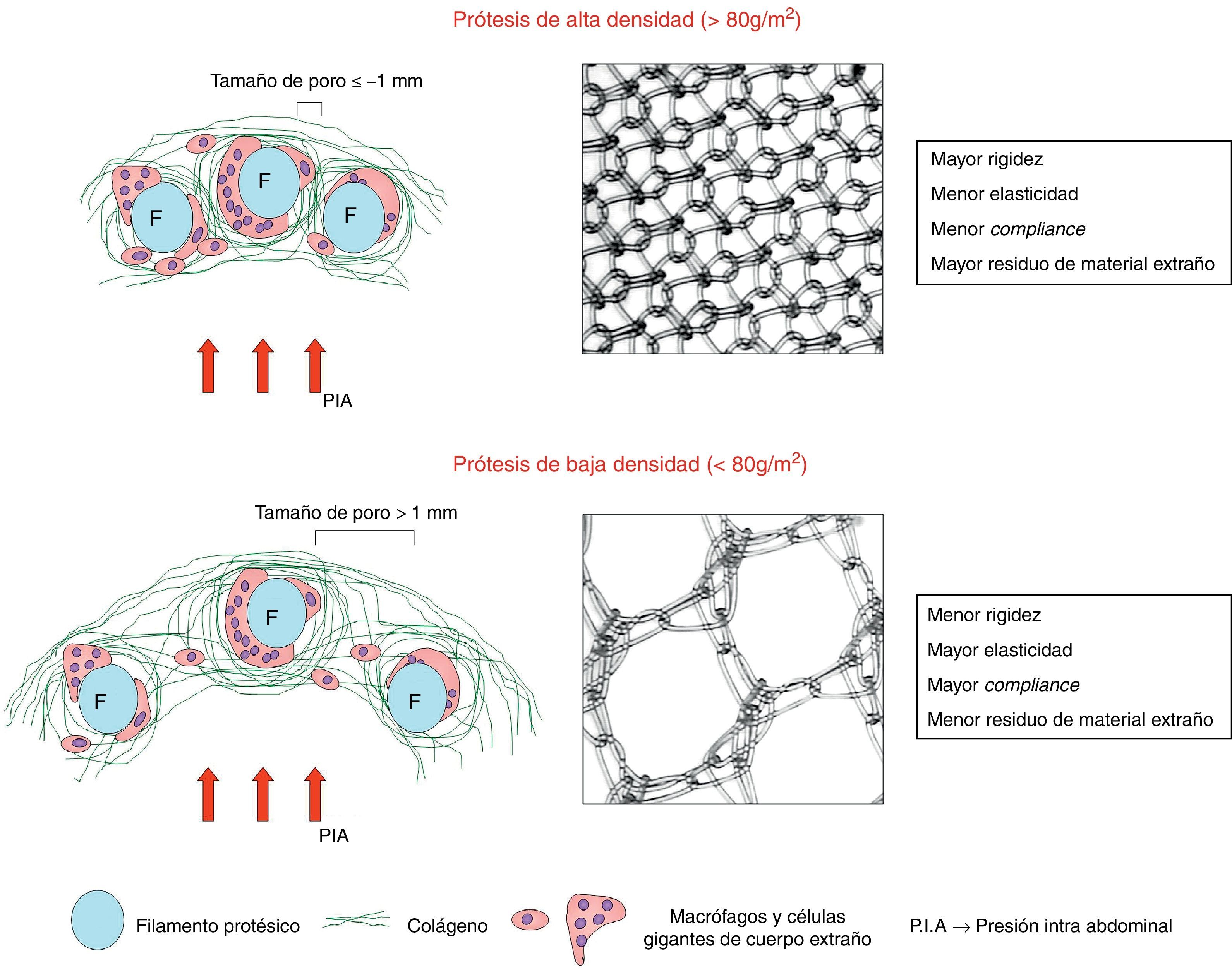
Todos los cambios anteriores han dado lugar a modificaciones en la clasificación de las prótesis reticulares, de tal forma que, dependiendo del parámetro g/m2, se han clasificado en prótesis de alto o de bajo peso (o de alta o baja densidad, respectivamente) (fig. 2).
Se consideran prótesis de alto peso aquellas que se sitúan por encima de 80g/m2, y de bajo peso, las que se encuentran por debajo de esta cifra. Recientemente se han incluido en la clasificación las prótesis de media densidad, cuyo peso estaría entre 50 y 80g/m2, por lo que las bajas densidades se sitúan entonces entre 35 y 50g/m2. En algunas clasificaciones recientes8 todavía se incluye otro tipo, denominado de muy baja densidad, cuyo peso estaría por debajo de los 35g/m2 (tabla 2).
Clasificación de las prótesis reticulares atendiendo a su densidad
| Alta densidad: >80g/m2 |
| Media densidad: 50-80g/m2 |
| Baja densidad: 35-50g/m2 |
| Muy baja densidad: <35g/m2 |
Modificada de Earle y Mark8.
Algo importante que hay que tener en cuenta es que a veces el peso protésico es independiente del tamaño del poro. Ello se debe a que hay prótesis con un diseño de poro pequeño, con una estructura espacial y un anudado o entrecruzamiento simple y, a su vez, un filamento muy fino, que son incluidas en las clasificaciones como de baja densidad por tener en su conjunto un peso en g/m2 bajo.
Este último aspecto es importante, ya que, de acuerdo con la escuela alemana9, nosotros consideramos que el tamaño del poro protésico es el principal parámetro para considerar una prótesis como de alta o de baja densidad. De esta manera, las prótesis de alta densidad tendrían un diseño con poro pequeño, mientras que las de baja densidad tendrían un poro amplio.
También se han diseñado prótesis reticulares con material absorbible. De esta forma, se elaboran prótesis parcialmente absorbibles o de tipo híbrido, en las cuales hay componentes absorbibles y no absorbibles. Estas prótesis son de poro amplio y, por lo tanto, de baja densidad10.
Otra innovación en los materiales de tipo reticular ha sido el pretratamiento de estos; el más empleado es el recubrimiento con titanio, en prótesis tanto de alta como de baja densidad. Los resultados parecen ofrecer ventajas con relación a los implantes de PP convencional11.
Los objetivos de los nuevos diseños de baja densidad son, fundamentalmente, reducir la cantidad de material extraño que queda ubicado en el huésped y dejar una fibrosis menor en el tejido receptor12. Ello permitiría que la pared abdominal no sufra en algunos casos «rigideces», que pueden observarse en algunos pacientes operados con prótesis convencionales de PP, especialmente con aquellas de alta densidad (es decir, de poro pequeño). No cabe duda de que la ventaja de reducir la cantidad final de material extraño en el organismo receptor debería ser ventajosa, de manera especial en aquellos implantes efectuados en pacientes muy jóvenes. Obviamente, en estos pacientes el biomaterial ha de permanecer a veces largo tiempo incluido en los tejidos, y no se sabe todavía la reacción o los cambios últimos que pueden generar después de muchos años de haberse efectuado el implante.
Estudios de nuestro grupo13 han demostrado que la integración y la resistencia mecánica, tanto en el caso de las prótesis de bajo peso como en el de las parcialmente absorbibles, son similares a las de las prótesis reticulares convencionales de alto peso. Es de destacar que ya desde los primeros momentos del implante (dos semanas) el depósito de colágeno en las prótesis de amplio poro es muy precoz14. Este hecho podría explicar que no existan diferencias en cuanto a resistencia mecánica entre estas prótesis de baja y las de alta densidad, cuando se realizan ensayos a tiempos largos de estudio (3-6 meses después del implante). En un reciente trabajo de nuestro grupo, hemos podido comprobar que el tejido receptor modula a largo plazo el comportamiento de los implantes, obteniendo valores de resistencia mecánica similares cuando se comparan prótesis de alto y bajo peso15.
Otro material incorporado en forma de prótesis reticular ha sido el fluoruro de polivinilideno16. Este polímero unido al PP convencional para constituir una prótesis ha sido empleado incluso para reparaciones intraperitoneales17.
Una innovación también importante en el campo de las prótesis reticulares ha sido la creación de prótesis autofijables. Estas prótesis tienen un sistema de adhesión en forma de gancho que además es biodegradable, lo que permite la adherencia al tejido de forma casi inmediata. Están confeccionadas con PP y ácido poliglicólico, y su estructura es de poro pequeño18.
Actualmente, también disponemos de prótesis reticulares de politetrafluoroetileno (PTFE) no expandido, que son prótesis de media densidad (70g/m2), aunque por el momento no existen resultados clínicos de su comportamiento (aunque sí experimentales19).
Finalmente, englobados dentro de las prótesis reticulares, se encuentran los materiales totalmente absorbibles. Los primeros en ser utilizados como soporte temporal fueron compuestos de poliláctico y poliglicólico. La biodegradación de estas prótesis es de 2-3 meses. Actualmente han aparecido prótesis absorbibles reticulares de larga duración, formadas por compuestos de poliglicólico y politrimetilcarbonato (TIGR-matrix®) y poli-4-hidroxibutirato (PHASIX®). Estos biomateriales sufren una degradación paulatina que varía entre 12 y 36 meses20.
La prótesis reticular ideal, desde el punto de vista mecánico, sería aquella que mejor se adaptara a las propiedades fisiológicas de la pared abdominal. Hay que tener en cuenta que la pared del abdomen no se comporta como un sistema estático, sino que está sometida a cambios de presión continuos. Las prótesis deberían soportar la tensión mecánica en todas las direcciones, teniendo en cuenta la anisotropía de la pared abdominal21–23 y permitiendo una movilidad homogénea ante esfuerzos puntuales (tos, vómito, etc.) o permanente (presión positiva intraabdominal).
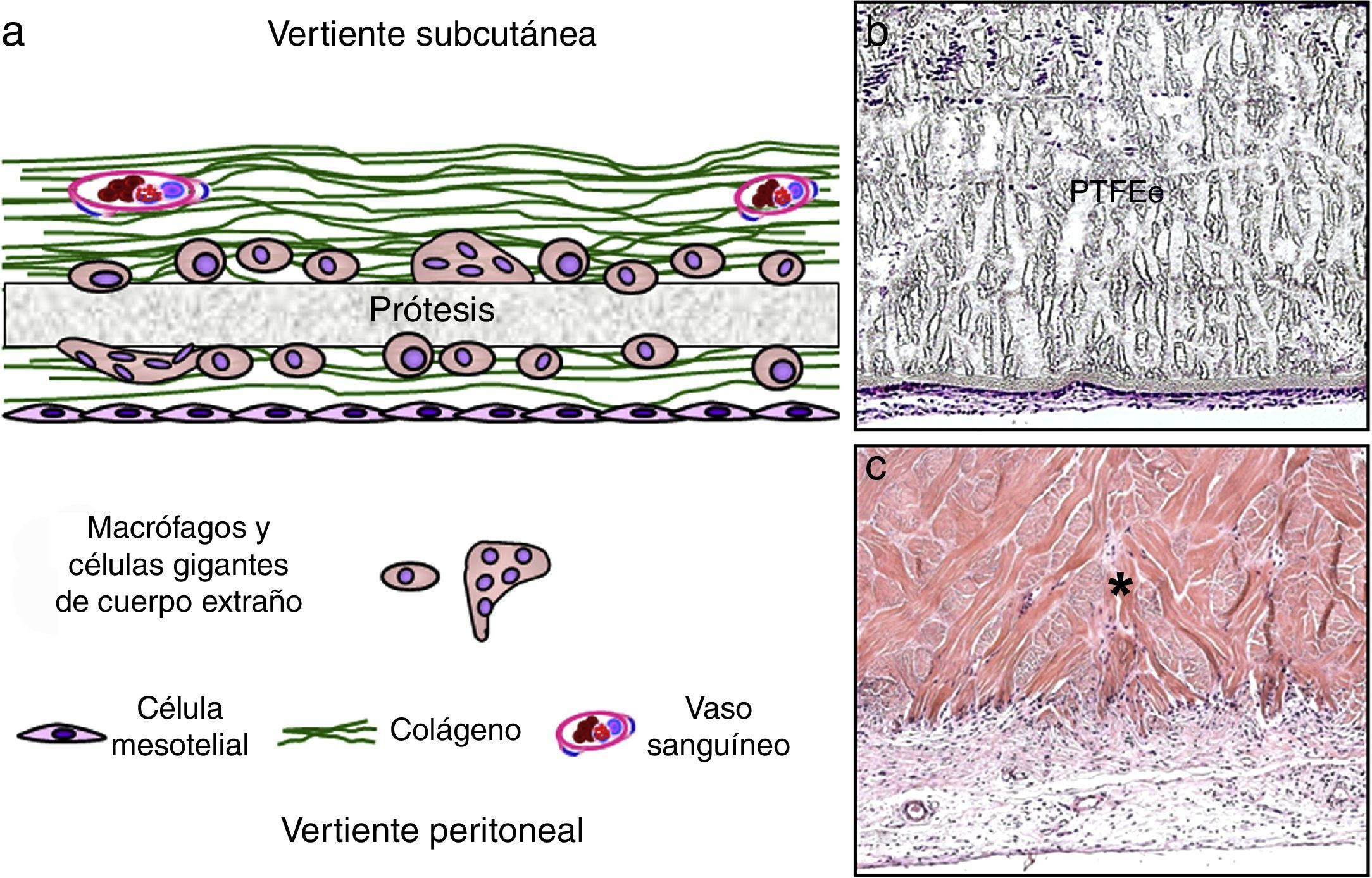
Las prótesis laminares (fig. 3) están representadas fundamentalmente por el PTFE expandido (PTFEe), en todas sus variantes. Su integración es de tipo celular, invadiendo las células procedentes del tejido receptor los tercios más externos del material. Desde el punto de vista tisular, el mecanismo de integración se lleva a cabo finalmente por encapsulación. Los vasos no penetran en los intersticios del PTFEe, y la interfaz prótesis-tejido receptor es débil desde el punto de vista mecánico.
a) Esquema de integración de prótesis de tipo laminar; b) Aspecto microscópico de una prótesis sintética no absorbible de PTFEe transcurridos 3 meses del implante experimental (hematoxilina-eosina, 100×); c) Prótesis biológica absorbible de origen biológico (*) a los 90 días del implante experimental (tricrómico de Masson, 100×). PTFE: politetrafluoroetileno expandido.
Cuando alguna de estas prótesis se ha modificado (por ejemplo, perforándose con pequeños orificios, es decir, creando así una prótesis macro-microporosa), los resultados de resistencia mecánica no mejoran24.
En la última generación de prótesis de PTFEe ha surgido otra modificación en la que se suprime la integración celular por la vertiente peritoneal del implante, y solamente dicha integración se efectúa por la vertiente superficial de la prótesis, que va provista de una superficie rugosa (DualMesh®). Esta modificación tampoco ha mejorado la resistencia mecánica de las prótesis convencionales de PTFEe25.
Algo importante en cuanto a modificaciones de estas prótesis ha sido su impregnación con una solución argéntica y clorhexidina para impedir la adhesión bacteriana en los primeros momentos después del implante (DualMesh Plus®). Estudios efectuados con esta modificación han constatado el beneficio aportado por este pretratamiento en este tipo de biomaterial26.
Pero quizás las diferencias más interesantes que poseen las prótesis laminares respecto a las reticulares son aquellas que acontecen cuando el biomaterial se coloca en contacto directo con el peritoneo visceral.
Estudios realizados sobre la formación de neoperitoneo (tanto in vitro como in vivo) en la vertiente protésica en contacto con las vísceras abdominales han demostrado que las características de este dependen de la estructura del material empleado en la reparación.
Las prótesis laminares permiten un buen desarrollo de neoperitoneo. En estudios experimentales27 se observa ya muy precozmente una red de fibras de colágeno recubiertas de células mesoteliales típicas. Estas fibras se colocan de forma paralela a la superficie protésica y se acompañan por un gran número de células, sobre todo fibroblastos y algunas células de reacción a cuerpo extraño.
Después de este tiempo, el neoperitoneo se remodela, desapareciendo la mayoría de las células de reacción a cuerpo extraño (índice de la buena tolerancia de la prótesis), y los fibroblastos son las dominantes.
Finalmente, las fibras de colágeno se sitúan de forma paralela a la superficie protésica, y el mesotelio se sitúa por fuera de estas, en contacto con el peritoneo visceral.
La génesis de este neoperitoneo perfectamente conformado evita una de las complicaciones que pueden aparecer después de la colocación de una prótesis en contacto con el peritoneo visceral, que es la formación de adherencias.
Las prótesis reticulares tipo PP generan, por el contrario, un neoperitoneo con una estructura desorganizada, de textura rugosa, con algunas zonas de hemorragia y necrosis que facilitarían la aparición de adherencias. Por tanto, la estructura reticular de la prótesis probablemente condicione una inapropiada disposición de las células mesoteliales sobre esta.
Estos comportamientos se pueden corroborar en estudios efectuados in vitro, en los que, tras la siembra de células mesoteliales sobre diferentes biomateriales, la mesotelización uniforme y rápida se consigue solamente con prótesis de tipo laminar28.
En estudios in vivo, cuando se emplea un mismo biomaterial con estructura diferente, por ejemplo PTFE (en forma de malla o bien laminar), la morfología del neoperitoneo cambia. Por ello, la composición química del biomaterial no tiene ninguna influencia en este comportamiento29.
Entre las prótesis laminares existen actualmente materiales poliméricos, absorbibles, cuya estructura es un copolímero formado por ácido poliglicólico y trimetilcarbonato (Bio-A®). Estos materiales tienen un comportamiento peritoneal similar a las prótesis de PTFEe, y presentan una buena mesotelización. Respecto a su integración tisular, su comportamiento consiste en encapsulación por tejido conectivo y reabsorción entre 3 y 6 meses30. Son materiales diseñados para refuerzo tisular. En clínica se han publicado resultados preliminares, ensayando este material en reparación herniaria31.
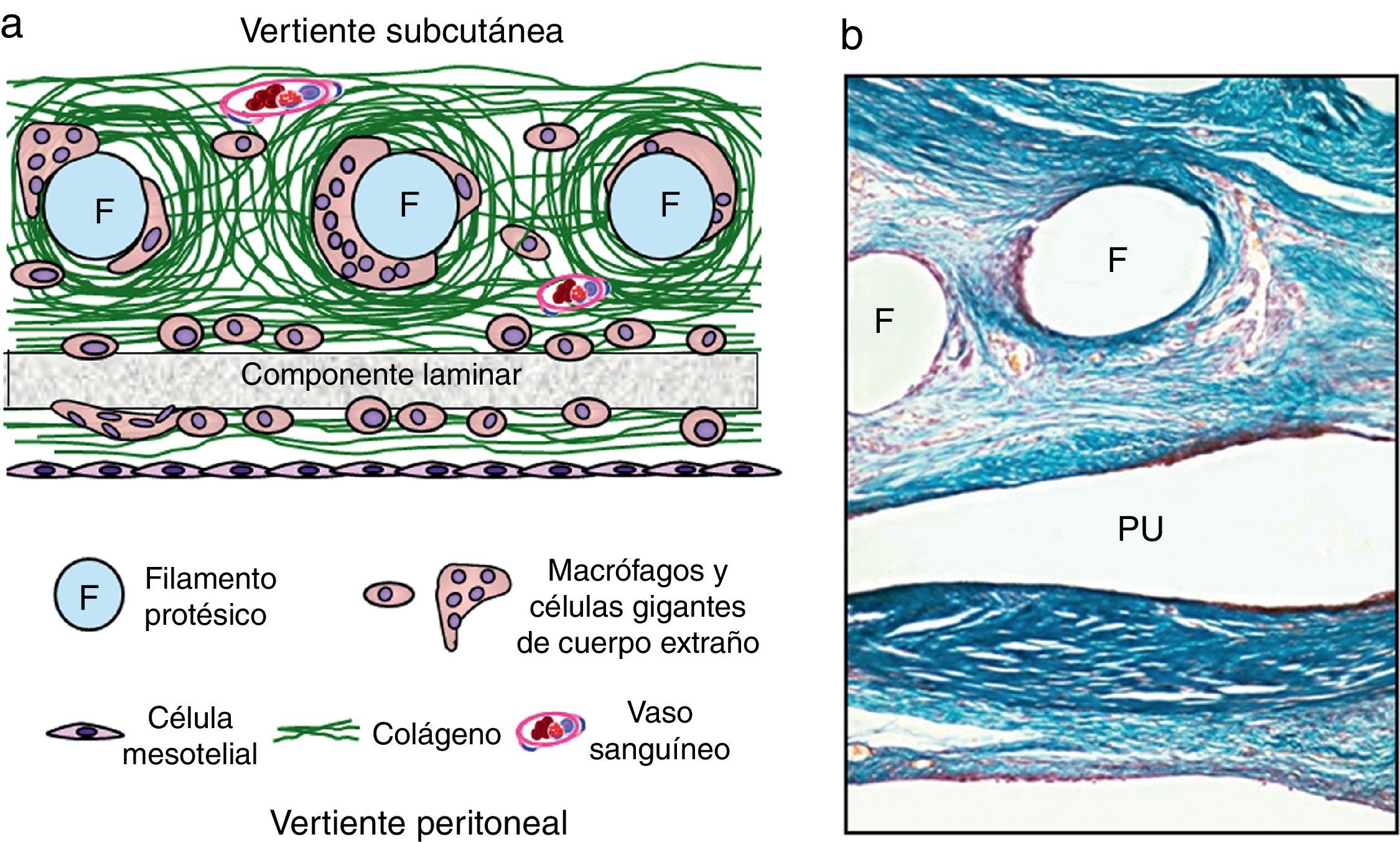
Para reunir en una sola prótesis la respuesta tisular de reticulares y laminares, han surgido las prótesis compuestas (fig. 4). De esta forma, se podrían alcanzar las cualidades básicas de un implante, propuestas por Schein et al.32, que deberían ser: a) buena integración tisular; b) buen comportamiento a nivel peritoneal, y c) buena resistencia mecánica después del implante.
a) Esquema de integración de prótesis de tipo composite; b) Imagen a microscopia óptica de una prótesis compuesta por filamentos de polipropileno (F) (vertiente subcutánea) y recubierta por una lámina no absorbible de poliuretano (PU) hacia la vertiente peritoneal (tricrómico de Masson, 100×).
Estas prótesis de «doble capa» o composites sirven para la reparación de grandes defectos herniarios, en los que básicamente hay que llevar a cabo una reconstrucción total de la pared abdominal y en los cuales prácticamente no hay soporte de tejido, por lo que las prótesis tienen que quedar ubicadas en contacto con el peritoneo visceral. Estas prótesis han abierto un amplio abanico de posibilidades en la reparación de grandes defectos abdominales. Por ello, el objetivo primordial de estas es mejorar el comportamiento en relación con la interfaz visceral y evitar la aparición de algunas complicaciones, como cuadros de obstrucción intestinal por formación adherencial y fístula entero-cutánea, generada la mayor parte de las veces por el contacto entre el intestino y el material protésico.
Las prótesis compuestas tienen dos componentes: uno de ellos puede ser el biomaterial principal (primer componente), al que se puede añadir otro, que cumpla la función específica que no puede llevar a cabo el primero (segundo componente). Así, la finalidad del diseño de estas prótesis es que el biomaterial que constituye el primer componente asuma el papel de integración tisular, y el segundo componente sea el que quede ubicado en contacto directo con el peritoneo visceral y module el comportamiento en esta interfaz. Ambos componentes suelen estar unidos mediante pegamentos acrílicos, termosellado e incluso sutura.
Los biomateriales que forman el primer componente suelen ser prótesis de tipo reticular (bien PP, bien poliéster). El segundo componente suele ser de tipo laminar, y puede ser absorbible o no absorbible.
Debido a las características de este segundo componente, se habla de prótesis con «barreras físicas y/o químicas». Las primeras serían aquellas provistas de un componente no absorbible, y las segundas, con un componente absorbible.
La integración de estas prótesis se consigue a través de su componente reticular, mientras que el segundo componente permite una correcta mesotelización.
Ambas barreras físicas y/o químicas no ofrecen diferencias significativas en relación con el depósito mesotelial y la formación de un neoperitoneo estable, si bien los componentes biodegradables de estas (en el caso de las químicas) ofrecen la ventaja de no dejar residuos en el organismo receptor, al ser biodegradadas por el mismo33.
Recientemente han surgido prótesis composite con dos componentes biodegradables de poliglecaprona, en los que la parte de material no degradable está entre las dos capas mencionadas, similar a una estructura «en sándwich». Este diseño dejaría el componente no degradable preparado para su integración al tejido, una vez que las capas que lo recubren sufran la correspondiente biodegradación. La tendencia actual en cuanto a la génesis de nuevos composites es diseñar prótesis parcialmente absorbibles en la zona, cuya función es la integración con el tejido receptor y prótesis con barreras solamente de tipo químico34.
Las prótesis biológicas o bioprótesis son materiales de origen natural, derivadas de colágeno, de procedencia animal o humana. El objetivo de estos biomateriales es conseguir, además de la reparación, la regeneración tisular, de manera que una vez implantados estimulen elementos de la matriz extracelular del receptor, favorezcan la angiogénesis e incluso impliquen a los factores de crecimiento en la creación de una neopared abdominal. Su misión en condiciones ideales es alcanzar no solo la reparación de la zona, sino la regeneración tisular. Para conseguir este último objetivo es necesario que el proceso de degradación/regeneración esté controlado. Este control requiere el pretratamiento de las bioprótesis con diferentes sustancias, que crean enlaces covalentes entre las fibras de colágeno e impiden la degradación rápida de estas por las diferentes colagenasas.
Varias prótesis biológicas están actualmente disponibles en el mercado. Su clasificación se puede realizar atendiendo a varios factores: a) la especie animal de origen: animal (xenogénico) o humano (alogénico); b) la procedencia del tipo de matriz tisular (dermis, pericardio, submucosa intestinal), y c) la presencia o ausencia de enlaces covalentes entre las moléculas de colágeno. La presencia de enlaces (los cross-link en terminología inglesa) hace que estos materiales no sean biodegradables, mientras que la ausencia de enlaces (sin cross-link) haría degradables a las mismas35. Creemos que una clasificación que atienda a este último parámetro es la más adecuada desde el punto de vista clínico. El cirujano debe saber, dependiendo del tipo de reparación que va a realizar, cuál es el material biodegradable o cuál es el que va a permanecer en los tejidos de forma definitiva.
Las prótesis biológicas constituyen una nueva herramienta disponible para el tratamiento de defectos de la pared abdominal. Sin embargo, hasta el momento, la experiencia clínica en el empleo de estas prótesis es todavía limitada, debido a varias causas. En primer lugar, la existencia de otros materiales inertes (PP, poliéster, PTFEe) que han aportado buenos resultados tras su implante. En segundo lugar, las indicaciones precisas que tienen estas prótesis biológicas, que se destinan fundamentalmente a zonas de reparación afectadas por contaminación bacteriana. En tercer y último lugar, por el coste de estos materiales, que es muy elevado.
Por otro lado, los trabajos publicados en los que se menciona el uso de bioprótesis carecen de un seguimiento a medio/largo plazo suficiente como para obtener resultados y conclusiones en cuanto al beneficio de su uso36.
Muchos trabajos recogen experiencias de un solo caso, y otras series cortas aportan experiencias iniciales que no son concluyentes en cuanto a la utilidad real del empleo de estos biomateriales37. Por ello, es necesario realizar estudios prospectivos con seguimientos a largo plazo que evalúen el rendimiento real y la relación coste/beneficio de estos materiales.
El comportamiento de estas bioprótesis desde el punto de vista reparativo en la integración tisular, en las que tienen enlaces covalentes, es muy similar a las prótesis poliméricas de tipo laminar. En las bioprótesis desprovistas de enlaces, el tejido receptor acaba sustituyendo al material, aunque con una significativa variabilidad en el tiempo. Estas últimas prótesis todavía necesitan un control respecto al momento exacto de su biodegradación. En implantes peritoneales, la formación de neoperitoneo es similar al inducido por las prótesis laminares de origen polimérico38.
Estructura de la prótesis y su lugar de ubicaciónVisto el comportamiento de los diferentes tipos de materiales, tanto en la interfaz prótesis-tejido de anclaje como en la peritoneal, podemos deducir donde colocar una prótesis reticular o una laminar:
Cualquier prótesis de estructura reticular (no absorbible, absorbible o parcialmente absorbible, independientemente de su composición química), debe ser siempre colocada en una interfaz tejido-tejido, nunca en contacto con el peritoneo visceral. Cuando estas se colocan en contacto con las asas intestinales, pueden surgir diferentes efectos adversos, tales como formación adherencial, obstrucción39 o fístula intestinal40. Los resultados mecánicos muestran un comportamiento óptimo para estas prótesis de tipo reticular.
Las prótesis laminares, sean poliméricas o biológicas, tienen un excelente comportamiento en la interfaz peritoneal. La integración tisular genera una encapsulación en las no absorbibles. En las biodegradables de origen biológico, el tejido receptor puede reemplazar al material protésico en un tiempo variable, aunque cuando la biodegradación es lenta, existe inicialmente encapsulación, al igual que sucede en las poliméricas30 (tabla 3).
Integración de las prótesis a nivel del tejido receptor y formación del neoperitoneo
| Prótesis-tejido receptor (integración-resistencia biomecánica) | Neoperitoneo | |
| Reticulares (polipropileno, poliéster, PVDF, PTFE) | +++++ | + |
| Laminares (poliméricas y biológicas) | ++ | +++++ |
| Prótesis compuestas | +++++ | +++++ |
Por último, las prótesis tipo composite tienen un comportamiento óptimo en todas las interfaces, por lo que son los materiales idóneos para reparar defectos totales de la pared abdominal.
En general, los biomateriales destinados a la reparación herniaria están permanentemente evolucionando respecto a su composición polimérica, buscándose materiales totalmente absorbibles a medio y largo plazo. Otra de las líneas de investigación es la mejora de la integración tisular incluso en condiciones adversas. En este sentido, cabe destacar los estudios que se están realizando, de forma experimental de momento, pretratando los diferentes materiales con recubrimientos poliméricos que pueden liberar fármacos de una forma controlada (como, por ejemplo, antibióticos) y, con ello, impedir la aparición de complicaciones, como la infección41,42.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses