Los hongos endofitos son organismos que se caracterizan por liberar una gran variedad de metabolitos secundarios al medio. En el presente estudio se caracterizó la capacidad de un hongo endofito con micelio estéril aislado de Espeletia sp. para controlar al fitopatógeno de la patata Phytophthora infestans. La secuencia de las regiones internal transcribed spacer (ITS) del hongo mostró un 94% de similitud con la de Diaporthe phaseolorum. La interacción antagónica entre Diaporthe sp. y P. infestans se evaluó en 3 medios de cultivo: agar papa dextrosa (PDA), jugo V8 y Czapek. En las pruebas duales se observó el efecto antagonista que ejerció Diaporthe sp. en el crecimiento de P. infestans, que mostró diferencias en el efecto inhibitorio de acuerdo con el medio usado. Se detectó una expresión diferencial del gen que codifica para la amilasa durante el antagonismo.
Los hongos endofitos se caracterizan por producir una gran variedad de proteínas y metabolitos secundarios1,9,10, que los convierte en microorganismos potencialmente útiles en diversos campos, como la medicina y la agricultura, entre otros. Un apreciable número de las proteínas secretadas por los endofitos generan antagonismo frente a una gran variedad de fitopatógenos6. La caracterización de los genes involucrados en las pruebas de antagonismo es actualmente un importante tema de investigación, ya que permitiría entender el mecanismo molecular involucrado en estas interacciones y estimular, así, el desarrollo de herramientas de control biológico mucho más contundentes2.
Phytophthora infestans es el agente causal del tizón tardío de la patata y el tomate, enfermedad que causa pérdidas económicas incalculables a escala mundial. Durante años se ha intentado controlar a P. infestans mediante el uso de productos químicos. Sin embargo, además de los altos costes económicos que genera su uso y de los efectos dañinos que éstos pueden llegar a causar, con el tiempo se seleccionan cepas del patógeno resistentes a los químicos. Por tal razón, surge la necesidad imperiosa de producir controles biológicos que ayuden a mitigar el efecto devastador de P. infestans5.
En estudios anteriores, se caracterizó el potencial inhibidor de 100 hongos endofitos aislados de Espeletia grandiflora y Espeletia corymbosa contra organismos fitopatógenos como Fusarium oxysporum, P. infestans, Rhizoctonia solani, Botrytis cinerea, Ralstonia solanacearum, Pseudomonas syringae, Erwinia carotovora y Xanthomonas campestris4. En esta evaluación se escogieron los endofitos que tuvieron un efecto biocontrolador sobre P. infestans y que identificaron un hongo con micelio estéril, que se caracterizó por inhibir el crecimiento del oomiceto sin contacto físico de los micelios, lo que evidenciaba la producción de algún tipo de compuesto difusible causante de este tipo de antagonismo6.
Las interacciones de tipo antagonista se caracterizan por un diálogo molecular que depende de la disponibilidad de los nutrientes del medio, de la edad del inóculo y de los hongos involucrados en la interacción, ya que todas las interacciones antagónicas son altamente específicas y se encuentran mediadas por la expresión diferencial de genes, como en el caso de la interacción entre Heterobasidion annosum y Physisporinus sanguinolentus11.
El principal objetivo de esta investigación fue evaluar in vitro el potencial biocontrolador de Diaporthe sp. sobre P. infestans, así como caracterizar la expresión diferencial de algunos genes en Diaporthe sp. durante el antagonismo.
Materiales y métodosOrganismos y condiciones del medioEl hongo endofito de micelio estéril se recuperó previamente a partir de hojas de frailejón del páramo de Cruz Verde y P. infestans se recuperó a partir de plantas de patata amarilla (Solanum phureja) con síntomas de tizón tardío. La cepa de P. infestans se caracterizó previamente en este laboratorio, y presentó el haplotipo mitocondrial ii a, el tipo de apareamiento A1 y todas las características morfológicas y moleculares propias de la especie (Restrepo, datos sin publicar). El endofito y P. infestans se mantuvieron a temperatura ambiente (promedio anual de 17°C) en cajas de Petri con medios agar papa dextrosa (PDA) (agar al 1,7% y glucosa al 2%) y jugo V8 (177,6ml; carbonato de calcio de 1g y agar de 17g para 1l) durante 8 días antes de realizar las pruebas de antagonismo.
Identificación del hongo endofito de micelio estérilLa extracción, amplificación y secuenciación de la región ITS (internal transcribed spacer) se realizó según Avila et al4. En resumen, se realizó la extracción de ADN a partir de muestras miceliales liofilizadas; posteriormente, se realizó la amplificación por PCR de la región ITS mediante el uso de los cebadores ITS4 e ITS519, los que amplificaron la región ITS1, 5.8S e ITS2. La secuencia ITS se sometió a una comparación frente a una base pública de datos con el algoritmo Blastn con parámetros por defecto3.
Pruebas de antagonismoLas pruebas de antagonismo se desarrollaron en 3 medios de cultivo: Czapek, PDA y jugo V8. Se hizo crecer a los antagonistas a temperatura ambiente durante 8 días. Para los ensayos de antagonismo o ensayos duales se tomó un disco de 5mm de diámetro de una colonia de P. infestans de 8 días de crecimiento en PDA a partir del borde de la zona de crecimiento del oomiceto. P. infestans se sembró 48 h después de haber sembrado el endofito4. Como controles se cultivaron tanto el endofito como el oomycete por separado. Cada cultivo tuvo 5 réplicas.
A partir del tercer día y hasta el octavo se realizaron mediciones diarias del diámetro de crecimiento de la colonia para P. infestans. El experimento completo se repitió 3 veces.
ABC = ∑ i = 1 n - 1 [ ( t i + 1 - t i ) ( y i + y i + 1 ) / 2 ]
Sobre la base de los datos de crecimiento diario de la colonia de P. infestans, se estimó el área bajo la curva (ABC) del crecimiento de la colonia mediante el uso de la siguiente fórmula:
Donde t=tiempo en días e y=diámetro de la colonia de P. infestans en centímetros.
Extracción de ARNSe realizaron extracciones de ARN del endófito Diaporthe sp. y del oomiceto al quinto y al octavo día después de iniciadas las pruebas duales. El mismo procedimiento se empleó para los controles, P. infestans y Diaporthe sp. crecidos de manera independiente. La extracción se llevó a cabo mediante el SV Total RNA Isolation System (Promega, EE. UU.) y el PureYield RNA Midiprep System (Promega), según las instrucciones del fabricante.
Para cada extracción se tomó un raspado de micelio correspondiente a cada tiempo de muestreo a partir de los medios sólidos en donde se realizaron las pruebas duales. Los raspados miceliales de las 5 réplicas de cada tiempo se mezclaron y luego la mezcla se liofilizó o maceró en nitrógeno líquido para la posterior extracción de ARN. Igualmente, se realizó la extracción de ARN de Diaporthe sp. que crecía solo, de P. infestans que crecía solo, de P. infestans durante el antagonismo al quinto y al octavo día como control y del endofito en el antagonismo al quinto y al octavo día. Con el fin de evitar contaminaciones con el fitopatógeno en las pruebas duales, las muestras del endofito se tomaron a 0,5cm de distancia con respecto a la zona de interacción entre los 2 organismos.
El ARN aislado a partir de los raspados miceliales del endófito y del oomiceto se congeló inmediatamente a −80°C. La integridad del ARN se verificó en geles desnaturalizantes de agarosa al 1,2% (1,2g de agarosa; 87ml de agua con dietilpirocarbonato, 10ml de morpholineopropan esulfonic acid (MOPS) 10X y 3ml de formaldehído al 37%, para un volumen final de 100ml). Como tampón para la electroforesis se utilizó MOPS 1X.
Reverso-transcriptasa-PCRA partir del ARN de las distintas muestras miceliales, se sintetizó ADN complementario (ADNc) de cadena sencilla por medio de la utilización de iScript® cDNA Synthesis Kit (Bio-Rad, EE.UU.). La calidad del ADNc de cadena sencilla se verificó en geles de agarosa al 1%. Los productos de ADNc de cadena sencilla se utilizaron como sustrato para la reacción de amplificación por PCR (94°C durante 2min, 94°C durante 30 s, 45°C durante 30 s y 72°C durante 1min) en busca de genes involucrados en el antagonismo de Diaporthe sp. en contra de P. infestans.
Sobre la base de estudios anteriores, se diseñaron cebadores que amplificaran el gen de la amilasa20. Por otro lado, se diseñaron cebadores para el gen de la endopoligalacturonasa, debido a su posible expresión durante el antagonismo. La secuencia del gen se obtuvo a partir del GenBank, con número de acceso AJ582180 . Como control se utilizó la fracción ribosómica 18S, y su secuencia se obtuvo a partir de un alineamiento de todas las secuencias ribosómicas 18S para Diaporthe sp.; se obtuvo como último resultado una secuencia consenso, a partir de la cual se diseñaron los cebadores.
ResultadosPruebas de antagonismo entre Diaporthe sp. y P. infestansLa secuencia de la región ITS del hongo endofito aislado de Espeletia sp. resultó en un 94% similar a la del hongo Diaporthe phaseolorum. Por esta razón, el hongo de micelio estéril sólo se pudo clasificar hasta la categoría de género y se lo nombró en lo sucesivo Diaporthe sp. La secuencia se envió al GenBank y presentó el número de acceso EU272511 .
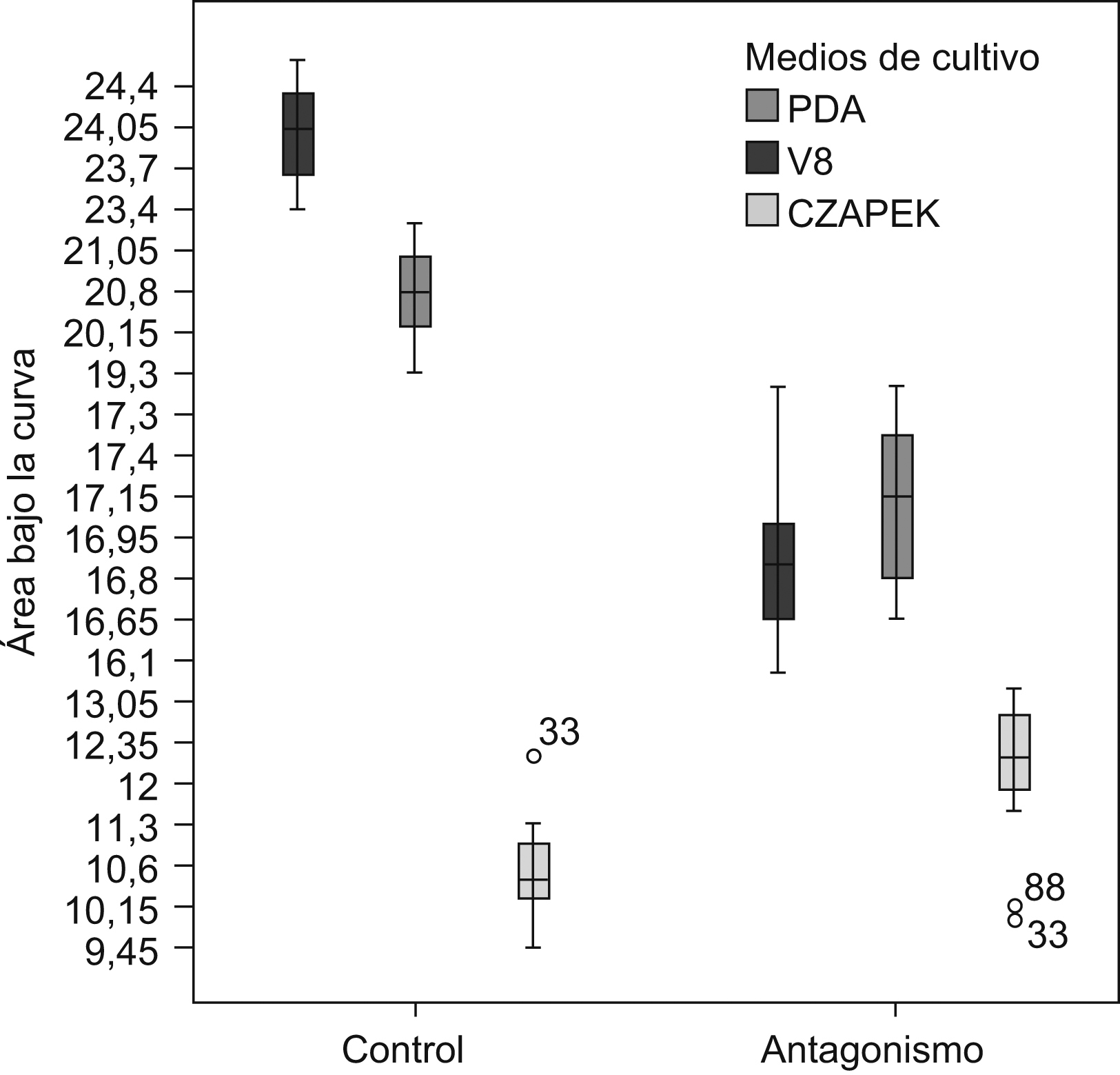
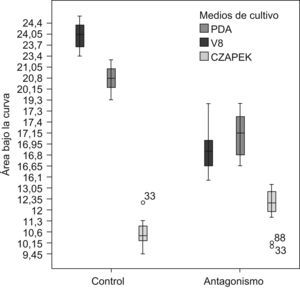
Las características morfológicas del antagonismo en los 3 medios de cultivo fueron distintas. En el medio V8, el hongo endofito presentó la mayor biomasa y crecimiento algodonoso en comparación con los otros dos medios, además de tener un crecimiento mucho más acelerado. En PDA, el hongo endofito Diaporthe sp. creció más lentamente en comparación con lo observado en el medio V8. En el medio V8, P. infestans se inhibió en un 30%, mientras que en PDA la inhibición en su crecimiento fue de un 16,64%. En el medio Czapek no se observó antagonismo, varianza que en la mayoría de las pruebas duales no se inhibió el crecimiento de P. infestans. El ABC obtenida para P. infestans en los medios jugo V8 y PDA mostró diferencias significativas entre los controles y las pruebas duales (p<0,001). Mediante un análisis de la varianza del ABC y una prueba de comparación múltiple de medias (Tukey) para los 3 medios estudiados se evidenciaron diferencias significativas entre los medios jugo V8 y Czapek en la inhibición del crecimiento de P. infestans (p<0,001). En la figura 1 se pueden observar las diferencias entre los controles y los antagonismos para los 3 medios de cultivo estudiados, aunque no se evidenciaron diferencias marcadas entre los medios jugo V8 y PDA.
Figura 1. Diferencias del área bajo la curva para los ensayos de antagonismo y los controles en las siembras duales de P. infestans y Diaporthe sp. en los medios jugo V8 y PDA. Los resultados obtenidos para el medio Czapek no muestran ningún tipo de patrón estadísticamente significativo, el que sí se aprecia entre los medios PDA y jugo V8, tanto en los controles como en los antagonismos.
La variación del ABC para los 3 experimentos fue baja, tanto para los antagonismos como para los controles, y demostró la reproducibilidad de los datos obtenidos para cada experimento (datos no mostrados). Todos estos datos indican que el medio adecuado para realizar las pruebas de antagonismo para este estudio e, idealmente, favorecer la expresión génica del hongo endófito es un medio rico en nutrientes, como el jugo V8 o el PDA.
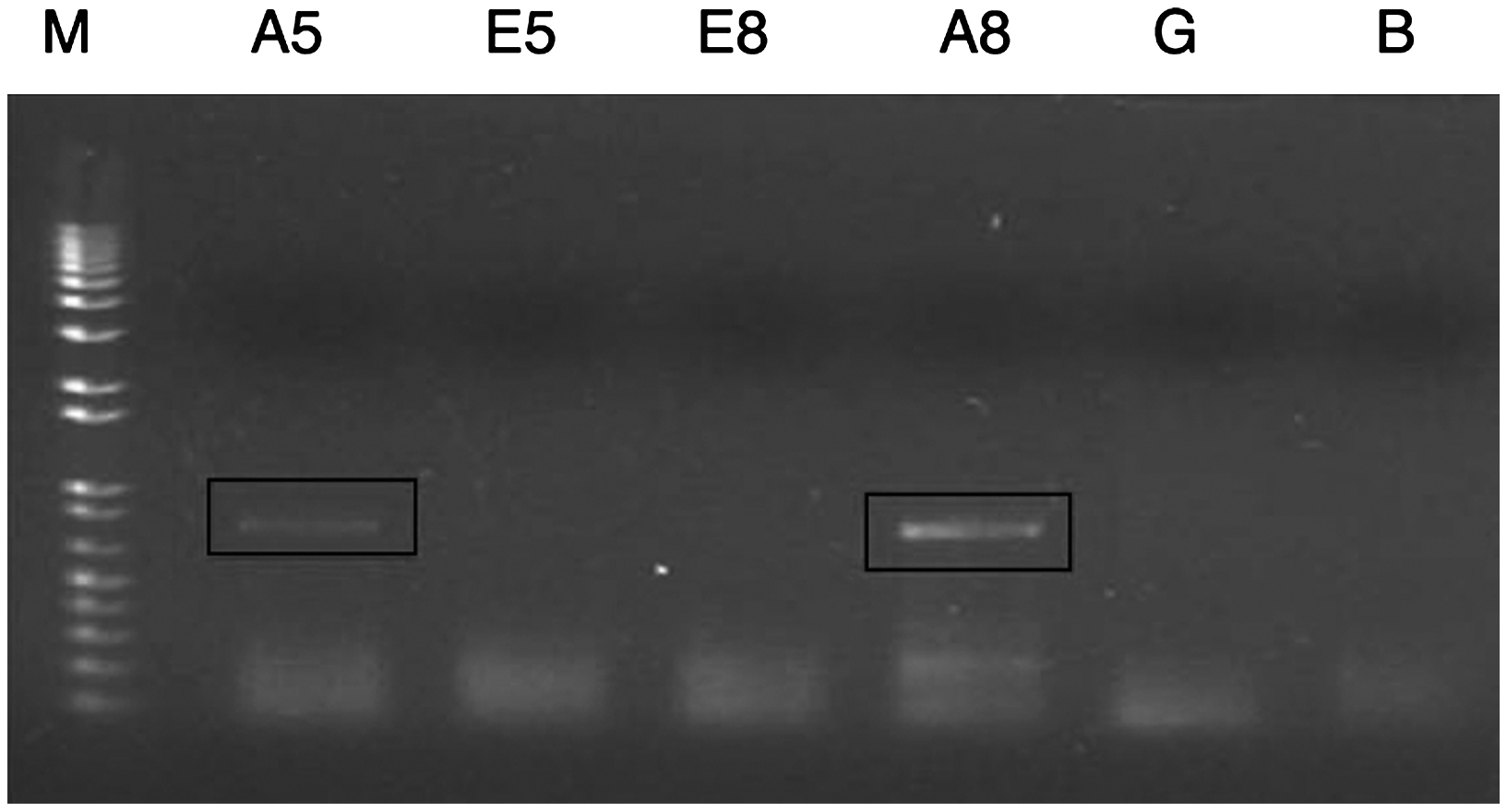
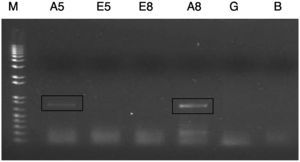
Búsqueda de genes expresados diferencialmente durante el antagonismoSobre la base de estudios anteriores, en los que se reportó la expresión diferencial del gen de la amilasa de D. phaseolorum en pruebas de antagonismo frente a hongos tropicales y subtropicales, se diseñaron cebadores para amplificar este gen. Además, se diseñaron cebadores para el gen de la endopoligalacturonasa, debido a su posible expresión diferencial durante el antagonismo. En la figura 2 se observa la expresión diferencial del gen de la amilasa en el endofito en las pruebas de antagonismo al quinto y octavo día. No hubo expresión del gen de la amilasa del endofito al crecer en ausencia de P. infestans. De igual manera, no hubo amplificación del gen de la endopoligalacturonasa en ninguna de las muestras miceliales (resultados no mostrados).
Figura 2. Reacción de reverso-transcriptasa-PCR (RT-PCR) a partir del ácido desoxirribonucleico complementario del hongo endofito Diaporthe sp. enfrentado al fitopatógeno Phytophthora infestans al usar los cebadores correspodientes al gen de la amilasa. Se puede observar la expresión diferencial del gen de Diaporthe sp. en el antagonismo al quinto y octavo día. A5: amplificación a partir del ácido ribonucleico (ARN) total de Diaporthe sp. en el antagonismo al quinto día; E5: amplificación a partir del ARN total de Diaporthe sp. que crecía solo al quinto día; E8: amplificación a partir del ARN total de Diaporthe sp. que crecía solo al octavo día; A8: amplificación a partir del ARN total de Diaporthe sp. en el antagonismo al octavo día; G: amplificación a partir del ADN genómico de Diaporthe sp.; B: control negativo.
DiscusiónDado el interés creciente en encontrar alternativas de control para fitopatógenos, en los últimos años los investigadores han volcado su interés en caracterizar el antagonismo de los fitopatógenos ejercido por los hongos endofitos. El presente estudio pretendió avanzar en el conocimiento de una interacción particular entre P. infestans y un hongo endófito de micelio estéril (género Diaporthe) para, en el futuro, considerar el uso de este endófito como herramienta de control dentro de una estrategia de tratamiento integrado de enfermedades.
Estos resultados mostraron que el antagonismo entre el hongo y oomiceto en particular es una interacción que se encuentra determinada por el medio de cultivo en el que ésta tome lugar. Aunque el mayor porcentaje de inhibición de Diaporthe sp. sobre P. infestans se registró en el medio V8 (inhibición del 30% en comparación con el medio PDA, donde la inhibición fue del 17%), no se apreciaron diferencias significativas entre estos 2 medios. La similitud en los datos obtenidos para el ABC para estos 2 medios se puede deber a que son medios enriquecidos que favorecen el crecimiento tanto del endofito como del oomiceto, que por competencia de nutrientes puede llevar a una interacción antagónica2. En efecto, se ha reportado que los hongos endofitos son microorganismos muy competitivos que pueden producir metabolitos secundarios que inhiben a una gran variedad de hongos, entre ellos los hongos fitopatógenos. La ausencia de un halo de inhibición en el medio Czapek se puede deber a que no es un medio rico en nutrientes y no favorece una interacción antagónica entre Diaporthe sp. y P. infestans, lo que da apoyo a la hipótesis de un antagonismo mediado por la competencia de nutrientes2.
El antagonismo que ejerció Diaporthe sp. hacia P. infestans se manifestó en la aparición de un halo de inhibición a partir del quinto día de las pruebas de antagonismo, que se acentuó cada vez más hasta el octavo día. La ausencia de contacto físico entre los 2 hongos se debe posiblemente a la producción de compuestos que se difunden por el medio7. De igual forma, la ausencia de contacto físico puede deberse a la producción de una gran variedad de enzimas, como lacasas, peroxidasas, endoglucanasas, caseinasas, amilasa y exoglucanasas, que pueden estar causando la inhibición antagónica, y su concomitante producción determina que un hongo sea competitivo20.
El conocimiento de las redes genéticas que se movilizan en una interacción de antagonismo bajo condiciones controladas es un paso fundamental para el desarrollo de herramientas de control biológico mucho más eficaces. En la búsqueda de genes posiblemente expresados durante el antagonismo, se detectó la expresión diferencial del gen de la amilasa, que evidenció algún papel determinante en la inhibición que causó Diaporthe sp. sobre P. infestans en la pruebas duales. Este resultado confirma reportes anteriores en los que Diaporthe sp., en pruebas de antagonismo hacia hongos tropicales y subtropicales, se caracterizó por la producción de amilasa20.
El gen de la endopoligalacturonasa en Diaporthe sp. no se amplificó, posiblemente porque los cebadores utilizados se diseñaron a partir de Diaporthe helianti. La no amplificación podría deberse a que esta enzima tiene una secuencia muy conservada entre especies. De la misma manera, no se puede descartar que la ausencia de endopoligalacturonasa se deba a su no expresión durante el antagonismo.
Estos resultados mostraron que las interacciones de antagonismo dependen del medio de cultivo en el que se llevan a cabo estos ensayos, ya que el comportamiento de Diaporthe sp. sobre P. infestans varió de acuerdo con el medio usado y demostró que el sustrato en el que se produce el metabolito bioactivo que causa la inhibición del crecimiento es un componente esencial para desarrollar herramientas de control biológico en contra de P. infestans11. Estas conclusiones son válidas para el aislamiento de Diaporthe sp., con el que se trabajó en el laboratorio, obtenido a partir de Espeletia sp. De igual forma, es importante tener en cuenta que algunas especies del género Diaporthe, en particular D. phaseolorum, son hongos fitopatógenos, por lo que sería indispensable estudiar las implicaciones ecológicas de su eventual uso en estrategias de control biológico12.
Las pruebas de antagonismo entre 2 hongos se encuentran determinadas por un diálogo molecular que lleva como resultado último a la expresión diferencial de los genes del endofito, que causan el antagonismo posiblemente por la producción de una gran cantidad de proteínas, metabolitos secundarios y sustancias volátiles que inhiben el crecimiento del fitopatógeno8,14,15,16,17,18. El conocimiento sobre estas redes moleculares que llevan a un reconocimiento y a una posterior inducción génica es de gran importancia en el desarrollo de herramientas de control biológico, ya que permiten conocer mucho más a fondo este tipo de interacciones y desarrollar métodos mucho más efectivos para el control de P. infestans13. La amilasa es tan sólo una de las tantas enzimas que, muy posiblemente, se están produciendo de manera inducida en las interacciones antagónicas. Estudios futuros que utilicen herramientas de genómica funcional de alto poder serían indispensables para realizar una caracterización molecular completa entre Diaporthe sp. y P. infestans. Análisis estadísticos obtenidos por Yuen et al20 demuestran una correlación significativa (p<0,05) entre la tasa de crecimiento y la capacidad competitiva; es decir que hongos con crecimiento lento son mucho más competitivos que aquellos hongos con crecimiento rápido, debido a que sintetizan una gran variedad de enzimas.
Autor para correspondencia.