Se desconocen los efectos que sobre el hongo Pochonia chlamydosporia pueden causar los plaguicidas y bioestimulantes vegetales que son usados en sistemas protegidos de producción de hortalizas.
ObjetivosLa efectividad de P. chlamydosporia frente a Meloidogyne spp. podría verse afectada por productos usados en sistemas protegidos de producción de hortalizas. Con el fin de evaluar cualquier potencial efecto sobre el hongo, se realizaron dos ensayos in vitro.
MétodosEl efecto en la germinación de clamidosporas se evaluó en un primer ensayo, y el crecimiento micelial y la producción de clamidosporas en un segundo. Con estos resultados se determinó la compatibilidad de cada producto con el hongo.
ResultadosLa germinación de clamidosporas fue superior al 50% con los tratamientos control, FitoMas E, Biobras-16 y Amidor; se registraron valores menores con otros productos y algunos incluso la inhibieron completamente. El crecimiento fúngico se potenció con Biobras-16 al 106,23%, lo promovieron entre un 50-100% el control, FitoMas E y Cuproflow, y el resto de productos generó un crecimiento inferior al 50%. La producción de clamidosporas se estimuló con Cipermetrina, Benomilo, Zineb, Mitigan, Karate, FitoMas E y Amidor; con Cuproflow fue menor al 50%, y el resto la inhibió totalmente. De los productos evaluados, el 54% fueron compatibles con P. chlamydosporia, el 8% resultaron tóxicos, y el 38%, muy tóxicos.
ConclusionesFueron compatibles con P. chlamydosporia Cipermetrina, Karate, Amidor, Benomilo, Zineb, Mitigan y FitoMas E. De ser necesaria la utilización del resto de los productos para el manejo integrado de plagas en sistemas protegidos de producción de hortalizas, se recomienda evitar el contacto directo con P. chlamydosporia.
The effects of pesticides and plant bio-stimulants used in protected vegetable production systems on the fungus Pochonia chlamydosporia are unknown.
AimsThe effectiveness of P. chlamydosporia against Meloidogyne spp. could be affected by products used in protected vegetable production systems. Two in vitro assays were carried out to evaluate any potential effect that pesticides and bio-stimulants often used in these systems could have on the fungus.
MethodsThe effect on chlamydospore germination was evaluated in a first assay, and mycelia growth and sporulation in a second. With these results, the compatibility of each product with the fungus was determined.
ResultsChlamydospores germination was over 50% with the control, FitoMas E, Biobras-16 and Amidor. Lower results were observed with other products, with some of them even inhibiting germination completely. Fungal growth was potentiated by Biobras-16 to 106.23%, promoted up to 50-100% by the control, FitoMas E and Cuproflow, and was below 50% with the rest of the products.Cipermetrina, Benomilo, Zineb, Mitigan, Karate, FitoMas E and Amidor promoted fungal sporulation, which was below 50% with Cuproflow and completely inhibited by the other products. Fifty-four percent of the products evaluated were compatible with P. chlamydosporia, while 8% were toxic and 38%, very toxic.
ConclusionsCipermetrina, Karate, Amidor, Benomilo, Zineb, Mitigan and FitoMas E were compatible with P. chlamydosporia. If it is necessary to use any of the other products for integrated pest management in protected vegetable production systems, it is recommended to avoid direct contact with P. chlamydosporia.
La generalización en Cuba de los sistemas protegidos de producción de hortalizas (SPPH) logró un impacto socioeconómico favorable en la obtención de hortalizas frescas para el mercado local y la exportación4,12. Transcurrido un tiempo de instaurada esta tecnología, se detectaron problemas fitosanitarios; entre ellos, las especies de Meloidogyne Goeldi causaban disminuciones en los rendimientos agrícolas y pérdidas económicas9. Para controlar esta plaga se usaron nematicidas, pero no se lograron los resultados esperados14. Por tanto, otras medidas de manejo, como la utilización de especies fúngicas nematófagas, adquieren importancia por su efectividad e inocuidad para el medio ambiente y el hombre7,20.
A partir de aislamientos nativos de Pochonia chlamydosporia (Goddard) Zare y Gams, se seleccionó la cepa IMI SD 187 de la variedad catenulata (Kamyscho ex Barron y Onions) Zare y Gams como la más efectiva para el biocontrol de Meloidogyne spp. Se obtuvo de esta manera el bioproducto KlamiC®, utilizado en el biocontrol de nematodos formadores de agallas en sistemas de producción orgánicos de hortalizas3,5,10. Actualmente se emplea en SPPH considerados como agroecosistemas perturbados debido a la aplicación sistemática de fertilizantes minerales, plaguicidas y bioestimulantes, factores valorados de alto riesgo para la persistencia del hongo.
Por esta razón, se propuso evaluar los efectos in vitro que provocan los plaguicidas y bioestimulantes vegetales más usados en SPPH sobre P. chlamydosporia.
Se evaluaron 11 plaguicidas y dos bioestimulantes. Las dosis in vitro utilizadas guardaron relación con las aplicadas en campo18 (tabla 1). Cada producto se incorporó al medio de cultivo según el método de Clark et al. (1982)6.
Dosis de los plaguicidas y bioestimulantes vegetales usados para la evaluación de la compatibilidad con Pochonia chlamydosporia
| Nombre químico | Nombre comercial | Acción | Dosisa (%) |
|---|---|---|---|
| Mezcla de sales minerales+sustancias naturales (aminoácidos, sacáridos y polisacáridos) | FitoMas E | Bioestimulante vegetal | 0,02 |
| Brasinólido: [(2a, 3a, 22R, 23R)-tetrahidroxi-24a-metil B-homo-7-oxa-5a colestan-6-ona] | Biobras-16 | Bioestimulante vegetal | 0,40 |
| Trihidroxi cloruro de dicobre | Cuproflow SC 37,75 | Fungicida | 0,03 |
| Etileno bis-ditiocarbamato de cinc | Zineb PH 80 | Fungicida | 0,02 |
| 1-benzimidazol-2-ilcarbamato de metilo | Benomilo PH 50 | Fungicida | 2,00 |
| (RS)-2-(2,4-diclorofenil)-3-(1H-1,2,4-triazol-1-il) propil1,1,2,2-tetrafluoroetil éter | Domark 100 CE 10 | Fungicida | 0,01 |
| Metil-N-fenilacetil-N-2,6,xilil-DL-alanina+Ion cinc de etileno bis ditiocarbamato de manganeso | Galben PH 8 | Fungicida | 0,002 |
| Ion cinc de etileno bis ditiocarbamato de manganeso | Mancozeb PH 80 | Fungicida | 0,02 |
| (Z)-(1R,3R)-3-(2-cloro-3,3,3-trifluoroprop-1-enil)-2,2-dimetilciclopropanocarboxilato de (S)-α-ciano-3-fenoxibencilo+(Z)-(1S,3S)-3-(2-cloro-3,3,3-trifluoroprop-1-enil)-2,2-dimetilciclopropanocarboxilato de (R)-α-ciano-3-fenoxibencilo | Karate CE 5,0 | Insecticida | 0,17 |
| (1RS,3RS;1RS,3SR)-3-(2,2-diclorovinil)-2,2-dimetilciclopropanecarboxilato | Cipermetrina CE 10 | Insecticida | 0,5 |
| O,S-dimetilfosfamidotioato | Amidor CS 60 | Insecticida | 0,006 |
| 2,2,2-tricloro-1,1-bis(4-clorofenil)etanol | Mitigan CE 18,5 | Acaricida | 0,002 |
| O,O-dimetil S-metilcarbamoilmetil fosforoditioato | Rogor L 40 | Acaricida | 0,004 |
La dosis in vitro de cada producto guardó relación con las utilizadas para el manejo integrado de plagas en el campo, de acuerdo con el Registro Central de Plaguicidas18.
Se preparó el medio agar papa dextrosa con antibiótico (PDA [BioCen]: 39g/l de H2O destilada, más cloranfenicol, tetraciclina y estreptomicina [50mg/l]) en un matraz Erlenmeyer de un litro. Se esterilizó y se dejó enfriar hasta alcanzar una temperatura de 36°C, momento en que se incorporaron los productos disueltos en H2O destilada estéril.
En un primer ensayo se vertieron 10ml en placas de Petri (80mm de diámetro) y se añadieron posteriormente 0,2ml de una suspensión que contenía 4,3×105 clamidosporas/ml, obtenida a partir del bioproducto KlamiC® (Lote 010213: 4,3×107 clamidosporas/g, viabilidad del 92,3% y humedad del 6,61%). Las placas se incubaron a 25°C, durante 48h. En microscopio (ZEISS-AxioLab®, ×20) se cuantificaron 100 clamidosporas y, de ellas, cuántas estaban germinadas (tubo germinativo superior a dos veces el tamaño de la clamidospora).
En un segundo ensayo se vertieron en placas de Petri 20ml del medio que contenía los productos, se colocó un disco de 5mm de diámetro del crecimiento masivo de P. chlamydosporia en el centro de la placa y se incubaron durante 21 días a temperatura constante de 25°C. Se determinó el diámetro de las colonias y se recogieron las clamidosporas en 5ml de Tween 80 (0,5ml de Tween/l de H2O destilada). Posteriormente se contabilizaron en una cámara de Neubauer en microscopio (×20). Se calculó el área de la colonia (AC=π·r2) y se determinó la producción de clamidosporas/mm2 de colonia.
La compatibilidad se obtuvo por el método de Alves et al. (1998)1, según la fórmula T=[20 (CV)+80 (ESP)]/100; donde T es toxicidad, CV, crecimiento micelial (%) y ESP, producción de clamidosporas (%). Se realizó una clasificación de acuerdo con los valores siguientes: 0-30=muy tóxico; 31-45=tóxico; 46-60=moderadamente tóxico;>60=compatible.
Cada producto constituyó un tratamiento y un control, con seis réplicas, bajo diseño completamente aleatorizado, con dos repeticiones en el tiempo. Las variables germinación de clamidosporas y área de la colonia se transformaron por ASENO (√x/100) y Log10(x+1), respectivamente. Los datos se analizaron mediante ANOVA unifactorial y se compararon con la prueba de Tukey (p=0,05), utilizándose el paquete STATISTICA v. 8.
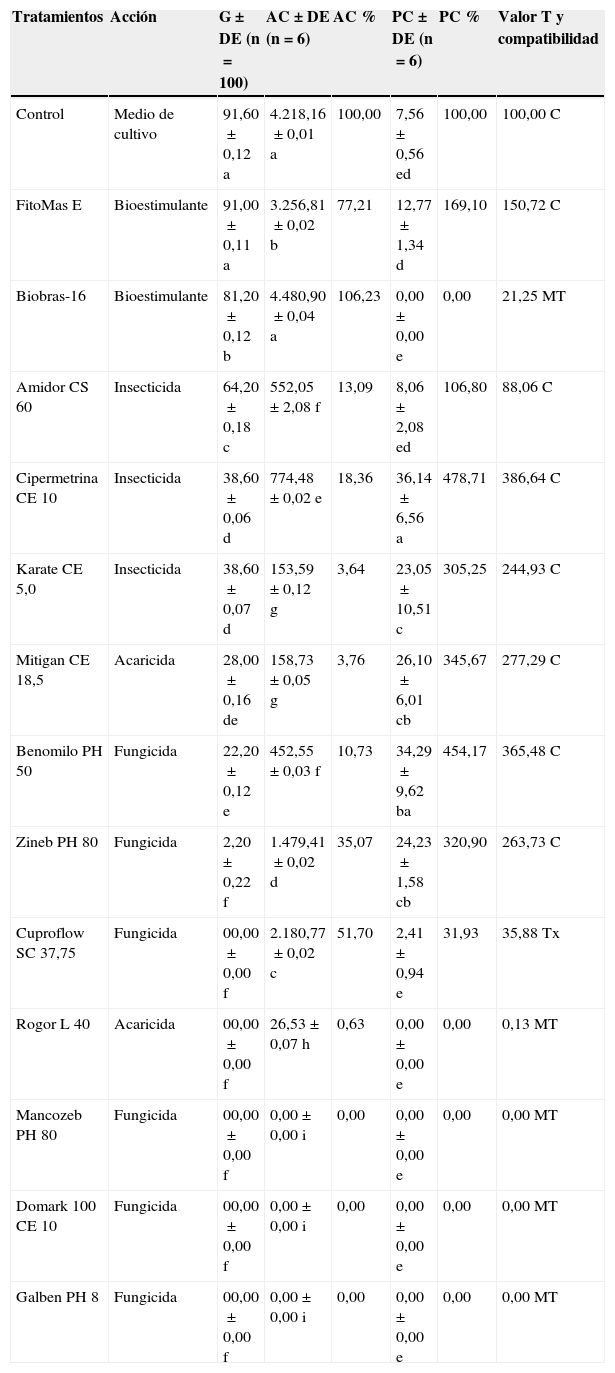
En el primer estudio, se alcanzó una germinación superior al 90% en los tratamientos control y FitoMas E; la germinación fue del 50-90% con Biobras-16 y Amidor, y el resto de los plaguicidas produjeron una germinación inferior al 50% o inhibieron totalmente este proceso (tabla 2).
Efecto de los plaguicidas y bioestimulantes vegetales sobre la germinación y producción de clamidosporas, crecimiento micelial y compatibilidad con Pochonia chlamydosporia
| Tratamientos | Acción | G±DE (n=100) | AC±DE (n=6) | AC % | PC±DE (n=6) | PC % | Valor T y compatibilidad |
|---|---|---|---|---|---|---|---|
| Control | Medio de cultivo | 91,60±0,12 a | 4.218,16±0,01 a | 100,00 | 7,56±0,56 ed | 100,00 | 100,00C |
| FitoMas E | Bioestimulante | 91,00±0,11 a | 3.256,81±0,02 b | 77,21 | 12,77±1,34 d | 169,10 | 150,72C |
| Biobras-16 | Bioestimulante | 81,20±0,12 b | 4.480,90±0,04 a | 106,23 | 0,00±0,00 e | 0,00 | 21,25MT |
| Amidor CS 60 | Insecticida | 64,20±0,18 c | 552,05±2,08 f | 13,09 | 8,06±2,08 ed | 106,80 | 88,06C |
| Cipermetrina CE 10 | Insecticida | 38,60±0,06 d | 774,48±0,02 e | 18,36 | 36,14±6,56 a | 478,71 | 386,64C |
| Karate CE 5,0 | Insecticida | 38,60±0,07 d | 153,59±0,12g | 3,64 | 23,05±10,51 c | 305,25 | 244,93C |
| Mitigan CE 18,5 | Acaricida | 28,00±0,16 de | 158,73±0,05g | 3,76 | 26,10±6,01 cb | 345,67 | 277,29C |
| Benomilo PH 50 | Fungicida | 22,20±0,12 e | 452,55±0,03 f | 10,73 | 34,29±9,62 ba | 454,17 | 365,48C |
| Zineb PH 80 | Fungicida | 2,20±0,22 f | 1.479,41±0,02 d | 35,07 | 24,23±1,58 cb | 320,90 | 263,73C |
| Cuproflow SC 37,75 | Fungicida | 00,00±0,00 f | 2.180,77±0,02 c | 51,70 | 2,41±0,94 e | 31,93 | 35,88Tx |
| Rogor L 40 | Acaricida | 00,00±0,00 f | 26,53±0,07h | 0,63 | 0,00±0,00 e | 0,00 | 0,13MT |
| Mancozeb PH 80 | Fungicida | 00,00±0,00 f | 0,00±0,00 i | 0,00 | 0,00±0,00 e | 0,00 | 0,00MT |
| Domark 100 CE 10 | Fungicida | 00,00±0,00 f | 0,00±0,00 i | 0,00 | 0,00±0,00 e | 0,00 | 0,00MT |
| Galben PH 8 | Fungicida | 00,00±0,00 f | 0,00±0,00 i | 0,00 | 0,00±0,00 e | 0,00 | 0,00MT |
AC: área de la colonia (mm2); C: compatible; DE: desviación estándar; G: germinación de clamidosporas (%); MT: muy tóxico; PC: producción de clamidosporas (mm2); T: valor calculado de la toxicidad; Tx: tóxico.
a-i: las distintas letras en las columnas evidencian diferencias significativas según la prueba de Tukey (p=0,05).
En el segundo ensayo, el crecimiento fúngico se potenció hasta un 106,23% con Biobras-16, comparado con el control. Este crecimiento fúngico estuvo entre 50-100% con el control, FitoMas E y Cuproflow. Los demás plaguicidas analizados dieron lugar a un desarrollo micelial inferior al 50%, y los fungicidas Mancozeb, Domark y Galben inhibieron totalmente el crecimiento (tabla 2).
La producción de clamidosporas se estimuló con Cipermetrina, Benomilo, Zineb, Karate, FitoMas E y Amidor en comparación con el control. Cuproflow produjo clamidosporas por debajo del 50% y Biobras-16, Rogor, Mancozeb, Domark y Galben impidieron el desarrollo de este proceso (tabla 2).
Un 54% de los productos resultó compatible con el hongo, un 8% fueron tóxicos y un 38% muy tóxicos (tabla 2).
Algunos tratamientos inhibidores de la germinación de clamidosporas y del crecimiento micelial estimularon la producción de clamidosporas/mm2, lo cual puede estar relacionado con una respuesta intrínseca de la cepa para lograr mantenerse a pesar de los efectos de esos productos.
En agroecosistemas donde se utilice P. chlamydosporia se recomienda el uso racionalizado de los productos que inhiben al menos en el 50% la germinación de clamidosporas.
Los insecticidas Cipermetrina, Karate y Amidor, los fungicidas Benomilo y Zineb, el acaricida Mitigan y el bioestimulante FitoMas E pueden utilizarse de forma segura en el manejo integrado de plagas en SPPH.
Si bien el efecto de los fungicidas en agricultura es bien conocido16,19,22, en la presente investigación se observó que el bioestimulante Biobras-16 y el acaricida Rogor tuvieron un efecto negativo sobre P. chlamydosporia var. catenulata. Las sustancias químicas constitutivas de estos productos, brasinólido en el bioestimulante y dimetoato en el acaricida, inhibieron totalmente la producción de clamidosporas (tabla 2).
Plaguicidas organofosforados afectaron la permeabilidad de las membranas celulares y la síntesis enzimática de hongos2. Quizás estas mismas causas provocaron los efectos inhibitorios de algunos productos sobre P. chlamydosporia. Otros estudios informaron de que el nematicida fostiazato provocó una reducción del 55% de las poblaciones de P. chlamydosporia en el suelo11, y también se ha documentado el efecto fungicida de algunos insecticidas sobre hongos entomopatógenos8,17.
Como alternativa a los productos incompatibles con P. chlamydosporia se recomiendan medidas menos agresivas, como el uso de ácaros depredadores21, el hongo antagonista Trichoderma13 y plaguicidas de origen botánico15.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen al ingeniero Angel Moreno Torres, exespecialista en Sanidad Vegetal del Módulo de SPPH de Veguitas, Granma, Cuba, el suministro de los plaguicidas utilizados en el presente estudio.