Las infecciones por cigomicetos, producidas tanto por hongos mucorales como entomoftorales, se caracterizan por la invasión de los vasos sanguíneos y de otros órganos o estructuras adyacentes. Los mucorales suelen producir infección orbitorrinocerebral, pulmonar, cutánea, digestiva o diseminada y su desarrollo se ve favorecido por ciertas enfermedades de base (diabetes, insuficiencia renal) o factores de riesgo (neutropenia, inmunosupresión, sobrecarga de hierro). Se asocian a una elevada mortalidad y la clave del éxito reside en el diagnóstico y el tratamiento antifúngico precoz asociado, en la mayoría de los casos, a un desbridamiento quirúrgico amplio. En la actualidad, el isavuconazol representa una alternativa en el tratamiento de la mucormicosis refractaria o intolerante a la anfotericina B liposomal, y dadas sus características farmacocinéticas y farmacodinámicas, así como su escasa toxicidad, constituye la mejor opción para el tratamiento de mantenimiento de estas infecciones fúngicas invasivas.
Infections due to zygomycetes, caused by mucorales and entomophthorales, are characterized by angioinvasion and invasion of neighboring organs or structures. Mucorales most commonly cause rhinocerebral, pulmonary, cutaneous or disseminated infection and its spread is favored by several diseases (such as diabetes or chronic kidney disease) and risk factors (neutropenia, immunosuppression, iron overload). They have a high mortality rate, and the key to success in their treatment are early diagnosis, prompt administration of antifungal treatment, and extensive surgical debridement. Currently, isavuconazole constitutes an option for the treatment of those mucormycosis refractory to liposomal amphotericin B. Due to its pharmacokinetic and pharmacodynamic characteristics and its low toxicity, it is also the best choice for maintenance therapy.
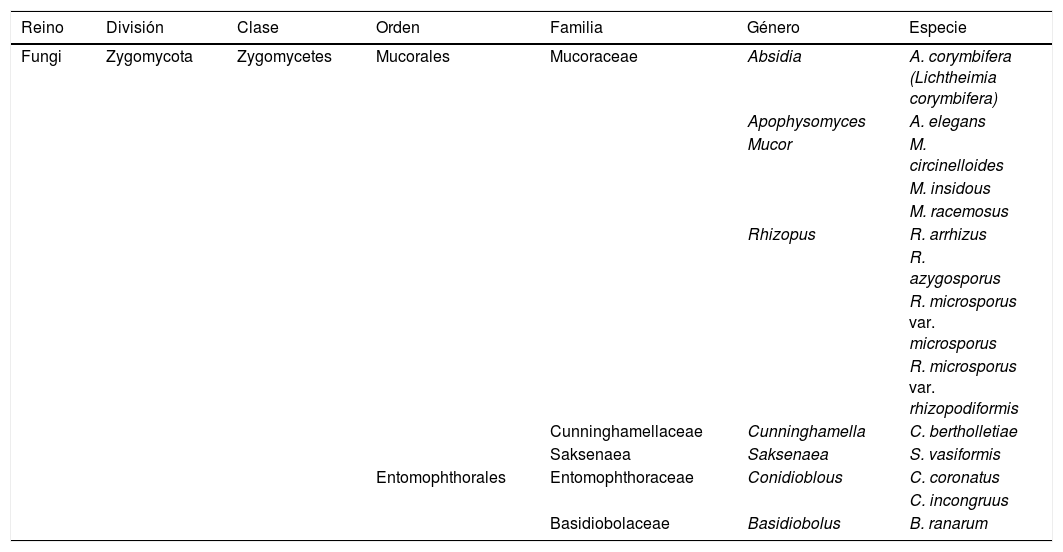
El término zigomicosis (cigomicosis) hace referencia a las infecciones causadas por hongos cigomicetos y engloba las originadas tanto por hongos mucorales como entomoftorales (tabla 1). Poseen una gran capacidad para invadir los vasos sanguíneos y, a través de los mismos, invadir rápidamente otros órganos o estructuras adyacentes. Los mucorales suelen producir infección orbitorrinocerebral, pulmonar, cutánea, digestiva o diseminada, y su desarrollo se ve favorecido por ciertas enfermedades de base (diabetes, insuficiencia renal) o factores de riesgo (neutropenia, inmunosupresión, sobrecarga de hierro)23. Se asocian a una elevada mortalidad y la clave del éxito reside en el diagnóstico y el tratamiento antifúngico precoz, asociado en la mayoría de los casos a un desbridamiento quirúrgico amplio.
Clasificación taxonómica de los agentes causales de cigomicosis
| Reino | División | Clase | Orden | Familia | Género | Especie |
|---|---|---|---|---|---|---|
| Fungi | Zygomycota | Zygomycetes | Mucorales | Mucoraceae | Absidia | A. corymbifera (Lichtheimia corymbifera) |
| Apophysomyces | A. elegans | |||||
| Mucor | M. circinelloides | |||||
| M. insidous | ||||||
| M. racemosus | ||||||
| Rhizopus | R. arrhizus | |||||
| R. azygosporus | ||||||
| R. microsporus var. microsporus | ||||||
| R. microsporus var. rhizopodiformis | ||||||
| Cunninghamellaceae | Cunninghamella | C. bertholletiae | ||||
| Saksenaea | Saksenaea | S. vasiformis | ||||
| Entomophthorales | Entomophthoraceae | Conidioblous | C. coronatus | |||
| C. incongruus | ||||||
| Basidiobolaceae | Basidiobolus | B. ranarum |
Las esporas de los mucorales, difundidas mediante aerosoles producen colonizaciones o infecciones sinopulmonares en los huéspedes expuestos y en riesgo. Sin embargo, las hifas angioinvasivas son las causantes de la invasión tisular y de la diseminación en condiciones favorables de pH, concentración de hierro y defectos en la inmunidad celular24.
La mayoría de las mucormicosis se adquieren en la comunidad; sin embargo, se ha descrito la adquisición nosocomial e incluso algunos seudobrotes hospitalarios relacionados con vendajes, agujas o depresores linguales contaminados. Los factores de riesgo subyacentes más frecuentes para presentar una cigomicosis se encuentran en la tabla 2. Aproximadamente el 40-100% de los pacientes con enfermedades hematológicas malignas que desarrollan cigomicosis presentan neutropenia, que precede en un mínimo de 10 días a la infección22,24.
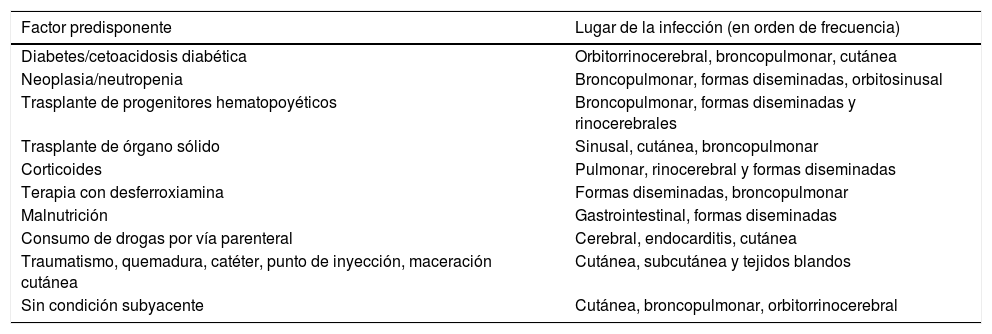
Relaciones entre las condiciones predisponentes y la localización de las formas clínicas de la cigomicosis
| Factor predisponente | Lugar de la infección (en orden de frecuencia) |
|---|---|
| Diabetes/cetoacidosis diabética | Orbitorrinocerebral, broncopulmonar, cutánea |
| Neoplasia/neutropenia | Broncopulmonar, formas diseminadas, orbitosinusal |
| Trasplante de progenitores hematopoyéticos | Broncopulmonar, formas diseminadas y rinocerebrales |
| Trasplante de órgano sólido | Sinusal, cutánea, broncopulmonar |
| Corticoides | Pulmonar, rinocerebral y formas diseminadas |
| Terapia con desferroxiamina | Formas diseminadas, broncopulmonar |
| Malnutrición | Gastrointestinal, formas diseminadas |
| Consumo de drogas por vía parenteral | Cerebral, endocarditis, cutánea |
| Traumatismo, quemadura, catéter, punto de inyección, maceración cutánea | Cutánea, subcutánea y tejidos blandos |
| Sin condición subyacente | Cutánea, broncopulmonar, orbitorrinocerebral |
La verdadera incidencia de la cigomicosis invasiva no es conocida, aunque en estudios poblacionales en Estados Unidos se ha estimado en 1,7 casos por 1.000.000 de habitantes/año entre 1992 y 1993, lo que supone unos 500 casos por año23. En estudios iniciales que incluían un amplio número de pacientes, hasta 2003, el factor de riesgo más frecuente era la diabetes mellitus (36%), seguida de las hemopatías malignas (17%)26. En estudios posteriores, las enfermedades hematológicas constituían ya el factor de riesgo más importante para la mucormicosis (50%), seguidas de la diabetes (23%) y los traumatismos16. En los últimos años se ha descrito un incremento importante en la incidencia de esta enfermedad en instituciones aisladas o unidades hematológicas específicas europeas y americanas, alcanzando un 8% en pacientes con leucemia, un 2-3% en receptores de trasplante de médula ósea y un 13% en pacientes oncológicos, todos ellos grupos de enfermos en situaciones particulares23. En nuestro país, la incidencia es baja, cercana a 0,43 casos por millón de habitantes/año y de 0,62 casos por 100.000 ingresos en un estudio poblacional realizado en 200530. En otro estudio más reciente de 557 pacientes tratados mediante un trasplante alogénico, únicamente 5presentaron una mucormicosis (0,89%)8.
Presentación clínica y evoluciónLas distintas formas de presentación clínica de las cigomicosis y su localización anatómica se encuentran especialmente relacionadas con los factores de riesgo y las enfermedades subyacentes que favorecen su aparición y desarrollo27. En cierta manera, cada uno de los factores de riesgo parece promover un tropismo predeterminado hacia un lugar u otro de asentamiento de la infección13, como se observa en la tabla 2. Sin embargo, en el paciente oncohematológico o en el receptor de trasplante de progenitores hematopoyéticos (TPH), al coincidir varios de estos mismos factores simultáneamente, pueden presentar formas diseminadas24,27.
En la serie de 929 pacientes antes comentada26, la distribución de formas clínicas fue la siguiente: sinusal 39%, pulmonar 24%, cutánea 19%, cerebral 9%, gastrointestinal 7%, diseminada 6% y una miscelánea de varias formas 6%. Sin embargo, la localización pulmonar fue la forma de presentación clínica más frecuente en los pacientes oncohematológicos (60%) y en los receptores de TPH (52%), a diferencia de los pacientes con diabetes (16%). Las formas rinocerebrales, sinusales y orbitosinusales son menos frecuentes en los pacientes con neoplasias o trasplantados24,27.
La mortalidad global de los pacientes con cigomicosis es de aproximadamente el 40%, aunque en pacientes hematológicos supera el 60%21. La tasa de mortalidad varía según el género y la especie del hongo implicado, la forma de presentación clínica, la enfermedad de base y el estado clínico del paciente (descompensación metabólica, recurrencia o refractariedad de la neoplasia), el tipo y el momento de la cirugía y la extensión de la enfermedad11,24,27. La supervivencia depende del lugar de localización de la infección por los mucorales: 90% en las formas cutáneas aisladas, 87% en sinusitis sin afectación cerebral, 45% en formas rinocerebrales, 36% en las pulmonares, 33% en la enfermedad cerebral focal, 16% en las formas diseminadas y 10% en las gastrointestinales24.
DiagnósticoLos requisitos para el diagnóstico son un alto índice de sospecha, el reconocimiento de los factores de riesgo y la rápida evaluación de la sintomatología clínica. La úlcera necrótica con escara negruzca (cutánea o mucosa) es la lesión característica de la mucormicosis y debe alertar sobre la misma en todo paciente con factores de riesgo22,27. Para valorar la extensión de la lesión a tejidos adyacentes son útiles la tomografía computarizada y la resonancia magnética, que además permiten la identificación de trombos intravasculares y de lesiones en estructuras profundas y en el sistema nervioso central. No obstante, ninguna de estas técnicas proporciona imágenes específicas de la mucormicosis, aunque algunos autores han revelado que el denominado «signo del halo inverso» o un recuento cuantitativo elevado del número de lesiones nodulares pulmonares (> 10) podría tener una mayor asociación con la mucormicosis que con la aspergilosis, especialmente en pacientes oncohematológicos6,9. Con todo ello, el diagnóstico definitivo se basa en la observación microscópica y el aislamiento del agente causal mediante cultivo microbiológico de las lesiones biopsiadas o tratadas mediante cirugía de exerésis22,27. Los hemocultivos de los pacientes con mucormicosis son habitualmente negativos. Aunque no se han encontrado biomarcadores útiles que ayuden al diagnóstico de la mucormicosis, probablemente el futuro resida en técnicas de amplificación mediante PCR en tiempo real y de hibridación in situ con el empleo de sondas de ADN específicas4,27.
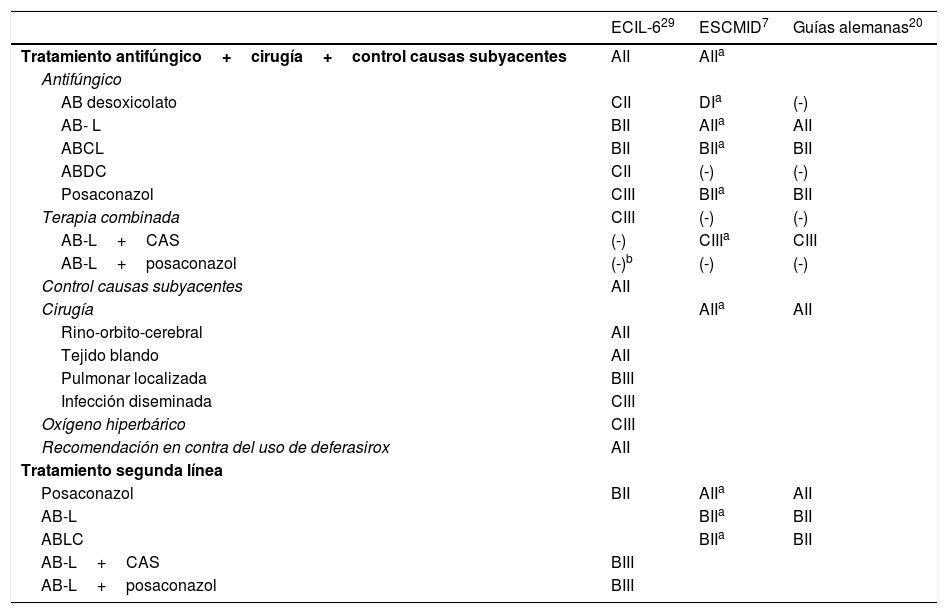
TratamientoEl tratamiento de las mucormicosis debe basarse en la rapidez y la certeza diagnóstica, el control de los factores predisponentes, la potencial mejora del estado inmunológico y la combinación de un tratamiento antifúngico adecuado junto a una cirugía de desbridamiento y exéresis amplia y extensa, en ocasiones muy agresiva y mutilante. Además, concretamente en enfermos neutropénicos es muy importante la recuperación del número y funcionalidad de los neutrófilos. Las recomendaciones de las diferentes guías europeas se encuentran en la tabla 3. La mayoría de ellas se basan en consensos de opinión de expertos o en trabajos con una escasa evidencia7,20,29.
Tratamiento inicial de las mucormicosis. Guías terapéuticas
| ECIL-629 | ESCMID7 | Guías alemanas20 | |
|---|---|---|---|
| Tratamiento antifúngico+cirugía+control causas subyacentes | AII | AIIa | |
| Antifúngico | |||
| AB desoxicolato | CII | DIa | (-) |
| AB- L | BII | AIIa | AII |
| ABCL | BII | BIIa | BII |
| ABDC | CII | (-) | (-) |
| Posaconazol | CIII | BIIa | BII |
| Terapia combinada | CIII | (-) | (-) |
| AB-L+CAS | (-) | CIIIa | CIII |
| AB-L+posaconazol | (-)b | (-) | (-) |
| Control causas subyacentes | AII | ||
| Cirugía | AIIa | AII | |
| Rino-orbito-cerebral | AII | ||
| Tejido blando | AII | ||
| Pulmonar localizada | BIII | ||
| Infección diseminada | CIII | ||
| Oxígeno hiperbárico | CIII | ||
| Recomendación en contra del uso de deferasirox | AII | ||
| Tratamiento segunda línea | |||
| Posaconazol | BII | AIIa | AII |
| AB-L | BIIa | BII | |
| ABLC | BIIa | BII | |
| AB-L+CAS | BIII | ||
| AB-L+posaconazol | BIII |
AB-L: anfotericina B liposomal; ABCL: anfotericina B complejo lipídico; ABDC: anfotericina B dispersión coloidal; CAS: caspofungina; ECIL-6: European Conference on Leukemia and Lymphoma; ESCMID: European Society of Clinical Microbiology and Infectious Diseases; (-): no recomendación expresa o específica.
Un desbridamiento quirúrgico amplio debe realizarse en todas las formas de mucormicosis lo más pronto posible. Deben eliminarse todas las zonas necróticas de cualquier localización con suficientes márgenes de seguridad, aunque esto implique una agresividad importante.
No existen estudios aleatorizados sobre la eficacia de los antifúngicos debido a la baja incidencia de dicha infección. La sensibilidad in vitro de los mucorales a los antifúngicos es baja. Hasta la actualidad, únicamente la anfotericina B, el posaconazol y el isavuconazol muestran actividad frente a la mayoría de estos hongos. El inicio precoz del tratamiento antifúngico mejora la progresión de los pacientes, tal como demuestra un estudio retrospectivo en el que la mortalidad a las 12 semanas se duplicaba si la anfotericina B se iniciaba a los 6 días o más del diagnóstico5.
Como tratamiento inicial, la anfotericina B en su forma liposomal (AmB-L) es preferible por su menor toxicidad y mejor tolerancia, además de mayor eficacia, a otras formulaciones de anfotericina B, y constituye la recomendación de las diferentes guías7,29. Se recomiendan dosis de 5mg/kg/día por vía intravenosa hasta conseguir la resolución de la enfermedad, aunque se han llegado a emplear 7,5 y 10mg/kg/día. En la actualidad, la dosis óptima sigue siendo objeto de controversia. Respecto a las terapias combinadas, los resultados existentes provienen de estudios in vitro, de modelos experimentales en animales y de algún caso clínico publicado. Aunque las combinaciones más usadas son AmB-L con caspofungina o posaconazol, estas no son recomendadas por la mayoría de las guías como tratamiento inicial. Un estudio retrospectivo con 106 pacientes hematológicos no encontró diferencias en la supervivencia a las seis semanas en los pacientes que recibían terapia combinada respecto a los de anfotericina B en monoterapia15. En un estudio con formas rinocerebrales de mucormicosis, en pacientes no neutropénicos, en el que se practicaba también cirugía extensa, parecía que la combinación de anfotericina B con caspofungina podía resultar favorable25. Es evidente que se necesitan estudios con un mayor número de pacientes para demostrar este hecho.
Para los pacientes que han respondido a las formulaciones lipídicas de anfotericina B, el posaconazol o el isavuconazol pueden ser usados como terapia de mantenimiento o continuación. El posaconazol, administrado preferiblemente en tabletas gastrorresistentes (300mg cada 12h durante el primer día y después 300mg al día) es una buena opción33. Existe experiencia de uso durante≥6 meses en mucormicosis invasivas. No existen datos clínicos para posicionarlo como tratamiento inicial de la mucormicosis, según las guías ECIL se considera una alternativa a la AmB-L o como tratamiento de mantenimiento29, y según las guías europeas podría usarse como terapia inicial aunque con una recomendación moderada7. Los comprimidos gastrorresistentes y la solución intravenosa permiten su uso en pacientes con mucositis grave o en la enfermedad injerto contra huésped intestinal. Aun utilizando estas nuevas formulaciones de posaconazol que parecen garantizar concentraciones adecuadas, en opinión de algunos expertos sería aconsejable, en el caso de infecciones graves y extensas, disponer de alguna determinación orientativa de la concentración plasmática para asegurar que la concentración del fármaco prescrita es óptima.
Como tratamiento de rescate en pacientes que no responden o no toleran la anfotericina B, puede utilizarse también el posaconazol o el isavuconazol7,29. Si se utiliza la formulación intravenosa del posaconazol debe tenerse en cuenta la función renal y el aclaramiento de la creatinina para evitar toxicidad por acúmulo de sulfobutiléter-β-ciclodextrina (SBECD) y en estos casos, como comentaremos posteriormente, sería mejor usar isavuconazol. Aunque con algunas limitaciones, un estudio mostró una respuesta parcial o completa al posaconazol oral en el 60% de 91 pacientes intolerantes o sin respuesta a la anfotericina B y un 20% de estabilidad32.
El tratamiento debe continuarse hasta la resolución de la semiología clínica y de los signos radiológicos de la infección aguda y, si es posible, hasta el fin de la causa condicionante de la inmunosupresión, hecho que implica una duración prolongada, a veces de meses de tratamiento14.
Se han usado diferentes tratamientos adyuvantes. El oxígeno hiperbárico inhibe el crecimiento fúngico in vitro y corrige la acidosis láctica, lo que favorece la acción oxidativa de la anfotericina B; además, aumenta la fagocitosis, los factores de crecimiento, la angiogénesis y, por tanto, la respuesta terapéutica y la probabilidad de curación. Su uso puede ser beneficioso en enfermos diabéticos con formas rinocerebrales, pero su utilidad en enfermos oncohematológicos y receptores de alo-TPH todavía es dudosa31. La utilización de deferasirox, un nuevo agente quelante del hierro, ofrecía resultados prometedores en estudios experimentales en los enfermos con sobrecarga de hierro postransfusional12. Sin embargo, en el único ensayo clínico realizado, aumentaba la mortalidad en la rama que lo asociaba al antifúngico, probablemente por fallos en el diseño y la metodología28. El beneficio clínico real esperado de otras terapias, como el uso de estatinas, avaladas por estudios de actividad in vitro, probablemente sea marginal y tardío en el tiempo.
Tal como se ha comentado, el pronóstico de la mucormicosis es ominoso pese al diagnóstico precoz y a la combinación del tratamiento antifúngico y del desbridamiento quirúrgico. Son factores independientes de mortalidad la infección diseminada, la insuficiencia renal y la infección por Cunninghamella.
El isavuconazol en el tratamiento de la mucormicosisEl isavuconazol ha sido aprobado por la FDA y EMA para el tratamiento de la mucormicosis. Las CMI del isavuconazol son 2-4 veces superiores a las del posaconazol2. No obstante, los resultados clínicos favorables obtenidos con el isavuconazol podrían deberse a unos parámetros pK-pD propicios que permitirían alcanzar un AUC/CMI en pulmón (y otros órganos) más óptima, consiguiendo una mayor exposición con respecto al posaconazol, dado que este parámetro (AUC/CMI) junto a la Cmin son predictivos de la eficacia de los azoles y compensarían las diferencias de CMI comparadas entre ambos para determinados géneros y especies de mucorales. En un modelo experimental realizado en ratones neutropénicos infectados con Rhizopus la eficacia del isavuconazol resultó comparable con la de la AmB-L en la reducción de la carga fúngica en los tejidos pulmonar y cerebral, y en la supervivencia a los 21 días17.
El estudio VITAL19 (fase iii, abierto, multicéntrico) sobre la eficacia y la seguridad del isavuconazol en el tratamiento de la mucormicosis comparaba un grupo de 37 pacientes con diferentes enfermedades de base con los pacientes de un grupo control del registro FungiScope que habían recibido anfotericina B. La mayoría de los pacientes presentaban afectación pulmonar (16) seguida de sinusal (16), ocular (7) y del sistema nervioso central (6). Once pacientes presentaron una infección diseminada. El género más frecuentemente aislado fue Mucor (20), seguido de Rhizopus (9), Rhizomucor (5), Lichtheimia (2) y Cunninghamella (1). En 21 pacientes el isavuconazol se administró como tratamiento inicial, en 16 pacientes como alternativa por intolerancia a otros antifúngicos (5) o refractariedad (11). En el 31,4% de los casos (11) se obtuvo una respuesta satisfactoria, en 5 de 35 casos (14,3%) completa y en un 17,1% (6 de 35 casos) parcial. Los resultados fueron validados por un comité. La mortalidad en los pacientes hematológicos resultó del 55 y el 59%, a los días 42 y 84, respectivamente. En conjunto, la mortalidad global del estudio VITAL fue del 33% y del 41,3% para los controles pareados. En los 21 pacientes que recibieron isavuconazol de inicio, la mortalidad fue similar a la presentada por los controles que recibieron anfotericina B (57,1% frente al 49,7%). Este hecho, con todas las limitaciones existentes, orienta en la posibilidad de que el isavuconazol pueda ser utilizado como primera línea de tratamiento de la cigomicosis. Los efectos adversos atribuibles al uso del isavuconazol en este estudio fueron similares a los comunicados en el ensayo clínico para el tratamiento de la aspergilosis invasiva18.
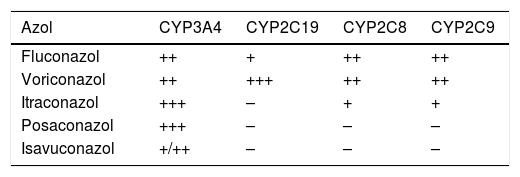
El isavuconazol, a día de hoy, junto con el posaconazol, representa una alternativa en el tratamiento de la mucormicosis refractaria o intolerante a la AmB-L. En esta situación la dosis aconsejada es de 200mg, por vía intravenosa u oral, cada 8h en seis dosis (como dosis de carga), para después pasar a 200mg diarios. Dado que la formulación intravenosa es soluble en agua, puede administrarse en pacientes con insuficiencia renal. Además, debe tenerse en cuenta que el isavuconazol presenta menos interacciones farmacológicas, y de menor intensidad, con los inmunosupresores que el posaconazol10, por lo que sería más útil para aquellos pacientes que reciben dichos fármacos (tabla 4), como en el caso del alo-TPH con enfermedad de injerto contra huésped o en los trasplantados de órgano sólido.
Agentes triazoles e inhibición comparativa de las isoenzimas del CYP450
| Azol | CYP3A4 | CYP2C19 | CYP2C8 | CYP2C9 |
|---|---|---|---|---|
| Fluconazol | ++ | + | ++ | ++ |
| Voriconazol | ++ | +++ | ++ | ++ |
| Itraconazol | +++ | – | + | + |
| Posaconazol | +++ | – | – | – |
| Isavuconazol | +/++ | – | – | – |
CYP450: citocromo P450; –: no inhibición; +: leve inhibición; ++: moderada inhibición; +++: fuerte inhibición.
Modificado y adaptado de varias referencias enumeradas en la bibliografía.
Recientemente, se ha especulado sobre la necesidad de la monitorización de las concentraciones plasmáticas del isavuconazol en la práctica clínica para evaluar su eficacia o su toxicidad, como sucede con otros azoles (voriconazol, posaconazol o itraconazol), en el caso de las infecciones fúngicas invasivas por hongos filamentosos, especialmente la aspergilosis. Al respecto de esta controversia, los hallazgos de un reciente estudio apoyan la premisa de que la determinación rutinaria de la concentración plasmática del isavuconazol no es necesaria en los pacientes que reciben este antifúngico, en ausencia de datos adicionales y ante la falta de un punto de corte definido en los ensayos clínicos1. No obstante, se aceptaría que en circunstancias especiales se monitorizara la concentración del fármaco, como en el caso de pacientes con fracaso terapéutico, hepatotoxicidad inesperada, falta de adherencia, obesidad, uso de medicación concomitante que pudiera reducir las concentraciones de isavuconazol, edad<18 años, presencia de disfunción hepática moderada o localización de la infección fúngica en órganos santuarios (sistema nervioso central, ojo, hueso, etc.), quedando por definir estas condiciones en el caso de las mucormicosis. En este estudio el examen de las concentraciones plasmáticas de 283 muestras de pacientes que recibían isavuconazol en la práctica clínica frente a las obtenidas de ensayos clínicos mostraron valores prácticamente idénticos (> 1μg/ml en el 90% de los pacientes)1.
El coste del tratamiento de la mucormicosis con el isavuconazol ha sido recientemente comparado con el tratamiento estándar en el Reino Unido3. Este estudio inglés demuestra que el isavuconazol puede ser una opción coste-eficaz en el tratamiento de la mucormicosis en comparación con AmB-L en la fase inicial, seguido posteriormente de posaconazol oral en fase de mantenimiento3. Un modelo económico basado en la perspectiva del sistema de salud de este país exploró los costes de tratamiento con el isavuconazol frente a la AmB-L seguida de posaconazol. El estudio caso-control mostró similar eficacia para ambos fármacos y se adoptó una estrategia de minimización de costes, siendo los costes directos y de hospitalización estimados desde la perspectiva del sistema nacional de salud. Con ello, los costes por paciente para el isavuconazol y AmB-L más posaconazol fueron de 26,810 £ frente a 41,855 £, respectivamente, con ahorros primariamente procedentes de la adquisición del fármaco y de los costes de hospitalización, por todo lo cual los autores concluyeron que el isavuconazol podría reducir los costes en comparación con el tratamiento estándar de la mucormicosis, si bien también opinaron que hacen falta más estudios para confirmar definitivamente estos resultados.
Conflicto de interesesAmbos autores han recibido contraprestaciones por asesorías, participación en reuniones científicas y foros, así como impartido conferencias para los Laboratorios Pfizer, MSD, Gilead y Astellas Pharma.