La infección fúngica invasora ha aumentado en los últimos años por el incremento de los factores de riesgo; la candidemia es la principal manifestación clínica. Candida albicans es la especie más frecuente, aunque actualmente se ha observado un aumento en otras especies del género.
ObjetivosAnalizar la epidemiología, los factores de riesgo y la sensibilidad antifúngica de los aislamientos en hemocultivos de especies de Candida diferentes de C.albicans en nuestro hospital en los últimos 12años.
MétodosSe estudiaron retrospectivamente las características epidemiológicas de 107 pacientes con candidemia ingresados en nuestro hospital. Se determinó la sensibilidad de las especies de Candida al fluconazol, el itraconazol, el voriconazol, la anfotericinaB, la 5-fluorocitosina, la caspofungina, la micafungina y la anidulafungina mediante el método de microdilución Sensititre Yeast One (Izasa, España).
ResultadosDe los 109 aislamientos, 59 correspondieron a las siguientes especies de Candida (diferentes de C.albicans): 25 Candida parapsilosis complex, 14 Candida glabrata complex, 13 Candida tropicalis, 4 Candida krusei, una Candida lipolytica, una Candida membranaefaciens y una Candida pulcherrima. El factor de riesgo más frecuente en adultos y niños con candidemias por estas especies fue ser portador de catéter. El 8,5% de estos aislamientos fueron resistentes al fluconazol.
ConclusionesEl resultado de nuestro trabajo confirma la necesidad de conocer la epidemiología de las especies de Candida diferentes de C.albicans, su sensibilidad in vitro y los factores de riesgo asociados, especialmente en pacientes con dichos factores.
Invasive fungal infection (IFI) has increased in recent years due to there being a greater number of risk factors. IFI caused by Candida is the most frequent, and although Candida albicans is the most isolated species, there is currently a decrease of C. albicans and an increase of other species of the genus.
AimsTo analyse the epidemiology, risk factors, and antifungal susceptibility of blood culture isolates of non-C.albicans Candida species in our hospital in the last 12years.
MethodsA retrospective study was conducted on 107 patients with candidaemia admitted to our hospital. Candida isolates susceptibility to fluconazole, itraconazole, voriconazole, amphotericinB, 5-fluorocytosine, caspofungin, micafungin, and anidulafungin was determined by means of a microdilution technique (Sensititre Yeast One; Izasa, Spain).
ResultsFrom a total of 109 strains, 59 belonged to non-C. albicans Candida species: 25 Candida parapsilosis complex, 14 Candida glabrata complex, 13 Candida tropicalis, 4 Candida krusei, 1 Candida lipolytica, 1 Candida membranaefaciens, and 1 Candida pulcherrima. The most common risk factor in adults and children was catheter use. It was observed that 8.5% of those non-C.albicans strains were resistant to fluconazole.
ConclusionsThe results of this work confirm that it is necessary to know the epidemiology of non-C.albicans Candida species, the in vitro susceptibility of the species involved, and the main risk factors, especially in patients with predisposing conditions.
En los últimos años han aumentado las infecciones fúngicas invasoras (IFI)36 debido al aumento de los factores de riesgo como la inmunosupresión, los tratamientos quimioterápicos, la antibioterapia de amplio espectro, los trasplantes de órgano sólido o de progenitores hematopoyéticos, la infección por el virus de la inmunodeficiencia humana, las intervenciones quirúrgicas, las enfermedades autoinmunes, la prematuridad y la edad avanzada20,21,23,24,27,31,34,35,37. La candidemia es la principal manifestación clínica de IFI. Candida albicans es la especie más frecuente, pero actualmente se observa un aumento de otras especies del género1,7,14,16–18,33,42,43.
Nuestro objetivo es analizar retrospectivamente la epidemiología, los factores de riesgo y la sensibilidad antifúngica de los aislamientos obtenidos en hemocultivo de especies de Candida no-C. albicans en el Hospital Universitario de Valme (Sevilla) en los últimos 12años.
Material y métodosEstudiamos retrospectivamente las características epidemiológicas y los factores de riesgo de 107 pacientes con candidemia ingresados en el Hospital Universitario Valme de Sevilla entre enero de 2001 y diciembre de 2012. Se procesaron los hemocultivos por el sistema BACTEC® 9240 (Becton Dickinson, EE.UU.). Los aislamientos se identificaron mediante subcultivo en el medio CHROMagar Candida (Becton Dickinson®, EE.UU.) y por el sistema Vitek (bioMérieux®, Marcy-l’Etoile, Francia) con tarjeta YBC hasta 2004 y a partir de ese año con tarjera YST. La sensibilidad a los antifúngicos se determinó mediante el método de microdilución Sensititre Yeast One (Izasa, España). Las cepas aisladas con anterioridad al año 2010 se conservaron congeladas a −80°C y en 2010 se descongelaron para evaluar la sensibilidad a las equinocandinas mediante el método de microdilución mencionado, sin realizar previamente una nueva identificación. Se utilizaron los puntos de corte epidemiológicos recomendados por el Clinical and Laboratory Standards Institute (CLSI); para las equinocandinas, el fluconazol y el voriconazol se utilizó el documento M27-S46, para el itraconazol y la 5-fluorocitosina, el M27-A35, y el punto de corte arbitrario (CMI>1μg/ml como resistente) para la anfotericinaB33. Para cada episodio de candidemia se recogieron los datos demográficos, la procedencia, la patología de base y los factores de riesgo.
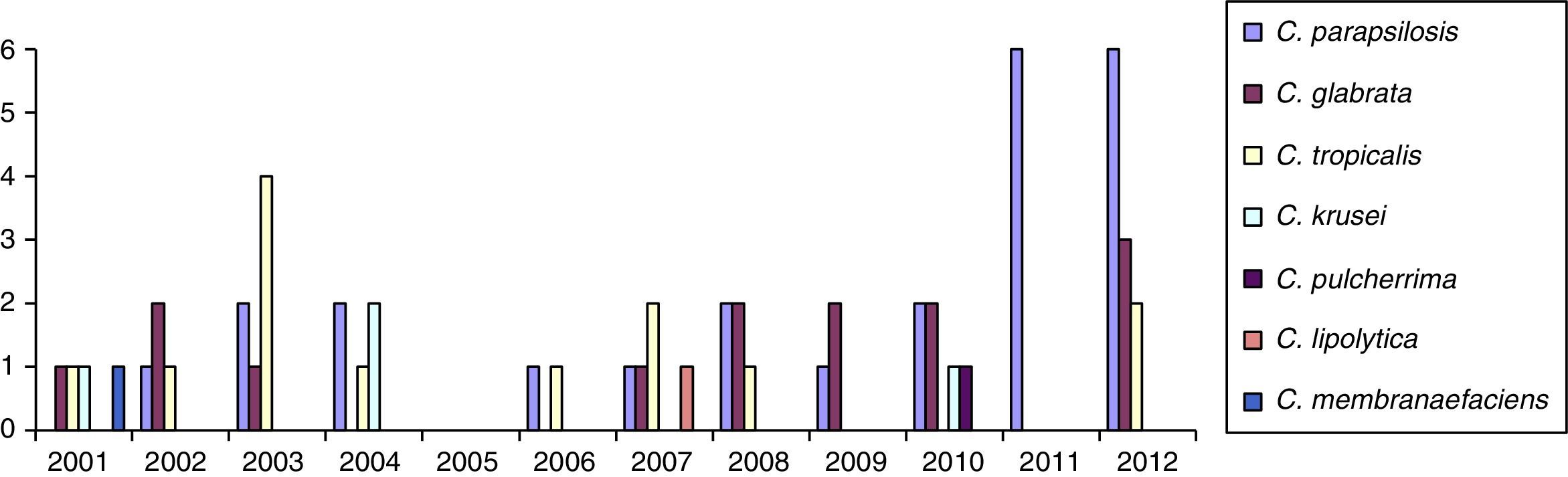
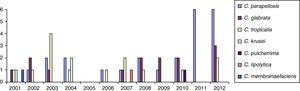
ResultadosSe obtuvieron 5.485 hemocultivos positivos con valor clínico, de los que 107 (1,9%) correspondieron a candidemias. De los 109 aislamientos obtenidos (2 pacientes tenían candidemias mixtas), 50 correspondieron a C.albicans (46%) y 59 (54%) a otras especies del género (aisladas de 52 adultos y 7 neonatos). La distribución de estas últimas especies fue la siguiente: 25 Candida parapsilosis complex, 14 Candida glabrata complex, 13 Candida tropicalis, 4 Candida krusei, una Candida pulcherrima, una Candida lipolytica y una Candida membranaefaciens. En las 2 candidemias mixtas se aislaron C.albicans junto con C.glabrata complex, y C.albicans junto con C.tropicalis. En las tablas 1 y 2 aparecen las características demográficas y la distribución de las especies de Candida no-C. albicans. En la tabla 3 se recogen los factores de riesgo de todos los pacientes con candidemias por estas últimas especies. En la figura 1 se representa la distribución de los aislamientos de Candida no-C. albicans en estos 12años. En la tabla 4 se muestra la sensibilidad in vitro de estos aislamientos estudiados.
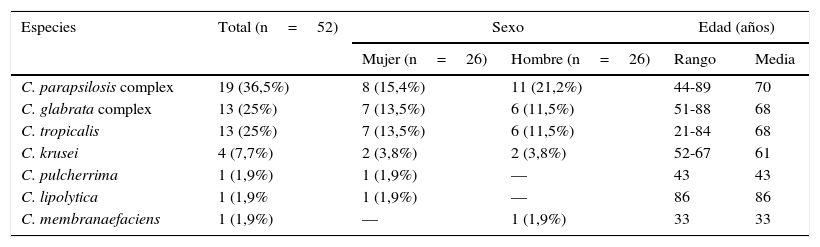
Distribución demográfica (sexo y edad) de los pacientes adultos con aislamientos de especies de Candida no-C. albicans
| Especies | Total (n=52) | Sexo | Edad (años) | ||
|---|---|---|---|---|---|
| Mujer (n=26) | Hombre (n=26) | Rango | Media | ||
| C. parapsilosis complex | 19 (36,5%) | 8 (15,4%) | 11 (21,2%) | 44-89 | 70 |
| C. glabrata complex | 13 (25%) | 7 (13,5%) | 6 (11,5%) | 51-88 | 68 |
| C. tropicalis | 13 (25%) | 7 (13,5%) | 6 (11,5%) | 21-84 | 68 |
| C. krusei | 4 (7,7%) | 2 (3,8%) | 2 (3,8%) | 52-67 | 61 |
| C. pulcherrima | 1 (1,9%) | 1 (1,9%) | — | 43 | 43 |
| C. lipolytica | 1 (1,9% | 1 (1,9%) | — | 86 | 86 |
| C. membranaefaciens | 1 (1,9%) | — | 1 (1,9%) | 33 | 33 |
Distribución demográfica (sexo y edad) de la población pediátrica con aislamientos de especies de Candida no-C. albicans
| Especie | Total (n = 7) | Sexo | Edad (días) | ||
|---|---|---|---|---|---|
| Mujer | Hombre | Rango | Media | ||
| C. parapsilosis complex | 6 (85,7%) | 3 (42,8%) | 3 (42,8%) | 11-28 | 16 |
| C. glabrata complex | 1 (14,3%) | - | 1 (14,3%) | 14 | 14 |
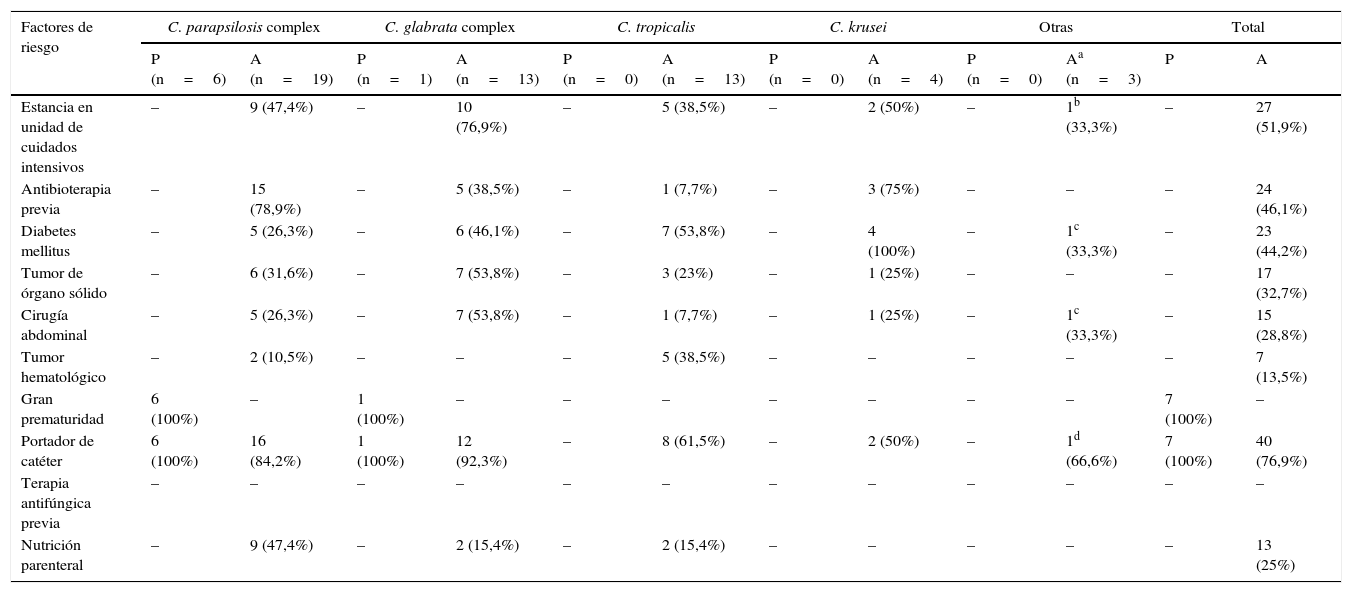
Factores de riesgo según la especie en candidemias por especies de Candida no-C. albicans en la población pediátrica (P) y en la adulta (A)
| Factores de riesgo | C. parapsilosis complex | C. glabrata complex | C. tropicalis | C. krusei | Otras | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| P (n=6) | A (n=19) | P (n=1) | A (n=13) | P (n=0) | A (n=13) | P (n=0) | A (n=4) | P (n=0) | Aa (n=3) | P | A | |
| Estancia en unidad de cuidados intensivos | – | 9 (47,4%) | – | 10 (76,9%) | – | 5 (38,5%) | – | 2 (50%) | – | 1b (33,3%) | – | 27 (51,9%) |
| Antibioterapia previa | – | 15 (78,9%) | – | 5 (38,5%) | – | 1 (7,7%) | – | 3 (75%) | – | – | – | 24 (46,1%) |
| Diabetes mellitus | – | 5 (26,3%) | – | 6 (46,1%) | – | 7 (53,8%) | – | 4 (100%) | – | 1c (33,3%) | – | 23 (44,2%) |
| Tumor de órgano sólido | – | 6 (31,6%) | – | 7 (53,8%) | – | 3 (23%) | – | 1 (25%) | – | – | – | 17 (32,7%) |
| Cirugía abdominal | – | 5 (26,3%) | – | 7 (53,8%) | – | 1 (7,7%) | – | 1 (25%) | – | 1c (33,3%) | – | 15 (28,8%) |
| Tumor hematológico | – | 2 (10,5%) | – | – | – | 5 (38,5%) | – | – | – | – | – | 7 (13,5%) |
| Gran prematuridad | 6 (100%) | – | 1 (100%) | – | – | – | – | – | – | – | 7 (100%) | – |
| Portador de catéter | 6 (100%) | 16 (84,2%) | 1 (100%) | 12 (92,3%) | – | 8 (61,5%) | – | 2 (50%) | – | 1d (66,6%) | 7 (100%) | 40 (76,9%) |
| Terapia antifúngica previa | – | – | – | – | – | – | – | – | – | – | – | – |
| Nutrición parenteral | – | 9 (47,4%) | – | 2 (15,4%) | – | 2 (15,4%) | – | – | – | – | – | 13 (25%) |
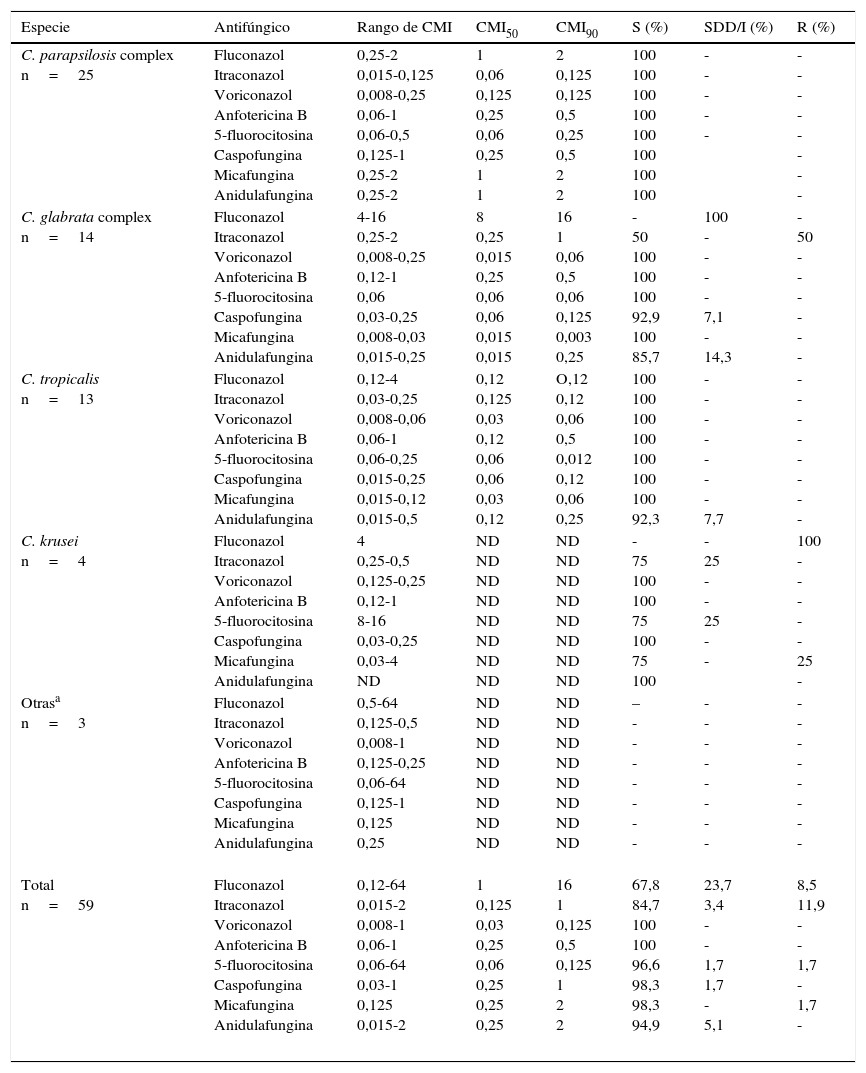
Sensibilidad in vitro (mg/l) de especies de Candida no-C. albicans a diferentes antifúngicos: rango, CMI50, CMI90 y categoría clínica
| Especie | Antifúngico | Rango de CMI | CMI50 | CMI90 | S (%) | SDD/I (%) | R (%) |
|---|---|---|---|---|---|---|---|
| C. parapsilosis complex n=25 | Fluconazol Itraconazol Voriconazol Anfotericina B 5-fluorocitosina Caspofungina Micafungina Anidulafungina | 0,25-2 0,015-0,125 0,008-0,25 0,06-1 0,06-0,5 0,125-1 0,25-2 0,25-2 | 1 0,06 0,125 0,25 0,06 0,25 1 1 | 2 0,125 0,125 0,5 0,25 0,5 2 2 | 100 100 100 100 100 100 100 100 | - - - - - | - - - - - - - - |
| C. glabrata complex n=14 | Fluconazol Itraconazol Voriconazol Anfotericina B 5-fluorocitosina Caspofungina Micafungina Anidulafungina | 4-16 0,25-2 0,008-0,25 0,12-1 0,06 0,03-0,25 0,008-0,03 0,015-0,25 | 8 0,25 0,015 0,25 0,06 0,06 0,015 0,015 | 16 1 0,06 0,5 0,06 0,125 0,003 0,25 | - 50 100 100 100 92,9 100 85,7 | 100 - - - - 7,1 - 14,3 | - 50 - - - - - - |
| C. tropicalis n=13 | Fluconazol Itraconazol Voriconazol Anfotericina B 5-fluorocitosina Caspofungina Micafungina Anidulafungina | 0,12-4 0,03-0,25 0,008-0,06 0,06-1 0,06-0,25 0,015-0,25 0,015-0,12 0,015-0,5 | 0,12 0,125 0,03 0,12 0,06 0,06 0,03 0,12 | O,12 0,12 0,06 0,5 0,012 0,12 0,06 0,25 | 100 100 100 100 100 100 100 92,3 | - - - - - - - 7,7 | - - - - - - - - |
| C. krusei n=4 | Fluconazol Itraconazol Voriconazol Anfotericina B 5-fluorocitosina Caspofungina Micafungina Anidulafungina | 4 0,25-0,5 0,125-0,25 0,12-1 8-16 0,03-0,25 0,03-4 ND | ND ND ND ND ND ND ND ND | ND ND ND ND ND ND ND ND | - 75 100 100 75 100 75 100 | - 25 - - 25 - - | 100 - - - - - 25 - |
| Otrasa n=3 | Fluconazol Itraconazol Voriconazol Anfotericina B 5-fluorocitosina Caspofungina Micafungina Anidulafungina | 0,5-64 0,125-0,5 0,008-1 0,125-0,25 0,06-64 0,125-1 0,125 0,25 | ND ND ND ND ND ND ND ND | ND ND ND ND ND ND ND ND | – - - - - - - - | - - - - - - - - | - - - - - - - - |
| Total n=59 | Fluconazol Itraconazol Voriconazol Anfotericina B 5-fluorocitosina Caspofungina Micafungina Anidulafungina | 0,12-64 0,015-2 0,008-1 0,06-1 0,06-64 0,03-1 0,125 0,015-2 | 1 0,125 0,03 0,25 0,06 0,25 0,25 0,25 | 16 1 0,125 0,5 0,125 1 2 2 | 67,8 84,7 100 100 96,6 98,3 98,3 94,9 | 23,7 3,4 - - 1,7 1,7 - 5,1 | 8,5 11,9 - - 1,7 - 1,7 - |
I: intermedio; ND: no determinada; R: resistente; S: sensible; SDD: sensible dependiente de la dosis.
C. pulcherrima: CMI fluconazol 0,5mg/l, CMI itraconazol 0,125mg/l, CMI voriconazol ≤0,008mg/l, CMI anfotericina B 0,25mg/l, CMI 5-fluorocitosina ≤0,006mg/l, CMI caspofungina 0,12mg/l, CMI micafungina 0,12mg/l y CMI anidulafungina 0,25mg/l.
C. lipolytica: CMI fluconazol ≥64mg/l, CMI itraconazol 0,5mg/l, CMI voriconazol 1mg/l, CMI anfotericina B 0,125mg/l, CMI 5-fluorocitosina ≥64mg/l, CMI caspofungina 1mg/l, CMI micafungina y anidulafungina ND.
C. membranaefaciens: CMI fluconazol 4mg/l, CMI itraconazol 0,125mg/l, CMI voriconazol ND, CMI anfotericina B 0,25mg/l, CMI 5-fluorocitosina ≤ 0,006mg/l, CMI caspofungina, micafungina y anidulafungina ND.
Está descrito el aumento progresivo de las especies de Candida no-C. albicans como agentes causales de candidemia en el ámbito hospitalario. La especie más frecuente en este estudio fue C.parapsilosis complex (23%), seguida de C.glabrata complex (13%), lo que coincide con el estudio CANDIPOP (24,9 y 13,4%, respectivamente)38 y el estudio FUNGEMYCA (26,6 y 11,5%)33. En otro estudio realizado en Andalucía42 la especie preponderante Candida no-C. albicans fue C.parapsilosis complex (15,6%), lo que también coincide con nuestro estudio, pero la segunda en frecuencia fue C.tropicalis (13,3%), dato que difiere de los nuestros pero que concuerda con los de Almirante et al.1,12 (10%). Nuestros datos tampoco se correlacionan con estudios internacionales, donde la primera especie fue C.glabrata complex, seguida de C.parapsilosis complex19,20,34,36,37.
En los pacientes adultos, los factores de riesgo más frecuentes para el desarrollo de candidemia fueron ser portador de catéter (76,9%), estancia en la UCI (51,9%) y tratamiento antibiótico previo (46,1%), resultados similares a otros publicados1,39,43. En la población pediátrica estos factores fueron la prematuridad y la presencia de catéter, al igual que en otros estudios9,13,40,45. C.parapsilosis complex (85,7%) fue la más aislada, al igual que lo descrito por otros autores13,30, lo que se relacionó en el 100% de los casos con el uso de catéter3,13,15,20,28,35,36,41. C.glabrata complex parece relacionarse con la edad avanzada y las enfermedades oncohematológicas26,38. El 92,8% de nuestros pacientes con candidemia por esta especie eran adultos (el 50% mayores de 65años), como en otros trabajos15,20,35,37. Ninguno padecía enfermedad oncohematológica3,13,15,20,25,28,35,37,41. Diversos autores relacionan C.tropicalis con neoplasias oncohematológicas y con el trasplante de células hematopoyéticas20,35,36. El 38,5% de los pacientes con C.tropicalis presentaban neoplasias hematológicas. La candidemia por C.krusei se asocia con tratamiento previo con fluconazol, enfermedades oncohematológicas, neutropenia y la propia colonización por esta especie3,13,15,20,28,35,37,41. Ninguno de nuestros pacientes presentó los factores de riesgo mencionados. C.pulcherrima se aisló en un paciente con catéter. No encontramos en la literatura factores de riesgo asociados a la candidemia por esta especie. Como lo observado por otros autores, el factor de riesgo de candidemia por C.lipolytica en nuestro estudio fue ser portador de catéter2,8,22. La infección por VIH y el tiempo prolongado en la UCI fueron los factores de riesgo que encontramos en la candidemia por C.membranaefaciens, lo que no coincide con lo descrito en otros trabajos11. Por sexos, predomina el masculino sobre el femenino (61,5% vs. 38,5%), datos que resultan similares a los publicados32,46. Los patrones de sensibilidad se corresponden a los esperados, sin observar diferencias con diversos estudios4,10,13,29,33,38,44,45. Todos los aislamientos de C.glabrata complex fueron sensibles dependiendo de la dosis (SDD) al fluconazol, al igual que en el estudio CANDIPOP38 pero en discrepancia con otros, en los que se detectó resistencia en el 6,3 y el 7,4% de los aislamientos estudiados33,42. C.lipolytica fue resistente al fluconazol y la 5-fluorocitosina, y SDD al itraconazol, como en otros estudios publicados2,8,22.
ConclusionesLa distribución de especies de Candida no-C. albicans causantes de candidemia depende fundamentalmente de los factores de riesgo asociados a cada paciente; la mayoría de nuestros pacientes presentaron 2 o más factores de riesgo. Es necesario conocer estos datos epidemiológicos y la sensibilidad a los diferentes antifúngicos, incluso con cada centro hospitalario, para poder instaurar una terapia antifúngica empírica adecuada. La sensibilidad de las cepas estudiadas en este trabajo se corresponde con el patrón habitual de nuestra área.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.