Psilocybe cubensis es una especie de acción psicodisléptica, que crece sobre estiércol vacuno en praderas de zonas tropicales y subtropicales, consumido en México desde épocas ancestrales tanto con fines ceremoniales y rituales como curativos o medicinales. Artemia franciscana es un crustáceo utilizado con frecuencia como organismo modelo para pruebas de toxicidad.
ObjetivosConocer la toxicidad de P. cubensis, a través de un extracto de esta especie, sobre nauplios y adultos de A. franciscana.
MétodosLos especímenes se recolectaron en la región de Bahía de Banderas, Jalisco, México, se secaron y homogeneizaron en agua de mar artificial. Los bioensayos se realizaron en tubos de ensayo con diferentes concentraciones del extracto de P. cubensis (EAP) y con dicromato de potasio como sustancia tóxica de referencia. Para conocer la toxicidad se calculó la concentración letal media (CL50) en nauplios y adultos y el porcentaje de inhibición de la eclosión de los quistes de A. franciscana.
ResultadosLos nauplios presentaron una CL50=135μg/ml, mientras que la de los adultos fue CL50=172μg/ml. El EAP inhibió la eclosión de los quistes en un 100% en todas las concentraciones.
ConclusionesBajo las condiciones de este estudio, el extracto de P. cubensis resultó tóxico para nauplios y adultos de A. franciscana.
Psilocybe cubensis is a species with psychodysleptic action that grows on cattle dung in pastures in the tropics and subtropics. This fungus has been widely used in Mexico since ancient times both for ceremonies and rituals, as well as for healing or medicinal purposes. Artemia franciscana is a crustacean frequently used as a model organism for toxicity testing.
AimsWith the objective of determining the toxicity of P. cubensis, the results of a study with the extract of P. cubensis on nauplii and adults of the brine shrimp A. franciscana are presented.
MethodsSpecimens were collected at Bahía de Banderas, Jalisco, Mexico, and were dried and homogenized in artificial sea water. Bioassays were carried out on crystal vials filled with different concentrations of the extract of P. cubensis (EAP), and with potassium dichromate as reference toxic compound. The median lethal concentration (LC50) in nauplii and adults and the inhibition of cysts hatching in A. franciscana were calculated.
ResultsNauplii showed a LC50=135μg/ml, while adults a LC50=172μg/ml. Cysts’ hatching was inhibited by the EAP at all tested concentrations.
ConclusionsUnder the conditions of this study, the extract of P. cubensis was toxic for nauplii and adults of A. franciscana.
Psilocybe cubensis (Earle) Singer es una especie coprófila que fructifica en el estiércol vacuno de las praderas de zonas tropicales y subtropicales8. Tiene una amplia distribución, se conoce en América, desde Estados Unidos hasta Argentina, en Asia en Camboya, Filipinas, India, Tailandia y Vietnam, y en Oceanía tanto en Australia, como en Tasmania, Nueva Zelanda, o las islas Fiji10. Desde la época prehispánica se ha consumido en México, tanto en ceremonias y rituales como con fines medicinales. Al igual que todas las especies alucinógenas del género Psilocybe, su cuerpo fructífero, a excepción de las laminillas, se torna azul-verdoso al tocarse o manipularse y presenta un olor y sabor semejantes a los de la harina fermentada9. En la actualidad es consumido como droga recreativa, por algunos sectores de la población mexicana (principalmente adolescentes), aunque su posesión es considerada delito. A pesar de que en México no se han llevado a cabo estudios sobre su toxicidad, existen evidencias que permiten considerarlo como tóxico para el hombre1–3,16, pues su ingestión provoca desviación o perturbación del mecanismo psíquico (debido a las toxinas indólicas denominadas psilocibina y psilocina) que se manifiesta con alucinaciones visuales y auditivas (efecto psicodisléptico)9,19. También puede causar trastornos de ansiedad, ataxia, convulsiones severas, desorientación, hipotensión, hipertensión, parestesia, disforia, espasmos musculares, midriasis, náuseas, salivación, sudoración, taquicardia, inconsciencia, hiperventilación, agresividad, suicidio e incluso la muerte como consecuencia de reacciones alérgicas graves1,16.
Artemia franciscana Kellog es un crustáceo utilizado como organismo modelo en pruebas de toxicidad20, incluida la detección de toxinas fúngicas11,22, debido a su adaptabilidad a diferentes condiciones abióticas y fuentes nutricionales, ciclo de vida corto, baja variabilidad genética y disponibilidad continua de quistes y organismos a bajo coste en comparación con otros organismos modelo15. Se ha utilizado en la evaluación de la toxicidad de extractos de plantas5, detección de citotoxicidad de productos naturales marinos4, metabolitos fúngicos6,7,14 y compuestos químicos como el dióxido de cloro en agua de mar17.
El objetivo de este estudio fue determinar la toxicidad de P. cubensis mediante el cálculo de la concentración letal media (CL50) utilizando para ello A. franciscana como organismo modelo, con la intención de iniciar los estudios que permitan establecer la toxicidad de las poblaciones de esta especie en México.
Los cuerpos fructíferos de P. cubensis se recolectaron en la región de Bahía de Banderas (costa norte del estado de Jalisco, México, 20°39’18” N y 105°11’42”) durante la temporada de lluvias, que abarca de finales de junio a finales de octubre. Para la obtención de su extracto acuoso (EAP) se utilizó la metodología modificada de Kirsten y Bernardi12, que consiste en tomar 8g de ejemplares secos y molidos, y mezclarlos con 80ml de agua de mar artificial (Coral Reef®) para obtener metabolitos totalmente solubles. De esta forma se evitaron variaciones en la salinidad derivadas de una extracción con agua destilada y sus posteriores diluciones en el medio acuoso experimental, que pudieran ocasionar estrés y posible muerte a las artemias (debido al súbito choque osmótico). La mezcla se calentó a 80°C durante 15 minutos y se dejó enfriar a temperatura ambiente. Posteriormente se centrifugó a 1.500G durante 5 minutos, se recuperó el sobrenadante y se almacenó a 4°C hasta su utilización (tiempo de almacenamiento menor a 15 días). El bioensayo de toxicidad se llevó a cabo utilizando dicromato de potasio (DP) como sustancia de referencia (testigo positivo tóxico)14, diluido a diferentes concentraciones en el mismo medio salino.
Los quistes de A. franciscana (INVE®, Salt Lake City, Utah, EE.UU.) (1g) se colocaron en 100ml de agua de mar artificial (40ups) para su hidratación; posteriormente se trasladaron a una cámara de eclosión de 15l con agua ajustada a la misma salinidad, manteniendo una temperatura de 28°C, aireación e iluminación constante hasta su eclosión. Para el bioensayo con nauplios (larvas de A. franciscana) se realizó la cosecha de los mismos el tercer día de la eclosión. El resto de los organismos se trasladaron a un acuario (20l), manteniendo los parámetros anteriores, añadiendo Spirulina maxima Bernard deshidratada como nutriente, hasta alcanzar la edad adulta a los 15 días21.
Se prepararon soluciones stock tanto del EAP como del DP, a partir de las cuales se realizaron diluciones para obtener concentraciones de 250, 100, 50, 25 y 10μg/ml para el EAP y de 500, 250, 100, 50, 25, 10 y 5μg/ml para el DP. Se colocaron 5 o 10ml de cada dilución en tubos de ensayo, y se introdujeron 10 nauplios o 10 adultos por tubo, respectivamente. Como testigos se utilizaron las mismas cantidades de nauplios y adultos, en los mismos volúmenes de agua, pero sin agregar EAP ni DP. Los bioensayos se realizaron por sextuplicado. Al término de 24h de exposición se contaron los organismos muertos en cada tubo de ensayo, los cuales se consideraron sin vida al no presentar movimiento de sus apéndices durante 10 segundos. El cálculo de la CL50 se realizó de acuerdo con Reed y Muench18.
Para el bioensayo de la inhibición de la eclosión, se colocaron 40 quistes de A. franciscana por tubo de ensayo, se hidrataron y posteriormente se aplicó el mismo patrón de concentraciones de DP y EAP, con 3 réplicas. Se contaron los organismos eclosionados en cada concentración en un tiempo de 24 y 48h, teniendo en cuenta los que se encontraban en estado de umbrella (estadio en el cual el nauplio comienza a emerger del quiste y su apariencia es similar a un paraguas), así como los que alcanzaron el estadio nauplial, y se calculó el porcentaje de inhibición de la eclosión.
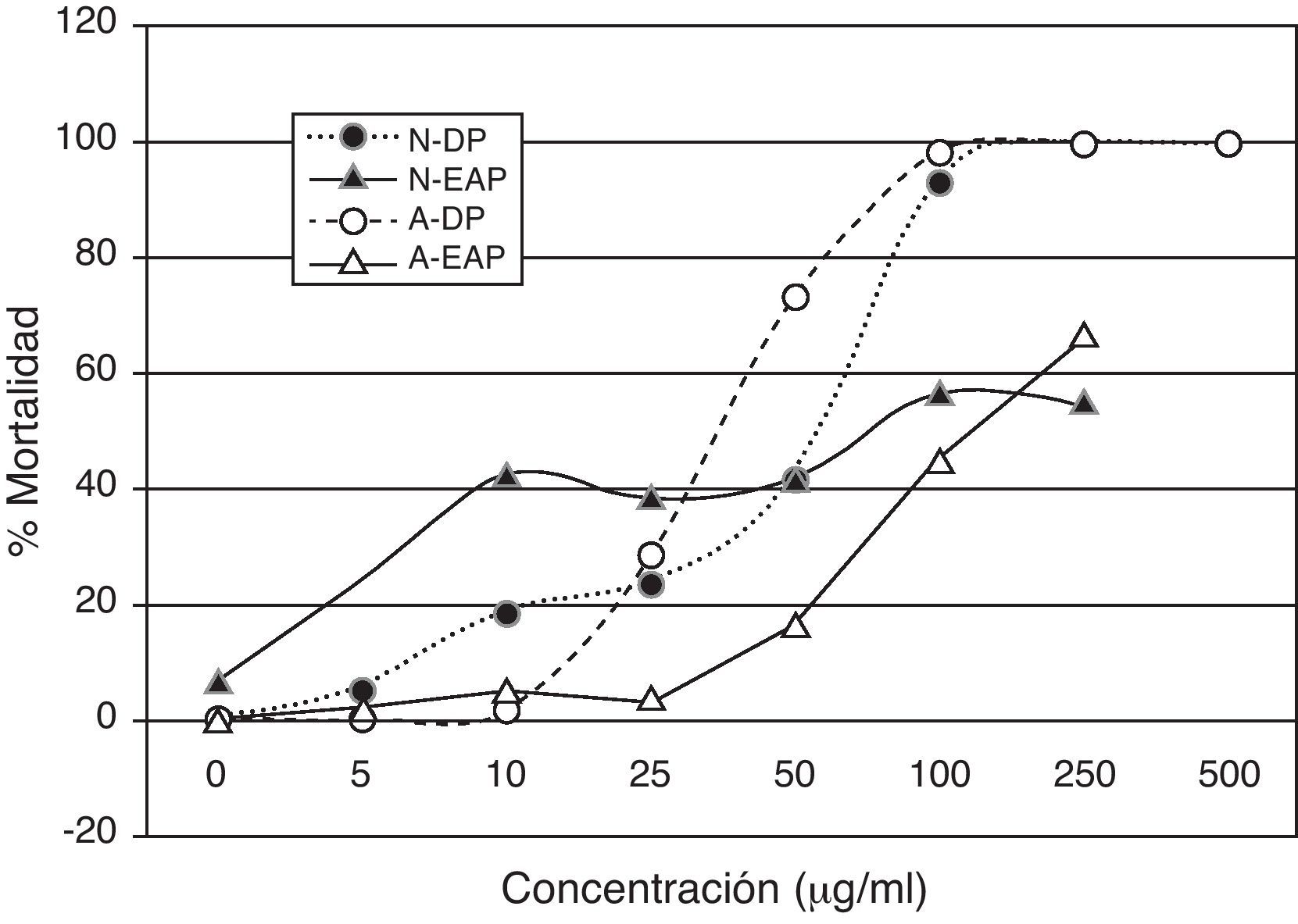
El resultado de este estudio fue que el EAP en concentraciones de 10 a 50μg/ml provoca alrededor del 40% de mortalidad de los nauplios, mientras que en concentración mayor provocó aproximadamente el 55% de mortalidad (fig. 1). La CL50 fue de 135μg/ml para el EAP, y de 53μg/ml para el DP. En los organismos adultos se observó que el EAP en concentraciones de 10 a 25μg/ml ocasiona mortalidad muy baja, que se incrementa en concentraciones mayores hasta alcanzar un máximo cercano al 70%. La CL50 para organismos adultos resultó de 172μg/ml para el EAP y de 46μg/ml para el DP.
Porcentaje de mortalidad de nauplios y adultos de A. franciscana causada por las diferentes concentraciones del extracto acuoso de P. cubensis (EAP) y dicromato de potasio (DP). A-DP: adultos con tratamiento DP; A-EAP: adultos con tratamiento EAP; N-DP: nauplios con tratamiento DP; N-EAP: nauplios con tratamiento EAP.
En estudios similares en especies comestibles como Pleurotus ostreatus (Jacq.) P. Kumm. y Pleurotus pulmonarius (Fr.) Quél. se obtuvo una CL50 superior a los 1.000μg/ml en A. franciscana, mientras que Paxillus involutus (Batsch) Fr. presentó una CL50 de 94,4μg/ml, por lo que se consideró como poco seguro para el consumo humano14. Lo anterior sugiere que, bajo las condiciones establecidas en el presente protocolo, los especímenes de P. cubensis recolectados en la región costa norte de Jalisco, México, podrían considerarse poco recomendables para su consumo, aunque su toxicidad es mucho menor a la de micotoxinas, como la aflatoxina GI, el diacetoxiscirpenol, la gliotoxina y la esterigmatocistina, que a bajas concentraciones (0,47-3,5μg/ml) provocaron mortalidad del 50% de los nauplios de Artemia salina L.11. Kirsten y Bernardi12 administraron a ratones (por vía interperitoneal) un extracto de P. cubensis con una concentración de 10μg/ml, encontrando modificaciones importantes en su comportamiento normal. La concentración mencionada se corresponde con una de las utilizadas en este estudio, que causó efectos negativos en la supervivencia de A. franciscana, principalmente en nauplios.
Bajo condiciones ambientales adversas, las hembras de A. franciscana liberan embriones en la etapa de gastrulación rodeados por una cápsula (quistes). Estos quistes se encuentran en estado de diapausa, por lo que su metabolismo se reduce al máximo y su resistencia a factores de estrés es muy alta13. Una vez que las condiciones ambientales son apropiadas, la diapausa se rompe, el embrión se activa y retoma su desarrollo hasta ser liberado como nauplio23. En el presente estudio se observó un porcentaje de inhibición de la eclosión del 100% a todas las concentraciones de EAP; sin embargo, bajo el efecto de un tóxico conocido (DP), la eclosión fue del 32%. Lo anterior sugiere que el EAP produjo el mantenimiento de la diapausa del embrión en desarrollo, o bien la muerte del mismo. Determinar las causas de la alta inhibición de la eclosión demostrada por el EAP es el objetivo de estudios en proceso.
Se agradecen los recursos aportados por el proyecto COECYTJAL 066-2009-661 para el desarrollo de esta investigación.