De la literatura publicada se desprende que las infecciones producidas por hongos dematiáceos afectan con mayor frecuencia a pacientes inmunodeprimidos, y que estas infecciones se manifiestan desde formas subcutáneas hasta formas diseminadas que pueden comprometer la vida del paciente. En muchos casos la infección se relaciona con la inoculación del microorganismo por distintos mecanismos traumáticos, lo que determina que la evolución de la infección muchas veces sea lenta.
Caso clínicoSe describen dos casos clínicos de feohifomicosis causados por Phaeoacremonium parasiticum, con un paciente oncológico con lesiones subcutáneas que afectaban a la mano y antebrazo izquierdos, y otro paciente que presentaba abscesos subcutáneos en la pierna izquierda.
ConclusionesEstos casos confirman la presencia de este hongo en España y demuestran la complejidad en el tratamiento. Fue necesario el uso combinado de anfotericina B (complejo lipídico) y de posaconazol, junto con varias resecciones quirúrgicas, para poder conseguir superar la infección que presentaba uno de los pacientes.
From the available literature, it is demonstrated that dematiaceous fungal infections mostly affect immunosuppressed patients. These infections can occur in different forms, from subcutaneous infection to disseminated forms that may compromise the life of the patient. In many cases the infection is related to the inoculation of the microorganism by diverse traumatic mechanisms, which determines the course of the infection to be slower in some cases.
Case reportWe describe two cases of phaeohyphomycosis caused by Phaeoacremonium parasiticum: A cancer patient with subcutaneous lesions affecting the left hand and forearm, and a patient who presented with subcutaneous abscesses in the left leg.
ConclusionsThese cases confirm the presence of this type of fungus in Spain. In the second case a combination of amphotericin B lipid complex and posaconazole, together with several surgical resections, were necessary in order to overcome the infection.
La incidencia de infecciones fúngicas ha aumentado significativamente en las últimas décadas, paralelamente a los avances médico-tecnológicos. Esta situación se ha observado principalmente en pacientes inmunodeprimidos, como los enfermos oncológicos o aquellos sometidos a trasplante de órgano sólido o de progenitores hematopoyéticos. Tal es el caso de un tipo de infección que por sus características clínicas y por el género del hongo causante, Ajello y Hay2 propusieron denominar feohifomicosis en el año 1974. Este es un término que incluye un amplio espectro de infecciones causadas por hongos cuya característica común es la de producir hifas septadas con pigmentación de melanina, pero que se diferencian de las micosis clínicas causadas por hongos negros, establecidas de manera histórica (cromomicosis y eumicetomas). Estos hongos dematiáceos están presentes en suelos relacionados con detritus vegetales, que pueden ser la causa de enfermedades tanto en plantas como en el ser humano y los animales. La diversidad de estas infecciones queda reflejada en la variedad de cuadros clínicos publicados en la literatura, destacando principalmente dos formas clínicas: la subcutánea y la diseminada29.
A lo largo del tiempo, la nomenclatura de los agentes etiológicos también ha sufrido continuos cambios según las ordenaciones taxonómicas utilizadas; Crous et al.7 propusieron en 1996 el nuevo género Phaeoacremonium, morfológicamente intermedio entre los géneros Acremonium y Phialophora, y definieron la especie Phialophora parasitica como la nueva especie Phaeoacremonium parasiticum, junto con cinco nuevas especies.
A continuación analizamos la etiología, la presentación clínica y el tratamiento de dos casos de nuestro hospital de feohifomicosis subcutánea en pacientes inmunodeprimidos.
Casos clínicosCaso 1Se trata de un varón de 78 años de edad, con antecedentes de nefrectomía por neoplasia renal, insuficiencia renal crónica, neoplasia de próstata hormonorrefractaria con metástasis óseas y cardiopatía isquémica. En mayo de 2007 acude al Servicio de Urgencias por un cuadro de tumefacción de unos 3 días de evolución en la mano izquierda. Refiere que hace un mes presentó un hematoma espontáneo autolimitante en la cara dorsal de la mano izquierda. A su ingreso, el paciente presentaba una clínica compatible con insuficiencia cardiaca biventricular y un edema en toda la extremidad, acompañado este de signos eritematosos. Ante una probable celulitis, se comenzó con un tratamiento antibiótico con amoxicilina-clavulánico. A pesar del tratamiento instaurado, el paciente empeoró progresivamente, por lo que se le realizó una punción de la extremidad para drenaje del líquido alojado y biopsia del dorso de la mano. En el estudio histopatológico de la biopsia se observaron focos de necrosis asociados a un infiltrado inflamatorio granulomatoso, con presencia de hifas tabicadas con la tinción de Grocott y hematoxilina-eosina. Se añadió voriconazol al tratamiento antibiótico previo y se realizó desbridamiento quirúrgico. Los desbridamientos quirúrgicos fueron un total de tres e incluían la mano y el antebrazo, y comprometían los distintos compartimentos fasciomusculares. En todos ellos se drenó abundante material purulento de coloración marronácea que infiltraba toda la musculatura de la extremidad. A pesar del tratamiento la evolución no fue favorable al tratarse de un paciente monorreno con una insuficiencia renal crónica y un empeoramiento progresivo de la función renal, además de presentar acidosis metabólica junto con una nueva descompensación de su insuficiencia cardiaca. El paciente falleció a las tres semanas de su ingreso.
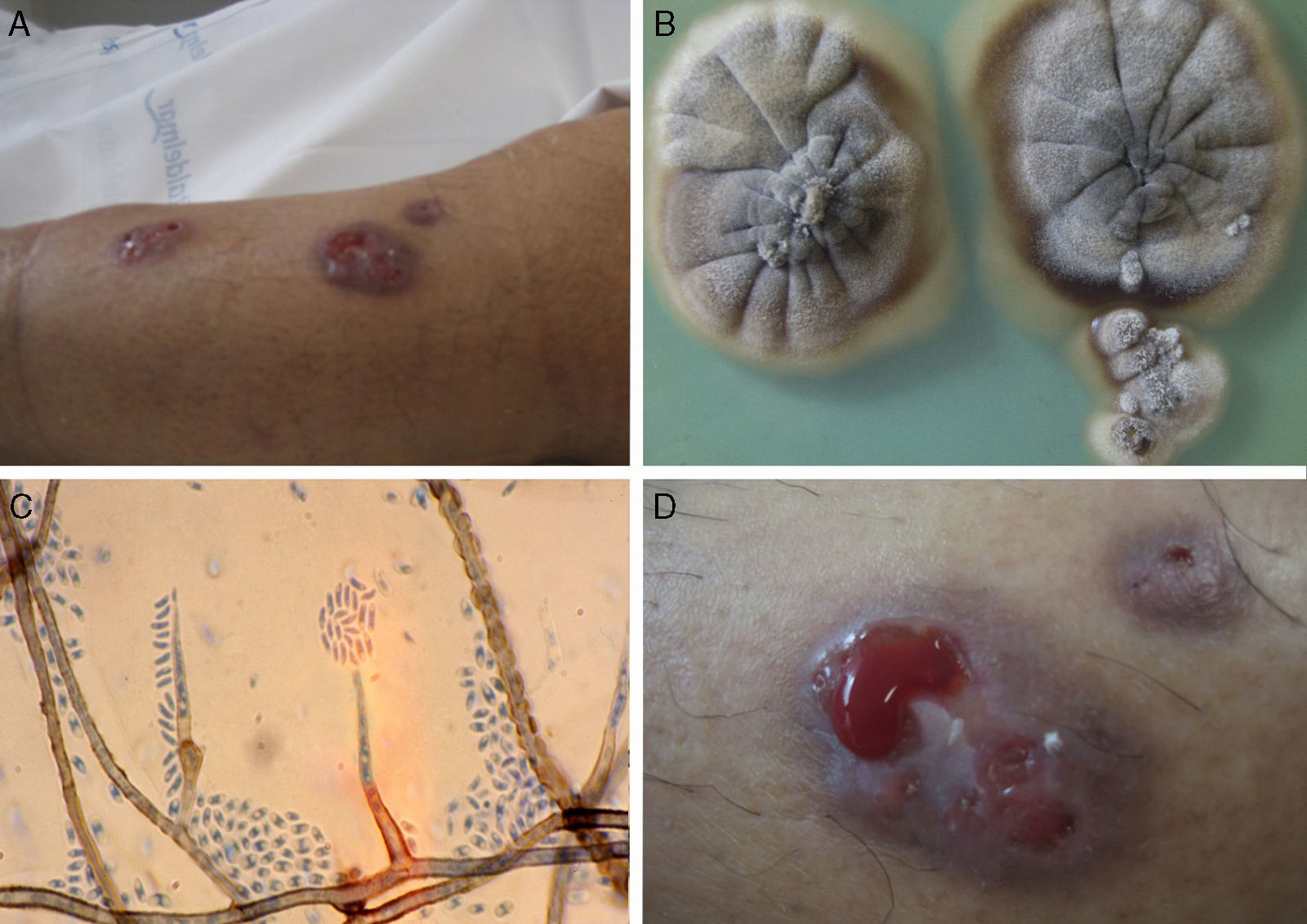
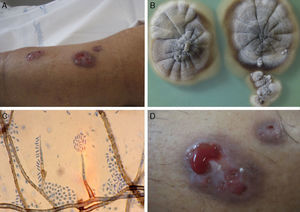
Caso 2Se trata de un varón de 72 años de edad, con antecedentes de diabetes mellitus tipo 2 y trasplante renal de donante en asistolia. En abril de 2009 acude a la consulta por presentar diferentes puntos fistulosos sin lesión ulcerativa en la zona anterolateral de la pierna izquierda que drenaban abundante material purulento (fig. 1). Las lesiones habían aparecido de manera espontánea cuatro meses antes en forma de úlceras hemorrágicas catalogadas inicialmente de origen vascular, y evolucionaron a abscesos subcutáneos. Se realizó una ecografía de partes blandas que mostraba la abscesificación de las lesiones, y una resonancia magnética que reflejaba signos de celulitis y miositis en las caras laterales del muslo y la pierna, en ausencia de osteomielitis. Se procedió al desbridamiento de las lesiones, obteniendo abundante material purulento, y se inició tratamiento con voriconazol, intravenoso al principio, y después, oral.
Las muestras obtenidas de ambos pacientes, tanto líquidos de drenaje de las lesiones como muestras de biopsias, fueron sembradas en agar glucosado de Sabouraud (Difco), agar Sabouraud con cloranfenicol (bioMérieux) y agar Mycosel (Difco). Los cultivos obtenidos fueron resembrados en agar extracto de malta (Difco) y agar harina de avena (Difco), e incubados a 30°C para la correcta identificación de los aislamientos. Transcurridas tres semanas de la siembra de las muestras se aisló en el medio agar glucosado de Sabouraud un hongo filamentoso de aspecto aterciopelado, color miel-marrón-gris y pliegues radiales en el anverso, mientras que en el reverso mostraba una pigmentación marronácea irregular (fig. 1). En el microscopio se observaron hifas septadas, ramificadas, inicialmente hialinas y de pared lisa, volviéndose de color pardo y a menudo con abundantes gotas de exudado que daban a la pared un aspecto tuberculado. El conidióforo era recto, simple o ramificado, algo aciculado hacia el ápice, de 15-40μm de longitud, y se apreciaba discretamente un collarete donde se acumulaban las conidias en masas mucosas. Las conidias eran hialinas, de pared fina y forma cilíndrica o elíptica de 3-4×1,5-2μm (fig. 1). Estas observaciones permitieron la identificación de la especie, según lo descrito8,19, como Phaeoacremonium parasiticum.
Posteriormente se realizó un estudio de sensibilidad in vitro frente a diferentes antifúngicos siguiendo la pauta del fabricante mediante la técnica E-test® (AB Biodisk). Los valores de concentración mínima inhibitoria obtenidos fueron los siguientes: voriconazol 0,19μg/ml y posaconazol 2μg/ml, que fueron interpretados como valores de sensibilidad; itraconazol, 5-fluorocitosina y caspofungina≥32μg/ml, interpretados como valores de resistencia; fluconazol≥256μg/ml, valor igualmente de resistencia, y anfotericina B 2μg/ml, que se interpretó como sensibilidad disminuida.
La evolución posquirúrgica del paciente fue satisfactoria, con buen aspecto de las heridas y sin constatar nuevos focos de drenaje purulento, motivo por el cual pudo ser dado de alta. No obstante, el paciente debió ingresar a la semana del alta, de forma programada, para realizar un tratamiento con anfotericina B (complejo lipídico) por presentar toxicidad hepática por voriconazol. Más tarde presentó disfunción renal por nefrotoxicidad, lo que llevó a cambiar la anfotericina B por itraconazol, hasta la lenta mejoría de la función renal. A los 3 meses el paciente precisó un nuevo desbridamiento que afectó la parte lateral de la pierna, sobre la musculatura de la tibia anterior y los músculos peroneos. Se instauró un tratamiento combinado de posaconazol y anfotericina B (complejo lipídico) durante 20 días, con buena evolución posterior. Fue dado de alta con posaconazol oral de mantenimiento hasta completar 12 meses. Un año después de suspender el tratamiento antifúngico el paciente se mantiene asintomático y sin lesiones cutáneas activas.
DiscusiónEl género Phaeoacremonium es una inusual causa de infección en el ser humano, aunque este hongo se encuentra en el ambiente y es causante de enfermedades en la plantas25. Desde que Ajello et al.1 describen en 1974 la nueva especie Phialophora parasitica como la causante de una infección subcutánea en un paciente con trasplante renal, pocos casos han sido publicados en la literatura. Podemos considerar que los procesos infecciosos de estos hongos dematiáceos son provocados principalmente por la inoculación de un cuerpo extraño, ya que se presentan mayoritariamente como procesos subcutáneos con lenta instauración tras la inoculación. Afectan tanto a personas inmunocompetentes como inmunodeprimidas, aunque tienen una mayor incidencia en estos últimos, tal como se desprende de la literatura5,6. La especie Phaeoacremonium parasiticum presenta mayor incidencia en pacientes sometidos a un trasplante renal, como en uno de nuestros casos y los de otros autores13,21, con valores de incidencia de incluso el 36% en alguna serie4. La especie es también causante de otros cuadros clínicos, como endocarditis16, eumicetoma18, endoftalmitis20 y, últimamente, también onicomicosis30. De igual manera han sido implicadas otras especies del género, como Phaeoacremonium inflatipes26, Phaeoacremonium rubrigenum14, Phaeoacremonium krajdenii17 o Phaeoacremonium aleophilum15. La determinación de las especies del género Phaeoacremonium por las características morfológicas como único criterio nos puede llevar a resultados incorrectos, ya que las diferencias entre especies pueden no ser evidentes para el personal poco experimentado; en nuestro caso, el aislamiento fue enviado al laboratorio de la Unidad de Microbiología de la Facultad de Medicina de Reus para la confirmación de la especie. Algunos autores, gracias a los avances en las técnicas moleculares y a la utilización del marcador molecular del gen de la β-tubulina (solo al alcance de algunos laboratorios), han podido profundizar en la correcta determinación de las especies3,4,9.
Desde el punto de vista terapéutico, el abordaje quirúrgico precoz es la primera modalidad de tratamiento a considerar en este tipo de infecciones subcutáneas. Además, dado el crecimiento infiltrativo de estos hongos en el tejido, es frecuente que queden hifas residuales en los márgenes de resección, dando ocasión a nuevas recidivas. Por este motivo, con frecuencia es necesario realizar varios desbridamientos para la completa curación, como ocurrió en los dos casos presentados.
La segunda modalidad complementaria del tratamiento es la terapia antifúngica. Así, al repasar en Medline la literatura publicada, se aprecia poco consenso en cuanto al tratamiento antifúngico, motivado por la baja incidencia clínica de estos procesos infecciosos causados por el género Phaeoacremonium. Todos los tratamientos descritos presentaron diferentes patrones de actividad frente a este grupo de hongos dematiáceos10,22,23.
Asimismo, el patrón de sensibilidad in vitro de Phaeoacremonium parasiticum que obtuvimos en estos dos casos fue comparable al de otros estudios11,12,18: destacaba la mayor actividad de los nuevos triazoles (voriconazol y posaconazol)23,24, a pesar de no estar consensuados los puntos de corte de sensibilidad clínicos para estos hongos filamentosos; la actividad de estos triazoles ha resultado excelente en algunas series de casos publicados27,28. Las ventajas de estos nuevos triazoles, además de su gran espectro antifúngico, son que pueden administrarse por vía oral, tienen una excelente farmacocinética tanto para las infecciones de piel y partes blandas como para el sistema nervioso central, y permiten tratamientos de larga duración con buena tolerancia, como los que con frecuencia necesitan estos casos. Dada la potencial gravedad de los cuadros producidos por estos hongos en pacientes inmunodeprimidos, se plantea la duda acerca de la conveniencia y eficacia de los tratamientos antifúngicos combinados. En el segundo caso, la combinación de posaconazol con anfotericina B (complejo lipídico) resultó claramente más eficaz que la monoterapia. Aunque esta pauta de tratamiento no está estandarizada, su empleo puede resultar de gran utilidad como alternativa al tratamiento clásico.
En nuestros dos casos el estudio histopatológico de los tejidos ayudó a observar elementos fúngicos, lo que facilitó adelantar el diagnóstico e instaurar el tratamiento antifúngico lo antes posible para evitar un desenlace fatal31. En conclusión, podemos considerar, a tenor de nuestra propia experiencia, que ante un cuadro infeccioso de estas características la clave del tratamiento es la combinación del desbridamiento quirúrgico de las lesiones, tanto al inicio como durante el seguimiento de la infección, junto con la medicación antifúngica.
Queremos expresar nuestro agradecimiento a la Dra. Josepa Gené, de la Unitat de Microbiologia, Facultat de Medicina i Ciències de la Salut, Universitat Rovira i Virgili (Reus), por la confirmación de la identidad de los aislamientos.