La histoplasmosis diseminada (HD) es una infección fúngica oportunista en pacientes con infección por VIH gravemente inmunocomprometidos. El síndrome hemofagocítico (SHF), que puede presentarse en estos pacientes coinfectados cuando la respuesta inmunitaria está significativamente alterada, suele estar asociado a una elevada mortalidad.
ObjetivosDescribir las características epidemiológicas, clínicas, analíticas y microbiológicas, así como evaluar la presencia de SHF, en pacientes con HD-VIH.
MétodosEstudio retrospectivo de serie de casos, consistente en la revisión de registros clínicos de pacientes con diagnóstico de HD e infección VIH, durante los años 2014 y 2015.
ResultadosEl 1,3% (8/597) de los pacientes VIH presentaron HD. El 100% se hallaban en estadio C3 y el 75% (6/8) no se encontraban en terapia antirretroviral combinada (TARVc). Los dos pacientes restantes habían comenzado recientemente el tratamiento con TARVc (posible síndrome de reconstitución inmunológica). El 62,5% (5/8) cumplieron con criterios diagnósticos de SHF. Las manifestaciones clínicas más frecuentes fueron el síndrome linfoproliferativo y consuntivo, el compromiso respiratorio y la citopenia. En el 75% (6/8) de los pacientes se aisló Histoplasma en ganglios, en el 25% (2/8) en muestras hemáticas y en uno adicionalmente en tejido intestinal. La terapia antifúngica fue anfotericina B desoxicolato; no se emplearon adyuvantes. La mortalidad global fue del 50%.
ConclusionesEn nuestra serie la coinfección HD-VIH progresó en la mayoría de los casos a SHF con elevada mortalidad. El cuadro clínico puede asemejarse al de otras enfermedades sistémicas, como la tuberculosis, o presentarse simultáneamente a ellas. Con el fin de obtener un diagnóstico precoz y poder prescribir la terapia específica oportuna es importante poseer un adecuado índice de sospecha en pacientes con síndrome linfoproliferativo y consuntivo asociado a citopenia grave.
Disseminated histoplasmosis (DH) is an opportunistic fungal infection in severely immunocompromised patients with HIV infection. Haemophagocytic syndrome (HFS), which can occur in these co-infected patients when the immune response is significantly altered, is often associated with high mortality.
AimsTo describe the epidemiological, clinical, analytical and microbiological characteristics, along with studying the presence of HFS, in patients with DH-HIV.
MethodsA retrospective study was conducted on a case series using data from the clinical records of patients diagnosed with DH and HIV infection during the years 2014 and 2015.
ResultsDH was diagnosed in 8 (1.3%) of 597 HIV patients. All patients were in stage C3, and 75% (6/8) were not receiving combined antiretroviral therapy (CART). The remaining two patients had recently begun CART (possible immune reconstitution syndrome). Five (62.5%) of the 8 patients met criteria for HFS. The most frequent clinical symptoms were lymphoproliferative and consumptive syndrome, respiratory compromise, and cytopenia. Histoplasma was isolated in lymph nodes of 75% (6/8) of the patients, in blood samples in 25% (2/8), and also in intestinal tissue in one patient. The antifungal therapy was amphotericin B deoxycholate, without adjuvants. The overall mortality was 50%.
ConclusionsIn this case series, DH-HIV co-infection frequently progressed to HFS with high mortality. The clinical picture may resemble that of other systemic opportunistic infections, such as tuberculosis, or can take place simultaneously with other infections. Clinical suspicion is important in patients with severe cytopenia and lymphoproliferative and consumptive syndrome in order to establish an early diagnosis and prescribing a timely specific therapy.
La histoplasmosis diseminada (HD) es una entidad fúngica que puede ser oportunista en pacientes con infección por el virus de la inmunodeficiencia humana (VIH) gravemente inmunocomprometidos. Histoplasma presenta una amplia distribución geográfica que incluye América (excepto Chile), África, Asia y Australia; suele encontrarse en regiones geográficas tropicales y subtropicales, con condiciones de humedad, suelo o vegetación que permiten su crecimiento1,20. El registro latinoamericano de esta entidad suele no ajustarse a la prevalencia real20, con la descripción de frecuencias variables de la coinfección HD-VIH, y cifras menores del 10% en países como Panamá, Colombia, Argentina y Brasil5,14,22,26 o mayores del 35% en zonas de Venezuela, Guayana Francesa y Centroamérica1,18,20. La tasa de mortalidad atribuible a esta patología se sitúa entre el 20% y cifras cercanas al 40%, lo que supera a la descrita en la coinfección VIH-tuberculosis1,3,5,8,12,14,17,18,22,26. Asimismo, la mortalidad se ve incrementada por la presencia de otros microorganismos oportunistas, siendo este suceso más frecuente en pacientes con concentraciones bajas de linfocitos T CD412,17,18,20,26.
Las manifestaciones clínicas debidas a la infección por Histoplasma pueden ser diversas según el estado inmunológico del paciente10; en el paciente con VIH existe una desregulación de la respuesta inmune que genera un estado proinflamatorio dependiente de la inmunidad innata, además del agotamiento de las células NK6,10,25. Esta sobreexpresión inmunológica desmedida ante un agente oportunista en un estadio avanzado de la infección por VIH puede comenzar con un cuadro clínico oligosintomático; la progresión inflamatoria sistémica ante la persistencia de un agente oportunista como Histoplasma permitiría la posterior progresión a una disfunción orgánica múltiple que puede evolucionar en hemofagocitosis linfohistiocitaria o síndrome hemofagocítico (SHF)6,24. Esta última entidad, a pesar de ser poco descrita en el contexto de la coinfección HD-VIH, no es infrecuente en los estadios avanzados de esta micosis invasiva16,19,21,23–25, pudiendo presentarse en el contexto de reconstitución inmune tras el inicio de la terapia antirretroviral combinada (TARVc)9,13, o como parte de la evolución natural de la infección VIH en los pacientes en estado de abandono o no adherentes a la TARVc4,8,12,17.
El objetivo de la presente revisión es describir las características sociodemográficas, clínicas, analíticas, patológicas y microbiológicas de pacientes con coinfección HD-VIH en un hospital público peruano entre enero de 2014 y diciembre de 2015.
MetodologíaSe estudió de manera retrospectiva una serie de casos correspondiente a pacientes internados en el Hospital Nacional Dos de Mayo en Lima, Perú, con diagnóstico de histoplasmosis e infección VIH durante el período que iba de enero de 2014 a diciembre de 2015. Se revisaron los registros clínicos y analíticos de los pacientes incluidos. Todos los cultivos reportados se realizaron por métodos convencionales de aislamiento en agar Sabouraud, y no se había utilizado el método de lisis-centrifugación ni métodos automatizados en muestras sanguíneas. Para el diagnóstico del SHF se tuvieron en cuenta los criterios de Henter et al.15 publicados en la guía HLH 2004. El diagnóstico del síndrome implica la inclusión en al menos cinco de los ocho criterios siguientes: (1) fiebre; (2) esplenomegalia; (3) citopenia (al menos dos series de las siguientes: hemoglobina 9g/dl; 1.000neutrófilos/μl; 100.000plaquetas/mm3); (4) triglicéridos 265mg/dl o fibrinógeno 150mg/dl; (5) hemofagocitosis en médula ósea, bazo o ganglios, sin evidencia de malignidad; (6) actividad de células NK baja o ausente; (7) ferritina 500μg/l; (8) CD25 soluble 2.400U/ml. Otras anormalidades consistentes con el diagnóstico son los síntomas meníngeos, las adenopatías, la ictericia, el edema, presencia de rash, enzimas hepáticas alteradas, hipoproteinemia, hiponatremia, VLDL elevado o HDL disminuido.
ResultadosDe 597 pacientes con infección VIH admitidos en el período de estudio, ocho pacientes (1,3%) presentaron diagnóstico de HD. Se trataba de adultos jóvenes con una mediana de edad de 33 años (rango intercuartil de 5,25 años), predominantemente varones (5/8). La mayoría de pacientes (7/8) procedían o habían viajado a zonas endémicas de histoplasmosis, el 62,5% (5/8) presentaban antecedente de tuberculosis y la mayoría presentaban otros antecedentes de infecciones oportunistas (ver tabla 1).
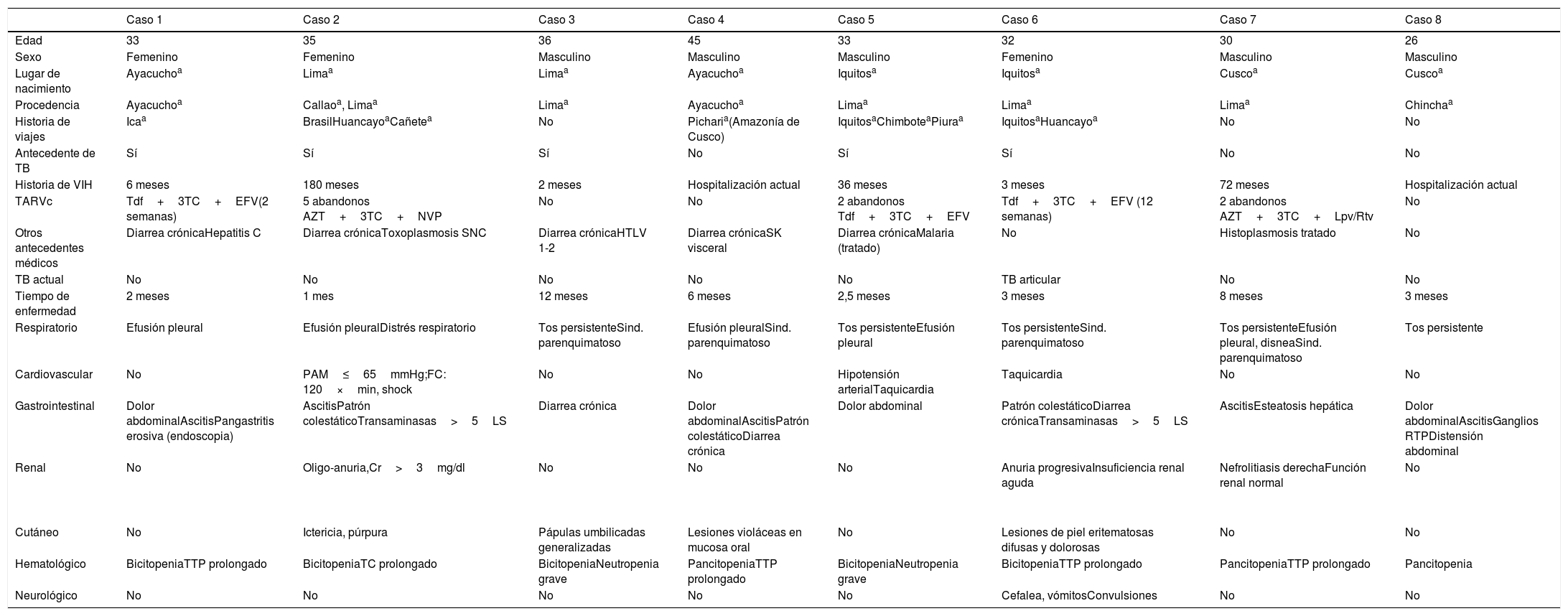
Características clínicas y epidemiológicas de los pacientes con HD-VIH que desarrollaron SHF
| Caso 1 | Caso 2 | Caso 3 | Caso 4 | Caso 5 | Caso 6 | Caso 7 | Caso 8 | |
|---|---|---|---|---|---|---|---|---|
| Edad | 33 | 35 | 36 | 45 | 33 | 32 | 30 | 26 |
| Sexo | Femenino | Femenino | Masculino | Masculino | Masculino | Femenino | Masculino | Masculino |
| Lugar de nacimiento | Ayacuchoa | Limaa | Limaa | Ayacuchoa | Iquitosa | Iquitosa | Cuscoa | Cuscoa |
| Procedencia | Ayacuchoa | Callaoa, Limaa | Limaa | Ayacuchoa | Limaa | Limaa | Limaa | Chinchaa |
| Historia de viajes | Icaa | BrasilHuancayoaCañetea | No | Picharia(Amazonía de Cusco) | IquitosaChimboteaPiuraa | IquitosaHuancayoa | No | No |
| Antecedente de TB | Sí | Sí | Sí | No | Sí | Sí | No | No |
| Historia de VIH | 6 meses | 180 meses | 2 meses | Hospitalización actual | 36 meses | 3 meses | 72 meses | Hospitalización actual |
| TARVc | Tdf+3TC+EFV(2 semanas) | 5 abandonos AZT+3TC+NVP | No | No | 2 abandonos Tdf+3TC+EFV | Tdf+3TC+EFV (12 semanas) | 2 abandonos AZT+3TC+Lpv/Rtv | No |
| Otros antecedentes médicos | Diarrea crónicaHepatitis C | Diarrea crónicaToxoplasmosis SNC | Diarrea crónicaHTLV 1-2 | Diarrea crónicaSK visceral | Diarrea crónicaMalaria (tratado) | No | Histoplasmosis tratado | No |
| TB actual | No | No | No | No | No | TB articular | No | No |
| Tiempo de enfermedad | 2 meses | 1 mes | 12 meses | 6 meses | 2,5 meses | 3 meses | 8 meses | 3 meses |
| Respiratorio | Efusión pleural | Efusión pleuralDistrés respiratorio | Tos persistenteSind. parenquimatoso | Efusión pleuralSind. parenquimatoso | Tos persistenteEfusión pleural | Tos persistenteSind. parenquimatoso | Tos persistenteEfusión pleural, disneaSind. parenquimatoso | Tos persistente |
| Cardiovascular | No | PAM≤65mmHg;FC: 120×min, shock | No | No | Hipotensión arterialTaquicardia | Taquicardia | No | No |
| Gastrointestinal | Dolor abdominalAscitisPangastritis erosiva (endoscopia) | AscitisPatrón colestáticoTransaminasas>5LS | Diarrea crónica | Dolor abdominalAscitisPatrón colestáticoDiarrea crónica | Dolor abdominal | Patrón colestáticoDiarrea crónicaTransaminasas>5LS | AscitisEsteatosis hepática | Dolor abdominalAscitisGanglios RTPDistensión abdominal |
| Renal | No | Oligo-anuria,Cr>3mg/dl | No | No | No | Anuria progresivaInsuficiencia renal aguda | Nefrolitiasis derechaFunción renal normal | No |
| Cutáneo | No | Ictericia, púrpura | Pápulas umbilicadas generalizadas | Lesiones violáceas en mucosa oral | No | Lesiones de piel eritematosas difusas y dolorosas | No | No |
| Hematológico | BicitopeniaTTP prolongado | BicitopeniaTC prolongado | BicitopeniaNeutropenia grave | PancitopeniaTTP prolongado | BicitopeniaNeutropenia grave | BicitopeniaTTP prolongado | PancitopeniaTTP prolongado | Pancitopenia |
| Neurológico | No | No | No | No | No | Cefalea, vómitosConvulsiones | No | No |
3TC: lamivudina; AZT: zidovudina; Cr: creatinina; EFV: efavirenz; FC: frecuencia cardiaca; HD: histoplasmosis diseminada; HTLV 1-2: virus linfotrópico de células T humanas; Lpv/Rtv: lopinavir/ritonavir; LS: límite superior; NVP: nevirapina; PAM: presión arterial media; RTP: retroperitoneal; SHF: síndrome hemofagocítico; SK: sarcoma de Kaposi; TARVc: terapia antirretroviral combinada; TB: tuberculosis; TC: tiempo de coagulación; Tdf: tenofovir; TTP: tiempo parcial de tromboplastina; VIH: virus de la inmunodeficiencia humana.
La totalidad de los pacientes tenían historia previa de abandono de la TARVc o nunca habían iniciado la misma. De igual manera todos los casos se hallaban en el estadio C3 (6 casos ≤100cél/μl). Dos pacientes habían comenzado la TARVc 2 semanas y 3 meses, respectivamente, antes del diagnóstico de HD. El 62,5% de los pacientes (5/8) cumplían con criterios de SHF (todos presentaron fiebre y esplenomegalia), dos pacientes presentaron 4 criterios mayores y uno 3 criterios, pero estos tres pacientes presentaron más de un criterio de anormalidad consistente con el diagnóstico de SHF (tabla 2). En todos los casos el cuadro clínico se caracterizó por fiebre elevada (38-41°C), adenopatías, visceromegalia (hepatomegalia o esplenomegalia), pérdida de peso ponderal, además de citopenia grave (anemia, leucopenia, trombocitopenia). En todos los pacientes hubo algún tipo de compromiso respiratorio (tos persistente en cinco pacientes, y compromiso parenquimatoso o pleural en siete pacientes). Tres pacientes sufrieron una alteración hemodinámica con progresión hacia fallo orgánico y muerte.
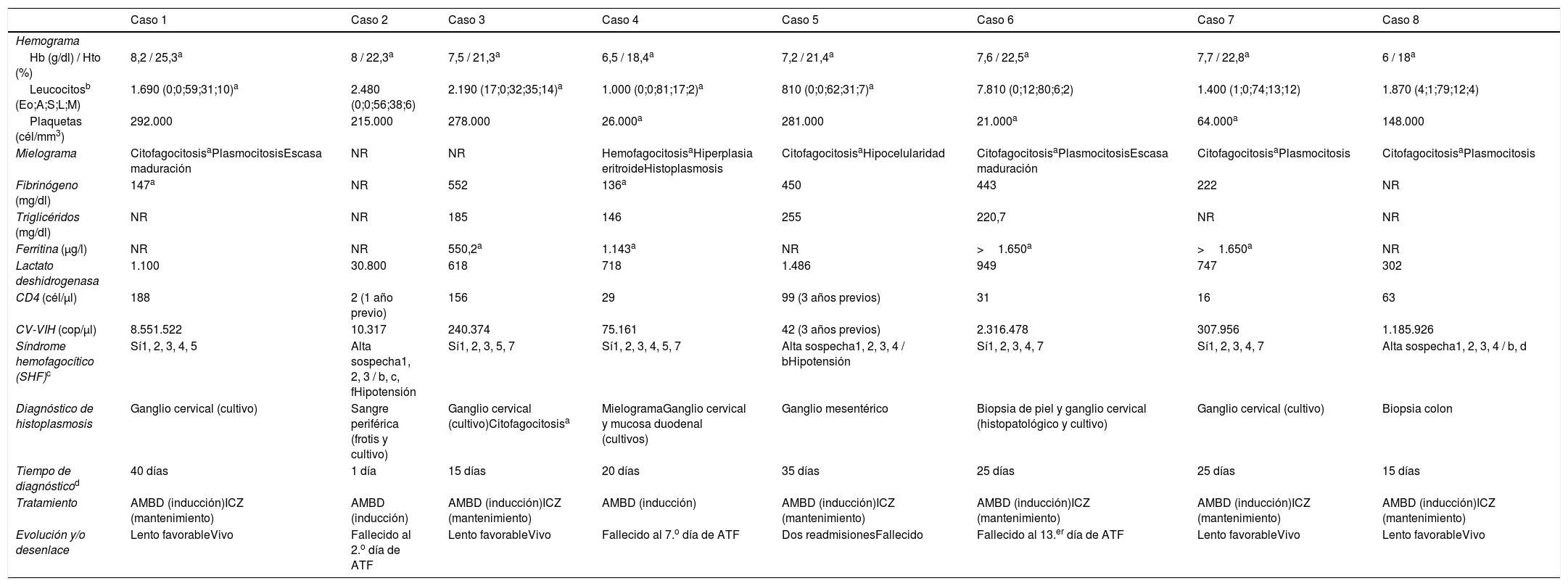
Parámetros bioquímicos y diagnósticos, y evolución de los pacientes con HD-VIH que desarrollaron SHF
| Caso 1 | Caso 2 | Caso 3 | Caso 4 | Caso 5 | Caso 6 | Caso 7 | Caso 8 | |
|---|---|---|---|---|---|---|---|---|
| Hemograma | ||||||||
| Hb (g/dl) / Hto (%) | 8,2 / 25,3a | 8 / 22,3a | 7,5 / 21,3a | 6,5 / 18,4a | 7,2 / 21,4a | 7,6 / 22,5a | 7,7 / 22,8a | 6 / 18a |
| Leucocitosb (Eo;A;S;L;M) | 1.690 (0;0;59;31;10)a | 2.480 (0;0;56;38;6) | 2.190 (17;0;32;35;14)a | 1.000 (0;0;81;17;2)a | 810 (0;0;62;31;7)a | 7.810 (0;12;80;6;2) | 1.400 (1;0;74;13;12) | 1.870 (4;1;79;12;4) |
| Plaquetas (cél/mm3) | 292.000 | 215.000 | 278.000 | 26.000a | 281.000 | 21.000a | 64.000a | 148.000 |
| Mielograma | CitofagocitosisaPlasmocitosisEscasa maduración | NR | NR | HemofagocitosisaHiperplasia eritroideHistoplasmosis | CitofagocitosisaHipocelularidad | CitofagocitosisaPlasmocitosisEscasa maduración | CitofagocitosisaPlasmocitosis | CitofagocitosisaPlasmocitosis |
| Fibrinógeno (mg/dl) | 147a | NR | 552 | 136a | 450 | 443 | 222 | NR |
| Triglicéridos (mg/dl) | NR | NR | 185 | 146 | 255 | 220,7 | NR | NR |
| Ferritina (μg/l) | NR | NR | 550,2a | 1.143a | NR | >1.650a | >1.650a | NR |
| Lactato deshidrogenasa | 1.100 | 30.800 | 618 | 718 | 1.486 | 949 | 747 | 302 |
| CD4 (cél/μl) | 188 | 2 (1 año previo) | 156 | 29 | 99 (3 años previos) | 31 | 16 | 63 |
| CV-VIH (cop/μl) | 8.551.522 | 10.317 | 240.374 | 75.161 | 42 (3 años previos) | 2.316.478 | 307.956 | 1.185.926 |
| Síndrome hemofagocítico (SHF)c | Sí1, 2, 3, 4, 5 | Alta sospecha1, 2, 3 / b, c, fHipotensión | Sí1, 2, 3, 5, 7 | Sí1, 2, 3, 4, 5, 7 | Alta sospecha1, 2, 3, 4 / bHipotensión | Sí1, 2, 3, 4, 7 | Sí1, 2, 3, 4, 7 | Alta sospecha1, 2, 3, 4 / b, d |
| Diagnóstico de histoplasmosis | Ganglio cervical (cultivo) | Sangre periférica (frotis y cultivo) | Ganglio cervical (cultivo)Citofagocitosisa | MielogramaGanglio cervical y mucosa duodenal (cultivos) | Ganglio mesentérico | Biopsia de piel y ganglio cervical (histopatológico y cultivo) | Ganglio cervical (cultivo) | Biopsia colon |
| Tiempo de diagnósticod | 40 días | 1 día | 15 días | 20 días | 35 días | 25 días | 25 días | 15 días |
| Tratamiento | AMBD (inducción)ICZ (mantenimiento) | AMBD (inducción) | AMBD (inducción)ICZ (mantenimiento) | AMBD (inducción) | AMBD (inducción)ICZ (mantenimiento) | AMBD (inducción)ICZ (mantenimiento) | AMBD (inducción)ICZ (mantenimiento) | AMBD (inducción)ICZ (mantenimiento) |
| Evolución y/o desenlace | Lento favorableVivo | Fallecido al 2.o día de ATF | Lento favorableVivo | Fallecido al 7.o día de ATF | Dos readmisionesFallecido | Fallecido al 13.er día de ATF | Lento favorableVivo | Lento favorableVivo |
AMBD: anfotericina B desoxicolato; ATF: terapia antifúngica; CV-VIH: carga viral VIH; Hb: hemoglobina; HD: histoplasmosis diseminada; Hto: hematocrito; ICZ: itraconazol; NR: no realizado; SHF: síndrome hemofagocítico; VIH: virus de la inmunodeficiencia humana.
cél./ml (Eo: eosinófilos; A: neutrófilos no segmentados; S: neutrófilos segmentados; L: linfocitos; M: monocitos).
Criterios SHF15: (1) fiebre; (2) esplenomegalia; (3) citopenia; (4) triglicéridos 265mg/dl o fibrinógeno 150mg/dl; (5) hemofagocitosis en médula ósea, bazo o ganglios, sin evidencia de malignidad; (6) baja o ausente actividad de células NK; (7) ferritina 500?g/l; (8) CD25 soluble 2.400U/ml. Otras anormalidades consistentes con el diagnóstico: (a) síntomas meníngeos; (b) adenopatías; (c) ictericia; (d) edema; (e) rash; (f) enzimas hepáticas alteradas; (g) hipoproteinemia, hiponatremia; (h) VLDL elevado o HDL disminuido.
En el 75% (6/8) de los casos se llegó al diagnóstico de la histoplasmosis por cultivo microbiológico; en los dos pacientes restantes las muestras de anatomía patológica llevaron al diagnóstico de la infección. En seis pacientes se identificó Histoplasma a partir de tejido ganglionar (5/6 cultivo, 6/6 histopatología); en dos casos Histoplasma se identificó a partir de muestras hematológicas (sangre periférica y médula ósea), en dos pacientes se identificó en tejido intestinal y en un paciente a través de una biopsia de piel. El tiempo medio entre la admisión del paciente y el diagnóstico de histoplasmosis definitivo fue de 22 días. En todos los casos el tratamiento inicial fue anfotericina B desoxicolato, prescrito inmediatamente después del diagnóstico. En ningún paciente se utilizaron corticoides, inmunoglobulina endovenosa o quimioterapia. La mortalidad global fue del 50% (tres pacientes en las primeras dos semanas de inicio de tratamiento y un paciente pasados los 30 días de su admisión) (ver tablas 1 y 2).
DiscusiónSe presentaron ocho casos de HD durante los años 2014 y 2015, que representan el 1,34% del total de pacientes con VIH admitidos en nuestro hospital durante el período de estudio. Panamá, Colombia, Argentina y Brasil tienen una prevalencia de VIH inferior al 10%5,14,22,26. Sin embargo, la frecuencia de histoplasmosis como oportunista en estadio sida es elevada en Latinoamérica (Venezuela 80%18; Argentina 70%12; Ceará, Brasil 39%4) e inferior al 30% en Alabama, EE.UU.3. La diferencia entre nuestros datos estimados de frecuencia y la prevalencia regional de HD puede ser debida a unas técnicas de cribado y de diagnóstico poco eficaces o a diferencias epidemiológicas de la población estudiada con respecto a otros países del entorno. En este sentido, en nuestra revisión, el abordaje diagnóstico invasivo (biopsias de tejido o aspirado de médula ósea) fue la única alternativa disponible, en detrimento del antígeno urinario para la detección de Histoplasma, aun conociendo su elevada sensibilidad y efectividad para el diagnóstico de HD en pacientes VIH2,7,11. Esta última prueba tiene un acceso limitado y un alto coste en nuestro medio.
Del total de casos, cinco pacientes cumplieron con criterios para SHF, mientras que los restantes presentaron criterios incompletos (por no disponibilidad o no realización de exámenes: triglicéridos, fibrinógeno, ferritina, aspirado de médula), pero la sospecha diagnóstica era alta según los criterios adicionales para SHF15. Los casos y series que describen la presencia secundaria de SHF en pacientes VIH (con características similares a las encontradas en nuestros pacientes) arrojan una limitada evidencia sobre la asociación SHF-VIH. En la mayoría de los casos se trata de adultos jóvenes con una concentración de linfocitos T CD4 inferior a 100cél/μl, viremias elevadas e historia de abandono o no inicio del TARVc6,16,19,21,23–25. Nuestra serie resalta el inicio reciente de la TARVc en dos pacientes, uno de ellos con manifestación de HD dos semanas después de inicio y un segundo con diagnóstico tres meses posteriores al inicio de TARVc, ambos casos abordados en el contexto de probable reconstitución inmunológica. La reconstitución inmunológica en casos de HD en pacientes VIH puede también manifestarse como SHF9,13. Por otro lado, la predisposición a presentar simultáneamente otra infección oportunista es en promedio del 30%12,17,18,26, siendo las más frecuentes la tuberculosis, la neumocistosis y la paracoccidioidomicosis17,18,26. En nuestra serie describimos una mayor frecuencia de diarrea crónica y algunas patologías infecciosas como tuberculosis, hepatitis C, HTLV y toxoplasmosis, enfermedades con un cuadro clínico similar que dificulta en mayor medida el diagnóstico de HD. Los pacientes descritos cursaron clínicamente con cuadro de síndrome linfoproliferativo (adenomegalias, visceromegalia y síntomas B) y citopenia (pancitopenia y bicitopenia, con predominio de las series roja y blanca). La mayoría de reportes de SHF en pacientes con HD-VIH describen los mismos hallazgos, como elevación excesiva de las concentraciones de ferritina y lactato deshidrogenasa (DHL), pérdida de peso y síntomas sistémicos6,16,19,21,23–25. En pacientes con HD-SHF la presencia de citopenia de la serie roja (anemia grave) suele ser frecuente4,17, además de la presencia de fiebre y visceromegalia en más del 80% de casos5,12,17,18,22,26; también se describen síntomas respiratorios en cerca del 60% de los pacientes22,26. Todos los pacientes de nuestra serie presentaron compromiso respiratorio, abdominal y hematológico.
La mortalidad global en nuestros pacientes con HD-VIH fue del 50%, lo que contrasta con los reportes descritos en la literatura, con cifras que oscilan entre el 20 y el 30% en Sudamérica5,8,12,17,22,26 y 39% en Alabama3. El compromiso hemodinámico (hipotensión o choque) en tres pacientes llevó al fallo multiorgánico y la muerte; en dos de ellos se aisló Histoplasma en hemocultivo o médula ósea. Ningún paciente de la serie recibió corticoides en su tratamiento. En las series de SHF en HD-VIH las mortalidades descritas son mayores del 50%24,25, y los reportes aislados describen una evolución favorable después de únicamente el tratamiento antifúngico19,24; en otros casos existen terapias de apoyo (corticoides o etopósido) para el control de la inmunidad6,21,23. No obstante, en estudios con mayor número de casos se muestran resultados contradictorios, donde la mayor mortalidad se presenta con el uso de esquemas que incluyen corticoides o inmunoglobulina en contraposición al no empleo de los mismos (80% vs. 60% y 60% vs. 38%, respectivamente)24,25. Probablemente la administración de estos adyuvantes tuviera lugar en pacientes con mayor progresión de la enfermedad y compromiso generalizado, lo cual puede sesgar los resultados. Los factores de riesgo asociados con la mortalidad en pacientes coinfectados HD-VIH con o sin SHF se han descrito en relación con el compromiso hemodinámico, renal y el estado inmunovirológico (ausencia de supresión virológica, no TARVc o abandono de la misma), además de la presencia de fungemia y retraso del tratamiento antifúngico3,8,24,26.
El tratamiento antifúngico dependerá de la rapidez con la que se plantee el diagnóstico presuntivo o se alcance el diagnóstico definitivo. Los métodos diagnósticos invasivos, como biopsias o aspirado de médula ósea, poseen buena sensibilidad, con reportes retrospectivos de HD-VIH donde se describen altas tasas de positividad en los cultivos (82-93%)4,5,12,26 e identificación histopatológica en biopsias y aspirados de médula ósea (93%)26. Sin embargo, el crecimiento del hongo en los medios de cultivo convencionales podría llegar a tardar. Este tipo de métodos diagnósticos se realizaron con todos los pacientes de nuestra serie, y el tiempo promedio desde la admisión hospitalaria hasta el diagnóstico definitivo fue de 22 días. No obstante, cuando el diagnóstico por métodos convencionales es rápido hay que sospechar de la existencia de una alta carga fúngica y, por tanto, de un mal pronóstico, como fue el caso del paciente en el que se aisló Histoplasma del torrente sanguíneo, que sugería una rápida diseminación del hongo. La detección del antígeno urinario para Histoplasma en casos de HD debe realizarse al mismo tiempo que el cultivo o la toma de biopsias por tratarse de un método de mayor rapidez, con alta sensibilidad y especificidad2,7,15. La antigenuria para Histoplasma en pacientes con SHF por HD-VIH tiene una alta rentabilidad diagnóstica al margen del síndrome de reconstitución inmunológica, incluso con resultados de cultivos tisulares negativos13,24,25.
En conclusión, se debe tener en consideración el diagnóstico de HD en los pacientes con infección VIH procedentes de áreas endémicas, con concentraciones de linfocitos T CD4 inferiores a 100cél/μl, sin TARVc y que cursen con manifestaciones clínicas de síndrome linfoproliferativo y consuntivo asociado a citopenia. Además, debe descartarse la existencia de SHF. Los cultivos convencionales y la detección de antigenuria son esenciales para un abordaje temprano y manejo oportuno de esta patología, con la consiguiente reducción de la mortalidad asociada. Finalmente, siendo Perú un país altamente endémico de tuberculosis, cuya presentación clínica es similar a la de la histoplasmosis en su variante diseminada, ambas entidades siempre deben ser consideradas dentro del diagnóstico diferencial.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.