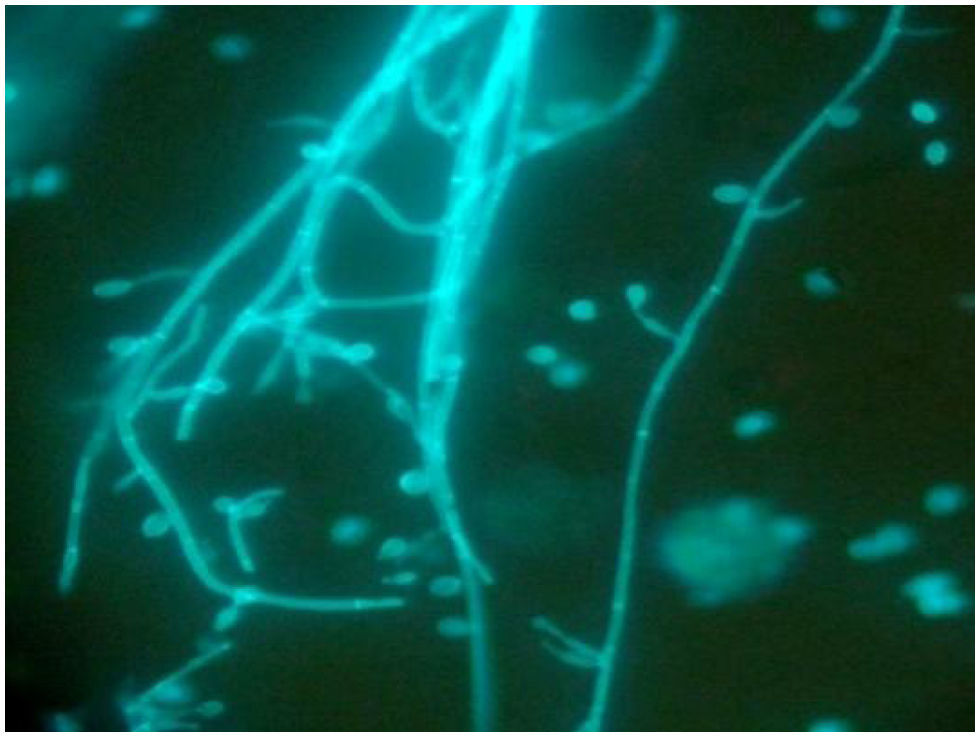
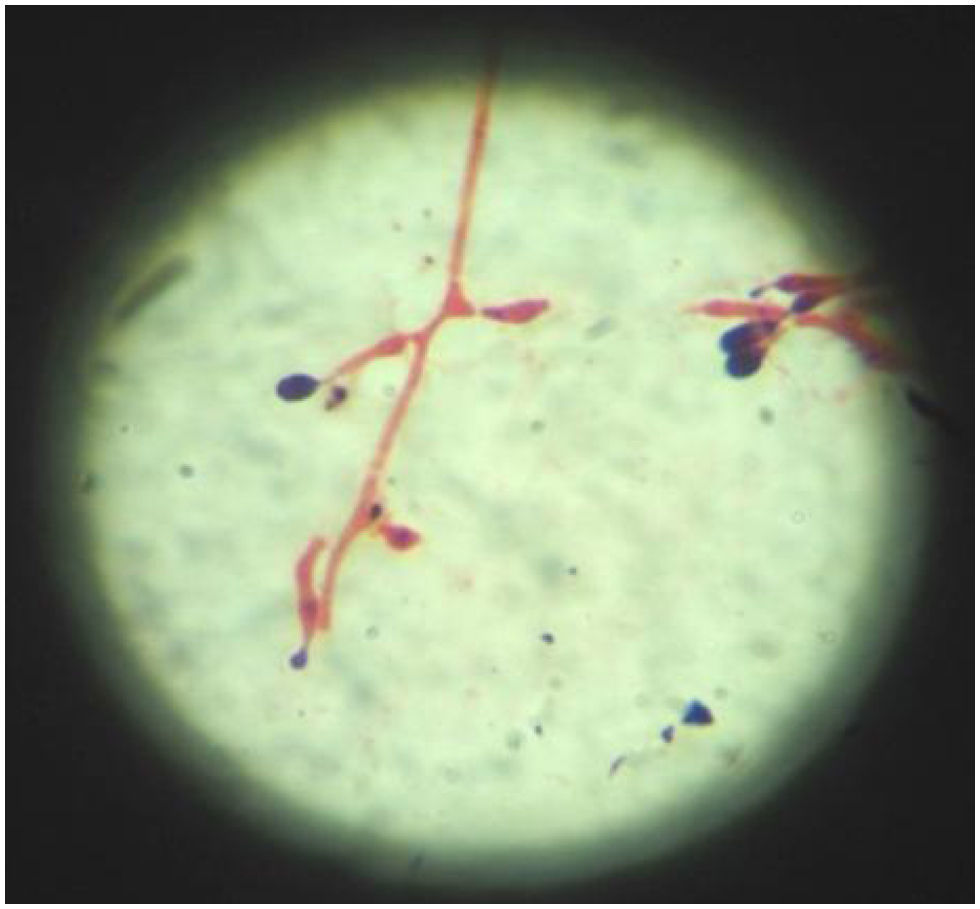
Presentamos el caso de un paciente de 9 años que fue diagnosticado de linfoma de Burkitt en agosto de 2009. El 26 de agosto inició un tratamiento quimioterápico con ciclofosfamida (250mg/12h IV), vincristina (2mg IV) y metotrexato (3.000mg). En septiembre de 2009 fue intervenido tras presentar un cuadro pseudoobstructivo de varias semanas de evolución. También se observaron lesiones equimóticas aisladas en la piel. En la analítica general destacaban: hemoglobina 4,07×106/μl, leucocitosis 16,3×103/μl (neutrófilos 80,2%, linfocitos 12,4%, monocitos 5,6%, eosinófilos 1,1% y basófilos 0,7%), plaquetas 564×103/μl y proteína C reactiva 146,34mg/l. Se decidió intervenir al paciente de dicha masa abdominal por laparotomía exploratoria, tras lo cual se inició tratamiento intravenoso con meropenem (1.150mg/8h), teicoplanina (280mg/24h), metronidazol (220mg/24h) y anfotericina B (85mg/24h). Tras la intervención fue trasladado a la unidad de cuidados intensivos, donde al ingreso presentó progresiva distensión abdominal, con importante débito por ileostomía, regular estado general con FC: 140lpm, TA: 107/58mmHg; elevada PCR (176mg/l) y Ta 38,7°C. El estudio histopatológico de la pieza de intestino delgado enviado reveló intensa necrosis isquémica transmural, con trombos de fibrina en vasos de pequeño y mediano calibre de todas las capas del intestino con presencia de acúmulos de hifas fúngicas septadas y tabicadas que se ramificaban en ángulo agudo y que infiltraban los vasos y los trombos. Coincidiendo con los picos febriles iniciales se procedió a la extracción de sangre, que fue inoculada en dos tandas de frascos de hemocultivos aerobios (BactAlert, bioMérieux-España, S.A.). Tras 14–16h de incubación los hemocultivos resultaron positivos. La observación de la tinción de calcoflúor (fig. 1) y de la tinción de Gram (fig. 2) de los hemocultivos positivos, evidenció la presencia de hifas largas, septadas que se caracterizaban por la presencia de células conidiógenas con bases hinchadas y conidios ovalados. Posteriormente, se procedió al subcultivo en agar sangre, agar chocolate, agar glucosado Sabouraud y agar glucosado Sabouraud-cloranfenicol a 37 °C, con una atmósfera enriquecida en el 5% con CO2. Tras 24h de incubación se observaron unas colonias de coloración negruzca, extensas, lisas y de aspecto algodonoso. El microorganismo fue identificado en base a características macro y micromorfológicas como Scedosporium prolificans. El paciente continuó con pancitopenia de la que nunca logró recuperarse. Desarrolló shock séptico y a pesar de iniciarse tratamiento con drogas vasoactivas y ventilación mecánica finalmente falleció.
En los últimos años hemos asistido a un aumento en la frecuencia de la infección fúngica invasora (IFI) que se ha convertido en un importante problema a la hora del manejo de enfermos inmunodeficientes, especialmente en los pacientes hematológicos que reciben quimioterapia, durante la fase de trasplante de progenitores hemopoyéticos. Tradicionalmente las IFI estaban fundamentalmente causadas por Candida albicans, pero en la actualidad se observa un aumento de la frecuencia de IFI por Aspergillus spp., principalmente, y por otros hongos filamentosos como Fusarium spp., Scedosporium spp. y zigomicetos, hongos levaduriformes como Trichosporon spp., Blastoschizomyces capitatus y Rhodotorula spp., así como hongos dematiáceos2. Dicha frecuencia podría estar relacionada entre otros, con la utilización profiláctica generalizada de fluconazol en estos pacientes. S. prolificans fue descrito en 1984 por Malloch y Salkin como patógeno humano y fue denominado Scedosporium inflatum6. Los géneros Scedosporium y Pseudallescheria han sido reclasificados en los últimos años, gracias a la utilización de nuevas técnicas de taxonomía molecular basadas en la secuenciación de ácidos nucleicos9. Actualmente, se han descrito varias especies patógenas dentro del género Scedosporium, como Pseudallescheria boydii, Pseudallescheria allipsoidea, S. apiospermum, S. aurantiacum, S. dehoogi y S. prolificans.
S. prolificans es un hongo filamentoso que afecta mayoritariamente mayoritariamente a enfermos inmunodeficientes3,5,7., la neutropenia secundaria a quimioterapia se ha descrito como el mayor factor de riesgo asociado a IFI, junto con inmunodeficiencias de diverso tipo, tratamientos antibióticos de amplio espectro, el uso de catéter venoso central (CVC) durante largos períodos de tiempo, la administración de nutrición parenteral, la desnutrición y la alteración de las barreras anatómicas (piel y mucosas)1. A estos factores de riesgo endógeno habría que añadir como factor exógeno la existencia de obras en los hospitales que pueden dar lugar a infecciones nosocomiales en esta población de riesgo4.
S. prolificans es un patógeno multirresistente. La anfotericina B, 5-fluorocitosina y algunos azoles tienen una baja actividad antifúngica in vitro frente a este microorganismo. Debido a su resistencia in vitro e in vivo a prácticamente todos los antifúngicos disponibles, se carece actualmente de un tratamiento eficaz, y la mayoría de las infecciones diseminadas tienen un desenlace fatal8.