En 1984 se crearon los Grupos de Trabajo en Micología de Venezuela (GTMV), proporcionando un abordaje novedoso al estudio de las micosis, en especial las micosis endémicas.
ObjetivosConocer los aportes en el estudio sistemático de las micosis en Venezuela durante 26 años de labor de los GTMV.
MétodosSe realizó revisión de la casuística publicada por los GTMV en el Boletín Informativo Las Micosis en Venezuela desde 1984 hasta 2010.
ResultadosSe obtuvieron 36.968 diagnósticos de micosis superficiales, 1.989 de profundas sistémicas y 822 de profundas localizadas. La dermatofitosis fue la patología superficial más frecuente, paracoccidioidomicosis e histoplasmosis las profundas sistémicas, y cromoblastomicosis la profunda localizada. Se realizó la distribución geográfica de los casos de micosis profundas, pudiendo delimitar las zonas endémicas.
DiscusiónLas micosis superficiales constituyen un problema de salud pública por su alta morbilidad y pueden ser responsables de epidemias en grupos de riesgo. La paracoccidioidomicosis y la histoplamosis se reportaron con mayor frecuencia, incluso antes de haberse conformado los GTMV. El número de cromoblastomicosis y esporotricosis en Venezuela supera a lo reportado en otros países. Los GTMV han contribuido al conocimiento de la incidencia y prevalencia las micosis en el país, además de su divulgación como problema de salud pública, siendo un aporte invaluable que debe mantenerse en el tiempo, tratando no solo de reportar la casuística anual, sino también detallar aspectos clínico-epidemiológicos que permitan realizar seguimiento de la evolución de estas patologías.
In 1984 the Venezuelan Work Groups in Mycology (VWGM) were created introducing an innovative approach to the study of the mycoses in Venezuela.
AimTo study the occurrence of the mycoses in Venezuela.
MethodsReview the reported cases of mycoses by the newsletter Boletín Informativo Las Micosis en Venezuela (VWGM) from 1984 to 2010.
ResultsThe data collected showed 36,968 reported cases of superficial mycoses, 1,989 of deep systemic cases, and 822 of localized mycoses. Pityriasis dermatophytosis was the most common superficial infection, and paracoccidioidomycosis and histoplasmosis the most frequent deep systemic infection. Chromoblastomycosis was the most frequently diagnosed subcutaneous infection. The data provided showed the distribution by geographical area for each of the fungal infections studied, which may help to establish the endemic areas.
DiscussionSuperficial mycosis is a public health problem due to its high morbidity and is probably responsible for some of the outbreaks in high-risk groups. Paracoccidioidomycosis and histoplasmosis were reported more often, which agrees with earlier reports prior to the formation of the VWGM. Cases of sporotrichosis and chromoblastomycosis in Venezuela can be considered unique due to the high number of cases. This study highlights the contribution of the VWGM to the behavior of the mycoses in Venezuela, its incidence, prevalence, and the recognition of these infections as a problem of public health importance. The VWGM should keep working in this endeavor, not only reporting new cases, but also unifying the clinical and epidemiological criteria, in order to properly monitor the evolving epidemiological changes reported in these types of infections.
Desde 1984 un pequeño grupo de investigadores organizados bajo la iniciativa de la Dra. María Cecilia Bastardo de Albornoz, asumieron el reto de iniciar el estudio sistemático de las enfermedades fúngicas, creando los Grupos de Trabajo en Micología de Venezuela (GTMV). Se conformaron 8 grupos en los estados Bolívar, Carabobo, Falcón, Lara, Monagas, Sucre, Zulia y en Caracas. También se contó con grupos de profesionales de los estados andinos Trujillo, Mérida y Táchira, quienes lamentablemente solo aportaron información durante 3 años. Desde su inicio, los GTMV proporcionaron un abordaje novedoso al estudio de las micosis, promoviendo el avance en el diagnóstico, la discusión de las distintas formas de presentación clínica, el estudio taxonómico de los aislados y la experiencia en el tratamiento, con especial énfasis en las micosis endémicas.
Con el esfuerzo de los GTMV se edita el Boletín Informativo Las Micosis en Venezuela, considerado su órgano divulgador. En él se registra la casuística anual de cada Grupo de Trabajo en Micología, se publican casos clínicos, investigaciones desarrolladas e información de interés para quienes laboran en el campo de la Micología. Esto ha permitido dar a conocer la situación epidemiológica de las micosis en Venezuela debido a que no son enfermedades de denuncia obligatoria en el sistema de salud, por lo que la información existente en los registros sanitarios es poca. A pesar del esfuerzo de los GTMV y la existencia de otros grupos de investigación y laboratorios públicos o privados que reportan su estadística de forma aislada, se considera que aún existe un importante subregistro de estas enfermedades2,10,11,18,20,24,25,35,40,42,46,48,49,52,55.
El objetivo de este trabajo fue realizar una recopilación de la casuística aportada por los GTMV en su órgano divulgador, con la finalidad de dar a conocer su aporte en el estudio de las micosis en Venezuela durante los últimos 26 años.
MetodologíaSe realizó una revisión sistemática de la casuística de las micosis aportadas por los GTMV en el Boletín Informativo Las Micosis en Venezuela desde su creación en 1984 hasta el año 2010. Se incluyeron también los datos obtenidos sobre micosis profundas (MP), desde 1970 hasta 1983, por el laboratorio del Instituto Nacional de Dermatología, Sección de Micología (actual Instituto de Biomedicina, Caracas). La mayoría de los casos reportados correspondieron a micosis confirmadas mediante estudio microscópico directo de muestras recolectadas a los pacientes, aislamiento del agente causal y/o detección de anticuerpos específicos mediante la técnica de inmunodifusión doble, en los casos de MP sistémicas. El estudio histopatológico no es de rutina, sin embargo, en algunos casos contribuyó a confirmar el diagnóstico. La información se presenta utilizando estadística descriptiva, describiendo la frecuencia de micosis superficiales y profundas (sistémicas y localizadas), así como sus agentes causales.
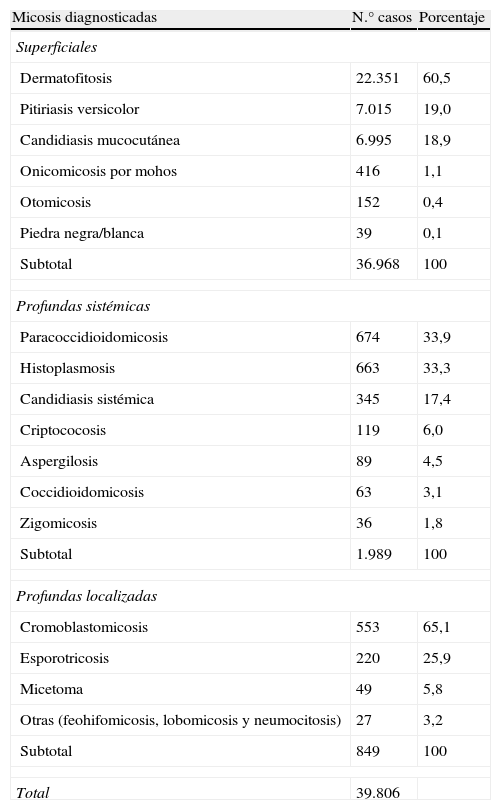
ResultadosDe todos los datos revisados durante el lapso comprendido entre 1984 y 2010, se obtuvieron 36.968 diagnósticos de micosis superficiales (tabla 1). La dermatofitosis fue la patología más frecuente (n=22.351; 60,5%), seguida de pitiriasis versicolor (n=7.015; 19,0%), candidiasis mucocutánea (n=6.995; 18,9%), y con menor frecuencia, onicomicosis por mohos (n=416; 1,1%), otomicosis (n=152; 0,4%) y piedra negra/blanca (n=39; 0,1%). En MP se realizaron 2.838 diagnósticos, de los cuales 1.989 correspondieron a MP sistémica, distribuyéndose en orden de frecuencia de la siguiente forma: paracoccidioidomicosis 33,4% (n=674), histoplasmosis 32,9% (n=663), candidiasis sistémica 17,0% (n=345), criptococosis 5,9% (n=119), aspergilosis 4,4% (n=89), coccidioidomicosis 3,1% (n=63) y zigomicosis 1,8% (n=36). En MP localizada se registraron 849 casos, con una mayor frecuencia de cromoblastomicosis (n=553; 65,1%), seguida de esporotricosis (n=220; 25,9%), micetoma (n=49; 5,8%) y otras (feohifomicosis, lobomicosis y neumocitosis) (n=27; 3,2%).
Micosis diagnosticadas por los Grupos de Trabajo en Micología de Venezuela, 1984-2010
| Micosis diagnosticadas | N.° casos | Porcentaje |
| Superficiales | ||
| Dermatofitosis | 22.351 | 60,5 |
| Pitiriasis versicolor | 7.015 | 19,0 |
| Candidiasis mucocutánea | 6.995 | 18,9 |
| Onicomicosis por mohos | 416 | 1,1 |
| Otomicosis | 152 | 0,4 |
| Piedra negra/blanca | 39 | 0,1 |
| Subtotal | 36.968 | 100 |
| Profundas sistémicas | ||
| Paracoccidioidomicosis | 674 | 33,9 |
| Histoplasmosis | 663 | 33,3 |
| Candidiasis sistémica | 345 | 17,4 |
| Criptococosis | 119 | 6,0 |
| Aspergilosis | 89 | 4,5 |
| Coccidioidomicosis | 63 | 3,1 |
| Zigomicosis | 36 | 1,8 |
| Subtotal | 1.989 | 100 |
| Profundas localizadas | ||
| Cromoblastomicosis | 553 | 65,1 |
| Esporotricosis | 220 | 25,9 |
| Micetoma | 49 | 5,8 |
| Otras (feohifomicosis, lobomicosis y neumocitosis) | 27 | 3,2 |
| Subtotal | 849 | 100 |
| Total | 39.806 | |
Fuente: Boletín Informativo Las Micosis en Venezuela. Años 1984-2010.
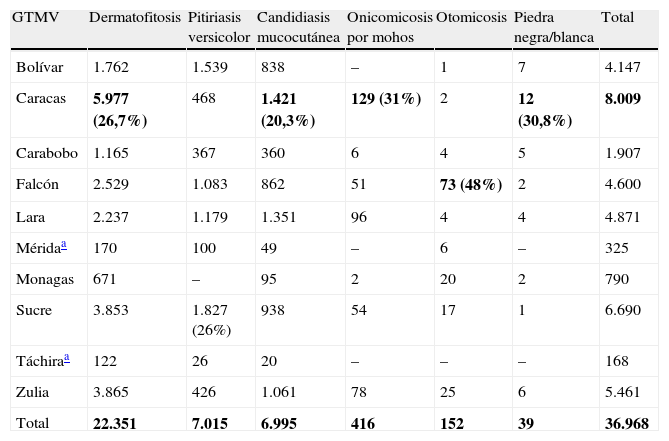
En cuanto al tipo de micosis superficial diagnosticada (tabla 2), el GTMV Caracas registró el mayor número de casos de dermatofitosis (n=5.977; 26,7%), candidiasis mucocutánea (n=1.421; 20,3%), onicomicosis por mohos (n=129; 31%) y piedra negra/blanca (n=12; 30,8%); el GTMV Sucre aportó el mayor número de pacientes con pitiriasis versicolor (n=1.827; 26%), y Falcón, el 48% de las otomicosis (n=73).
Casuística de micosis superficiales reportada por los Grupos de Trabajo en Micología de Venezuela, 1984-2010
| GTMV | Dermatofitosis | Pitiriasis versicolor | Candidiasis mucocutánea | Onicomicosis por mohos | Otomicosis | Piedra negra/blanca | Total |
| Bolívar | 1.762 | 1.539 | 838 | – | 1 | 7 | 4.147 |
| Caracas | 5.977 (26,7%) | 468 | 1.421 (20,3%) | 129 (31%) | 2 | 12 (30,8%) | 8.009 |
| Carabobo | 1.165 | 367 | 360 | 6 | 4 | 5 | 1.907 |
| Falcón | 2.529 | 1.083 | 862 | 51 | 73 (48%) | 2 | 4.600 |
| Lara | 2.237 | 1.179 | 1.351 | 96 | 4 | 4 | 4.871 |
| Méridaa | 170 | 100 | 49 | – | 6 | – | 325 |
| Monagas | 671 | – | 95 | 2 | 20 | 2 | 790 |
| Sucre | 3.853 | 1.827 (26%) | 938 | 54 | 17 | 1 | 6.690 |
| Táchiraa | 122 | 26 | 20 | – | – | – | 168 |
| Zulia | 3.865 | 426 | 1.061 | 78 | 25 | 6 | 5.461 |
| Total | 22.351 | 7.015 | 6.995 | 416 | 152 | 39 | 36.968 |
Los valores en negrita representan los mayores valores de cada rango: enfermedad/grupo de trabajo.
Fuente: Boletín Informativo Las Micosis en Venezuela. Años 1984-2010.
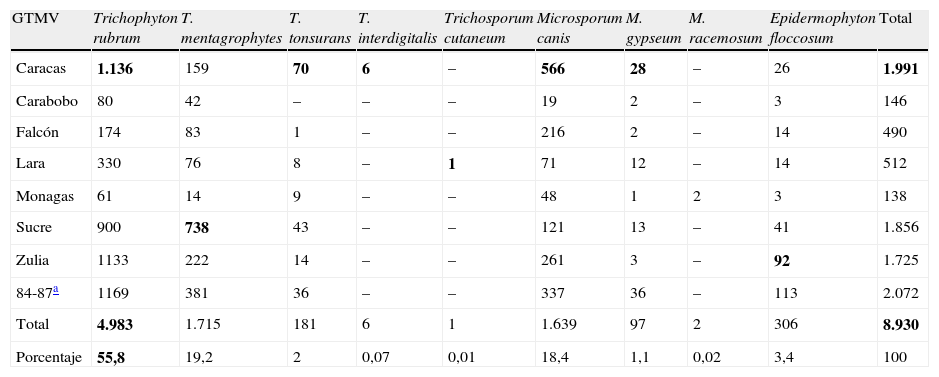
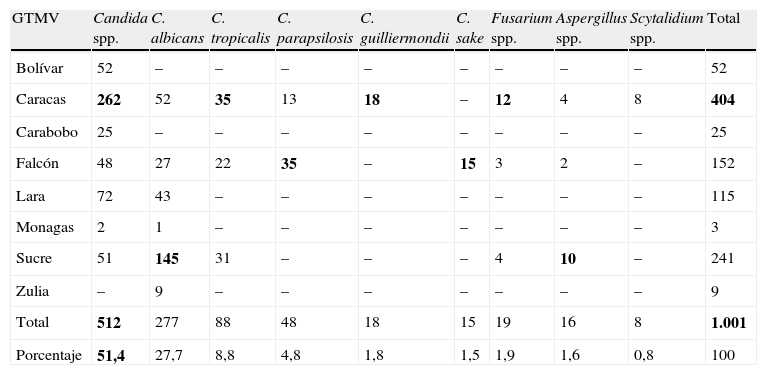
Los agentes causales de micosis superficiales no han sido reportados de forma continua por los GTMV; los datos recopilados acerca del aislamiento e identificación de dermatofitos (tabla 3) corresponden al registro publicado durante 11 años (1984-1987; 1997-1998; 2000-2001; 2004-2010), y para aislados no dermatofitos (tabla 4), al reporte de 3 años (1997-1998; 2007-2009). El agente dermatofito aislado con mayor frecuencia fue Trichophyton rubrum (n=4.983; 55,8%), con excepción del grupo de Falcón, quienes reportaron mayor aislamiento de Microsporum canis (tabla 3). En orden de frecuencia le siguen T. mentagrophytes (n=1.715; 19,2%), principalmente aislado por el GTMV Sucre; M. canis (n=1.639; 18,4%), por el GTMV Caracas; Epidermophyton floccosum (n=306; 3,4%), con la mayoría de los casos en el estado Zulia; y T. tonsurans (n=181; 2%) y M. gypseum (n=97; 1,1%), principalmente reportados por el GTMV Caracas. Las especies T. interdigitalis, M. racemosum y Trichosporum cutaneum fueron las menos frecuentes. Con respecto a las especies aisladas en micosis superficial no dermatofíticas (tabla 4) se evidenció que Candida spp. (n=512; 51,4%) fue la más frecuente, principalmente en Caracas. Entre las especies identificadas de este hongo se reportó un predominio de C. albicans (n=277; 27,7%), especialmente en el estado Sucre; seguida de C. tropicalis (n=88; 8,8%), con mayor número de casos en Caracas; C. parapsilosis (n=48; 4,8%), aislada con mayor frecuencia por el GTMV Falcón; y C. guilliermondii (n=18; 1,8%) y C. sake (n=15; 1,5%), reportadas por los GTMV Caracas y Falcón, respectivamente. Otros hongos aislados con menor frecuencia fueron Fusarium spp. (n=19; 1,9%), Aspergillus spp. (n=16; 1,6%) y Scytalidium spp. (n=8; 0,8%); este último solo ha sido notificado por el GTMV Caracas como agente de micosis superficial no dermatofítica.
Agentes causales de dermatofitosis reportados por los Grupos de Trabajo en Micología de Venezuela, durante 11 años
| GTMV | Trichophyton rubrum | T. mentagrophytes | T. tonsurans | T. interdigitalis | Trichosporum cutaneum | Microsporum canis | M. gypseum | M. racemosum | Epidermophyton floccosum | Total |
| Caracas | 1.136 | 159 | 70 | 6 | – | 566 | 28 | – | 26 | 1.991 |
| Carabobo | 80 | 42 | – | – | – | 19 | 2 | – | 3 | 146 |
| Falcón | 174 | 83 | 1 | – | – | 216 | 2 | – | 14 | 490 |
| Lara | 330 | 76 | 8 | – | 1 | 71 | 12 | – | 14 | 512 |
| Monagas | 61 | 14 | 9 | – | – | 48 | 1 | 2 | 3 | 138 |
| Sucre | 900 | 738 | 43 | – | – | 121 | 13 | – | 41 | 1.856 |
| Zulia | 1133 | 222 | 14 | – | – | 261 | 3 | – | 92 | 1.725 |
| 84-87a | 1169 | 381 | 36 | – | – | 337 | 36 | – | 113 | 2.072 |
| Total | 4.983 | 1.715 | 181 | 6 | 1 | 1.639 | 97 | 2 | 306 | 8.930 |
| Porcentaje | 55,8 | 19,2 | 2 | 0,07 | 0,01 | 18,4 | 1,1 | 0,02 | 3,4 | 100 |
Los valores en negrita representan los mayores valores de cada rango: agente etiológico/grupo de trabajo.
Fuente: Boletín Informativo Las Micosis en Venezuela. Años 1984-2010.
Agentes causales de micosis superficiales no dermatofíticas reportados por los Grupos de Trabajo en Micología de Venezuela, durante 3 años
| GTMV | Candida spp. | C. albicans | C. tropicalis | C. parapsilosis | C. guilliermondii | C. sake | Fusarium spp. | Aspergillus spp. | Scytalidium spp. | Total |
| Bolívar | 52 | – | – | – | – | – | – | – | – | 52 |
| Caracas | 262 | 52 | 35 | 13 | 18 | – | 12 | 4 | 8 | 404 |
| Carabobo | 25 | – | – | – | – | – | – | – | – | 25 |
| Falcón | 48 | 27 | 22 | 35 | – | 15 | 3 | 2 | – | 152 |
| Lara | 72 | 43 | – | – | – | – | – | – | – | 115 |
| Monagas | 2 | 1 | – | – | – | – | – | – | – | 3 |
| Sucre | 51 | 145 | 31 | – | – | – | 4 | 10 | – | 241 |
| Zulia | – | 9 | – | – | – | – | – | – | – | 9 |
| Total | 512 | 277 | 88 | 48 | 18 | 15 | 19 | 16 | 8 | 1.001 |
| Porcentaje | 51,4 | 27,7 | 8,8 | 4,8 | 1,8 | 1,5 | 1,9 | 1,6 | 0,8 | 100 |
Los valores en negrita representan los mayores valores de cada rango: agente etiológico/grupo de trabajo.
–: sin casos reportados.Fuente: Boletín Informativo Las Micosis en Venezuela. Años 1984-2010.
Los datos clínicos y epidemiológicos de los pacientes estudiados por los GTMV solo fueron reportados durante el período 1984-1998, evidenciándose que las características clínico-epidemiológicas de las micosis superficiales fueron similares en los diferentes estados del país. La dermatofitosis se presentó con relativa frecuencia desde los primeros años de vida hasta los 54 años de edad. El grupo etario más afectado fue el de 15-24 años, con predominio del sexo masculino. La forma clínica de presentación más frecuente fue la tiña del cuerpo y de los pies, producida principalmente por T. rubrum y T. mentagrophytes; le siguieron tiña inguinal, de la cabeza y de la uña, con los mismos agentes aislados, excepto en la tiña de la cabeza, donde predominó M. canis. En pitiriasis versicolor el grupo etario más afectado va desde los 10 años hasta los 34, con predominio del sexo masculino. La candidiasis mucocutánea mostró un pico bifásico de frecuencia, uno en los primeros 4 años de edad y el otro a partir de los 15 años hasta los 64, con un predominio importante del sexo femenino. En niños la región corporal más afectada fue la inguinocrural, y en adultos, las uñas y los pies.
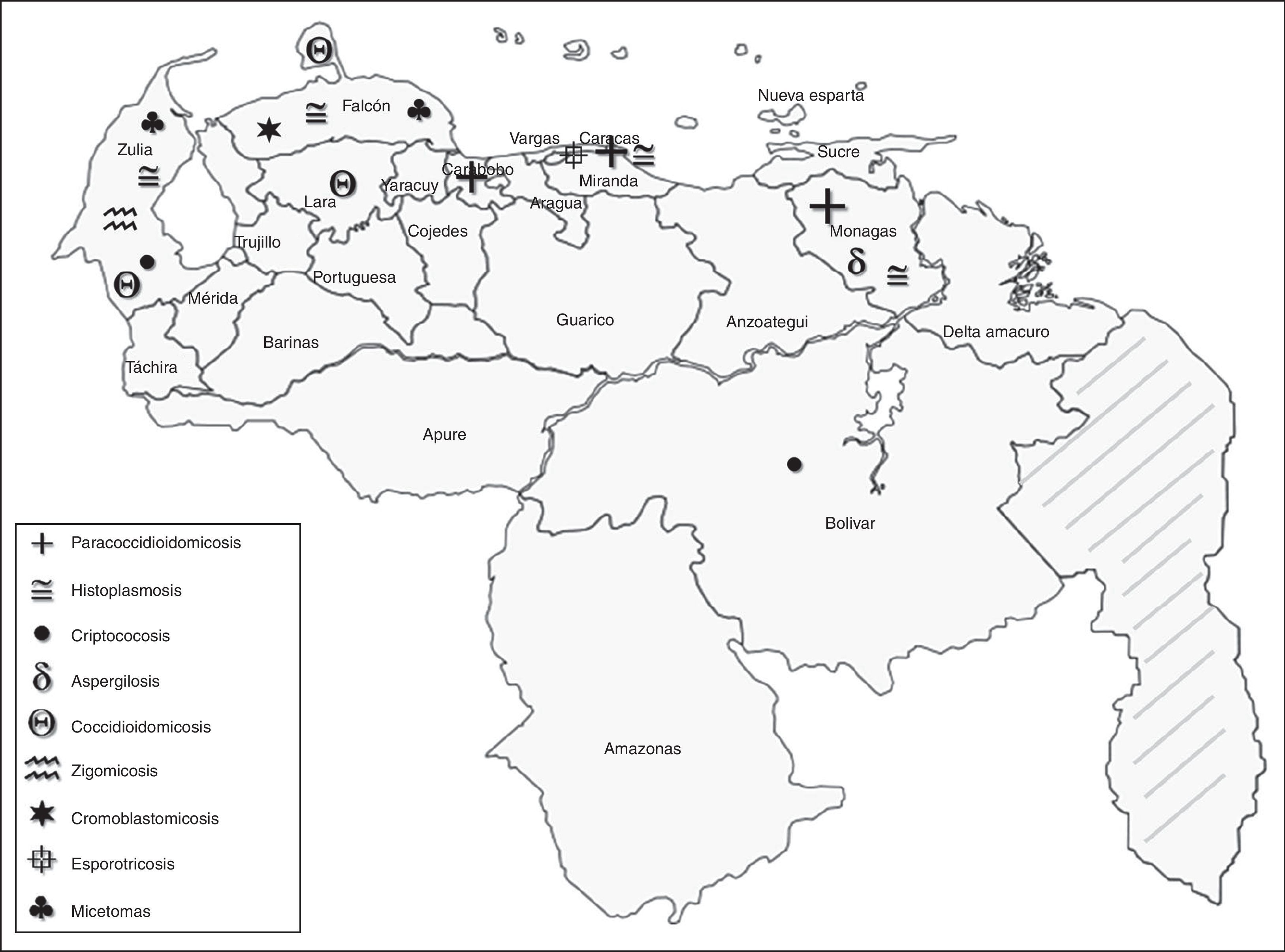
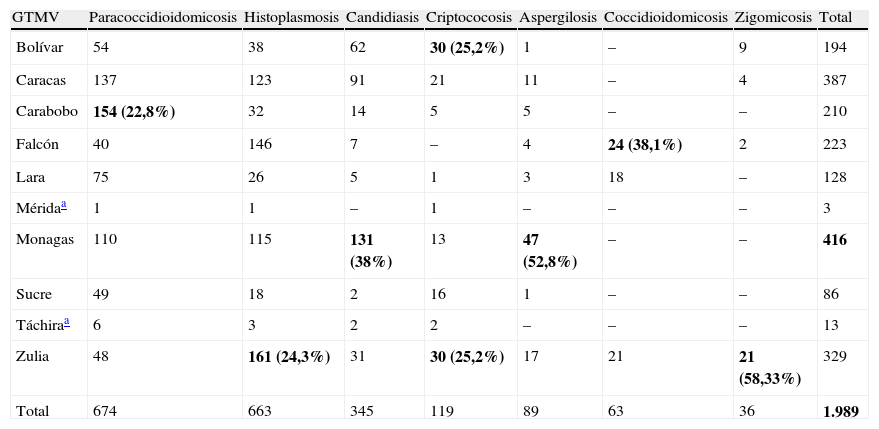
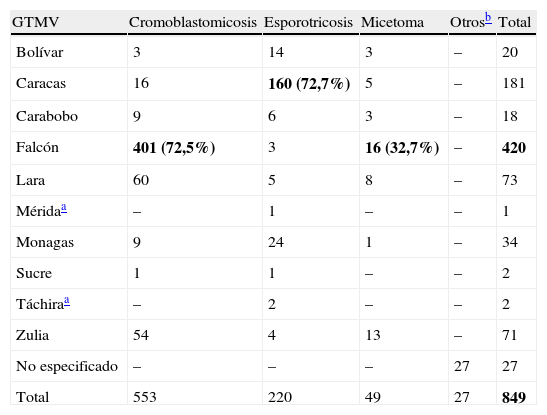
El aporte de cada GTMV en el diagnóstico de MP sistémica y localizada se presenta en las tablas 5 y 6, respectivamente. La mayoría de los casos de paracoccidioidomicosis se registraron en el estado Carabobo (n=154; 22,8%); hitoplasmosis y zigomicosis en el estado Zulia (n=161; 24,3% y n=21; 58,33%, respectivamente); candidiasis sistémica y aspergilosis en Monagas (n=131; 38% y n=47; 52,8%, respectivamente); criptococosis en los estados Zulia y Bolívar (cada uno con 30 casos, representando más del 50%) y coccidioidomicosis en el estado Falcón (n=24; 38,1%). En las MP localizadas (tabla 6) se pudo evidenciar que el GTMV Falcón registró el mayor número de casos de cromoblastomicosis (n=401; 72,5%) y micetoma (n=16; 32,7%), y el GTMV Caracas los de esporotricosis (n=160; 72,7%). Otros casos de MP localizada tales como: lobomicosis, feohifomicosis y neumocitosis han sido mencionados en la casuística de los GTMV, pero sin especificar la procedencia.
Casuística de micosis profundas sistémicas reportada por los Grupos de Trabajo en Micología de Venezuela, 1984-2010
| GTMV | Paracoccidioidomicosis | Histoplasmosis | Candidiasis | Criptococosis | Aspergilosis | Coccidioidomicosis | Zigomicosis | Total |
| Bolívar | 54 | 38 | 62 | 30 (25,2%) | 1 | – | 9 | 194 |
| Caracas | 137 | 123 | 91 | 21 | 11 | – | 4 | 387 |
| Carabobo | 154 (22,8%) | 32 | 14 | 5 | 5 | – | – | 210 |
| Falcón | 40 | 146 | 7 | – | 4 | 24 (38,1%) | 2 | 223 |
| Lara | 75 | 26 | 5 | 1 | 3 | 18 | – | 128 |
| Méridaa | 1 | 1 | – | 1 | – | – | – | 3 |
| Monagas | 110 | 115 | 131 (38%) | 13 | 47 (52,8%) | – | – | 416 |
| Sucre | 49 | 18 | 2 | 16 | 1 | – | – | 86 |
| Táchiraa | 6 | 3 | 2 | 2 | – | – | – | 13 |
| Zulia | 48 | 161 (24,3%) | 31 | 30 (25,2%) | 17 | 21 | 21 (58,33%) | 329 |
| Total | 674 | 663 | 345 | 119 | 89 | 63 | 36 | 1.989 |
Los valores en negrita representan los mayores valores de cada rango: enfermedad/grupo de trabajo.
Fuente: Boletín Informativo Las Micosis en Venezuela. Años 1984-2010.
Casuística de micosis profundas localizada reportada por los Grupos de Trabajo en Micología de Venezuela, 1984–2010
| GTMV | Cromoblastomicosis | Esporotricosis | Micetoma | Otrosb | Total |
| Bolívar | 3 | 14 | 3 | – | 20 |
| Caracas | 16 | 160 (72,7%) | 5 | – | 181 |
| Carabobo | 9 | 6 | 3 | – | 18 |
| Falcón | 401 (72,5%) | 3 | 16 (32,7%) | – | 420 |
| Lara | 60 | 5 | 8 | – | 73 |
| Méridaa | – | 1 | – | – | 1 |
| Monagas | 9 | 24 | 1 | – | 34 |
| Sucre | 1 | 1 | – | – | 2 |
| Táchiraa | – | 2 | – | – | 2 |
| Zulia | 54 | 4 | 13 | – | 71 |
| No especificado | – | – | – | 27 | 27 |
| Total | 553 | 220 | 49 | 27 | 849 |
Los valores en negrita representan los mayores valores de cada rango: enfermedad/grupo de trabajo.
Fuente: Boletín Informativo Las Micosis en Venezuela. Años 1984-2010.
En datos recopilados entre 1984-1998 se observó que la mayoría de los casos de paracoccidioidomicosis ocurrieron en hombres con edades comprendidas entre los 30-55 años y una ocupación que los mantiene en contacto frecuente con la tierra (por ejemplo, agricultores); el 54% de los casos presentaron la forma clínica unifocal, de localización pulmonar. La histoplasmosis fue diagnosticada desde los primeros meses de vida, manteniendo una infección constante, con mayor frecuencia en el grupo etario de 30-39 años, afectando ambos sexos por igual; con excepción de la forma clínica del eritema nodoso, la cual casi siempre se presentó en el sexo femenino. En aproximadamente el 70% de los casos, la forma clínica pulmonar fue la predominante y la enfermedad diseminada se reportó, casi exclusivamente, en lactantes y niños.
Con respecto a las MP localizadas, la información clínico-epidemiológica aportada por los GTMV permitió establecer que la cromoblastomicosis es endémica en el estado Falcón, donde la mayoría de los casos fueron hombres, adultos, mayores de 20 años, y en menor proporción, niños y adolescentes; la región corporal más afectada fueron los miembros superiores. Los casos de esporotricosis ocurrieron en adultos jóvenes, con edades entre 25-45 años, agricultores o en actividades laborales que implicaban la manipulación de plantas; la forma clínica predominante fue la presencia de úlceras con nódulos siguiendo el trayecto linfático. Los casos de micetoma se describieron principalmente en adultos, con edades entre los 30-50 años, generalmente afectando miembros inferiores.
Antes de la creación de los GTMV, el laboratorio del Instituto Nacional de Dermatología, Sección de Micología (actual Instituto de Biomedicina, Caracas), reportó, desde 1970 hasta 1983, 41 casos de candidiasis, 38 de paraccocidioidomicosis, 23 de histoplasmosis, 22 de aspergilosis, 11 de esporotricosis, 6 de criptococosis y 2 de cromoblastomicosis, representando un total de 143 casos de MP que, sumados a esta casuística, elevan a 2.119 los casos de MP sistémicas y a 862 los de MP localizadas.
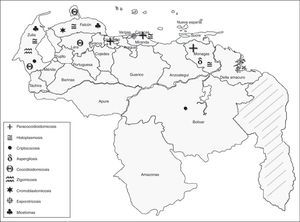
Con los datos aportados por los GTMV durante estos 26 años, se elaboró la distribución geográfica de los casos de MP para así detallar las zonas consideradas endémicas de estas micosis (fig. 1). La paracoccidioidomicosis es más frecuente en los estados Carabobo, Monagas y en Caracas; la histoplasmosis, en los estados Zulia, Monagas y en Caracas; la criptococosis, en los estados Zulia y Bolívar; aspergilosis en Monagas; coccidioidomicosis en los estados Falcón, Zulia y Lara (únicos estados del país donde se ha diagnosticado esta enfermedad hasta la fecha); zigomicosis en el estado Zulia; cromoblastomicosis en Falcón, Lara y Zulia; esporotricosis en Caracas y micetoma en los estados Falcón y Zulia. Es importante señalar que existen estados de Venezuela donde no se han conformado GTM y, por lo tanto, no se tiene información acerca de su situación respecto a estas patologías.
DiscusiónLos GTMV se encuentran localizados en áreas urbanas del país y aunque muchos de ellos se han convertido en centros de referencia regionales, es muy probable que la frecuencia de las infecciones por hongos sea mayor a la reportada en esta revisión. Los criterios para el reporte de la casuística han variado a lo largo de los años debido a que cada GTMV organizaba y editaba uno o 2 números del Boletín informativo Las Micosis en Venezuela al año, por lo que la unificación de las características clínico-epidemiológicas (edad, raza, sexo, enfermedades concomitantes como diabetes o infección por el virus de la inmunodeficiencia humana [VIH], ocupación, lugar anatómico de la afectación) no fue posible sino hasta fechas recientes. Esto conllevó que los datos de estratificación por género, grupo etario, factores predisponentes, características clínicas y epidemiológicas fueran insuficientes para evaluar si han ocurrido cambios, a lo largo del tiempo, en cada uno de estos parámetros, y su repercusión en la evolución de la enfermedad20–25.
Durante estos 26 años, los GTMV diagnosticaron 36.968 casos de micosis superficiales, lo que pudiera ser considerado un problema de salud pública por su alta morbilidad, y aunque no ocasionan la muerte, pueden ser responsables de epidemias en grupos de riesgo y de suspensión temporal de las actividades realizadas por los pacientes. Las dermatofitosis fueron las más frecuentes (60,5%) y las especies de dermatofitos aisladas semeja lo reportado por otros autores en América y Europa4,41,45. El predominio de estos agentes probablemente se deba a la estrecha relación con los hábitos antrofílicos, zoofílicos y geofílicos de los dermatofitos, que les permite mayor extensión de las vías de transmisión, aumentando su incidencia en zonas donde el saneamiento ambiental no es adecuado11,14.
La pitiriasis versicolor continúa en orden de frecuencia, siendo una micosis de diagnóstico fácil y económico que no requiere aislamiento del agente causal para su confirmación. Es considerada más como una patología cosmética que afecta a adolescentes y adultos jóvenes. Su prevalencia está directamente relacionada con las condiciones climáticas de la zona: altas temperaturas y humedad relativa, que favorecen la secreción de lípidos en la piel, creándose un microambiente adecuado para la colonización del agente causal. Además, las terapias con corticosteroides y la infección por VIH son consideradas como factores predisponentes3. La frecuencia observada en esta recopilación debería llamar la atención de los clínicos y micólogos, debido a que en Venezuela las presentaciones farmacológicas tópicas de los antifúngicos son ampliamente distribuidas y de venta sin prescripción facultativa, lo que podría ocasionar en pocos años la aparición de resistencia a estos antifúngicos, problema que debería ser estudiado en profundidad.
Especial atención merecen los casos de candidiasis mucocutánea, que aun cuando su incidencia se ha mantenido relativamente estable a lo largo de los años, representa el 18,9% de los casos reportados. Lamentablemente no se registran los factores predisponentes, la región anatómica afectada ni la incidencia de las especies de Candida aisladas (la mayoría corresponden a Candida spp.). Con el transcurrir de los años la importancia del aislamiento e identificación de este hongo se ha venido entendiendo en los laboratorios diagnósticos, debido a su conocido comportamiento, poco uniforme frente a los antifúngicos, y los actuales reportes de resistencia natural o adquirida de ciertas especies. Esto implica no solo el aislamiento e identificación de las especies responsables de candidiasis mucocutáneas y sistémicas, sino también la necesidad de realizar el antifungigrama (que debería ser tan de rutina como el antibiograma), especialmente en aislados provenientes de pacientes diabéticos y embarazadas, para evitar la prescripción de tratamiento farmacológico desconociéndose el patrón de susceptibilidad del agente12-14,26,32,35.
En los casos de onicomicosis por mohos, otomicosis y piedra negra/blanca es escasa la información acerca de las características clínico-epidemiológicas, desconociéndose en detalle el grado de distrofia ungueal que se presenta en los pacientes con onicomicosis (subungueal, proximal, distal, total, onicolisis y/o parioniquia). Los agentes que pueden estar implicados en estos casos de onicomicosis y otomicosis son mohos como Scytalidium dimidiatum, S. hialinum, Fusarium spp., Scopulariopsis spp., Aspergillus spp., Penicillium spp., Acremonium spp., entre otros3. En la información de 3 años de los agentes causales no dermatofitos, se evidenció el aislamiento de Aspergillus spp., Fusarium spp. y Scytalidium spp., representando el 4,3% de los aislados asociados a micosis superficiales no dermatofíticas, cifra importante si se consideran las dificultades terapéuticas de estos casos. Una vez más se resalta la importancia del cultivo como herramienta útil en el diagnóstico micológico, debido a que el aislamiento e identificación del agente involucrado plantea el reto de la terapia antifúngica que debe indicarse y permite establecer un pronóstico en relación con la respuesta terapéutica que pudiera esperarse.
A lo largo de estos años, los GTMV han contado con la participación de personal altamente capacitado en el diagnóstico de micosis profundas, realizando extraordinarios aportes al conocimiento de los mecanismos de transmisión y expresiones clínicas de las micosis endémicas, permitiendo, además, elaborar un mapa de las zonas endémicas en el país, lo que ha llevado a establecer que la procedencia o desplazamiento a estas áreas representa un dato epidemiológico de gran valor en la orientación diagnóstica de estas patologías2,7,9,34,44,47,50,51,60. Las zonas geográficas donde se encuentran los agentes etiológicos de MP se localizan básicamente en las zonas subtropicales y templadas de la Cordillera de los Andes, Sierra de San Luis, Cordillera de la Costa y Macizo Guayanés, con excepción de los agentes causales de coccidioidomicosis y cromoblastomicosis, cuyo hábitat son las regiones de clima seco y vegetación xerófila22. La identificación de los hongos causantes de estas micosis (sistémicas y localizadas) ha merecido especial atención incluso antes de la conformación de los GTMV. Los avances han sido notables, especialmente en el desarrollo de técnicas diagnósticas de mayor sensibilidad, especificidad y rapidez, además del estudio taxonómico y bioquímico favorecido por las herramientas de la biología molecular33,49,53. El incremento en el número de pacientes con inmunosupresión por causas infecciosas, metabólicas o farmacológicas, ha propiciado el estudio sistemático de las micosis oportunistas, observándose un progresivo aumento en su diagnóstico.
De los casos de MP sistémicas, la histoplasmosis y la paracoccidioidomicosis fueron las que se registraron con mayor frecuencia, incluso antes de haberse conformado los GTMV, manteniendo similitud con los datos aportados por otros estudios realizados en el país11,12,40,49. El mayor número de casos de paracoccidioidomicosis se ubicó en los estados Carabobo y Monagas, la mayoría procedentes de esas mismas áreas; en Caracas, se reportó un importante número de pacientes, pero este GTMV ha notificado que recibe pacientes procedentes de diversas partes del país, por lo que muchos de sus casos no son autóctonos. Durante los primeros años de labor de los GTMV, la forma clínica predominante de paracoccidioidomicosis era la multifocal con lesiones mucocutáneas y pulmonares; posteriormente, a medida que se afinó la búsqueda y el diagnóstico de los pacientes en las áreas endémicas, se logró detectar la enfermedad en fases menos avanzadas, siendo la forma unifocal, de localización pulmonar, la predominante. Los GTMV que reportaron el mayor número de casos de histoplasmosis se ubican en la región norte costera de Venezuela (Zulia, Falcón, Caracas y Monagas); las diferentes formas clínicas de esta micosis hicieron indispensable el estudio inmunológico del paciente para confirmar el diagnóstico (pruebas de hipersensibilidad retardada a antígenos fúngicos y detección de anticuerpos específicos mediante inmunodifusión doble), lo que llevó a la detección de un creciente número de casos.
La candidiasis sistémica es la tercera micosis profunda diagnosticada, contrario a lo publicado en otros países, sobre todo en pacientes con factores predisponentes (diabetes, infección por VIH y/o M. tuberculosis, trasplantes, hospitalización en unidades de cuidados intensivos, terapias con corticosteroides o agentes oncohematológicos)14,19,26. Desde el año 2006, el reporte de candidiasis como micosis oportunista ha venido incrementándose, probablemente porque la clara relación entre esta patología y los factores predisponentes mencionados ha llevado a los clínicos a orientar su diagnóstico, y a los micólogos a identificar la especie. Estos datos han estimulado el estudio de la susceptibilidad a los antifúngicos, llegándose a establecer las especies que poseen resistencia innata y las que tienen resistencia adquirida13,32,33.
La criptococosis es la cuarta MP sistémica en orden de frecuencia, llamando la atención que los estados que más la reportaron fueron Zulia y Bolívar. Lamentablemente no se registraron las características clínico-epidemiológicas de estos casos, sin embargo algunos GTMV hacen referencia a la localización de esta micosis a nivel del sistema nervioso central, especialmente en pacientes con infección por el VIH, similar a lo reportado en otros estudios10,26,33,42,48,52.
En la casuística revisada no se describieron las características clínico-epidemiológicas de los casos descritos de aspergilosis. Diferentes especies de Aspergillus pueden ocasionar diversas patologías, que van desde procesos inmunoalérgicos y formación de granulomas en vías respiratorias, hasta las formas pulmonares invasivas y diseminadas que afectan a pacientes inmunosuprimidos17. El diagnóstico de esta micosis se realiza mediante el aislamiento del hongo a partir de fluidos o secreciones corporales, requiriéndose de personal debidamente entrenado, capaz de diferenciar una contaminación del cultivo de una verdadera infección, siendo básico que exista la sospecha clínica para poder confirmar el diagnóstico empleando la muestra apropiada. Las pruebas serológicas son útiles para el diagnóstico de aspergilosis en individuos sin inmunosupresión severa, pero carecen de valor en pacientes con formas clínicas invasivas y diseminadas, en donde el aislamiento y las técnicas de biología molecular son la mejor opción diagnóstica.
Al contrario a lo que ocurre en Estados Unidos y en México, la frecuencia de coccidioidomicosis en Venezuela no supera el 5%. El mayor número de casos se reportó en el estado Falcón y aproximadamente el 50% de los pacientes procedían de la Península de Paraguaná. Estudios inmunoepidemiológicos realizados en esa zona, mediante la aplicación de intradermorreacción con coccidioidina, revelaron una prevalencia de infección del 26%, que aunado al reporte de casos de coccidioidomicosis, sustenta la existencia de un área endémica. Se considera que esta enfermedad debe ser descartada en todo paciente con síntomas respiratorios y/o lesiones ulcerosas en la piel que vivan en la zona o que informen haberse desplazado hacia ella8,9,29,35,47,64.
La zigomicosis en Venezuela es una de las micosis oportunistas menos frecuentes. Su mayor incidencia se observó en el estado Zulia, donde se reportó más del 50% de los casos, principalmente en pacientes inmunocomprometidos. Los agentes causales de zigomicosis son hongos ubicuos, con bajo potencial de virulencia, que en raras ocasiones producen enfermedad en individuos inmunocompetentes, pero esto cambia radicalmente en pacientes con alteraciones de la respuesta inmunitaria, quienes pueden desarrollar infecciones graves, de presentación insidiosa y fulminante1,16,57,59.
Resaltan con especial interés los casos de MP localizadas: cromoblastomicosis y esporotricosis. En Venezuela, la cromoblastomicosis fue descrita por primera vez por el Dr. J. A. O’Daly en un paciente proveniente del estado Yaracuy, y se postuló que una planta espinosa, Opuntia caribaea (guazábara), era la transmisora del hongo39,50,51,60. Desde la década de los 80, el estudio de la cromoblastomicosis en el país ha permitido: a) determinar que la zona endémica está localizada en la región árida de los estados Falcón, Zulia y Lara; b) establecer que se trata de una enfermedad rural, laboral y familiar, y c) detallar las características de los agentes involucrados e incluso, gracias a los estudios de biología molecular, describir una nueva especie de Cladophialophora, denominada C. yegresii, en honor a los aportes de Nicole Richard-Yegres y Francisco Yegres28,50,51,60. Más del 70% de los casos provenían del estado Falcón, donde la intensa actividad de búsqueda de los pacientes en pueblos y caseríos realizada por el GTMV Falcón ha permitido determinar no solo las características clínicas de la enfermedad, sino también la vía de transmisión y los posibles reservorios de los agentes5,6,9,27,44,50,51,58,60,61,63. Estudios realizados en grupos familiares con cromoblastomicosis han sugerido que se trata de una enfermedad multifactorial, en la cual inciden factores ambientales y de susceptibilidad genética, donde el componente heredable explicaría la endemia localizada en una zona bien delimitada del país, en poblaciones sedentarias con tendencia a la endogamia36,37,60,62.
En esporotricosis ocurre quizás algo muy parecido a la cromoblastomicosis, debido a que el GTMV Caracas ha sido pionero en la búsqueda de casos, reporte de datos clínicos y epidemiológicos, así como también de novedosos aportes para el cultivo y aislamiento de los agentes causales a partir de materia orgánica, proponiendo una metodología de trabajo para el procesamiento de la tierra que ha podido ser adaptada para la búsqueda ambiental de otros agentes de micosis profunda2,34. Más del 70% de los casos fueron reportados por el GTMV Caracas y quizás en esto incidan 2 factores primordiales: la existencia de una zona endémica y la búsqueda sistemática de pacientes sin esperar que acudan a consulta. El comportamiento estadístico de la cromoblastomicosis y la esporotricosis en Venezuela pudiera considerarse único, debido a que en los reportes mundiales revisados no se refiere tal cantidad de casos14,15. Actualmente, los GTMV mantienen la búsqueda activa con atención integral de los pacientes, apoyándose en los valiosos aportes al conocimiento de estas endemias, y en el personal altamente capacitado para su diagnóstico y tratamiento.
El micetoma en Venezuela es una patología de baja frecuencia probablemente debido a la dificultad diagnóstica en etapas tempranas de la enfermedad y a su naturaleza bacteriana y fúngica (actinomicetomas y eumicetomas, respectivamente). Más del 75% de los casos procedían de los estados Lara, Zulia y Falcón, en concordancia con los datos nacionales previamente descritos, en donde se señala que la enfermedad predomina en la región centro occidental del país, aunque se han reportado casos en Miranda y Guayana56. En Venezuela, el principal agente etiológico de actinomicetoma es Actinomadura madurae (40,3%), seguido por Nocardia brasiliensis (28%), mientras que para el eumicetoma es Pyrenochaeta mackinonnii (32%), P. romeroi (24%) y Madurella grisea (20%)30,31,43,54. La clásica formación de fístulas por donde se expulsan los gránulos no siempre es la forma clínica de presentación de la enfermedad; pueden presentarse micetomas muy pequeños (minimicetomas) o formas de granulación exuberante, de aspecto neoplásico, que dificultan el diagnóstico clínico, siendo importante descartar esta entidad patológica en todo paciente con úlceras, especialmente en las localizadas en miembros inferiores, que posean algún antecedente epidemiológico de importancia14,56. El diagnóstico clínico diferencial del micetoma debe hacerse con tuberculosis cutánea, neoplasias, úlceras por ectasia venosa, osteomielitis y otras micosis, tales como botriomicosis, esporotricosis, coccidioidomicosis y cromoblastomicosis, lo que resalta la importancia de la identificación del agente etiológico para poder instaurar la terapia correcta5,43,56.
El aumento creciente en la incidencia de las micosis, los elevados costos en los tratamientos farmacológicos y la aparición de resistencia a los antifúngicos, son solo 3 aspectos relevantes que justifican el estudio de las micosis en Venezuela. El aporte que han dado los GTMV al conocimiento del comportamiento de las micosis, su incidencia, prevalencia y divulgación como problema de salud pública en el país es invaluable y debe mantenerse en el tiempo, tratando no solo de presentar la casuística anual, sino también de unificar los criterios clínico-epidemiológicos que permitan realizar el seguimiento de la evolución epidemiológica en las poblaciones afectadas. Es importante la enseñanza de la Micología a los profesionales del Área de Ciencias de la Salud, tanto a nivel de pregrado como de posgrado, con la finalidad de fomentar el diagnóstico de estas infecciones, preparar personal calificado, incentivar la creación de Unidades de Micología en hospitales a nivel nacional o la formación de nuevos Grupos de Trabajo en Micología en zonas donde estos no existen38.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todos los que han integrado e integran los Grupos de Trabajo en Micología a lo largo de estos años por sus valiosos aportes al estudio de las micosis en Venezuela facilitado sus datos para elaborar la casuística editada en el Boletín informativo Las Micosis en Venezuela. Bolívar: Ytalia Blanco, Ismery Cabello, Julman Cermeño, Julmery Cermeño, Gerardo Godoy, Isabel Hernández de Cuesta, Thamara Mender, Ixora Requena, Yida Orellan. Caracas: María B. de Albornoz, Mireya Mendoza, Elsy Cavallera, Primavera Alvarado, María Elena Rico, Tony Alvarez, Elvia Díaz, Marilyn Puerta, Elio Villanueva. Carabobo: Rosa O. de Briceño, Fernando Gómez, Carolina Sánchez, Emperatriz de Diaz, Yudith E. Angulo. Falcón: Francisco Yegres, Nicole Richard-Yegres, Maigualida Pérez, Rosaura Hernández, Juan Chassaigne, Lairet G. Oberto P., Leila G. de Humbría, Leyla Humbría, Guillermo Fernández, Elsa Medina, Rene Nouel, Auristela Sánchez de Mirt, Omaira de Guanipa, Dilia Martínez Méndez, Yotzabet Saúl, Zaida Bracho. Lara: Carolina Rojas, Inmaculada Castro, Mayra González, Liselotte Aristimuño, Nancy Zambrano, Segundo Barroeta, Josefina Vicari. Monagas: Hilda Gómez, Sara Rodulfo, Henri Hernández A. Sucre: Josefa Díaz, Yenny Mujica, Annabella Smitter de Sanabria, Zuleika Medina, Mary Carmen Gómez, Urquia Zerpa. Zulia: Hernán Vargas-Montiel, Nieves Vargas de Caminos, Maritza Molero, Luzmila Mesa-Lie, Sofía R. de Valero. Tachira: Hugo Murzi, Orlando Ramírez, Luisa Remolina, Rosario Torres, Antonio Torres. Trujillo: José Escorza, Elina Rojas. Barinas: Irma Peña, Lendy Paredes, Rolando Hernández, Juan José Arias, Julio Tabares. Mérida: Isaura Graterol, Nacarid Alfonso.