Existen muchos modelos explicativos, en algunos casos controvertidos, sobre los mecanismos de acción de la acupuntura, aunque hasta ahora el mecanismo fundamental (celular y biocelular) propiamente dicho sólo se comprende de forma insuficiente. Se han descrito como posibles mecanismos de acción los mecanismos neuroquímicos, los efectos en segmento, la regulación del sistema nervioso vegetativo, la estimulación de la autorregulación, los efectos locales, así como las influencias sobre la función cerebral10,20,22. A modo de ejemplo, una de las hipótesis parte de la base de que la acupuntura actúa estimulando el sistema nervioso, puesto que los puntos de acupuntura están localizados mayoritariamente en los puntos de salida de las estructuras neurovasculares a través de las fascias. De esta forma, a la estimulación de las fibras aferentes del nociceptor denominado polimodal (PMR) se le atribuye un papel capital. Por otra parte, también se ha descrito que la puntura desencadena una reacción local inflamatoria y que se da igualmente una estimulación local del sistema endocannabinoide, lo que entre otras, ejerce una acción analgésica7,10,24. Otros estudios se inclinan más por la activación del sistema parasimpático y la participación de estructuras centrales (sistema límbico e hipotála-mo-hipofisario)6,7. Además, otros enfoques —analizados con más detalle en el presente artículo de revisión— parten de la base de que la puntura desencadena una extensión y una reorganización local del tejido conjuntivo. A continuación se describe sucintamente la compleja estructura de la piel, con el fin de adquirir una visión de conjunto. Al insertar la aguja, ésta atraviesa el epitelio poliestratificado de la piel (epidermis) y alcanza la dermis y el tejido conjuntivo subcutáneo. La dermis consta de un estrato papilar y de un estrato reticular (Fig. 1). Ambas capas poseen extensas redes vasculares que se encuentran entretejidas en una red de fibras de tejido conjuntivo (fibras de colágeno y fibras elásticas), sustancia fundamental amorfa, células musculares lisas, fibrocitos y adipocitos21. Debajo de la dermis se encuentra el tejido subcutáneo que establece la unión entre la dermis y las estructuras más profundas (fascias o periostio) y actúa como estrato de desplazamiento y amortiguador de la presión. Además de vasos sanguíneos, tejido adiposo y fibras nerviosas, la piel también posee glándulas sudoríparas, folículos pilosos y corpúsculos táctiles (corpúsculos de Vater-Pacini). Hay que resaltar que en todos los estratos de la piel hay fibrocitos, fibras de colágeno, sustancia fundamental amor-fa, vasos y fibras nerviosas (Fig. 1). Las fibras nerviosas vegetativas acompañan, entre otros, a las grandes arterias y arteriolas, e inervan las glándulas sudoríparas y los folículos pilosos. Huelga decir que existen numerosas fibras nerviosas aferentes (sensibles) y múltiples tipos de receptores21. Los fibrocitos son el tipo principal de células del tejido conjuntivo (en alemán, los fibrocitos, como células más bien inactivas, se diferencian de los fibroblastos activos, mientras que en inglés se habla casi exclusivamente de fibrocitos). Se encuentran en todos los tejidos conjuntivos y sintetizan componentes de la matriz extracelular. Entre estos componentes se encuentran las partes fibrosas, como el colágeno (sobre todo de tipo I, II, III y VII), las fibras elásticas, la fibronectina y las sustancias que carecen de forma (amorfas), entre las que se encuentran los glucosaminoglucanos y los proteoglucanos hidrófilos con fuerte carga negativa4,7,21. Los fibrocitos se pueden dividir, y participan en el mantenimiento y recambio metabólico (turnover) de la matriz liberando determinadas enzimas (las denominadas metaloproteinasas de la matriz). Durante la cicatrización pueden transformarse en miofibroblastos contráctiles21. Los fibrocitos, la matriz extracelular (fibras y sustancia fundamental amorfa), los vasos y las fibras nerviosas contenidas en la misma, así como las células libres del tejido conjuntivo (como los mastocitos, linfocitos, macrófagos y granulocitos) forman el sistema de regulación básica4-6. En la presente revisión se describen los estudios recientes que se ocupan del efecto de la puntura y del estiramiento del tejido conjuntivo12-19. En el centro de mira se encuentran los fibrocitos como células de soporte del tejido conjuntivo. Aparte, se estudió si la resistencia del tejido conjuntivo aumentaba con el número de rotaciones de la aguja, si se observaba algún efecto sobre dicha resistencia al extraer la aguja, y si influía también la resistencia propia del tejido en el lugar de la puntura (punto de acupuntura o zona adyacente).
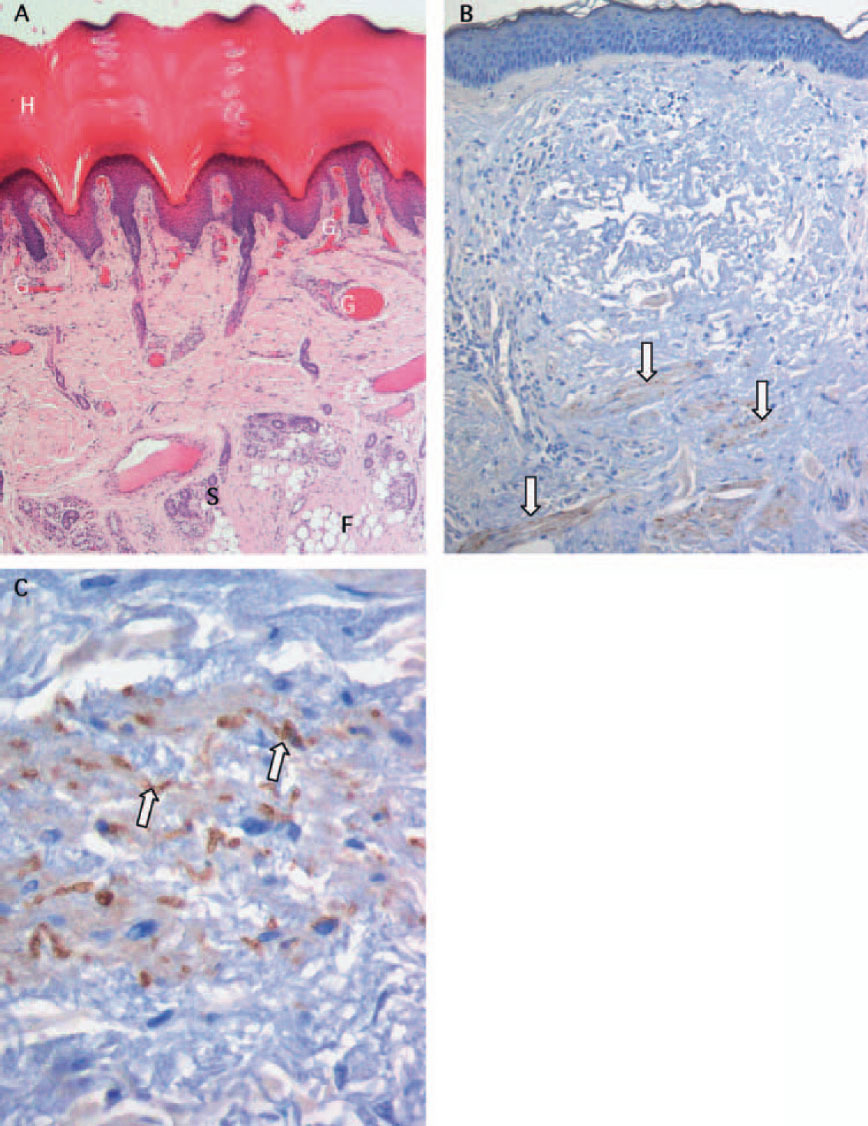
Fig. 1: Cortes de parafina de la piel de 4 µm de espesor: A) preparado con tinción de hematoxilina-eosina. Estrato córneo (H), vasos sanguíneos (G), tejido adiposo (F), glándulas sudoríparas (S) (Departamento de Anatomía y Biología Celular de la Universidad Ernst Moritz Arndt de Greifswald). B) y C) Determinación inmunohistoquímica de fibras nerviosas simpáticas con un anticuerpo contra tirosina hidroxilasa. Las estructuras de color marrón se corresponden con fibras nerviosas simpáticas (flechas). Vista general (B) y detalle aumentado (C) (Departamento de Anatomía y Biología Celular y Departamento de Patología de la Universidad Ernst Moritz Arndt de Greifswald).
MétodoLos efectos de la puntura y las subsiguientes rotaciones se estudiaron utilizando injertos de pared abdominal de ratas. Para ello, se marcó con tinta el lugar de la puntura. Un minuto después de la inserción de la aguja y del estiramiento, se fijó el tejido y se incluyó en parafina. A continuación se obtuvieron cortes del mismo y se realizó una tinción con tricrómico de Masson12. También se estudió en probandos (con un dispositivo asistido por ordenador que llevaba a cabo la puntura y las manipulaciones) en qué medida la fuerza aplicada aumentaba con el número de rotaciones y si la fuerza necesaria para la extracción de la aguja se incrementaba también con el número de rotaciones13,15. Además, se realizaron estudios complementarios en tejido conjuntivo subcutáneo que servía como control o que era estirado tanto in vivo como ex vivo17,19. El estiramiento del tejido se llevó a cabo en un equipo estandarizado, empleando fuerzas de tracción constantes. El stretching o estiramiento in vivo se realizó en ratones anestesiados. Para ello se unieron entre sí las extremidades del lado izquierdo y se separaron las del lado derecho (estiramiento de los músculos abdominales y de la piel del lado derecho). Así, la distancia entre el hombro y la cadera izquierda era tan sólo la mitad de la distancia entre el hombro y la cadera derecha17. Además se utilizaron líneas celulares humanas estables de fibroblastos. Se llevó a cabo un estudio inmunohistoquímico (anticuerpos contra conexina 43, µ-actina y µ-actina), así como la valoración del citoesqueleto de actina (actina filamentosa) con faloidina, microscopio electrónico y microscopio confocal de barrido láser12,16-19 .
ResultadosLos experimentos estandarizados demostraron que la fuerza necesaria para la rotación de la aguja aumentaba con el número de rotaciones de ésta. Por otra parte, también aumentaba consecuentemente la fuerza necesaria para extraer la aguja con el número de rotaciones aplicadas tras la puntura13. Los estudios histológicos realizados en piel de ratas mostraron las fibras de colágeno junto con los fibrocitos rodeando formalmente la aguja12. Estos resultados fueron también corroborados in vivo (en probandos) mediante exámenes ecográficos tras la acupuntura13. Como reacción a la puntura, el tejido conjuntivo se engrosó en la zona visible microscópicamente, aunque su composición cualitativa no varió12. Mediante el microscopio confocal de barrido láser se demostró que los fibrocitos forman una red amplia y ricamente ramificada en el tejido conjuntivo subcutáneo. Las protrusiones celulares pueden alcanzar una longitud de 200 µm y se encuentran parcialmente en contacto, tanto entre ellas como también con los citosomas de las células adyacentes. En los contactos celulares está presente la conexina 43, si bien no se encontraron uniones específicas como las gap junctions o uniones comunicantes, como es típico cuando existen conexinas. Los fibrocitos en cultivo mostraron las mismas propiedades que los fibrocitos del tejido conjuntivo subcutáneo16. Además, los fibroblastos contienen tanto µ-actina como µ-actina. Estos 2 componentes del citoesqueleto se reorganizan tras el estiramiento tisular18. También se demostró (in vivo y ex vivo) que los fibrocitos modificaban significativamente su morfología tras el estiramiento (el 25% de extensión tisular mantenida entre 10 y 120 min). Mientras que los fibrocitos no sometidos a extensión poseen una morfología dendrítica (pequeños citosomas, protrusiones finas y largas), los fibrocitos estirados son más grandes, planos y en forma de hoja, y forman finas prolongaciones que tan sólo se distinguen bien con la técnica láser confocal (lamelipodios)17-19. Asimismo, se ha desarrollado una tinción más intensa para la actina filamentosa (un componente del citoesquele-to)17. Hay que resaltar que las células vuelven a adoptar su morfología original unas horas después del estiramiento17. Los cambios en el citoesqueleto inducen distintos procesos biológicos celulares simultáneos (transducción de señales, expresión génica y adhesión a la matriz).
DiscusiónSe ha demostrado en distintos estudios que tanto la acupuntura como el estiramiento provocan múltiples efectos en los fibrocitos y el tejido conjuntivo circundante. Además, en la zona del canal de la puntura se produce un cambio en la orientación de las fibras de colágeno. Se supone que la interacción mecánica observada (que se refleja también por la resistencia creciente al aumentar el número de rotaciones de la aguja) es consecuencia de las fuerzas iniciales establecidas entre la aguja y el tejido. Entre ellas está la tensión superficial y probablemente las fuerzas eléctricas (p. ej., de atracción electrostática) que actúan sobre la aguja12,13. Esta hipótesis es muy verosímil, puesto que las fibras de colágeno y las fibras elásticas están asociadas a proteoglucanos cargados negativamente4.
De Qi ción sanguínea en el entorno del Mediante la puntura, y sobre todo punto de acupuntura está estrepor la rotación de la aguja, se pro-chamente relacionado con la produce una interacción con las fibras vocación de la sensación “De Qi” al de colágeno de la piel (colágeno de insertar la aguja. A este respecto, la tipo I). La interacción estrecha con rotación de la aguja es irrelevante, el tejido conjuntivo se manifiesta sólo importa la provocación del de forma no menos importante a “De Qi”11. Otro estudio demuestra través de la tensión que ofrece la que el aumento de la circulación piel cuando se extrae la aguja. La sanguínea está asociado con valodisposición alrededor de la aguja res de NO (monóxido de nitrógeno) equivale a la “sujeción” de la mis-más elevados, tanto en el entorno ma, y no ocurre casi nunca por del punto de acupuntura, como en puntura sin rotación, sino tan sólo el plasma sanguíneo. Este efecto tras rotaciones repetidas. Está am-no se ha observado en la “acupunpliamente aceptado que el efecto tura simulada”26. El material de la terapéutico reside en la “sujeción” aguja también desempeña un pa-de la aguja descrita en la acupun-pel importante en la interacción de tura tradicional desde hace más de la misma con el tejido conjuntivo. 2000 años8. El paciente describe el Como demuestran las imágenes de “De Qi” como una sensación dolo-microscopio electrónico de barrido, rosa o de pesadez en el entorno de las agujas de acero poseen una su-la aguja24. Otros estudios demues-perficie muy lisa, mientras que las tran que el aumento de la circula-de oro presentan una superficie bastante irregular. Aparentemente este es el motivo por el cual interactúan más con el tejido conjuntivo que las agujas de acero15.
Los fibrocitos forman una redHay que destacar también que tras la manipulación los fibrocitos no sólo modifican su morfología, sino que establece contactos celulares específicos, tanto in vivo (en una agrupación celular normal) como en cultivos celulares, a través de los cuales se mantienen en contacto con las protrusiones de las células adyacentes. Mediante estos contactos se hallan unidos entre sí también de forma indirecta los cito-esqueletos de las células adyacentes. Esta observación sugiere que los fibrocitos pueden formar “rutas celulares” in vivo o incluso una red que recorre todo el organismo. Se debate si este fenómeno podría constituir la base científica de la existencia de los meridianos16. Curiosamente, en los meridianos la conductividad eléctrica puede ser distinta. Se ha demostrado que la conductividad en el meridiano del corazón es más elevada en comparación con un control, sin embargo, en el meridiano del bazo no se aprecian diferencias. La distinta composición del tejido conjuntivo asociado al meridiano podría explicar este fenómeno1.
Los estímulos mecánicos provocan la transducción de señalesLa manipulación mecánica del tejido conjuntivo por estiramiento o puntura puede desencadenar la activación de distintas vías de señalización. Varios estudios del año 200623 han demostrado que la aplicación de fuerzas mecánicas a las células favorece la fosforilación en tirosina de una proteína (p130 CAS), por la cual se activa una cinasa (Rap1) asociada al citoesque-leto. Por ello, la p130 CAS está considerada como el mecanosensor primario responsable de la activación de cascadas subsiguientes de transducción de señal23. Además, hay que apuntar que la puntura con la aguja produce una pequeña herida, y la contracción del tejido conjuntivo observada tras la puntura es comparable a la situación que se presenta durante la cicatrización. En ella, los fibrocitos modifican su fenotipo y pasan a ser miofibroblastos contráctiles3. Además, las metaloproteinasas producen la destrucción, formación y transformación de la matriz extra-celular. La interacción de las fibras de tejido conjuntivo con los fibrocitos tiene lugar a través de moléculas de adhesión celular. Estas moléculas de adhesión (integrinas) atraviesan la membrana celular conectando así la matriz extracelular (membrana basal) con el citoesqueleto de las células9. La activación de los fibrocitos se refleja, entre otras, en la inducción de cascadas de transducción de señal, la modificación de la expresión génica y la liberación de distintas sustancias que actúan sobre las células presentes en el tejido conjunti-vo12,13,16,18,19. Por lo tanto, el estímulo mecánico se comunica con otras células, con lo que éstas también realizan la remodelación de la matriz extracelular25. Los experimentos in vitro demuestran que especialmente se induce la síntesis y secreción de factores locales de crecimiento, citocinas, sustancias vasoactivas, enzimas destructoras de la matriz y componentes de la matriz19. Esto tiene lugar, entre otras causas, por la activación de las vías de señalización intracelulares mediante las denominadas cinasas reguladas extracelularmente (ERK) y la modificación de la expresión de diferentes protooncogenes (como el c-fos y el c-jun), o por la regulación de genes que codifican componentes de la matriz extracelular, como la tenascina C o el colágeno de tipo XII2,27. Con ello, el fibrocito se halla aparentemente al comienzo de una cascada de procesos diversos inducidos por la inserción de la aguja (Fig. 2).
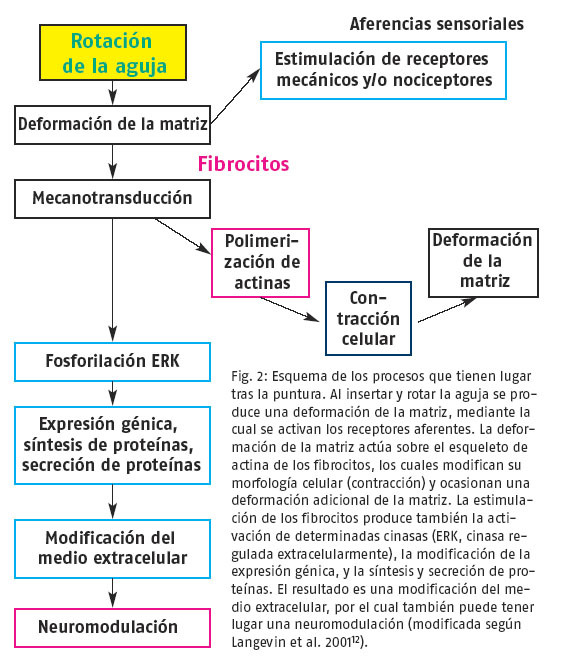
Fig. 2: Esquema de los procesos que tienen lugartras la puntura. Al insertar y rotar la aguja se produce una deformación de la matriz, mediante la cual se activan los receptores aferentes. La deformación de la matriz actúa sobre el esqueleto de actina de los fibrocitos, los cuales modifican su morfología celular (contracción) y ocasionan una deformación adicional de la matriz. La estimulación de los fibrocitos produce también la activación de determinadas cinasas (ERK, cinasa regulada extracelularmente), la modificación de la expresión génica, y la síntesis y secreción de proteínas. El resultado es una modificación del medio extracelular, por el cual también puede tener lugar una neuromodulación (modificada según Langevin et al. 200112).
ConclusionesLos estudios aquí presentados demuestran que la puntura y el estiramiento tisular ejercen efectos diversos sobre las fibras y las células del tejido conjuntivo (Fig. 2). Dichos estudios permiten suponer también que la mecanotransducción podría constituir posiblemente un mecanismo de acción de nivel superior no sólo de la acupuntura, sino también de otros tratamientos como la medicina manual, la osteopatía y la fisioterapia.
Información sobre los autores (requisitos STRICTA)El Prof. Dr. rer. med. habil. Jürgen Giebel es profesor numerario y colaborador científico del Departamento de Anatomía y Biología Celular de la Universidad Ernst Moritz Arndt de Greifswald. Entre sus materias de enseñanza se encuentran la anatomía macroscópica, la histología y la biología celular que imparte a estudiantes de medicina, odontología y biología humana. Sus campos científicos de trabajo son los estudios sobre los procesos de envejecimiento en las túnicas externas de los ojos, los tumores del sistema urogenital en cuanto a sus marcadores de pronóstico, así como los mecanismos de adherencia de los podocitos.
SinopsisLos efectos ampliamente conocidos de la acupuntura, como la modula-ción del sistema nervioso vegetativo, la estimulación del sistema endo-cannabinoide o la activación de la circulación sanguínea parecen basar-se en el fenómeno de orden superior de la mecanotransducción, por elcual las manipulaciones mecánicas producen un cambio transitorio enlas fibras de colágeno yfibrocitos principalmente. En consecuencia, lascascadas de transducción de señales ylas expresiones génicas inducidasen los fibrocitos podrían representar la base fundamental de todos losprocesos subsiguientes.