Con el avance de los métodos microbiológicos, cada vez es más frecuente el aislamiento de patógenos menos típicos en cuadros de infección uretral y rectal, además de los agentes etiológicos clásicos. Uno de ellos está formado por especies de Haemophilus no ducreyi (HND). El objetivo de este trabajo es describir la frecuencia, la sensibilidad antibiótica y las características clínicas de las uretritis y proctitis por HND en varones.
Pacientes y métodosSe realizó un estudio observacional descriptivo y retrospectivo, a partir de los resultados emitidos por el Laboratorio de Microbiología del Hospital Universitario Virgen de las Nieves de Granada, de los aislamientos, entre 2016 y 2019, de HND en episodios infecciosos genitales y rectales de varones adultos.
ResultadosSe aisló HND en 135 (7%) episodios. La especie más frecuente fue H. parainfluenzae (34/45; 75,6%). Los síntomas más frecuentes de las proctitis fueron: tenesmo rectal (31,6%) y adenopatías (10,5%); en aquellos con uretritis, fueron disuria (71,6%), supuración uretral (46,7%) y lesiones en el glande (27%), siendo manifestaciones similares a las infecciones provocadas por los genitopatógenos habituales. Un 43% de los pacientes eran VIH positivos. Las tasas de resistencia a antibióticos de H. parainfluenzae fueron elevadas a levofloxacino, ampicilina, tetraciclina y azitromicina.
ConclusiónLas especies de HND deberían tenerse en cuenta como posibles agentes etiológicos en episodios de infección uretral y rectal en varones, sobre todo en los casos con pruebas de detección negativas para agentes productores habituales de infecciones de transmisión sexual. Su detección microbiológica es fundamental para la instauración de un tratamiento efectivo dirigido.
With the advancement of microbiological methods, the isolation of less typical pathogens in cases of urethral and rectal infection is more frequent, apart from the classic etiological agents. One of them is formed by species of Haemophilus no ducreyi (HND). The objective of this work is to describe frequency, susceptibility to antibiotics, and clinical features of HDN urethritis and proctitis in adult males.
Patients and methodsThis is an observational retrospective descriptive study of the results obtained by the Microbiology laboratory of the Virgen de las Nieves University Hospital on the isolates of HND in genital and rectal samples from males between 2016 and 2019.
ResultsHND was isolated in 135 (7%) of the genital infection episodes diagnosed in men. H. parainfluenzae was the most commonly isolated (34/45; 75.6%). The most frequent symptoms in men with proctitis were rectal tenesmus (31.6%) and lymphadenopathy (10.5%); in those with urethritis, dysuria (71.6%), urethral suppuration (46.7%) and gland lesions (27%), so differentiating it from infections caused by other genitopathogens is difficult. 43% of patients were HIV positive. Antibiotic resistance rates for H. parainfluenzae were high to quinolons, ampicillin, tetracycline and macrolides.
ConclusionHND species should be considered as possible etiologic agents in episodes of urethral and rectal infection in men, especially in cases with negative screening tests for agents that cause sexually transmitted infections (STIs). Its microbiological identification is essential for the establishment of an effective targeted treatment.
Las infecciones del tracto genital constituyen una entidad frecuente en la práctica clínica diaria, y su retraso diagnóstico y terapéutico puede conllevar a consecuencias importantes sobre la fertilidad1. Dentro de las uretritis se distinguen 2 grandes grupos: gonocócicas (producidas por Neisseria gonorrhoeae) y no gonocócicas (producidas por otros agentes, siendo los más frecuentes Chlamydia trachomatis y Mycoplasma genitalium)2. No obstante, hasta en un 30-40% de los casos (dependiendo de las series) no se encuentra el agente etiológico3. Con respecto a las proctitis, los microorganismos más frecuentemente involucrados son N. gonorrhoeae, C. trachomatis y virus herpes simple tipo 2 (VHS-2)4. En los últimos años se han descrito nuevos agentes etiológicos involucrados en las uretritis no gonocócicas, entre ellos las especies mencionadas del género Haemophilus, cuya presencia parece estar aumentando en determinados colectivos de riesgo, como hombres que tienen sexo con hombres (HSH)2. En el caso de las proctitis con aislamiento de Haemophilus la información es más escasa; en una reciente revisión sistemática de la literatura sobre la importancia clínica del Haemophilus no ducreyi5, únicamente el 2,3% de las muestras eran de procedencia rectal. No obstante, es posible que su presencia y significado clínico estén infradiagnosticados a nivel rectal en dichos colectivos de riesgo, siendo fundamental la búsqueda activa en casos con sospecha clínica y cuadro compatible. De forma progresiva, están apareciendo en la literatura cada vez más casos de uretritis asociada a Haemophilus influenzae5, y recientemente se ha descrito su asociación con uretritis no gonocócica, tanto en HSH como con mujeres6. Este género está compuesto por pequeños bacilos gramnegativos anaerobios facultativos, pleomórficos, inmóviles y no esporulados con requerimientos nutricionales exigentes para su cultivo7. H. influenzae es un conocido colonizador del tracto respiratorio superior y el tracto genital8, pudiendo comportarse como patógeno oportunista9. Haemophilus parainfluenzae coloniza predominantemente la orofaringe, pudiendo dar lugar a infecciones por contigüidad, bacteriemias, endocarditis e infecciones genitales10. Otras especies menos conocidas son Haemophilus haemolyticus, la cual rara vez tiene potencial patógeno, Haemophilus pittmaniae y Haemophilus sputorum. Son muy similares a H. influenzae, siendo necesario recurrir al análisis de marcadores genéticos específicos para distinguirlos con precisión11,12.
Resulta de especial interés conocer el impacto real que tiene Haemophilus en estas localizaciones, especialmente porque suelen aislarse cepas resistentes a múltiples antibióticos13. Una vez informada su presencia, rápidamente detectable con espectrometría de masas (MALDI-TOF)14,15, la decisión de tratar debe guiarse por criterios más estrictos, a la espera del antibiograma que puede retrasarse hasta 48h.
El objetivo de nuestro estudio es describir la frecuencia, la sensibilidad antibiótica y las características clínicas de las uretritis y proctitis en varones por Haemophilus no ducreyi (HND)
Pacientes y métodosDiseño del estudioSe estudiaron los episodios clínicos con aislamientos de HND del total de muestras genitales de varones adultos recibidas por el Laboratorio de Microbiología del Hospital Virgen de las Nieves de Granada durante el periodo comprendido entre 2016 y 2019, tras ser sometidas a estudios de genitopatógenos siguiendo el procedimiento normalizado de trabajo de dicho centro asistencial16.
Criterios de inclusión y exclusiónSe incluyeron las muestras de pacientes asistidos en los servicios de urgencias (59/135; 43,7%), atención primaria (16/135; 11,9%) y consulta externa (60/135; 44,4%) de urología y enfermedades infecciosas, que atendieron a la población de Granada capital y los pueblos del área metropolitana de su influencia. Todos fueron episodios diferentes, ocurridos al menos con 6 semanas de diferencia del anterior. Se excluyeron aquellas muestras correspondientes a varones menores de 14 años y mujeres; muestras repetidas o con datos microbiológicos incompletos y aquellas sin información clínica del episodio.
Metodología empleadaEn todas las muestras se investigó, mediante PCR multiplex a tiempo real, la presencia de C. trachomatis, N. gonorrhoeae, Trichomonas vaginalis (BD MAX® CT/GC/TV BD, Franklin Lakes, NJ, EE. UU.) y M. genitalium, Mycoplama hominis y Ureaplasma urealyticum (BD MAX® System, BioGX DNA, 350-011-A-MAX, Ámsterdam, Países Bajos); además, se sembraron en medios de agar sangre (Becton-Dickinson, España), agar chocolate (Becton-Dickinson), agar Martin-Lewis (Becton-Dickinson) para N. gonorrhoeae y CromogenCandida (Bio-Rad, España) para Candida spp. La presencia de M. hominis y U. urealyticum fue indicada si se obtuvo en el estudio un valor de Ct ≤ 30. Para la identificación de los microorganismos que crecieron se usó espectrometría de masas, MALDI-TOF (Brucker Biotyper, Billerica, MA, EE. UU.). Además, se determinó la sensibilidad a los antibióticos (azitromicina, cefixima, cefotaxima, levofloxacino, penicilinas y tetraciclina) de HND mediante prueba de gradiente (MIC Test Strip, Liofilchem®, Italia). El desarrollo de las pruebas y la interpretación de los resultados se realizó según las recomendaciones del European Committee on Antimicrobial Susceptibility Testing (EUCAST) del año 2019 para H.influenzae. Además, se realizó la prueba rápida de la nitrocefina para la detección de beta-lactamasa.
Variables evaluadasSe recogieron las siguientes variables microbiológicas: especie de Haemophilus, aislamiento único (cultivo monomicrobiano) o junto a otros microorganismos, tipo de muestra genital, año y estudio de resistencia a los antibióticos. Las variables epidemiológicas y clínicas recogidas fueron: sexo y edad del paciente, manifestaciones clínicas durante la infección, número de recidivas, tratamiento antibiótico, infecciones de transmisión sexual previas y su etiología, existencia de contacto sexual de riesgo previo al diagnóstico, uso de preservativo, orientación sexual, tipo de prácticas sexuales, adicción al tabaco, alcohol u otras drogas, contacto con el ámbito de la prostitución y presencia de infección por el virus de la inmunodeficiencia humana (VIH). En los casos con serología positiva para VIH, se recogieron de forma añadida las siguientes variables: tiempo transcurrido desde el diagnóstico, estadio, cifra de linfocitos CD4 y carga viral en el momento del episodio.
Análisis estadísticoSe realizó un análisis estadístico descriptivo, calculando frecuencias absolutas y relativas para las variables cualitativas y medidas de tendencia central y dispersión para las cuantitativas. La hipótesis de independiente se ha contrastado con el estadístico Chi-cuadrado de Pearson o la prueba exacta de Fisher, cuando no se cumplieron las condiciones de aplicabilidad (no más del 20% de frecuencias esperadas inferiores a 5). Se consideró significativo un valor p<0,05. En el caso de variables cuantitativas, se ha calculado el test no paramétrico de Kruskall-Wallis, y las comparaciones 2 a 2 se han estudiado con el test de Mann-Whitney (nivel de significación corregido, 0,005). Los datos se analizaron con el software R 4.4.1
Consideraciones éticasEl protocolo del estudio se llevó a cabo con arreglo a la Declaración de Helsinki y las consideraciones éticas de la investigación epidemiológica. Este fue un estudio no intervencionista, con ninguna investigación adicional a los procedimientos rutinarios. Cumplió condiciones para la exención de consentimiento informado. El material biológico se utilizó solo para el diagnóstico estándar de infecciones del tracto genital, siguiendo las prescripciones de los médicos. No se realizó muestreo adicional ni modificación del protocolo diagnóstico de rutina. Se realizaron los análisis de datos utilizando una base de datos completamente anónima, donde los pacientes fueron sustituidos por episodios infecciosos diferentes, ocurridos al menos con 6 semanas de diferencia del anterior, si es que lo hubo. La entidad que concedió el permiso para acceder y utilizar los datos fue la Unidad de Gestión Clínica de Microbiología Clínica del Hospital Virgen de las Nieves de Granada, España. La realización de este estudio fue aprobada por el Comité de Ética de la Investigación Biomédica de Andalucía dentro del Proyecto «Importancia clínica del aislamiento de microorganismos Haemophilus no ducreyi en muestras de exudados uretrales y rectales». Número de registro: 2329-N-19.
ResultadosDurante los años 2016 y 2019 se recibieron en el laboratorio de microbiología un total de 6.434 muestras genitales, de las cuales 1.946 correspondían a varones y 4.488 a mujeres. Haemophilus se aisló en 186 ocasiones durante dicho periodo, de las cuales 51 correspondían a mujeres (niñas y adultas), suponiendo un 1.1% (51/4.488) y 135 a episodios diferentes procedentes de 115 varones adultos con diagnóstico clínico de uretritis y/o proctitis. En los varones supuso el 7% (135/1.946) del total de muestras. Podemos afirmar que, en nuestro medio, Haemophilus se detecta con mayor frecuencia en muestras genitales procedentes de varones que de mujeres, siendo la diferencia estadísticamente significativa (p<0,01).
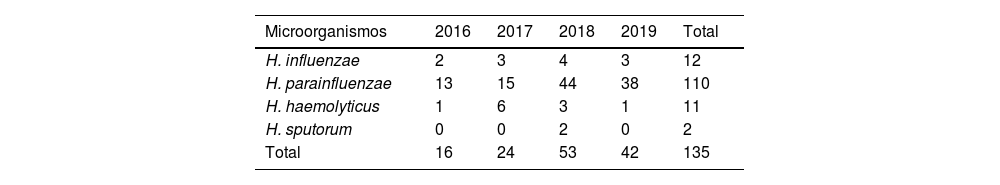
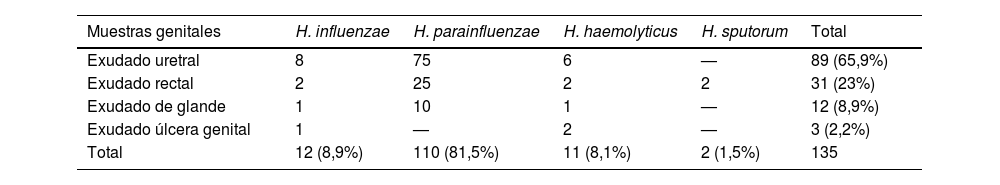
En la tabla 1 se muestra la distribución anualizada de las diferentes especies de HND en varones, a lo largo del periodo de estudio. En la tabla 2 se muestra la frecuencia con la que se detectan las especies de HND en los distintos tipos de muestras. Además, se estudió la frecuencia con que se aíslan las distintas especies HND en cultivo monomicrobiano o junto a otros microorganismos. Excluyendo 25 episodios de los que no disponemos de información en la historia clínica sobre posibles aislamientos concomitantes, en el 40,9% (45/110) de las muestras se aisló HND en solitario, con la siguiente distribución por especies: H. parainfluenzae (34/45; 75,6%), H. influenzae (6/45; 13,3%), H. haemolyticus (4/45; 8,9%) y H. sputorum (1/45; 2,2%). El análisis clínico y descriptivo de estos aislamientos en mujeres forma parte de otro trabajo de investigación, aunque informamos que hubo diferencias, estadísticamente significativas, entre varones y mujeres, siendo en los primeros la especie más frecuente H. parainfluenzae y, en las segundas, H. influenzae (Fisher, p<0,001). No se encontraron diferencias en cuanto a la edad entre ambos sexos. En el resto de muestras, hubo aislamientos concomitantes, siendo los microorganismos más frecuentemente aislados (entre paréntesis el número absoluto de veces en las que se aislaron, existiendo concomitancia de hasta 4 microorganismos diferentes en una muestra): U. urealyticum (28), N. gonorrhoeae (20), C. trachomatis (11), M. hominis (8), M. genitalium (6) y U. parvum (6).
Frecuencia con la que se detectan las especies de Haemophilus en los distintos tipos de muestras
| Muestras genitales | H. influenzae | H. parainfluenzae | H. haemolyticus | H. sputorum | Total |
|---|---|---|---|---|---|
| Exudado uretral | 8 | 75 | 6 | — | 89 (65,9%) |
| Exudado rectal | 2 | 25 | 2 | 2 | 31 (23%) |
| Exudado de glande | 1 | 10 | 1 | — | 12 (8,9%) |
| Exudado úlcera genital | 1 | — | 2 | — | 3 (2,2%) |
| Total | 12 (8,9%) | 110 (81,5%) | 11 (8,1%) | 2 (1,5%) | 135 |
Con respecto a los cuadros clínicos y sus manifestaciones, estos fueron proctitis y uretritis.
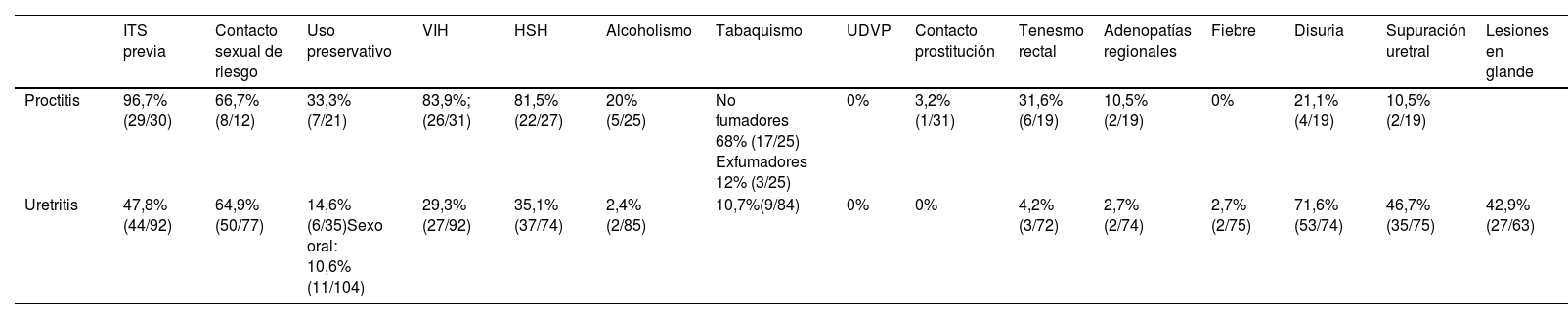
Se detectó HND en 31 episodios de proctitis de 24 varones, ya que 7 (22,6%) presentaron recidiva. La media de edad fue de 34,7 años (s=9,2). La mayoría había padecido previamente una infección de transmisión sexual (96,7%; 29/30), destacando VPH (75%; 21/28), sífilis (64,3%; 18/28), C. trachomatis (32,1%; 9/28), uretritis por U.urealyticum (25%; 7/28), N. gonorrhoeae (21,4%; 6/28), M. genitalium (21,4%; 6/28), M. hominis (10,7%; 3/28) y U. parvum (3,6%; 1/28). El resto de variables epidemiológicas y clínicas se recogen en la tabla 3. Del total de episodios de proctitis, en 13 (42%) de ellos el aislamiento microbiológico de HND fue en solitario. De ellos, se describieron manifestaciones clínicas en 3/13 (23%), predominando la disuria y supuración uretral (2/3; 66,7%) y el tenesmo rectal (1/3; 33,3%).
Variables epidemiológicas y clínicas correspondientes a los episodios de proctitis y uretritis
| ITS previa | Contacto sexual de riesgo | Uso preservativo | VIH | HSH | Alcoholismo | Tabaquismo | UDVP | Contacto prostitución | Tenesmo rectal | Adenopatías regionales | Fiebre | Disuria | Supuración uretral | Lesiones en glande | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Proctitis | 96,7% (29/30) | 66,7% (8/12) | 33,3%(7/21) | 83,9%; (26/31) | 81,5% (22/27) | 20%(5/25) | No fumadores 68% (17/25) Exfumadores 12% (3/25) | 0% | 3,2%(1/31) | 31,6%(6/19) | 10,5%(2/19) | 0% | 21,1% (4/19) | 10,5%(2/19) | |
| Uretritis | 47,8% (44/92) | 64,9% (50/77) | 14,6% (6/35)Sexo oral: 10,6% (11/104) | 29,3% (27/92) | 35,1% (37/74) | 2,4%(2/85) | 10,7%(9/84) | 0% | 0% | 4,2%(3/72) | 2,7%(2/74) | 2,7%(2/75) | 71,6%(53/74) | 46,7% (35/75) | 42,9%(27/63) |
HSH: hombres que tienen sexo con hombres; ITS: infección de transmisión sexual; UDVP: usuario de drogas por vía parenteral; VIH: virus de la inmunodeficiencia humana.
En 104 episodios de uretritis se identificó HND, correspondiendo a 91 varones (con 13 episodios recidivantes). La media de edad de este grupo fue de 34 años (s=10,3). El 47,8% (44/92) tenía antecedentes de infecciones de transmisión sexual, siendo las más frecuentes sífilis (26%; 24/92), U. urealyticum (21,7%; 20/92) y VPH (18,5%; 17/92), seguidas de N. gonorrhoeae (16,3%; 15/92), C. trachomatis (14,1%; 13/92), M. hominis (12%; 11/92), M. genitalium (10,9%; 10/92) y U.parvum (5,4%; 5/92). El resto de variables epidemiológicas y clínicas se recogen en la tabla 3. Del total de episodios de uretritis, en 32 de ellos (30,8%) se aisló HND en cultivo monomicrobiano, presentando manifestaciones clínicas 20 de ellos (62,5%). Las manifestaciones más frecuentes fueron disuria (17/20; 85%), lesiones en glande (13/20; 65%) y supuración uretral (7/20; 35%). Se describió fiebre únicamente en un caso (1/20; 5%). En comparación con los episodios en mujeres, los varones presentan menos episodios sintomáticos (p<0,005).
El 43,1% (53/123) de los pacientes eran VIH positivos. La mayoría tenía carga viral indetectable (88,9%; 48/54) y una cifra de linfocitos CD4 por encima de 500mm3 (87%; 47/54) en el momento del episodio infeccioso. Una gran parte de los casos correspondió a pacientes con adquisición reciente del VIH, en estadio A y sin inmunodepresión marcada. La presencia de VIH es más frecuente en varones que en mujeres (p<0,005) y en aislamientos de H. parainfluenzae (p<0,05).
Con respecto a los episodios recidivantes, fueron 10 recidivas clínicas con presencia del microorganismo en la muestra genital, correspondientes a 10 varones adultos diferentes. El 90% correspondieron a H. parainfluenzae (9/10) y el 10% a H. inflenzae (1/10). De ellos, 5 (50%) eran VIH positivos y 6 (60%) HSH. En todos ellos se administró inicialmente, de forma empírica, tratamiento genérico para ITS (ceftriaxona dosis única y doxiciclina/azitromicina). En el episodio clínico posterior, con el mismo aislamiento microbiológico, únicamente en 2 (20%) se administró tratamiento antibiótico dirigido por antibiograma. El resto (80%) no fueron tratados con antibiótico.
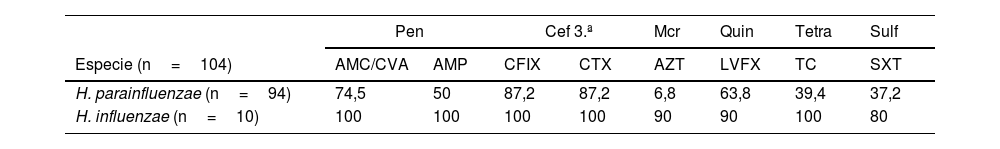
Con respecto a la sensibilidad antibiótica, en la tabla 4 se exponen las tasas encontradas, en 104 aislamientos de HND. Hubo un porcentaje del 50% de aislamientos productores de betalactamasas en el caso de H. parainfluenzae en nuestro estudio. En el caso de H. influenzae no se aislaron cepas productoras de betalactamasas. Se encontraron diferencias significativas (p<0,005) con respecto a la sensibilidad a algunos antibióticos de H. parainfluenzae en varones y mujeres adultas: sensibilidad a ampicilina (varones 50%; mujeres 100%); azitromicina (varones 6,8%; mujeres 27,3%); levofloxacino (varones 63,8%; mujeres 90,9%); tetraciclina (varones 39,4%; mujeres 0%) y trimetoprim/sulfametoxazol (varones 37,2%; mujeres 81,8%). No hubo diferencias estadísticamente significativas con respecto a la sensibilidad antibiótica de H. influenzae entre los 2 sexos.
Tasas de sensibilidad a los antibióticos de los antibiogramas realizados sobre los aislamientos de H. influenzae y H. parainfluenzae
| Pen | Cef 3.ª | Mcr | Quin | Tetra | Sulf | |||
|---|---|---|---|---|---|---|---|---|
| Especie (n=104) | AMC/CVA | AMP | CFIX | CTX | AZT | LVFX | TC | SXT |
| H. parainfluenzae (n=94) | 74,5 | 50 | 87,2 | 87,2 | 6,8 | 63,8 | 39,4 | 37,2 |
| H. influenzae (n=10) | 100 | 100 | 100 | 100 | 90 | 90 | 100 | 80 |
AMC/CVA: amoxicilina-ácido clavulánico; AMP: ampicilina; AZT: azitromicina; Carba: carbapenemes; Cef 3.ª: cefalosporinas de 3.ª generación; CFIX: cefixima; CTX: cefotaxima; LVFX: levofloxacino; Mcr: macrólidos; MEPM: meropenem; Pen: penicilinas; Quin: quinolonas; Sulf: sulfamidas; SXT: trimetoprim-sulfametoxazol; TC: tetraciclina; Tetra: tetraciclinas.
HND se aisló en el 2,9% (186/6.434) del total de muestras genitales recibidas, con diferencias importantes por sexo: 7% de las muestras procedentes de varones (135/1.946) y 1,1% (51/4.488) de las procedentes de mujeres. Muy pocos trabajos publicados describen la frecuencia con la que se aísla HND en muestras genitales. El 2,8% de los episodios de uretritis descritos por Vázquez et al.17 fueron causados por H. parainfluenzae. El 5% de las uretritis descritas por Ito et al.18 fueron causadas por HND, lo que corresponde al 14,3% de las uretritis no causadas por gonococo ni clamidia. El 1,76% de las uretritis estudiadas por Orellana et al.19 fueron producidas por H. parainfluenzae y el 1,12%, por H. influenzae. Por último, Foronda García-Hidalgo et al.1, en un estudio previo realizado en nuestro laboratorio durante 2016 y 2017, concluyeron que en el 8,65% de las muestras genitales procedentes de varones se detectó HND, fundamentalmente H. parainfluenzae (74,4%). La baja frecuencia de detección de HND podría deberse a que, con frecuencia, en la práctica habitual no se piensa en dichos agentes e incluso son indebidamente sustituidos por pruebas moleculares, imposibilitándose la detección de genitopatógenos oportunistas como HND.
La especie de HND detectada con más frecuencia en muestras genitales fue H. parainfluenzae (70,4%), seguida de H. influenzae (22,6%). La mayoría de HND se aislaron en muestras procedentes de varones (72,6%) y, en un 81,5% de ellas, se detectó H. parainfluenzae.
Sí llama la atención la comparativa del número de aislamientos de HND en muestras genitales del primer bienio (40) frente al segundo bienio del estudio (95), probablemente por dos razones: por un lado, el aumento progresivo de nuevas prácticas sexuales de riesgo sin protección en colectivos de riesgo como la población de nuestro estudio; y por otro, porque cada vez se piensa más en estas especies como posible agente etiológico en casos de uretritis y proctitis en los que las pruebas de detección de los agentes productores de ITS más frecuentes son negativas, realizándose por tanto cultivos en medios para su aislamiento.
Con respecto a los aislamientos concomitantes, en un 59,1% HND se aisló de forma conjunta con algún agente etiológico de ITS, pudiendo adoptar en estos casos un papel potenciador de dicho agente. En el resto (40,9%) el aislamiento fue en solitario. Dentro de este grupo, en los episodios de proctitis se describieron tanto síntomas rectales como uretrales (3/13; 23%), de forma similar a los episodios con aislamientos múltiples. En los episodios de uretritis, la presencia de HND en solitario se asoció con una mayor presencia de disuria y lesiones en glande en comparación con los aislamientos polimicrobianos.
El exudado uretral es el tipo de muestra genital procedente de varones en el que se aisló HND con mayor frecuencia. En comparación con la literatura, el aislamiento de HND en exudado rectal fue relativamente alta (16,6%) en nuestro laboratorio y muy baja según lo descrito en la literatura (2,3%)5. Estas diferencias podrían deberse a que, tradicionalmente, no se ha considerado la implicación de este género de bacterias en proctitis infecciosas y, por tanto, no suele buscarse en este tipo de muestra.
El antecedente de infecciones de transmisión sexual aparece en el 96,7% de los varones con proctitis y en un 47,8% de los afectados por uretritis, por lo que es un factor de riesgo importante. En nuestro estudio, los microorganismos que se aíslan con más frecuencia junto a HND en los varones con proctitis son, en orden de frecuencia: VPH, T. pallidum, Ureaplasma spp., Mycoplasma spp., Chlamydia spp. y N. gonorrhoeae. En el caso de la uretritis: T. pallidum, VPH, N. gonorrhoeae, Chlamydia spp., Ureaplasma spp. y Mycoplasma spp.
Destacamos la elevada tasa de infección por VIH observada, especialmente, en los pacientes diagnosticados de proctitis (83,9%), si bien la mayoría de ellos con control viroinmunológico. La elevada tasa de infección por VIH podría deberse a la confluencia de múltiples factores de riesgo asociados a la adquisición de todo tipo de infecciones de transmisión sexual. En los casos de uretritis también es alta (29,3%), aunque mucho menor. Estas diferencias podrían deberse a que los varones con proctitis reúnen más factores de riesgo asociados a la adquisición de infecciones de transmisión sexual, como la práctica de sexo anal. La mayoría de los pacientes con proctitis eran HSH (81,5%), mientras que, en el grupo de pacientes con uretritis, un 50% eran heterosexuales y un 35,1%, HSH.
Destacamos también la inclusión en la anamnesis de la práctica (o no) de sexo oral, ya que es un medio de transmisión de uretritis, tanto gonocócica como no gonocócica, reconocido por numerosos autores, como Lafferty et al.20, Schwartz et al.21, Bradshaw et al.22 o Barbee et al.23. Precisamente, este mecanismo de transmisión se ha asociado especialmente a las uretritis producidas por HND2,24. Sin embargo, a pesar de que la transmisión orogenital es un hecho constatado, sigue siendo algo desconocido para muchos clínicos, por lo que la detección de este tipo de patógenos a nivel orofaríngeo podría ser útil e interesante.
El uso de drogas por vía parenteral y el contacto con el entorno de la prostitución no se han asociado en nuestro trabajo a mayor riesgo de contraer infecciones genitales por HND, así como el tabaquismo o el alcoholismo.
En cuanto a los episodios recidivantes, se englobarían más en contexto de un fenómeno de recidiva clínica por persistencia del microorganismo en la muestra genital, debido la reaparición de manifestaciones clínicas de uretritis y/o proctitis con aislamiento persistente de HND en dicha muestra. Destacamos como principal causa de este fenómeno la inadecuada actitud terapéutica en el episodio inicial, puesto que, como se ha expuesto anteriormente, la antibioterapia empírica en el 100% de los episodios iniciales estaba basada en los protocolos de ITS generalizados y únicamente se trató de forma dirigida por antibiograma al 20% de las recidivas clínicas. La dosis única de cefalosporina de tercera generación no es suficiente para la erradicación de este microorganismo en el aparato genital, y la doxiciclina y la azitromicina suelen ser ineficaces debido a las altas tasas de resistencia descritas, sobre todo en H. parainfluenzae. Este aspecto junto con los factores de riesgo epidemiológicos (VIH, HSH) probablemente expliquen la persistencia de dicho microorganismo en los aislamientos en muestras genitales y también su mayor propagación al no comprobar su erradicación.
Los patógenos más frecuentemente implicados en la proctitis infecciosa de transmisión sexual son N. gonorrhoeae, que típicamente se acompaña de uretritis purulenta sin fiebre; C. trachomatis, que suele cursar con fiebre; virus herpes simple (VHS), más frecuente en inmunodeprimidos; o T. pallidum. Sin embargo, la elevada frecuencia con la que se producen coinfecciones dificulta el diagnóstico clínico. Recientemente se ha descrito la transmisión de patógenos entéricos a través de prácticas sexuales oroanales25. Una anamnesis detallada y una adecuada exploración física, que incluya idealmente anoscopia y rectoscopia, constituyen la base del proceso diagnóstico. El principal factor de riesgo que nos debe hacer sospechar y descartar este tipo de proctitis es la práctica reciente de coito anal receptivo sin protección. La posibilidad de extensión de los patógenos por contigüidad desde la zona genital a la zona anorrectal explicaría que las proctitis producidas por HND puedan acompañarse de síntomas uretrales (21,1% disuria y 10,5% supuración uretral).
Con respecto a los antibiogramas, calculando la media aritmética entre las tasas de sensibilidad frente a amoxicilina-clavulánico y a ampicilina detectadas en nuestro medio, podemos estimar la tasa de sensibilidad, en general, frente a penicilinas y compararla con la descrita en la literatura. En el caso de H. influenzae, en nuestro laboratorio estimamos una tasa de sensibilidad frente a penicilinas del 100%; en el de H. parainfluenzae, del 62,3%. Con la media entre ambas especies, obtenemos una tasa de sensibilidad de HND frente a penicilinas del 81,2%, similar a la descrita en anteriores trabajos22.
La tasa de sensibilidad de H. influenzae frente a cefalosporinas de 3.ª generación encontrada en nuestro laboratorio (100%) es similar en comparación con algunos estudios19,27, y superior a la descrita por Deguchi et al.28. Mientras que, en el caso de H. parainfluenzae, la tasa de sensibilidad en nuestro medio es algo menor (87,2%).
Destaca el aumento de las tasas de resistencia detectado en H. parainfluenzae frente a betalactámicos, especialmente frente a penicilinas y cefalosporinas de 3.ª generación. No hemos observado esta tendencia en el caso de H. influenzae. Varios trabajos recientes se refieren a H. parainfluenzae como un genitopatógeno oportunista multirresistente emergente. Sierra et al.13 señalan la mayor frecuencia con la que se detectan cepas resistentes en muestras genitales (28,6%) con respecto a las respiratorias (5,6%). Además, la frecuencia con la que se aíslan cepas resistentes, en general, ha aumentado significativamente, pasando del 13,3% en 2013 al 33,3% en 2017. Previamente, Faccone et al. habían alertado sobre cepas de H. parainfluenzae productoras de betalactamasa con elevadas CMI frente a ampicilina, amoxicilina-clavulánico, cefuroxima y cefotaxima.
Con respecto a los macrólidos, destaca la baja tasa de sensibilidad de Haemophilus parainfluenzae frente a azitromicina, del 6,8%, en contraste con la reportada en la literatura3,27, generalmente por encima del 60%.
En cuanto a la tasa de sensibilidad de HND frente a quinolonas, en el caso de H. parainfluenzae es del 63,8%, ligeramente inferior a la descrita por Sierra et al. en su serie13. En el caso de H. influenzae fue del 90% en nuestro laboratorio, próxima a la descrita en diferentes trabajos26,27.
Con respecto a la tasa de sensibilidad de H. parainfluenzae frente a tetraciclinas, destacamos que esta es inferior (39,4%) que la descrita en la mayoría de publicaciones, siendo próxima a la serie de Sierra et al. (53,7%)13. En cambio, la de H. influenzae en nuestra serie es prácticamente del 100%.
Por último, la tasa de sensibilidad de H. parainfluenzae frente a trimetoprim-sulfametoxazol encontrada en nuestro laboratorio (37,2%) es similar a la más frecuentemente reportada en la literatura3,13,27. En el caso de H. influenzae se registran tasas de sensibilidad del 80%, con una importante variabilidad en las diferentes series publicadas, desde el 30% a prácticamente el 100% de sensibilidad.
Si tenemos en cuenta que la tasa de sensibilidad de H. influenzae frente a cefotaxima es prácticamente del 100% en nuestro medio, parece que el tratamiento empírico es efectivo y que, en este caso, el uso concomitante de azitromicina o doxiciclina, para las que las tasas de resistencia son altas, añade poco beneficio y solo contribuye a ampliar el espectro ante situaciones inciertas. Por otro lado, la tasa de sensibilidad de H. parainfluenzae frente a ceftriaxona es del 92,5%.
Por otra parte, además de la importancia primordial de la antibioterapia en infección genitourinaria, se están buscando otras alternativas que permitan un mejor control de infecciones de difícil acceso antibiótico y/o recurrentes. Por ejemplo, el uso de probióticos basados en cepas de Lactobacillus spp. en cistitis recurrente y la cepa Escherichia coli Nissle 1917 en prostatitis crónica29. Cada vez se habla más de «urobioma»30, concepto que engloba la microbiota genitourinaria habitual que parece tener un papel protector frente a agentes con capacidad infectiva, ya que cambios en su composición se asocian a cuadros patológicos. Teniendo en cuenta que las especies del género Haemophilus también pueden colonizar el tracto genital y que no es infrecuente la presencia de recidivas clínicas a pesar de antibioterapia, no sería descabellado pensar en una posible utilidad de los probióticos en estos casos. No obstante, actualmente los datos de eficacia disponibles son escasos y hacen falta más estudios dirigidos.
Nuestro estudio tiene ciertas limitaciones, ya que, al ser retrospectivo, puede existir cierto sesgo de selección de pacientes, así como la falta de seguimiento y de confirmación de erradicación microbiológica en algunos pacientes. Por otra parte, el tamaño muestral, no obstante, debe tenerse en cuenta que estas especies suponen un porcentaje reducido de los aislamientos microbiológicos. Por último, las características clínicas y epidemiológicas se han realizado en episodios correspondientes a varones, sexo donde se presentan las tasas de aislamiento más altas (7%).
Como conclusión, debemos pensar en HND (sobre todo H. influenzae y parainfluenzae) como posible agente etiológico de episodios de uretritis y proctitis en v jóvenes, con factores de riesgo como infección por VIH, relaciones sexuales de riesgo previas o HSH. Por otra parte, deberá vigilarse el posible aumento de resistencia a los antimicrobianos más utilizados de forma empírica e intentar confirmar la erradicación microbiológica tras el tratamiento específico.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónLos autores declaran no haber recibido financiación para la realización de este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.