INTRODUCCIÓN
Desde la incorporación de la microinyección espermática (ICSI) como técnica en reproducción asistida, se pudo empezar a tratar a un importante grupo de pacientes infértiles, los azoospérmicos, a los que se puede sumar los varones vasectomizados y aquellos con criptozoospermia severa. Para la extracción de espermatozoides se practica principalmente la biopsia testicular (TESE), aunque también se puede aplicar la aspiración testicular o la aspiración de epidídimo.
Los espermatozoides testiculares son mayoritariamente inmóviles inmediatamente después de la biopsia, y si esta muestra se congela aún se acentuará más la inmovilidad espermática. Tras la descongelación, es frecuente encontrar una baja tasa de movilidad espermática, de modo que una pauta habitual en el laboratorio de embriología es dejar la muestra de biopsia un tiempo en cultivo para facilitar la recuperación de movilidad1. Sin embargo, a pesar del tiempo de cultivo, hay una serie de muestras que no recuperan ninguna movilidad.
La congelación está asociada a una pérdida de la movilidad espermática del 25 al 75%. El proceso de congelación-descongelación de espermatozoides incluye además un incremento en la generación de radicales superóxido que pueden provocar peroxidación de los lípidos de membrana alterando su fluidez y afectando a su función2. Algunos espermatozoides criopreservados tienen membranas intactas tras la descongelación, pero están inmóviles debido a su bajo estado metabólico de modo que conservan su capacidad fecundante.
En ICSI un factor determinante para obtener buenos resultados es tener la garantía de que los espermatozoides que se microinyectan estén vivos, y la mejor forma de tener esta garantía es inyectar espermatozoides móviles. Para las muestras que tienen una ausencia total de espermatozoides móviles hay varias técnicas de selección de espermatozoides viables: el llamado "mechanical touch"3 o toque mecánico de la cola espermática y valoración de la capacidad de recuperación de la forma de la cola o de la rigidez de ésta, aunque esta técnica es la más inocua para el espermatozoide, requiere cierta experiencia y tiene un componente de subjetividad. Otra técnica es el HOS test o test hipoosmótico, que consiste en poner los espermatozoides en un medio hipoosmótico, de modo que los espermatozoides vivos con su membrana íntegra se hincharán y la cola quedará enrollada siendo así fácilmente identificable; sin embargo, este test puede ser perjudicial para el espermatozoide y no se recomienda mucho su uso. En último lugar, una forma de identificación de espermatozoides vivos es el uso de pentoxifilina (PTX). La PTX reúne 2 características muy importantes: es un activador de la movilidad espermática pues es un inhibidor de la fosfodiesterasa, y además inhibe la generación de anión superóxido en su función como antioxidante. Un efecto negativo de la PTX es que puede causar bloqueo meiótico en los ovocitos de mamífero, da peores tasas de desarrollo en embriones de ratón, bloqueo en 2 células en algunas cepas de ratón o partenogénesis en ovocitos de ratón. En conclusión tiene un efecto pernicioso para los ovocitos. Para evitar este efecto adverso es necesario usarla de manera que la PTX esté en contacto con los espermatozoides para identificar aquellos con movilidad, pero tras la identificación hay que lavarlos en medio libre de PTX antes de la microinyección en el óvulo.
El presente trabajo pretende valorar qué parámetros se pueden mejorar al incorporar el uso de PTX en la rutina de trabajo de la ICSI con TESE y establecer el mejor protocolo de trabajo que redunde en una mejora de los resultados.
MATERIAL Y MÉTODOS
Pacientes
Análisis retrospectivo de 101 ciclos ICSI con TESE realizados en nuestra unidad entre 2005 y 2007 con mujeres menores de 41 años.
Se valoraron los siguientes parámetros: edad de la paciente, número de óvulos, óvulos maduros (MII), tasa de fertilización, tasa de división embrionaria, calidad de la cohorte embrionaria o embriones de buena calidad (EBC), número de embriones transferidos, tasa de gestación por punción (%Ges/P) y tasa de gestación por transfer (%Ges/T), según causa de esterilidad (donde establecemos 2 grupos: A, si la causa de infertilidad es masculina, o B, si además hay una causa femenina, que consideraremos como causa mixta), según si se utilizó TESE intraciclo en fresco o TESE congelada, en función de si se encontraron espermatozoides móviles o si sólo se microinyectaron espermatozoides inmóviles, según si se usó PTX o no (para poder recuperar espermatozoides móviles en la ICSI) y según si el paciente presenta una azoospermia por vasectomía o si es azoospérmico.
El análisis cromosómico reveló un cariotipo normal en todos los pacientes.
Recuperación de espermatozoides del tejido testicular
Los espermatozoides del tejido testicular fueron obtenidos mediante TESE bajo anestesia local. Se realizó una pequeña incisión en el escroto, atravesando la túnica vaginalis y albugínea (1-1,5 cm). Se realizaron extracciones de parénquima testicular de distintas zonas de la glándula hasta la obtención de espermatozoides. En caso de no obtener espermatozoides en un testículo se procedió a realizar múltiples biopsias en el contralateral. Los procedimientos fueron realizados por un andrólogo.
El tejido obtenido se colocó en una placa de Petri de doble pocillo bajo campana de flujo laminar con medio tamponado (Flushing Médium, Medicult. Denmark), dislacerado bajo lupa estereoscópica con la ayuda de 2 hojas de bisturí y observado al microscopio invertido para comprobar la presencia de espermatozoides. A continuación se transfirió a un tubo falcon cónico de 15 ml y se incubó durante 45 min.
Tras la obtención de material testicular en el que hay espermatozoides, una parte se procesa para ICSI y otra se criopreserva y almacena en nuestro banco criogénico de semen. De igual manera se procede con las TESE diagnósticas con resultado positivo que se criopreservan para su uso en un tratamiento posterior.
La muestra destinada a la ICSI se centrifuga a 300 g durante 5 min, con objeto de separar el tejido testicular de los espermatozoides, resuspendemos el pellet en 100 µl y se observa el pellet al microscopio en busca de espermatozoides. Se recoge el sobrenadante y se centrifuga a 400 g durante 5 min para obtener una suspensión de espermatozoides más limpia de tejido y glóbulos rojos. El segundo pellet se resuspende en 100 µl de medio tamponado. Este segundo pellet, si contiene espermatozoides, estará más limpio para usarlo en la microinyección. Se incuba el pellet obtenido durante al menos 45 min hasta el momento de la ICSI.
Criopreservación y descongelación del tejido testicular
Para la criopreservación del tejido testicular se llevó a cabo el siguiente protocolo: se añadió crioprotector en proporción 1:1 (Freezing médium Irving, USA), se dejó el tubo a temperatura ambiente durante 10 min para que el crioprotector penetrara en las células. La muestra se homogeneizó y se fraccionó en los criotubos de 2 ml o pajuelas de 0,5 ml correspondientes. Se equilibró en la nevera durante 1 h. A continuación se colocó en contacto con vapores de nitrógeno líquido durante 30 min. La muestra debe estar a 1 cm de la superficie del nitrógeno líquido, a continuación los criotubos o pajuelas se sumergieron en nitrógeno líquido y se almacenaron en nuestro banco de semen.
La descongelación de las muestras obtenidas por TESE se realiza a temperatura ambiente bajo campana de flujo laminar. Una vez descongelada la muestra se coloca en un tubo falcon cónico de 15 ml. Se añade un volumen similar de medio de cultivo (IVF Médium, Medicult. Denmark) y se centrifuga a 400 g durante 5 min para eliminar el crioprotector. El sobrenadante se coloca en otro tubo falcon cónico de 15 ml y se centrifuga a 800 g durante 5 min. El pellet obtenido se resuspende en medio de cultivo (IVF Médium, Medicult. Denmark).
Estimulación ovárica
La supresión hipofisiaria se llevó a cabo mediante protocolo largo de estimulación, protocolo corto o protocolo antagonista, con análogos de la GnRH (Procrín. Lab. Abbott. Madrid; Synarel. Lab. SEID Barcelona), cetrotide (Serono International S.A.) o orgalutran (Organon. Barcelona) induciendo el desarrollo folicular múltiple con FSHr (Gonal-F; laboratorios Serono. Madrid; Puregon Lab. Organon. Barcelona) o FSHr asociada a menopur (Ferring. Madrid).
El control de desarrollo folicular se realizó con determinaciones seriadas de estradiol sérico y ecografía transvaginal. Cuando los folículos alcanzaron un tamaño de 18 mm, se indicó la administración de 10.000 UI de hCGr (Ovitrelle. Serono.Madrid).
La recuperación de los ovocitos se realizó a las 34-36 h tras la administración de la hCG por punción transvaginal bajo guía ecográfica.
La suplementación de la fase lútea fue con la administración vía vaginal de 400 mg de progesterona micronizada (Utrogestan. Lab. SEID; Progeffik. Lab. Effik) comenzando al día siguiente de la extracción ovocitaria y aumentando a 600 mg/día desde el día del transfer. El embarazo clínico se confirmó a los 17 días postransfer con la determinación de bhCG y a los 24 días postransfer por ecografía vaginal mediante la presencia de, al menos, un saco gestacional con latido cardíaco.
Microinyección espermática, valoración, fertilización, división y transferencia embrionaria
El procedimiento de ICSI se realizó tal como lo describió van Steirteghem et al4.
En la preparación de la placa de ICSI, en los casos donde no hay espermatozoides móviles, se colocó la microgota de 5 µl de semen, 1 µl de la solución de PTX (Hemovás 300 mg. Laboratorios Robert. Barcelona).
En las ICSI realizadas sin PTX, si únicamente se dispone de espermatozoides inmóviles, su viabilidad se valoró mecánicamente con la pipeta de ICSI por la técnica del toque mecánico descrita por Marqués de Oliveira et al3.
El cultivo de los ovocitos y embriones se realizó usando la serie de medios Medicult (Medicult, Denmark).
La valoración de la fertilización ICSI se realiza a las 18-20 h postinseminación bajo microscopio invertido por la presencia de 2 pronúcleos y 2 corpúsculos polares. La calidad embrionaria se clasifica según un score embrionario que cataloga a los embriones dándoles una puntuación que oscila entre 0 y 10, valorando el número de blastómeros, su simetría y el grado de fragmentación citoplasmática.
Los embriones óptimos son los que tienen scores 8, 9 y 10.
Se transfiere un máximo de 3 embriones entre los días 2, 3 y 4 de cultivo embrionario y los embriones sobrantes que cumplen los criterios de calidad son criopreservados.
Estadística
El análisis estadístico se realizó usando el paquete estadístico SPSS versión 15. El test de la x2 se utilizó para determinar las diferencias significativas entre los grupos. El nivel de significación considerado fue p < 0,05.
RESULTADOS
Se valoró un total de 101 ciclos de ICSI con TESE de forma retrospectiva de los que obtuvo resultados comparativos de edad, número de ovocitos obtenidos, número de los que son maduros MII, tasa de fertilización, tasa de división, número de EBC obtenidos, número de embriones transferidos, %Ges/P y %Ges/T:
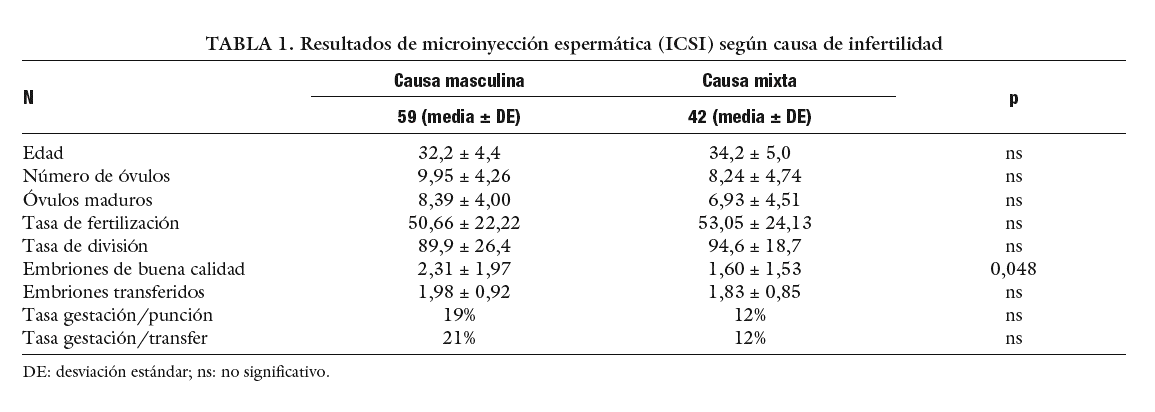
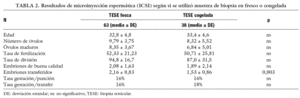
Según causa de infertilidad (tabla 1). Se establecen 2 grupos según si la única causa de infertilidad es la masculina o si además hay una causa femenina, que se considerará como causa mixta.
Cuando además de la causa masculina hay alguna causa femenina de esterilidad se observa que los resultados no presentan diferencias significativas en tasa de fertilización ni en tasa de gestación, pero se observa una diferencia en el número de embriones de buena calidad obtenidos.
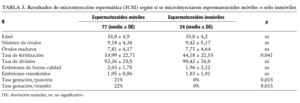
Según si se utilizó TESE intraciclo en fresco o TESE congelada (tabla 2). A pesar de que en las TESE congeladas se transfiere un número significativamente menor de embriones se observa que no hay diferencias significativas ni en tasa de fertilización ni en el número de EBC ni en la tasa de gestación.
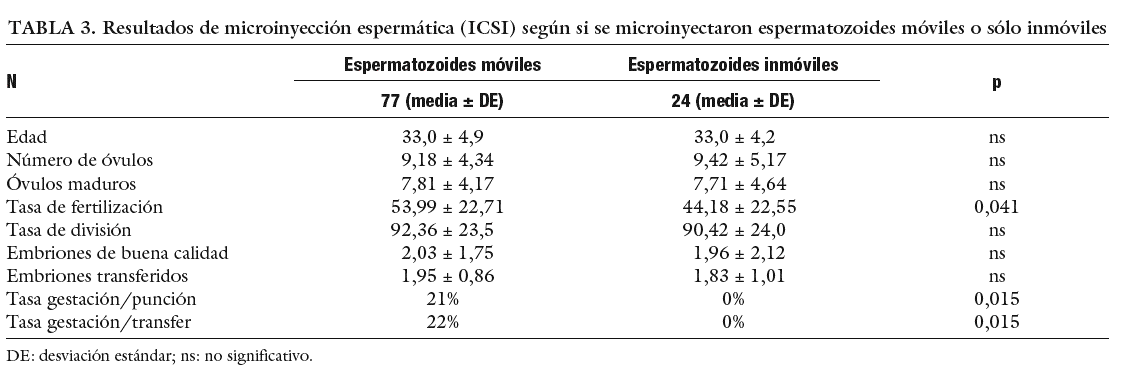
En función de si se encuentran espermatozoides móviles o si sólo se microinyectaron espermatozoides inmóviles (tabla 3). Cuando sólo se inyectan espermatozoides inmóviles se obtiene una tasa de fertilización y una tasa de gestación significativamente menores.
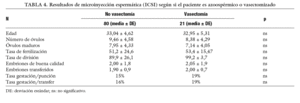
Según si el paciente es vasectomizado o azoospérmico (tabla 4). Los pacientes vasectomizados no obtienen ningún resultado significativamente mejor que el resto de las TESE, aunque se vea una ligera tendencia a tener una mejor tasa de gestación.
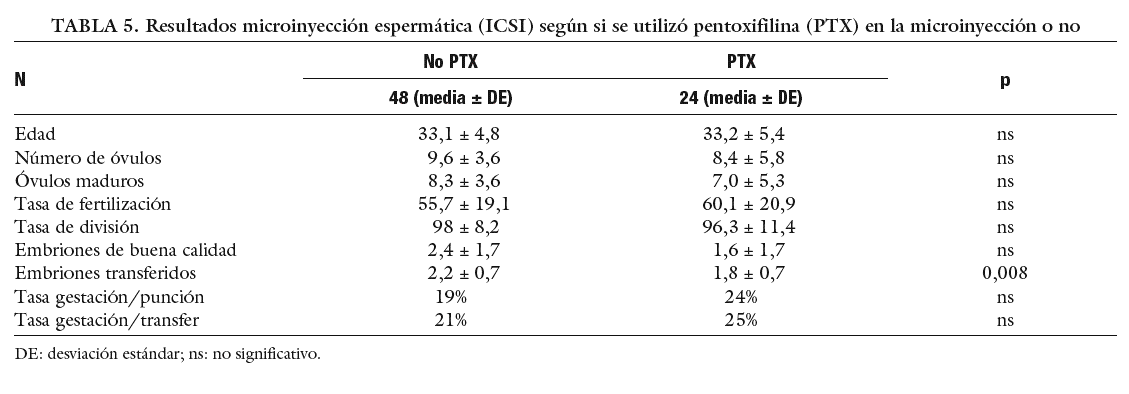
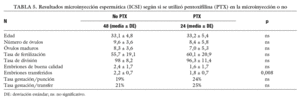
En función de que se haya usado PTX o no (ta bla 5). En la tabla 5 se compara el grupo de no PTX que tuvieron movilidad espermática (n = 48) con respecto al grupo con PTX con movilidad (n = 24), para valorar si habiendo movilidad espermática hay alguna diferencia por el hecho de haber usado PTX. Se observa que a pesar de que se transfieren menos embriones en el grupo de PTX (p = 0,08), no hay diferencias significativas en la tasa de gestación.
El uso de la PTX "per se" no presenta diferencias significativas en los resultados.
DISCUSIÓN
La PTX es un inhibidor de la fosfodiesterasa del grupo de las metilxantinas. Inhibe la rotura del adenosin monofosfato cíclico (cAMP) y es bien conocido que la concentración intracelular de cAMP juega un importante papel en la movilidad espermática. El uso de PTX en el procesamiento de los espermatozoides inmóviles, ya sea de muestras en eyaculado completamente astenozoospérmicas ya en muestras de TESE en fresco o en congelado, se ha demostrado que es efectiva5. Sabiendo además que la PTX es tóxica para los ovocitos, esto determina la forma de trabajo al realizar la microinyección y siempre se realizará un paso de lavado del espermatozoide identificado previo a la microinyección del óvulo6.
A la vista de los resultados son varias las conclusiones a las que llegamos. En primer lugar, se consiguieron mejores resultados en calidad embrionaria cuando la única causa de infertilidad es la masculina que si a ésta se le añade alguna causa de infertilidad femenina. No obstante el resultado final de tasa de gestación no da diferencias significativas.
Con respecto al uso de espermatozoides de TESE en fresco o de muestra congelada, se ve que no hay diferencias en tasa de gestación en ambos grupos, y ello a pesar de que en el grupo de TESE congelada se transfirió un número significativamente menor de embriones. Este resultado acorde con la bibliografía7 nos permite poder programar los ciclos de estimulación convenientemente de manera que en nuestra unidad el criterio que tenemos establecido es que para las parejas que aceptan un semen de donante en caso de no obtener espermatozoides en la biopsia, programamos la TESE en fresco sincronizada con el día de la extracción folicular, y en las parejas que no aceptan un semen de donante como alternativa a la ausencia de espermatozoides, se les programa una TESE diagnóstica en la que si hay espermatozoides se congela la muestra y posteriormente se programa el ciclo de estimulación de la mujer para inseminar con la muestra congelada. También hay que mencionar que en los casos de TESE en fresco para un primer ciclo ICSI, el criterio de nuestro laboratorio es congelar parte de la muestra biopsiada para que se utilice en caso de requerir un segundo o tercer ciclo de tratamiento. Hay grupos de trabajo que hacen extensible el criterio de congelación a muestras de eyaculado de pacientes criptozoospérmicos y oligozoospérmicos severos8 para garantizarse la disponibilidad de espermatozoides el día de la inseminación en caso de ausencia total de espermatozoides en ese día, práctica que en nuestra unidad no se lleva a cabo salvo contadas excepciones.
En el grupo de estudio de este trabajo se incorporó el uso de la PTX a partir de una fecha determinada, de modo que las biopsias previas a esa fecha (un total de 76) son sin PTX y ello incluye muestras tanto con espermatozoides móviles como con espermatozoides todos inmóviles. A partir de la incorporación de la PTX la casi totalidad de las muestras lleva PTX en las gotas de microinyección porque en las muestras que son totalmente inmóviles consigue que se recuperen algunos espermatozoides móviles, y en las que ya hay algunos espermatozoides móviles nos permite recuperar una mayor movilidad en un mayor número de espermatozoides debido a que la PTX aumenta la proporción de espermatozoides hiperactivados5, lo que redunda en una mejor selección de los espermatozoides que hay que microinyectar y la realización de la ICSI en menor tiempo. Cuando no usábamos PTX y la muestra era con espermatozoides completamente inmóviles, utilizamos la técnica del "mechanical touch"3, es decir, con un golpe a la cola del espermatozoide con la pipeta ICSI se observa la flexibilidad y capacidad de recuperación de la posición inicial de la cola para valorar que es un espermatozoide vivo, y si la cola se muestra rígida se desecha el espermatozoide y se considera no viable. Con esta técnica, de los 24 casos registrados en este estudio, se consiguió un 44,18% de tasa de fertilización que, como cabía esperar, es significativamente menor que en el grupo con espermatozoides móviles, un promedio de 1,96 embriones de buena calidad por paciente y una media de embriones transferidos de 1,83, que no varía significativamente del número de embriones transferidos en los casos en que se usaron espermatozoides móviles, y a pesar de ello no hubo ninguna gestación en este grupo, frente a un 21% de gestación del grupo con espermatozoides móviles. Es en este aspecto en el que la PTX ha aportado una clara ventaja en los resultados de fertilización y gestación, dado que su principal aportación es permitir la correcta identificación de los espermatozoides vivos9 al potenciar su movilidad6, y ello sobre todo es aplicable a las muestras congeladas dado que la congelación tiene como consecuencia una importante pérdida en la movilidad espermática2,10. Pero no solamente es beneficiosa la PTX en los casos de ausencia total de movilidad sino que también tiene sus ventajas en los casos donde la movilidad es escasa, porque al potenciarla permite que se reduzca el tiempo de incubación de la muestra, el tiempo de la microinyección y que, además, se pueda hacer una mejor selección espermática11,12. Esto es importante dado que se ha demostrado que el tiempo de incubación prolongado de los espermatozoides testiculares causa fragmentación del ADN13.
Dentro del grupo estudiado, se pueden diferenciar 21 casos de pacientes vasectomizados y una de nuestras preguntas era saber si los resultados serían significativamente mejores en este grupo, y sin embargo nos encontramos con que los resultados sólo muestran una pequeña tendencia a mejorar la tasa de gestación pero no significativa, de modo que no podemos afirmar que en este grupo tengamos un mejor pronóstico.
AGRADECIMIENTOS
A la Unidad de Andrología del Hospital Universitario de Canarias por la ejecución de las biopsias testiculares de los pacientes de la Unidad de Reproducción.
Al equipo de enfermería de nuestra unidad por su participación en la coordinación de los procedimientos quirúrgicos realizados.