La estenosis de la anastomosis uretrovesical es un problema relativamente poco frecuente tras la prostatectomía radical, aunque puede ser recidivante y de difícil tratamiento. Se conocen ciertos factores de riesgo que pueden ayudar a disminuir su presentación. Para la decisión del plan terapéutico debemos evaluar la estenosis y también la continencia tras la prostatectomía. Hay descritas múltiples opciones de tratamiento, pero la evidencia disponible sobre ellas es baja, limitándose a series de casos de diferente tamaño y seguimiento, y revisiones sobre el tema. Los tratamientos endoscópicos son los más extendidos, con unos porcentajes de éxito que oscilan según la técnica de incisión, resección o vaporización. Una opción adyuvante es la inyección local de fármacos que reduzcan el crecimiento fibroso. En casos recidivantes o con obstrucción completa, pueden requerirse reconstrucción quirúrgica, por vía perineal, abdominal o mixta, o derivaciones suprapúbicas.
Vesicourethral anastomotic stenosis is a relatively uncommon problem after radical prostatectomy, but it could become recurrent and difficult to treat. Risk factors are known, and they can help to decrease the incidence. When discussing the therapeutic plan, we must consider the stenosis risk, and also the urinary continence after the prostatectomy. Many treatment schedules are proposed, some of them with low available evidence, limited to case series with different number of patient and follow-up length, or reviews on the subject. Endoscopic options are the commonest, obtaining different success rates depending on the incision, resection or vaporization of the tissue. They could also benefit from the use of adjuvant local injections of drugs regulating tissue growth. Recurrent or obliterated cases could require surgical reconstruction using perineal, abdominal or combined approaches, or even suprapubic urinary diversions.
El cáncer de próstata (CaP) localizado es una enfermedad curable en un gran porcentaje de casos, mediante múltiples planteamientos. En este contexto, los efectos secundarios y las complicaciones de cada técnica cobran gran relevancia. Tras la prostatectomía radical (PR), el desarrollo de estenosis de la anastomosis uretrovesical (AUV) ocurre con moderada frecuencia, pudiendo deteriorar la calidad de vida del paciente. Conocer los factores que se asocian a la aparición de estenosis uretrovesical (EUV), y sospechar su aparición ante los primeros, síntomas puede ayudar a prevenir su aparición y diagnosticarla precozmente. Sobre el manejo de esta entidad, la evidencia se basa en series de casos, con pocas revisiones disponibles, habiéndose propuesto varios algoritmos de tratamiento. En esta revisión, resumimos el contexto actual sobre la EUV, describiendo su incidencia, los factores que se asocian a su aparición y las técnicas de diagnóstico. Analizamos críticamente los planteamientos terapéuticos publicados, comentando sus resultados y complicaciones asociadas, resumiendo cuáles serían las pautas de manejo más extendidas actualmente.
Material y métodosRealizamos una búsqueda sistemática en bases de datos (PubMed), con las siguientes palabras clave: prostate cancer, radical prostatectomy, posterior urethra, vesicourethral anastomotic stenosis, urethral stenosis, urethral stricture y bladder neck contracture. Seleccionamos los artículos relacionados con el tema de nuestra revisión: manejo de la estenosis de la anastomosis vesicouretral tras PR. Se incluyeron todo tipo de estudios publicados en idiomas inglés y español hasta 2017 y, adicionalmente, se revisó la bibliografía de los artículos encontrados para identificar trabajos no localizados en la nuestra primera búsqueda. Tras una selección de los artículos más relevantes, realizamos una lectura crítica y resumimos la evidencia existente relativa a la presentación y etiología del problema, factores de riesgo identificados, técnicas de diagnóstico y estrategias de tratamiento.
ResultadosContexto actual del tratamiento del cáncer de próstataEl CaP es la neoplasia más frecuentemente diagnosticada en varones en los países desarrollados, presentando un aumento de su supervivencia debido al diagnóstico precoz y a los avances terapéuticos1. Ante un tumor órgano-confinado, el abanico de tratamientos incluirá desde la PR —abierta, laparoscópica (PRL) o asistida por robot (PRLAR)—, hasta terapias focales —crioterapia, ultrasonidos focales de alta intensidad, electroporación—, pasando por las diferentes opciones de radioterapia (RT) —RT externa, braquiterapia de alta o baja tasa. Este contexto obliga a considerar los posibles efectos secundarios de cada tratamiento durante la discusión con el paciente sobre cómo tratar su tumor2. Las estenosis de uretra posterior ocurren tras cualquiera de estos tratamientos, ya sea en AUV como en el segmento uretral membranoso o prostático y, por tanto, su frecuencia de aparición, consecuencias y opciones de manejo deberían ser explicadas al paciente3,4. Según ciertos autores, este tema no es suficientemente abordado durante el planteamiento terapéutico del CaP, a pesar de su importante repercusión sobre la calidad de vida del paciente en caso de producirse2.
Definición e incidenciaLa EUV (vesicourethral anastomotic stenosis, en inglés) tras una PR viene definida por una reducción del calibre a nivel de la unión quirúrgica del cuello vesical con la uretra membranosa. Dado que la estenosis se localiza a nivel cervical, y como consecuencia del término anglosajón bladder neck contracture, también recibe el nombre de contractura del cuello vesical (CCV)2,3. No se ha definido un calibre uretral mínimo por debajo del cual consideraremos EUV, ni un método estándar de evaluación para diagnóstico y seguimiento2,5. Habitualmente, el método estándar para catalogar una EUV es la imposibilidad de franquearla con un cistoscopio de 15 o 17 Fr6,7. La falta de uniformidad en los métodos de diagnóstico se hace evidente en el amplio rango de incidencias reportado y los diferentes porcentajes de éxito obtenidos con los tratamientos planteados8. Su presencia se asocia por sí misma a una mayor incontinencia urinaria (IU) tras la PR que en pacientes sin EUV5. Además, las futuras intervenciones quirúrgicas (IQ) para su tratamiento pueden generar un empeoramiento de la IU en los pacientes con IU preexistente y conllevan cierto riesgo de aparición de IU de novo. También se ha demostrado que la EUV favorece el desarrollo de infecciones urinarias de repetición.
Debe diferenciarse la EUV de otras 2 entidades, que, aunque similares, presentan particularidades en su manejo:
- –
La contractura de cuello vesical tras tratamientos de hiperplasia benigna de próstata (RTU-próstata, vaporizaciones láser o adenomectomías prostáticas). Pese a la similar morfología en las pruebas de imagen y endoscópicamente, se ha evidenciado que son entidades diferentes y los resultados de su tratamiento difieren9.
- –
La disrupción completa de la AUV en el postoperatorio inmediato. Este contexto, habitualmente debido a sangrados locales que separan el extremo uretral del cuello vesical, origina una situación más grave, necesitando habitualmente reparaciones completas de la anastomosis o la formación de derivaciones urinarias10.
Globalmente, la EUV aparece entre un 1,3 y un 29% de todas las PR, aunque los datos más actuales acotan su incidencia a entre el 5 y el 10%3,11-14. Los abordajes mínimamente invasivos (PRL y PRLAR) han disminuido la incidencia, comparados con las técnicas de cirugía abierta, hasta fijarla en torno al 3%13,15,16. En series modernas de un único cirujano en centros de muy alto volumen esta incidencia llega a reducirse a menos del 1%6. Se ha calculado que aproximadamente 5.000 personas/año presentarán EUV, aplicando una estimación conservadora al volumen de cirugías prostáticas realizadas anualmente en EE. UU.3.
Desarrollo y factores de riesgoLa EUV aparece por el desarrollo y la progresión de tejido fibrótico en anastomosis entre la uretra y el cuello vesical reconstruido o preservado. Suelen hacerse evidentes aproximadamente a los 4-6 meses5,11,17 tras la IQ, aunque han sido descritas desde los 0,5 a los 55 meses12,18. Es excepcional que se presenten más tarde de 2 años tras la PR3, siendo esta una diferencia respecto a las estenosis desarrolladas tras la RT5.
Se han descrito situaciones que favorecen la aparición de EUV tras PR11:
- –
Extravasación de orina en la AUV, demostrada en una cistografía de control.
- –
Excesiva pérdida sanguínea durante la cirugía o en el postoperatorio.
- –
Antecedente de cirugías previas sobre el cuello vesical.
Las explicaciones que se han justificar este aumento de incidencia de AUV en estos pacientes son:
- –
Crecimiento excesivo de tejido fibrótico como respuesta a una fuga urinaria en la AUV.
- –
Disrupción de la sutura uretrovesical o de parte de la misma, por el desplazamiento debido a la formación de hematomas en el lecho quirúrgico tras la IQ.
- –
Incorrecta aposición de bordes mucosos en la sutura debido a una mala visualización intraoperatoria por un sangrado excesivo18.
- –
Compromiso de la vascularización y consecuente desarrollo de tejido cicatricial por ligadura masiva de vasos en el cuello vesical, en casos de hemorragia durante la IQ.
- –
Cuello vesical fino y devascularizado tras RTU-P o adenomectomía19. En esta situación, es recomendable esperar hasta la completa reepitelización, realizando una cistoscopia previa a la PR11.
También se ha encontrado relación entre EUV y factores individuales, como la edad avanzada en el momento de la PR o el tabaquismo y otras enfermedades con afectación microvascular, como enfermedades coronarias, diabetes mellitus e hipertensión18 —aunque esta relación podría estar mediada por el hábito tabáquico. La tendencia al desarrollo de excesiva fibrosis o cicatrices hipertróficas parece también implicada, asociándose la aparición de EUV con la anchura máxima de la cicatriz quirúrgica5.
Existe mayor desarrollo de EUV tras PR sin preservación vásculo-nerviosa6, lo que apoya la hipótesis de que la conservación del aporte vascular y neural a la zona pelviana puede tener también efectos beneficiosos de prevención de la retracción de la AUV. Se ha indicado mayor aparición de CCV tras PR retropúbica, comparada con el abordaje perineal20; en este caso, a pesar de mayor fuga anastomótica radiográfica en este segundo abordaje.
No se han encontrado diferencias entre evertir el cuello vesical previo a la realización de AUV21,22. Tampoco se conoce el calibre ideal necesario en la reconstrucción de cuello vesical, siendo el más habitual —cuando se mide— de 20-24 Fr6. Más controvertida es la relación entre el desarrollo de EUV y la RT posterior a la PR, con artículos sin encontrar aumento de incidencia23 frente a otros con diferencias en la presentación24. También está en duda la influencia del momento de la RT en la aparición de EUV, sin aparentes diferencias en la aparición entre la RT adyuvante frente a la RT de rescate, con incidencias entre un 3 y un 8,5%25, aunque con cierto consenso en que cuanto más se difiera la administración de la RT, menor será el riesgo de EUV26. Sin embargo, sí que parece demostrado un aumento de EUV en PR de rescate, alcanzando hasta un 42% de incidencia3.
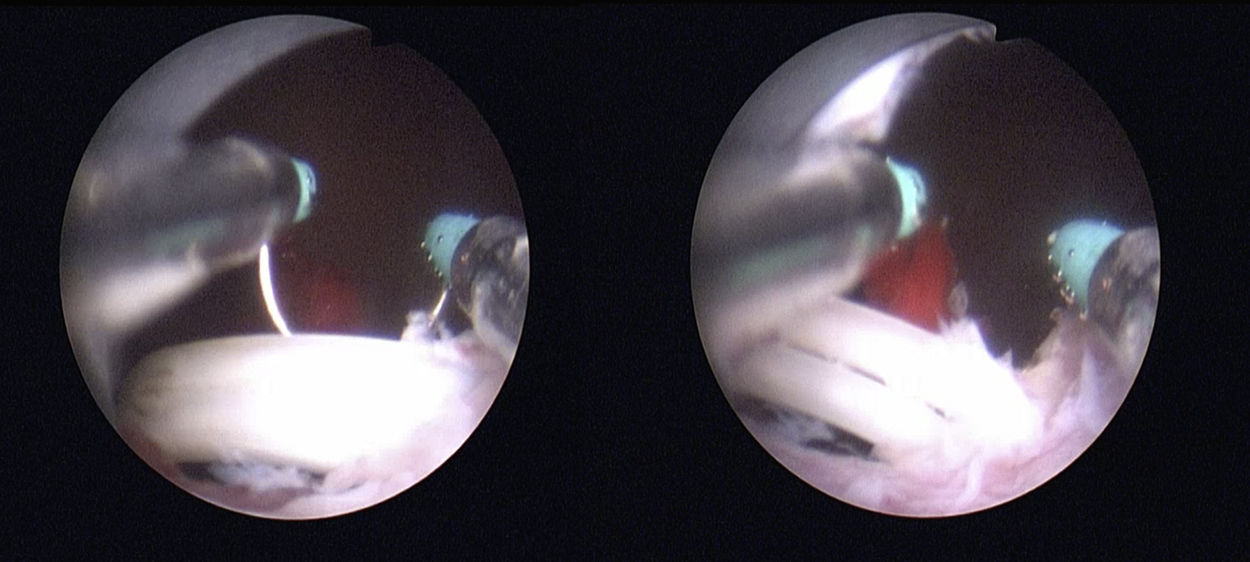
No se han encontrado diferencias en el desarrollo de EUV entre las PRL y las PRLAR13; sin embargo, ya hemos mencionado que estos abordajes han disminuido la incidencia comparados con las técnicas de cirugía abierta13,15,16. En estas series contemporáneas aparecen otras causas de EUV, como la migración de clips, identificados hasta en un 20% de casos27 (fig. 1).
La frecuencia de aparición de EUV también se relaciona con el volumen de PR realizadas, disminuyendo su incidencia con un mayor número de IQ. Esto se ha demostrado a nivel individual, analizando las curvas de aprendizaje de cirujanos con experiencia6, y a nivel comunitario, presentando menor aparición en centros de alto volumen —realizando > 60 PR/año28.
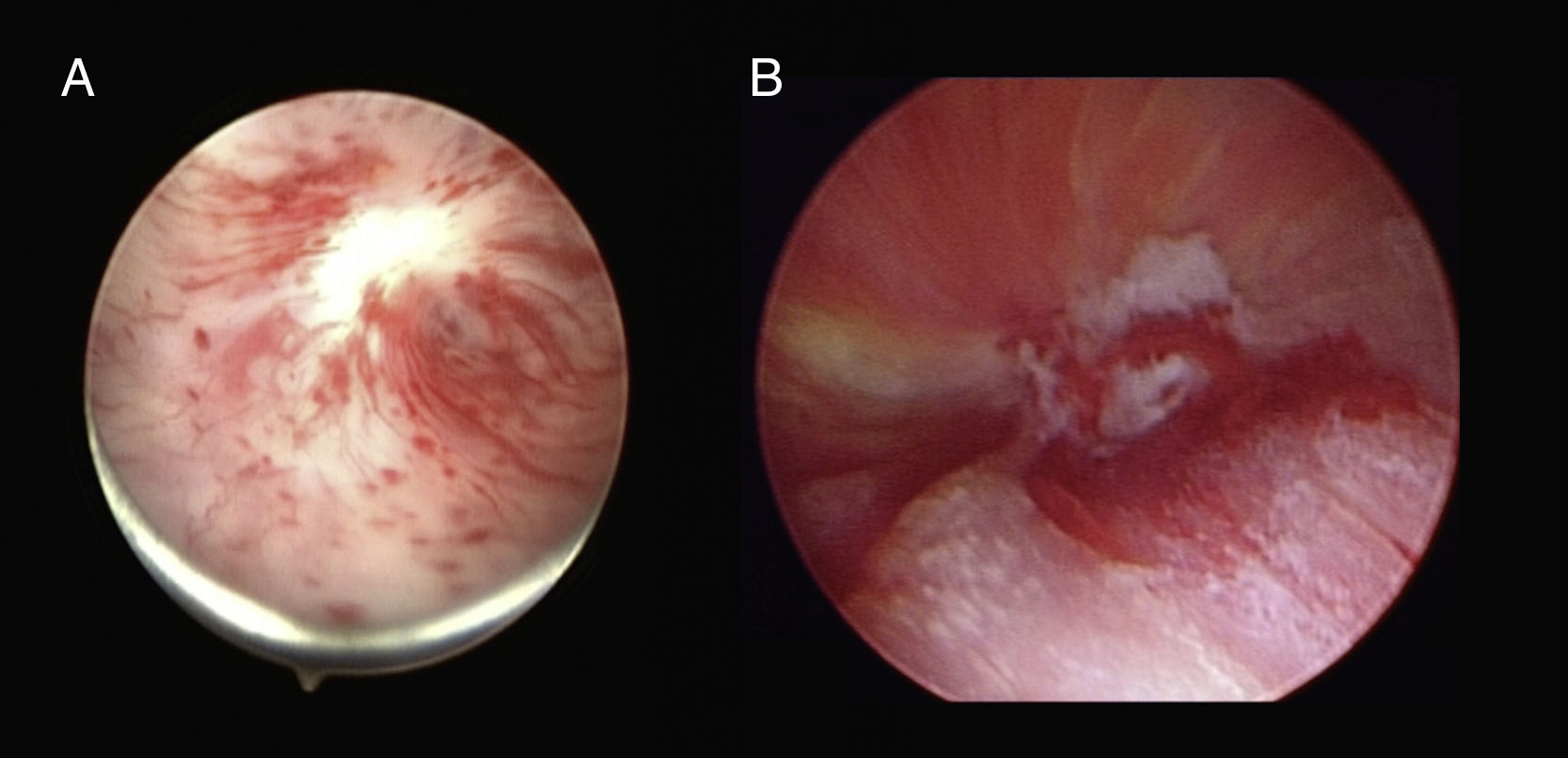
Diagnóstico y evaluación del pacienteClínicamente, la EUV suele presentarse como obstrucción al flujo urinario, llegando en casos severos a retención aguda de orina (RAO). Alternativamente, en algunos casos se presenta como IU que no mejora con el tiempo, y que puede o no asociarse a clínica obstructiva4. La flujometría con valores reducidos y una medición de residuo posmiccional con cifras elevadas aumentarán el grado de sospecha clínica8. Mediante la uretrografía retrógrada descartaremos la presencia de otras estenosis en la uretra anterior, y asociando cistouretrografía miccional seriada podremos ver la típica forma de embudo del cuello vesical tras PR, y estimar la longitud del segmento afectado4. La uretro-cistoscopia permite confirmar el diagnóstico (18) y analizar el calibre aproximado del área estenótica y estimar su longitud. Esta evaluación endoscópica es útil para analizar la función esfinteriana y valorar la integridad anatómica del esfínter externo (4). Endoscópicamente, pueden verse cuerpos extraños, como clips de polímero tipo Weck® Hem-o-lok (Teleflex. Research Triangle Park, NC, USA)27, clips reabsorbibles tipo Lapra-Ty (Ethicon®, Somerville, NJ, USA)29 o incluso clips metálicos. Si la estenosis es completa, se puede realizar cistoscopia anterógrada a través del tracto suprapúbico3, útil para valorar la distancia de la cicatriz del cuello vesical a los meatos ureterales (fig. 2).
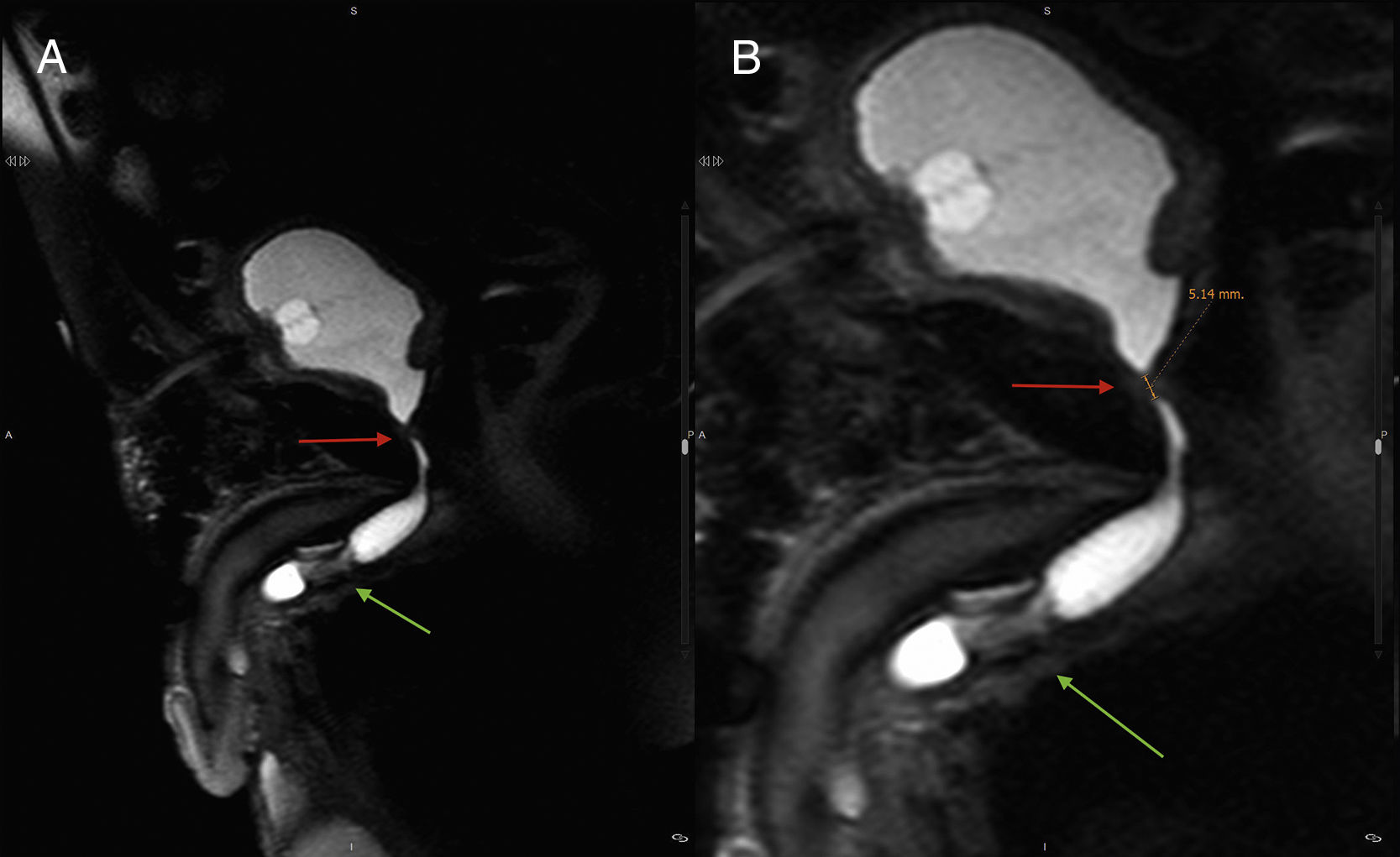
En casos de obliteración completa —aproximadamente un 20% de todas las EUV—, especialmente en aquellos en los que nos planteemos un tratamiento quirúrgico, conviene completar la evaluación con estudios de imagen transversales (tomografía computarizada o RM). Estas pruebas permitirán descartar otras complicaciones, como colecciones en el lecho quirúrgico o abscesos, y evaluar las relaciones de la vejiga con otras estructuras pelvianas (4). Asimismo, mediante RM podemos estimar la longitud del segmento estenótico o medir la distancia del muñón uretral al cuello vesical (fig. 3). Para una adecuada evaluación, es necesaria la distensión de la uretra, que se puede lograr mediante la introducción retrógrada intrauretral de suero o contraste, en ocasiones diluido en gel lubricante.
Imágenes de RM de paciente con EUV con obliteración completa, portando sonda suprapúbica. Flechas superiores horizontales: área de estenosis. Flechas inferiores oblicuas: manguito del esfínter urinario artificial. A) Imagen sagital en T2. B) Imagen sagital en T2 aumentada, con medición de longitud del segmento obliterado.
El estudio urodinámico puede ser de interés30 en varias situaciones: en casos con IU asociada7 para descartar daño esfinteriano, y cuando nos planteemos reconstrucción quirúrgica, para evaluar la capacidad vesical.
Debemos valorar siempre el antígeno prostático específico, tratando de descartar recidiva o persistencia tumoral local como etiología del crecimiento local en la AUV. Adicionalmente, el pronóstico oncológico del CaP inicial podrá comprometer el manejo de la EUV31. Otros aspectos a evaluar son el estado general del paciente, edad y posibles comorbilidades, que debemos considerar en el momento de decidir un plan terapéutico4.
Planteamientos terapéuticosEl manejo de las EUV tras PR es complejo y no está exento de efectos secundarios. El objetivo debe ser evitar la retención urinaria, recuperando un vaciado fisiológico y manteniendo la continencia32. Debido al relativamente bajo número de pacientes con esta entidad, la mayoría de la evidencia disponible se basa en series de casos3,33.
Se han publicado diferentes algoritmos de tratamiento de la EUV, basados en experiencias en centro único34,35, o tras revisiones de la literatura3,36,37. Consideran aspectos para la toma de decisiones como la IU asociada o la obliteración completa de la AUV. Con estos datos, elaboran diferentes pautas de manejos, dependiendo de los medios y las preferencias de cada centro o panel de expertos, siempre escalando desde técnicas endourológicas hasta cirugías abiertas de reconstrucción.
Retenciones precocesSe ha descrito hasta un 9% de casos de retención urinaria tras la retirada inicial de sonda tras la PR17. En este contexto, la recomendación es realizar uretro-cistoscopia y recolocación de sonda3, pudiendo requerir dilatación uretral previa. Se recomienda emplear sondas filiformes14 o dilatadores coaxiales, tratando de evitar crear falsas vías o lesionar la AUV3,17. Aunque se crea que la etiología es inflamatoria11, estas estenosis precoces —aparecen en las primeras 8 semanas— o también denominadas «inmaduras», recidivaron en casi el 100% de los casos pese a las dilataciones iniciales. Para su resolución posterior precisaron incisiones endoscópicas o dilataciones periódicas14,17.
Dilataciones y autocateterismosEl peldaño inicial en el tratamiento de las EUV son las técnicas endourológicas34. Las más sencillas son las dilataciones, pudiendo realizarse mediante balones neumáticos15,38, catéteres uretrales de calibres graduales14 o sondas metálicas12. La dilatación aislada de la EUV presenta un porcentaje de resolución muy escaso (11%)11,14, aunque presenta la ventaja de un bajo riesgo de empeoramiento de la continencia urinaria. Esto ha limitado su uso como primer intento, con finalidad diagnóstica y terapéutica, o a su aplicación en pacientes no candidatos a otro tipo de tratamientos —endourológicos o abiertos—, ya sea por deseo del paciente, estado general o comorbilidades6. Por el contrario, las dilataciones periódicas —realizadas en consulta bajo anestesia local— complementadas con protocolos de autocateterismos por parte del paciente son efectivas en un 73-92%5. Estos autocateterismos conllevan la posibilidad de complicaciones, como sepsis, uretrorragia, osteítis del pubis tras instrumentaciones traumáticas. En algunas ocasiones resultan imposibles de realizar dadas las características de la uretra o la falta de destreza del paciente.
Uretrotomía internaLa uretrotomía interna bajo visión directa (DVUI) clásica —empleando corte frío— es otra opción segura de tratamiento cuando la EUV está permeable, asociando bajo riesgo de provocar IU de novo18. Resuelve la estenosis solo en entre un 37 y un 50% de casos7,11,12,14, pero estos porcentajes mejoran si se complementa la DVIU con regímenes de dilataciones posteriores14. En pacientes en los que la EUV lleve asociada IU de esfuerzo, la DVUI aislada puede solucionar ambos problemas en hasta un 28% de casos, mientras que el 70% de los pacientes precisará la colocación de cabestrillo suburetral o esfínter urinario artificial (AUS) tras resolver la EUV7. Los pacientes tratados mediante DVIU deben ser adecuadamente informados de los riesgos relativos al agravamiento de la IU tras la intervención. En pacientes con IU ya tratada con un AUS, puede ser precisa la apertura del manguito periuretral para poder realizar la DVUI sobre la EUV39. Esta práctica se considera segura para el dispositivo, incluso repitiendo la DVUI, con una nueva apertura del manguito del AUS. Otro planteamiento consiste en asociar DVIU durante la IQ de recambio del AUS o del manguito, en casos de disfunción del dispositivo40. En caso de tener disponibilidad, pueden emplearse resectoscopios pediátricos o ureterorrenoscopios para evitar la apertura del manguito durante el tratamiento de las EUV41,42. En casos de obliteración completa de la AUV, existe cierto consenso en no recomendar abordajes endourológicos por sus riesgos34. No obstante, ciertos grupos intentan un «corte hacia la luz» o el paso de la zona cicatricial con guías rígidas, seguido de un régimen de autocateterismos o colocación de stents uretrales42, con resultados positivos en menos de la mitad de los casos.
Incisión con asa de CollinsLa incisión transuretral con asa de Collins y energía monopolar como tratamiento aislado de la EUV no suele recomendarse, debido al elevado (hasta 75%) riesgo de desarrollar IU de novo tras el procedimiento11,14, por lo que la mayoría de los autores la desaconsejan de manera aislada. Ciertos grupos reportan buenos resultados combinando esta incisión con la colocación, en el mismo tiempo quirúrgico, de un AUS40,42.
Resección transuretralLa resección transuretral (RTU) de la zona de estenosis representa una opción terapéutica con mayor porcentaje de éxitos en manos expertas12. Suele requerir una resección amplia de todo el tejido hipertrófico y fibrótico, asociándose en ciertos casos con la retirada de cuerpos extraños presentes a nivel de la EUV, como clips de polímero o metálicos29. Estas RTU precisan en ocasiones ser repetidas —especialmente en casos con RT asociada—, lo que aumenta el riesgo de complicaciones, que pueden ser potencialmente severas, como la osteítis del pubis o la lesión rectal.
Vaporización láser/bipolarSe han empleado láseres para esta resección: Ho-YAG (holmium:yttrium aluminum garnet)43,44, pero, incluso en combinación con la inyección perioperatoria de sustancias, no han conseguido mejorar los resultados obtenidos con el asa convencional43. Más recientemente, se ha usado la vaporización plasmacinética con energía bipolar, obteniendo, en una serie corta de casos, resultados satisfactorios37.
Inyección de sustancias antiproliferativasTras la incisión, resección o vaporización del tejido fibrótico presente en la EUV, se ha planteado la inyección local de sustancias con actividad antiproliferativa, con la intención de reducir el crecimiento hipertrófico del tejido y permitir una reepitelización adecuada que mantenga la permeabilidad. Los primeros intentos se realizaron aplicando diferentes concentraciones de triamcinolona34. Series más contemporáneas han empleado mitomicina C (MMC), inyectada localmente después de una DVIU en un subgrupo de pacientes con EUV recidivada tras incisiones previas. Con la asociación de MMC, consiguen una resolución duradera en un 72% de los pacientes32, con una ausencia de efectos negativos sobre la continencia y sin aumentar las complicaciones durante el implante futuro de un AUS32. Este porcentaje de éxito se ha repetido en otras series —de seguimiento medio y corto— en las que se asocia la DVUI e inyección de MMC, con un mes de cateterismo intermitente limpio (CIL)45.
Implante de stents uretralesLa colocación de stents uretrales de manera permanente UroLume® (American Medical Systems, Minnetonka, Minnesota, USA) para mantener la permeabilidad en casos de EUV obtuvo solo un 50% de éxito. Por el contrario, la mitad de casos desarrollaron IU de novo tras la inserción del stent35,41. Se ha descrito la colocación de un segundo stent en casos refractarios tras un primer implante, siendo necesaria la colocación de un AUS en estos casos. El uso del stent en este contexto de EUV ha caído en desuso, ya que la mayoría de casos con recidiva termina requiriendo algún tipo de derivación suprapúbica46.
EndouretroplastiasUn abordaje innovador fue la realización de endouretroplastias, empleando injertos mallados de piel —prepucial o braquial— tras la resección del área estenótica, en un intento de asegurar la adecuada reepitelización. Esta técnica, compleja técnicamente, se ha realizado en pocos casos, con éxito escaso, inferior al 55%47.
Reanastomosis mediante cirugía abiertaEn casos refractarios a múltiples intentos de manejo endoscópicos, o en pacientes con obstrucción completa de la AUV, debemos plantear un tratamiento quirúrgico más agresivo, intentando realizar una nueva anastomosis uretrovesical. Se han descrito abordajes por vía perineal48,49, abdominal, transpúbica o mixta2,3,10,30,31,34,35,50. Globalmente, estas reparaciones logran una AUV no obstructiva en un porcentaje elevado, que alcanza el 92% a largo plazo en algunas series30.
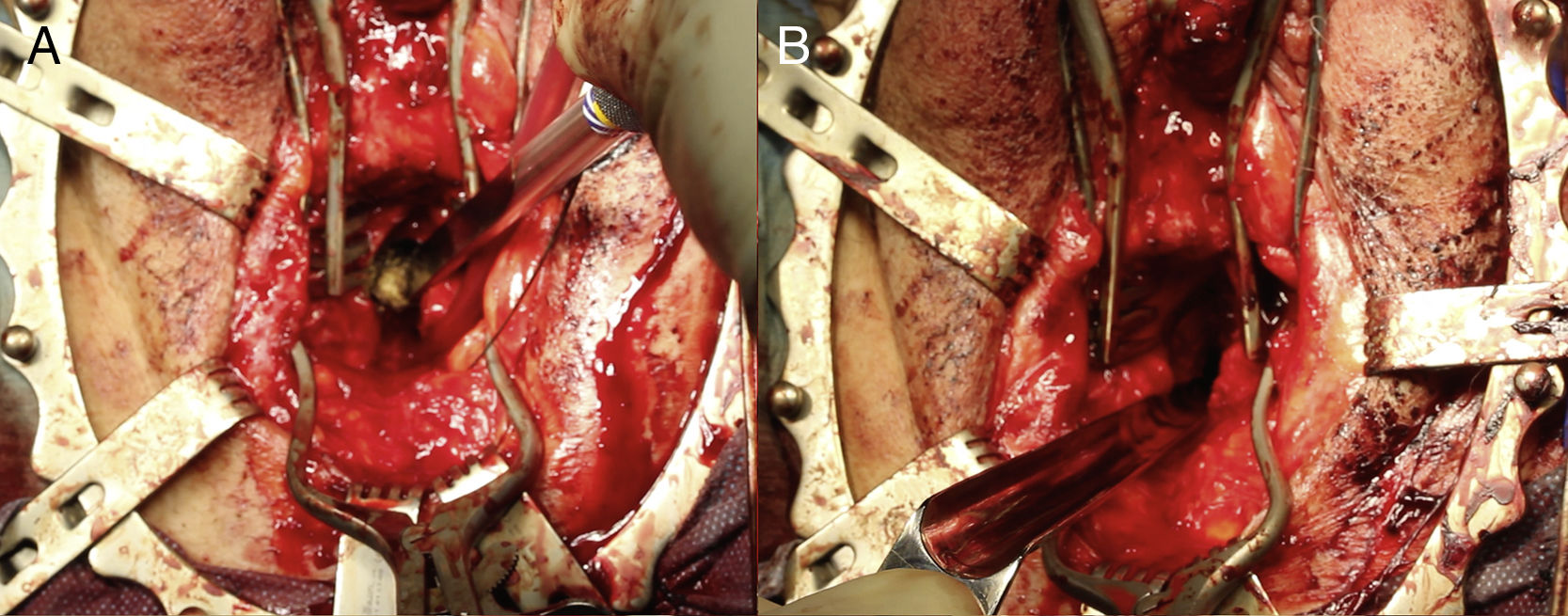
En la reanastomosis perineal, se realiza una disección profunda y se libera el tendón central del periné, seccionando la uretra en el lugar de la estenosis. Para identificar el cuello vesical se emplean sondas o cistoscopios insertados anterógradamente2,49. Para garantizar un buen acceso al cuello vesical y una anastomosis libre de tensión, se requiere el desarrollo del plano intercrural y, en ocasiones, la realización de pubectomía parcial inferior (fig. 4). Previo a la realización de la reanastomosis, se debe realizar una escisión cuidadosa del tejido fibrótico hasta liberar el cuello vesical y exponer mucosa sana a ese nivel4. Como consecuencia directa, esta IQ ocasiona casi siempre IU de novo, que precisará la colocación de un AUS. Este implante suele realizarse de 330 a 648,49 meses más tarde, tras confirmar que la reconstrucción ha sido exitosa y dando tiempo a la uretra para revascularizarse, lo que previene complicaciones48. Sin embargo, hay grupos que plantean la colocación del AUS en el mismo tiempo quirúrgico50. La reanastomosis uretrovesical por vía perineal consigue —en pacientes y centros seleccionados— ser exitosa en un porcentaje cercano al 90% de casos2,49. En casos complejos, con RT asociada o fístulas recto-uretrales, la vía perineal permite la resolución, requiriendo, en ocasiones, reforzar el área anastomótica con un colgajo del músculo gracilis30. En aquellos casos en los que exista extensión distal de la estenosis, se ha descrito también un colgajo tubular fasciocutáneo de piel peneana31.
El abordaje abdominal para la reanastomosis uretrovesical presenta porcentajes de resolución en torno al 60%8, pudiendo ser precisa una pubectomía parcial posterior o inferior para acceder a la zona de la estenosis30. Tras la realización de la nueva AUV, se sugiere la colocación de colgajos de epiplón10, peritoneales30 o de músculo recto31 para prevenir fístulas al pubis. En pacientes con EUV sin IU, la vía abdominal consigue preservar la continencia hasta en el 64% de los pacientes, por lo que se ha indicado como la vía de elección en ese contexto8,34. Casos complejos, con necesidad de abordaje abdómino-perineal, pueden requerir pubectomía completa35, siendo esta maniobra planteada de rutina en las series iniciales31.
La selección de pacientes es crítica antes de plantear estas reparaciones, ya que en casos de escasa capacidad vesical (< 300 cc) o con hiperactividad del detrusor, los resultados funcionales no serán buenos. Estas alteraciones son frecuentes en casos de lesiones esfinterianas7 y en pacientes que han recibido RT adyuvante o de rescate4,51. El paciente debe estar motivado y entender que será un planteamiento en 2cirugías, requiriendo un AUS o cabestrillo suburetral, con las posibles complicaciones asociadas a esta nueva IQ en pacientes complejos30,31,50.
En casos que no sean buenos candidatos para estas reconstrucciones, será preciso recurrir a derivaciones urinarias suprapúbicas30,51. Si es factible, intentaremos preservar la propia vejiga, formado estomas cateterizables, y si es preciso realizando enterocistoplastia de aumento50,52. Si la vejiga no es viable, realizaremos cualquiera de las derivaciones descritas tras cistectomía radical. Una opción específica, diseñada para este contexto, es la formación de una neovejiga ileal que anastomosaremos al extremo uretral proximal sano, y posterior implante de un AUS51. Todas las previamente mencionadas son cirugías reconstructivas de alta complejidad y elevada morbilidad, que deberían ser realizadas por cirujanos experimentados en centros de referencia53.
ConclusionesLa estenosis de la AUV puede ser una complicación importante tras la PR por CaP, requiriendo múltiples tratamientos para su resolución. El conocimiento de los factores de riesgo identificados y una cuidadosa técnica quirúrgica serán eficaces para minimizar su aparición. Debemos sospecharla en casos de dificultad para el vaciado vesical y ante IU persistente tras la IQ. El diagnóstico suele ser sencillo, aunque precisará ser ampliado en obstrucciones completas y cuando nos planteemos reconstrucciones abiertas. Existe consenso sobre el beneficio de una escalera terapéutica, iniciándola con técnicas endourológicas que pueden asociarse a la inyección local de sustancias o a ciclos de CIL. Se han ensayado múltiples técnicas de incisión, resección o vaporización de la AUV, con diferencias tanto en los porcentajes de éxito de IU de novo tras la IQ. Debemos individualizar el manejo de la EUV, considerando la continencia inicial, el estado general y oncológico, y las preferencias del paciente. En casos de obstrucción completa, o refractarios a múltiples intentos endoscópicos previos, pueden requerir cirugías abiertas de reanastomosis. Estas intervenciones son complejas y deberían ser realizadas en centros de referencia. Las derivaciones urinarias suprapúbicas, con o sin cistectomía asociada, pueden ser precisas tras fracasos previos o cuando la dinámica vesical está alterada.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.