INTRODUCCIÓN
La extracción testicular de espermatozoides (TESE, del inglés TEsticular Sperm Extraction), en combinación con la inyección intracitoplásmica (ICSI, del inglés Intra-Cytoplasmic Sperm Injection) de los espermatozoides, es un método efectivo (entendiéndose por tal una tasa de embarazo del 30-40% por ciclo) para el tratamiento de las azoospermias obstructivas y no obstructivas que conserven algún grado de espermatogénesis1-6. De forma resumida, podríamos recordar que la TESE está indicada en todas las azoospermias obstructivas (agenesia deferencial, obstrucción de conductos eyaculadores, vasectomizados, azoospermia tras herniorrafia, fracaso de epididimovasostomía o vasovasostomía, etc.) y no obstructivas (azoospermia por bloqueo parcial en la espermatogénesis, etc.), necrozoospermias, alteraciones de la eyaculación y, en algunas ocasiones, oligoastenozoospermia muy severas, criptozoospermia, cuando ambas se alternan con azoospermia7,8.
La referida TESE se puede realizar intraciclo, es decir coincidiendo con el día de la punción de los ovocitos en la pareja, y es lo que denominamos TESE-ICSI con espermatozoides frescos. Sin embargo, en otras ocasiones, de lo que disponemos es tejido testicular criopreservado, que se utiliza el día de dicha punción, y es lo que denominamos TESE-ICSI con espermatozoides congelados.
El empleo de espermatozoides, para ICSI, desde TESE en fresco o desde TESE congelada ha suscitado cierto debate sobre la eficacia, en cuanto a porcentajes de fertilización y embarazo, aunque muchas investigaciones arrojan resultados similares entre ambas técnicas1,9-15.
El objetivo de este estudio es reflejar los resultados de esta técnica, en cuanto a movilidad, tasa de fertilización, tasa de gestación y tasa de aborto se refiere, en nuestro medio y comprobar si existen diferencias significativas entre usar espermatozoides frescos y usar congelados en la técnica TESE-ICSI.
MATERIAL Y MÉTODO
En el presente trabajo, se han analizado los resultados obtenidos durante el período comprendido entre 2002 y 2004 (3 años). Todos los pacientes a los que se realizó la TESE fueron previamente citados en la consulta de andrología, al menos en 2 ocasiones, donde se les realizó una completa historia clínica, que incluía antecedentes familiares y personales, historia sexual y existencia de factores tóxicos. Al mismo tiempo, fueron sometidos a examen físico general y genital, valorando especialmente el tamaño y la morfología testicular. Entre las pruebas complementarias, se solicitó un perfil hormonal completo (FSH, LH, prolactina testosterona y estradiol) y estudio seminal, consistente como mínimo en 2 seminogramas con un intervalo de 15-60 días y al menos uno de ellos con técnica Recuperación de Espermatozoides Móviles (REM). Lógicamente, se descartó las eventuales infecciones asociadas mediante cultivo seminal, detección de Chlamydia trachomatis en uretra, serología de hepatitis, sífilis y VIH. A todos los sujetos se les realizó estudio de cariotípico y de la zona AZF, excepto a los varones vasectomizados.
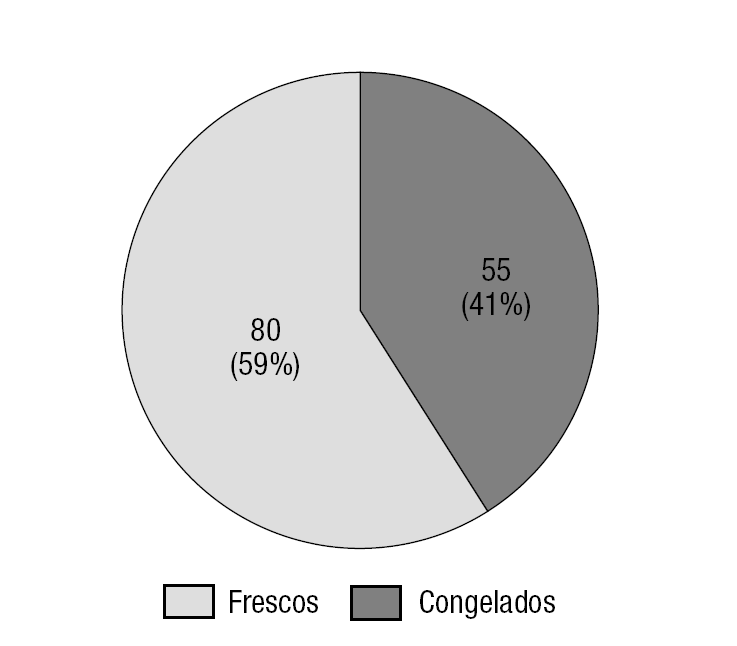
Durante el mencionado periodo de 3 años, se realizó un total de 148 TESE, y en 135 de ellas se realizó la transferencia de embriones. De estas 135 ICSI con transfer, 80 (59,3%) fueron realizadas usando espermatozoides frescos y las 55 restantes (40,7%), con espermatozoides congelados (fig. 1).
Figura 1. Número de TESE-ICSI con espermatozoides frescos y congelados.
Preparación de los espermatozoides
La TESE se realizó en el quirófano de la unidad de reproducción humana (URH) de nuestro centro, en régimen ambulatorio y con anestesia local. Se cumplió con todos los procedimientos requeridos en estos casos: consentimiento informado, valoración analítica general y monitorización de las constantes del paciente antes de la administración del anestésico mediante inyección cordonal de mepivacaína al 1%. Pasados unos 5 min, se procedió a incisión cutánea de aproximadamente 1 cm en el rafe medio escrotal y se accedió al testículo a través de la túnica vaginal. Posteriormente, se realizaron una o más incisiones en la albugínea de unos 0,3-0,5 cm en el polo superior del testículo en aparentes mejores condiciones, para obtener pulpa testicular tras extrusión. Dicho tejido se colocó en un medio de lavado (Medicult, Dinamarca) y fue disecado con la ayuda de 2 escalpelos estériles. El líquido contenido en la placa fue aspirado usando una pipeta automática y se procedió a su incubación a 37 oC al 5% de CO2. Justo antes del proceso de microinyección, el contenedor del líquido fue centrifugado a 600 g durante 5 min16.
Criopreservación, descongelado y preparación de espermatozoides16
Antes del congelado, 1 ml del medio crioprotector Test Yolk buffer, que contiene glicerol (Irvine Scientific, Santa Ana, CA), fue añadido a 2 ml de suspensión espermática a temperatura ambiente. La mezcla fue homogeneizada y colocada en un baño a 4 oC durante 45 min. Posteriormente la mezcla fue nuevamente homogeneizada y colocada con la ayuda de una pipeta automática en gotas de 100 µl sobre una superficie de hielo seco (Nagase, 1964). El congelado de las gotas se produce en aproximadamente 1 min. Las gotas congeladas (pastillas) fueron sumergidas en nitrógeno líquido (196 oC) y almacenadas en viales criotubo de 1 o 2 ml (Lab-Tek, Nalge Nunc International).
Para la descongelación, las pastillas fueron sacadas del nitrógeno líquido y colocadas en un tubo de Falcon de 5 ml (Beckton and Dickinson, Lincoln Park, NJ) durante 5 min a temperatura ambiente. El tubo con las pastillas fue colocado entonces a 37 oC en una cámara al 5% de CO2 durante 15 min. Para eliminar el medio de criopreservación, las muestras fueron lavadas mediante centrifugación con 2 ml de medio IVF (Medicult, Copenhagen, Dinamarca) a 600 g durante 5 min. Una vez que el sobrenadante fue eliminado, el sedimento (pellet) fue resuspendido en 100 µl de medio IVF. Esta suspensión final fue incubada a 37 oC y 5% de CO2 durante 1 h. A partir de entonces, la presencia de espermatozoides morfológicamente normales para ICSI fue comprobado bajo un microscopio invertido con una magnificación x100 (Diaphot; Nikon Corporation, Tokio, Japan). En algunos casos, encontramos únicamente espermatozoides inmóviles morfológicamente normales.
Estimulación ovárica y obtención de ovocitos16
La supresión hipofisaria se consiguió usando un protocolo largo con un análogo de la GnRH (Decapeptyl; Ipsen, Barcelona, España), seguido de estimulación con FSH recombinante (Gonal; Serono Laboratories, Madrid, España). La punción folicular transvaginal ecodirigida se llevó a cabo a las 36-38 h tras la inyección de HCG. Las células del cumulus-corona fueron inicialmente retiradas mediante un medio de lavado (Medicult, Copenhagen, Dinamarca) y 80 UI/ml de hialurodinasa (Hialurodinasa tipoIV-S, St Louis, MO) durante 1 min. Tras retirar las células de la corona, sólo los ovocitos en metafase II fueron inyectados.
Análisis estadístico
Los test estadísticos fueron llevados a cabo mediante la prueba de la χ2 para enfrentar las tasas de fertilización, gestación y aborto al origen de los espermatozoides (muestra fresca o criopreservada). Las diferencias fueron consideradas estadísticamente significativas si p < 0,05.
RESULTADOS
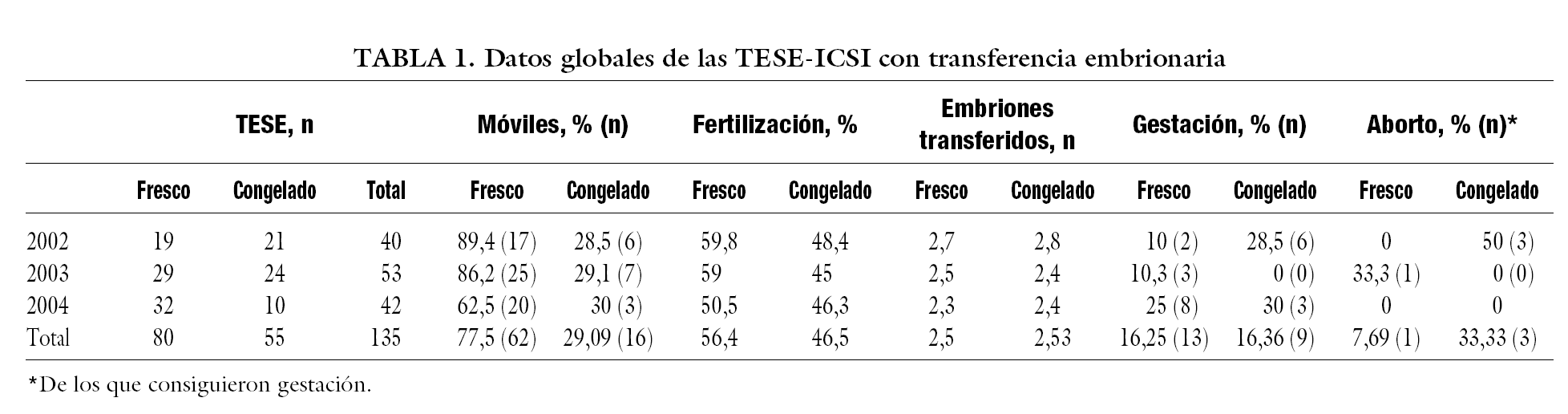
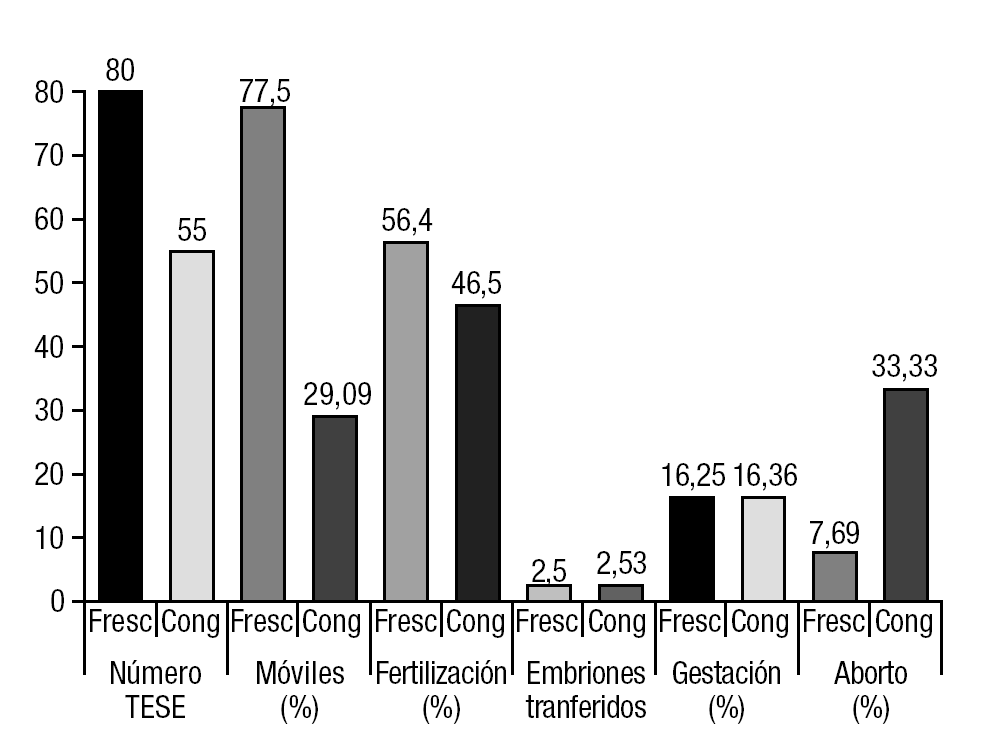
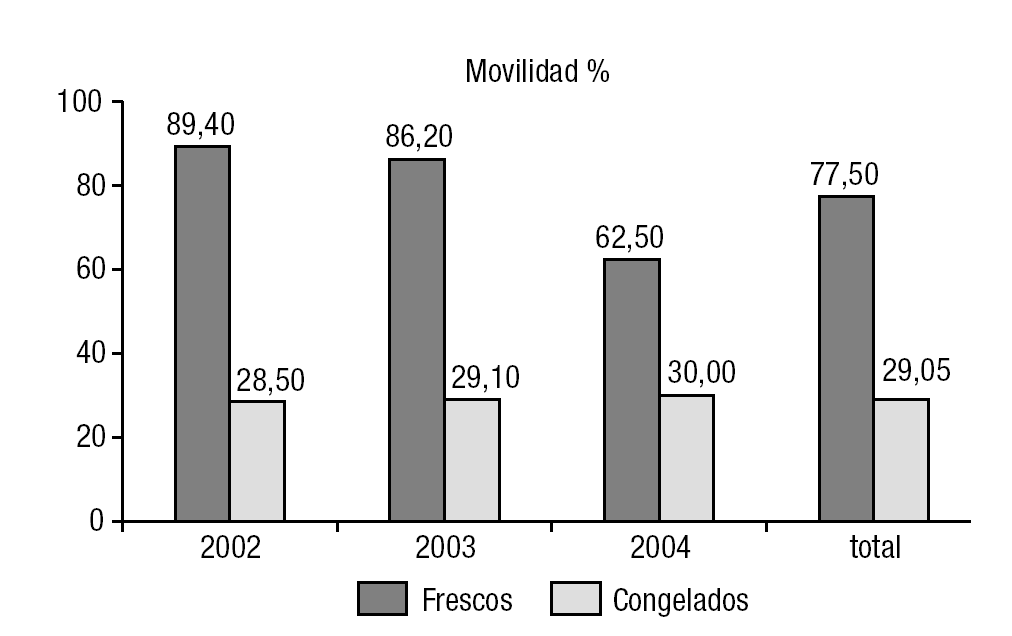
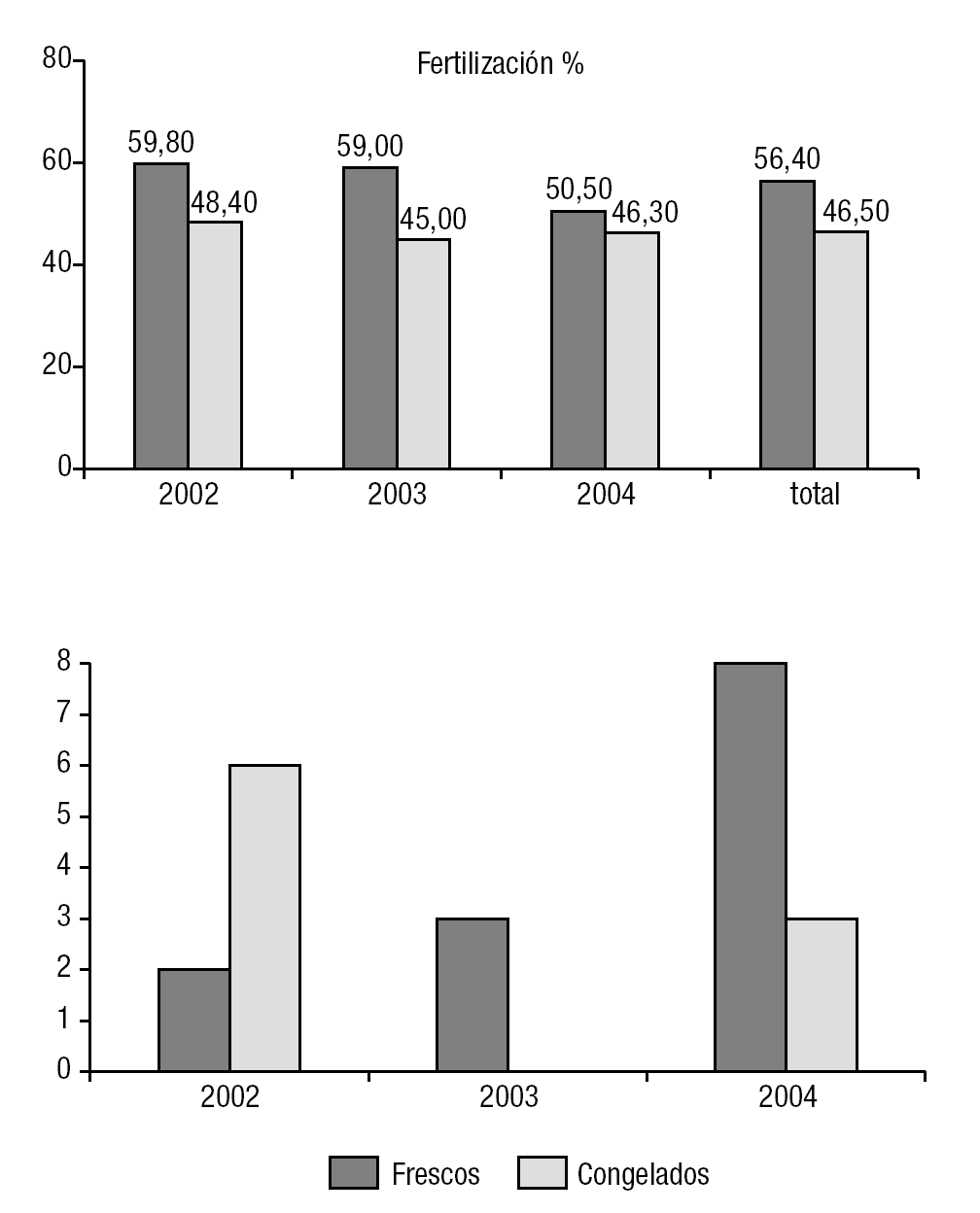
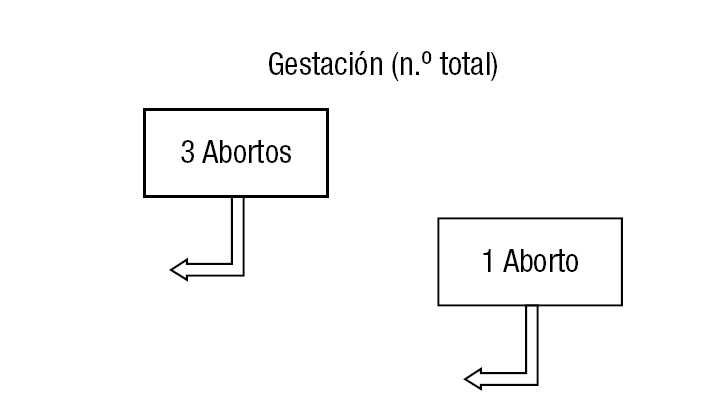
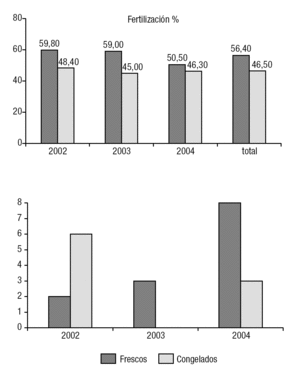
De las 148 TESE realizadas, se realizó transferencia embrionaria en 135 (91,2%); de las que no se pudo transerir, fue por fallos de fertilización en 12 casos (6 en frescos y 6 en congelados) y porque no se obtuvo ovocitos en 1 caso (fresco) En la tabla 1 se reflejan todos los datos obtenidos en los años analizados, así como los resultados totales, y en la figura 2 se muestra la representación gráfica. De las 135 TESE-ICSI con transferencia embrionaria realizadas, como dijimos anteriormente, 80 (59,3%) fueron con espermatozoides frescos, frente a 55 (40,7%) que se hizo con espermatozoides congelados (fig. 1). Del total de las muestras frescas, 62 (77,5%) presentaban una movilidad espermática de ++/++, frente a 16 (29%) de las que fueron criopreservadas (fig. 3). Estas diferencias en la movilidad fueron estadísticamente significativas (p < 0,01). La tasa media de fertilización en el grupo de espermatozoides frescos fue de un 56,4% (el 59,8, el 59 y el 50,5 en 2002, 2003 y 2004 respectivamente) y en el grupo de congeladas fue del 46,5% (el 48,4, el 45 y el 46,3 en 2002, 2003 y 2004 respectivamente) (fig. 4). El número medio de embriones transferidos fue de 2,5 en ambos grupos. Al hablar de tasas de gestación, los resultados obtenidos fueron el 16,25% (13/80) del grupo de espermatozoides frescos y del 16,36% (9/55) del de muestras congeladas. Uno de los embarazos en las mujeres inseminadas con espermatozoides frescos fue gemelar (año 2002). Sólo una de las pacientes en las que se consiguió embarazo con espermatozoides frescos sufrió aborto (el 7,69% de las gestantes; 1/13). En el grupo de embarazadas con espermatozoides congelados 3 pacientes abortaron (el 33,3% de las gestantes en este grupo; 3/9), aunque de aborto propiamente dicho solo hubo 1 caso, ya que en los otros 2 se trató de embarazos ectópicos, aunque se los haya incluido como abortos (fig. 5). Las diferencias obtenidas en los parámetros fertilización, gestación y aborto entre ambos grupos son independientes de que haya o no habido congelación, es decir no se encontró significación estadística. Sin embargo, en lo concerniente a la tasa de abortos, sería necesario aumentar el tamaño de la muestra y su comparación con otros grupos para considerar fiable dicha independencia en nuestro medio.
Figura 2. Representación gráfica de los resultados generales. Fresc: fresco; cong: congelado.
Figura 3. Tasa de movilidad por año y total.
Figura 4. Tasa de fertilidad por año y total.
Figura 5. Número de gestaciones y abortos por año.
DISCUSIÓN Y CONCLUSIONES
La mayoría de la parejas que deseen tener hijos en las que el varón presente azoospermia y posea espermatozoides viables en el testículo pueden ser tratadas con TESE e ICSI. No obstante y en muchas ocasiones, dicha técnica no puede ser realizada con espermatozoides frescos, ya que o no se conoce si realmente el paciente posee espermatozoides viables en su testículo (en las biopsias que sean diagnósticas) o no se encuentra una cantidad adecuada o de suficiente calidad para que se pueda usarlos en fresco. No obstante, muchas parejas son reacias a la donación de ovocitos o el uso de semen de donante en el caso de que, tras haber estimulado hormonalmente a la mujer, no se obtenga espermatozoides. Razón por la cual, en casos de "riesgo", se demanda una "prueba" en forma de biopsia diagnóstica, tanto para estudio anatomopatológico como para criopreservación de espermatozoides. Una criopreservación exitosa permite a las parejas tomar una decisión más tranquila y con la seguridad de saber que disponen de una nueva oportunidad para la obtención de espermatozoides. Asimismo evitamos, en muchas ocasiones, la repetición de biopsias testiculares y los efectos colaterales que éstas conllevan.
En nuestro estudio, y como cabría esperar, observamos que existe una diferencia significativa en la movilidad de los espermatozoides, según se trate de espermatozoides frescos o congelados, a favor de los primeros. Sin embargo, tal y como observamos en las tasas de fertilización y gestación, esta diferencia en la movilidad no se refleja posteriormente en los resultados finales, es decir, las diferencias observadas no tienen significación estadística. Ello indica que, a no ser que el número de espermatozoides móviles obtenidos en la biopsia testicular sea limitante, estas diferencias no van a impactar en los resultados de los ciclos de TESE/ICSI con espermatozoides testiculares congelados. Esto es un dato que consideramos importante, ya que informando y aconsejando a las parejas en tratamiento de fertilidad, según dichos resultados, éstas tendrán más facilidad a la hora de tomar una decisión y de no sentirse "presionados" a donar ovocitos o aceptar semen de donante por miedo a que los espermatozoides congelados sean de peor calidad o de obtener con éstos peores resultados.
Tomando los valores referidos a los abortos, vemos que de forma global éstos son más frecuentes con la utilización de espermatozoides congelados; sin embargo, cuando se realizó el análisis estadístico se evidenció que dicha diferencia no era significativa, aunque se precisaría de un mayor tamaño muestral para asegurar, con el grado de significación establecido, la independencia de las variables fresco/congelado con aborto. En cuanto a la mayor frecuencia de abortos en el grupo de espermatozoides congelados, cabría comentar que hay estudios en que se demuestra que la incubación de espermatozoides testiculares tras su descongelación resulta en un aumento en el nivel de fragmentación de ADN directamente proporcional al tiempo y la temperatura de incubación17. Esta susceptibilidad de los espermatozoides testiculares estaría relacionada con el hecho de que la cromatina de espermatozoides testiculares todavía no está compactada con puentes disulfuro y, por lo tanto, es más vulnerable al daño de ADN. Esto podría explicar, al menos en parte, la mayor tasa de aborto observada en el grupo en que se utilizó espermatozoides congelados. Respecto a esto también hay que comentar que se incluyó como abortos 2 embarazos ectópicos obtenidos en el primer año del período analizado, casos que probablemente se debieran a defectos técnicos.
Estos resultados nos sirven para evidenciar que en nuestro medio no existen prácticamente diferencias en la utilización de espermatozoides frescos o congelados ya que, como hemos expuesto, las tasas de éxito mediante una u otra técnica son similares. Aunque la motilidad espermática está claramente volcada a favor de las muestras frescas, esto no se refleja en los datos finales de gestación que, realmente, son los que interesan a la hora de valorar la eficacia de una u otra técnica. Aún faltan datos para demostrar si la congelación predispone o no a un mayor número de abortos, aunque esperaremos a ulteriores análisis para validar los resultados.
Correspondencia: Sergio Fumero Arteaga.
Servicio de Urología. Unidad de Andrología. Hospital Universitario de Canarias.
Ofra, s/n. 38320 La Laguna. Santa Cruz de Tenerife. España.
Correo electrónico: sergiofumero@hotmail.com