INTRODUCCIÓN
En los últimos años está quedando bien definido cómo tendría que ser un laboratorio de reproducción asistida (RA) ideal. Sin embargo, no todos los centros tienen la posibilidad de disponer de los recursos necesarios de espacio, económicos o de personal para alcanzar este objetivo.
Actualmente, las necesidades de un laboratorio de RA no son las mismas que en el momento de su diseño, ya que hasta hace pocos años éstos se concebían de la misma manera que un laboratorio general. Al proyectar un laboratorio de RA hay que tener en cuenta que sus modelos organizativos no son los mismos que los de un laboratorio convencional, ya que, por múltiples motivos, no tienen el mismo patrón de trabajo. Por ejemplo, tanto los protocolos como los métodos de trabajo, aun siendo fijos, se someten constantemente a revisión. En el caso de un laboratorio de RA, el personal debe estar altamente cualificado, por lo que necesita un largo período de aprendizaje. Por estos motivos, entre otros, hay que ser muy cuidadosos con los controles de todos los equipos y protocolos, y mantener un estricto cuidado de todos los materiales y medios de cultivo utilizados, así como una continua formación del personal.
El objetivo de este artículo es aportar nuestra experiencia a aquellos laboratorios de RA que, por un motivo u otro, no tienen a su alcance los recursos humanos o materiales necesarios para mejorar sus resultados de forma significativa. El fin último es mejorar la eficiencia del laboratorio en particular y la unidad de RA en general.
Los laboratorios "pequeños", ya sea por un reducido volumen de trabajo o por motivos puramente físicos, se encuentran a menudo con el problema de no poder incorporar nuevos equipamientos que les permitan situarse a la altura, en cuanto a resultados se refiere, de laboratorios mayores. Esto es así porque muchos laboratorios dependen todavía, tanto económicamente como en cuestiones de espacio, de un "laboratorio general". Una posible solución a este problema es incorporar a los equipos ya existentes pequeñas modificaciones y otros aparatos que mejoren su rendimiento, incrementar los controles de calidad y, sobre todo, no olvidar nunca que un embrión necesita un ambiente lo más parecido posible al seno materno.
A efecto de clasificar los cambios que se pueden aplicar a la unidad de RA, los agruparemos en 3 bloques:
INCORPORACIÓN DE EQUIPAMIENTO SUPLEMENTARIO
Cámaras de flujo y placas calefactoras
Por varios motivos, los laboratorios de reproducción trabajamos con diferentes tipos de cámaras de flujo laminar. Así, por ejemplo, existen en el mercado las Telstar micro H, AH-100, SBH-100, K-Systems, etc. La mayoría de estas cabinas de flujo carece de zonas termostatizadas de trabajo, lo que nos lleva a trabajar a temperaturas más bajas de lo deseable, cuando está demostrado que una correcta temperatura de trabajo es fundamental tanto para la buena evolución del ovocito como para su posterior fertilización y desarrollo embrionario. En el caso de que no se pueda disponer de una cámara de flujo con la superficie de trabajo atemperada, existe la posibilidad de incorporar pequeñas placas calefactoras, tanto en el interior de las cabinas como en las lupas; es interesante incorporar este tipo de placas también en los microscopios invertidos del laboratorio, y no sólo en el interior de las cabinas. Esto soluciona, en gran medida, el problema de la temperatura de trabajo, todo ello sin dejar de recalcar que lo mejor sería una cabina con zonas termostatizadas incorporadas para evitar tener aparatos dentro de las cabinas de flujo laminar.
Filtros
Los compuestos orgánicos volátiles (COV), de los que hablaremos más adelante, tienen un efecto negativo sobre el desarrollo embrionario. Para minimizar su concentración en el aire del laboratorio podemos utilizar torres CODA (CODA XTTM Mod GXTU-042
Incubadores
Es fundamental, para el buen desarrollo embrionario, mantener a una temperatura y un pH estables todos los ovocitos y embriones, tanto aquellos que estamos manipulando como los que estamos incubando. Para reducir al mínimo el número de veces que se abren los incubadores, podemos incorporar, aparte de las estufas de las que ya disponemos para incubar, otras, de menor tamaño y económicamente más asequibles, para utilizar como estufas de working, es decir, donde colocaremos los ovocitos o embriones con los que estamos trabajando en el momento (p. ej., los ovocitos que estamos denudando, identificando, etc.). De esta manera evitaremos abrir en exceso las estufas en las que estamos incubando óvulos o embriones, para mantener un ambiente mucho más estable.
CONTROL DE LAS CONDICIONES DE TRABAJO
Temperatura
Evidentemente, la temperatura tiene una importancia capital en un laboratorio de fecundación in vitro. La manera de tenerla controlada es mediante el uso de termómetros. Pueden incorporarse en el interior de la nevera, a fin de controlar que la temperatura sea la idónea para mantener en perfecto estado los medios de cultivo. Es esencial que las placas calefactoras estén a la temperatura deseada, ya que no siempre la temperatura que marcan los displays es la real de la placa. No hay que olvidar que la temperatura de 37 °C es la que tiene que llegar al óvulo o embrión, con lo que la temperatura de la placa debe ser superior. Podemos utilizar pequeños termómetros de superficie (Model 315c-DUAL-Magnet Surface Thermometer-PTC Instruments, Los Ángeles, Estados Unidos), que se colocan sobre todas las superficies planas y termostatizadas del laboratorio. Todas las temperaturas deben controlarse y registrarse diariamente.
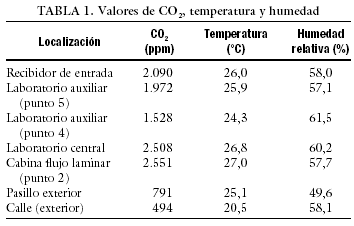
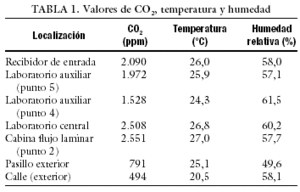
Para comprobar que en el interior de los incubadores no hay fluctuaciones de temperatura, es conveniente hacer mediciones a intervalos regulares. Esto hace inviable la utilización de termómetros convencionales, ya que cada vez que se abriese el incubador modificaríamos su temperatura. Para evitar este problema, existen sondas que toman automáticamente la temperatura a los intervalos de tiempo deseados. Con estas mismas sondas se pueden hacer también mediciones de CO2 (InControl 1050, Labotect). Paralelamente, se realizaron mediciones ambientales de CO2 con un equipo de lectura directa aq-5001 de Metrosonics con detector de infrarrojos, que permitió simultáneamente el registro de la temperatura y de la humedad relativa. Los resultados se presentan en la tabla 1.
Compuestos orgánicos volátiles
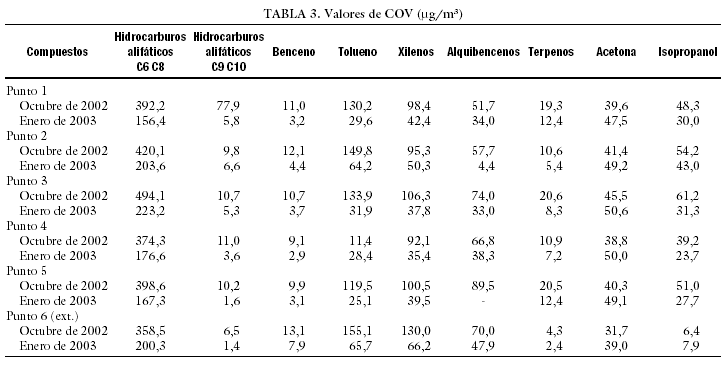
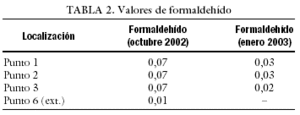
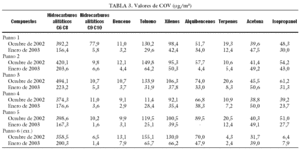
Como ya hemos comentado, valores elevados de COV influyen negativamente en el desarrollo embrionario. Para reducirlos, además de la instalación de las torres CODA, se pueden llevar a cabo cambios en nuestra forma de trabajo, a fin de reducir la generación de estos compuestos en el interior del laboratorio. Hay que intentar manipular la mínima cantidad de papel cerca de las cabinas de flujo y evitar la utilización de bolígrafos y rotuladores que despidan este tipo de compuestos. ¿Cómo saber si estos cambios disminuyen de forma efectiva la concentración de COV? Para ello se realizó un estudio que consistía en la determinación de los valores de COV, incluido el formaldehído, antes y después de poner en funcionamiento una torre CODA. Se tomaron 19 muestras de aire en 7 puntos diferentes, 5 en el interior del laboratorio, una en el exterior (aunque dentro del edificio) y una última de aire exterior. Las muestras tomadas se analizaron por espectrometría UV-Vis, las de formaldehído, y por cromatografía de gases, siguiendo el método analítico del INSHT MTAS/MA-032/A98, las de COV. Los resultados obtenidos a lo largo del estudio se presentan en las tablas 2-4. Cualitativamente, los COV hallados son los correspondientes a un aire no contaminado, y se identificaron principalmente hidrocarburos alifáticos, hidrocarburos aromáticos, terpenos, acetona e isopropanol. El estudio, tras la instalación de la torre CODA, reveló una disminución en los COV de entre un 50 y un 60%, lo que confirma la utilidad de este tipo de torres.
Controles microbiológicos
Es bien sabido que, en el interior de un laboratorio de reproducción asistida, es necesario tomar ciertas medidas de asepsia, como son la utilización de calzado especial o, en su defecto, polainas, mascarillas, gorros, uniformes exclusivos del laboratorio, etc. Estas medidas preventivas de higiene deben traducirse en una disminución de la concentración de microorganismos, lo que, a la larga, será un factor más que repercutirá en la mejora de la calidad embrionaria. Para asegurarnos de que estas medidas son las correctas, se puede realizar un control microbiológico mensual, tanto de superficie como ambiental, a través de laboratorios especializados. Es muy conveniente también llevar a cabo una desinfección del aire acondicionado al menos 2 veces al año.
Revisiones periódicas
Es más importante de lo que parece realizar revisiones periódicas, también por empresas especializadas, de todos los aparatos del laboratorio. Como mínimo deben hacerse 2 revisiones anuales de los incubadores, cámaras de flujo laminar y congelador de embriones.
Iluminación
Hasta hace poco, al construir cualquier laboratorio, se colocaban luces fluorescentes para su correcta iluminación. Ahora bien, al trabajar con ovocitos y/o embriones, esta luz puede influir negativamente en su desarrollo. Una solución es instalar guías de luz halógena con regulador. Con este pequeño cambio, que no tiene un coste excesivo ni precisa obras mayores, logramos disminuir la luz directa que incide sobre los ovocitos o embriones.
METODOLOGÍA DE TRABAJO
Hay otros factores que influyen enormemente en el éxito de una fecundación in vitro. Estos factores están referidos al momento estricto en el que estamos manipulando ovocitos o embriones. Hay que minimizar el tiempo que éstos están fuera del incubador, cubrir las placas con el máximo volumen posible de aceite mineral, trabajar con el semen en una cámara diferente a la de los ovocitos/embriones, seleccionar cuidadosamente los embriones a transferir y, si es posible, realizar la transferencia bajo control ecográfico, etc. En los últimos meses, en nuestro centro se están aplicando con éxito terapias de relajación dirigidas al momento de la transferencia embrionaria.
COMENTARIO FINAL
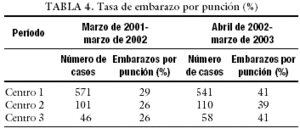
Tal como hemos expuesto, el establecimiento de las condiciones óptimas de trabajo es una tarea ardua y complicada que no podemos pasar por alto, pero que nos debe servir para ir avanzando en el buen desarrollo profesional del embriólogo a la hora de valorar la calidad embrionaria y la fertilización de ovocitos, así como para asegurar la estabilidad y el buen funcionamiento de todos los componentes del laboratorio, para así obtener gradualmente mayores porcentajes de embarazo, que es lo que, en definitiva, nos piden los pacientes.
La mayoría de los cambios a los que nos referimos a lo largo del trabajo se han realizado simultáneamente en 3 laboratorios diferentes.
Bibliografía general
ACGIH Committee On Bioaerosols. Guidelines for Assessments of Bioaerosols in the Indoor Environment. American Conference of Governmental Hygienists, Cincinnati, 1989.
Almeida PA, Bolton VN. The effect of temperature fluctuations on the cytoskeletal organization and chromosomal constitution of the human oocyte. Zygote 1995;3:357.
American Conference of Governmental Hygienists (ACGIH). Documentation of the thushold limit values and biological exposure indices, 5th ed. ACGIH, Cincinnati, 1986.
ASHRAE Standard 62-1989. Ventilation for acceptable indoor air quality. Atlanta: American Society of Heating, Refrigerating and Air Conditioning, Engineers, 1989.
Berenguer MJ. El síndrome del edificio enfermo: metodología para su evaluación. Barcelona: INSHT, 1993.
Boone WR, Johnson JE, Locke AJ, Crane MM, Price TM. Control of air quality in an assisted reproductive technology laboratory. Fertil Steril 1999;71:150.
Burge HA, Hoyer ME. Indoor air quality. Appl Occup Environ Hyg 1990;5:84-93.
Hudak A, Ungvary G. Embryotoxic effects of benzene and its methyl derivatives: toluene, xylene, Toxicology 1978;11:55.
Human Confort and Indoor Air Quality. Heating/Piping/Air Conditioning, 1990; p. 43-52.
Indoor Air Quality Investigations in Office Building. Industrial Hygiene News Report 1986;29(11).
International Labour Office. Encyclopaedia of occupational health and safety. 3th ed. Geneva: OIT, 1988.
Miró J. Evaluación de la creatividad y diseño de la plantilla. En: Fuentes X, editor. Dirección técnica y económica de laboratorios clínicos. Barcelona: IUPAC, 1999; p. 33-8.
Morris RH. Indoor air pollution: airborne viruses and bacteria. Heating/Piping/Air Conditioning, 1986; p. 59-86.
Noda Y, Goto Y, Umaoka Y, Shiotani M, Mori T. Culture of human embryos in alpha modification of eagle's medium under low oxygen tension and low illumination. Fertil Steril 1994;62: 1020.
Rousselin X, Falcy M. Le nez, les produits chimiques et la sécuri té. Cahiers de Notes Documentaires. N.o 124. Paris: INRS, 1986.
Textos Legales del Ministerio de Trabajo. Ordenanza General de Seguridad e Higiene en el Trabajo. Artículo 30. Madrid: Ministerio de Trabajo, 1971.