INTRODUCCIÓN
Desde el momento en que una pareja decide tener descendencia, la mayoría logra concebir durante el primer año, mientras que el 15% no lo consigue. Este porcentaje, aunque bajo, es significativo por su importancia asistencial y las maniobras en técnicas en reproducción asistida (TRA) que conlleva. De este 15%, interpretado globalmente, el factor masculino exclusivamente representa un 20%, mientras que estarían implicados ambos factores (masculino y femenino) en un 20-30% de ocasiones. Esto supone que hasta en un 50% de las parejas la causa de sus problemas reproductivos se encuentra en el varón. Cuando se analiza el factor masculino, se observa que hasta un 55% presenta alteraciones seminales, que cuando son graves se relacionan con microdeleciones del brazo largo del cromosoma Y, en un porcentaje entre un 10 y un 15%1-6.
Los genes relacionados con la fertilidad masculina se localizan en el brazo largo del cromosoma Y (Yq 11), en la denominada azoospermic zone factor (AZF). En ésta se localizan 3 intervalos bien diferenciados: AZFa, AZFb y AZFc, así como una cuarta región denominada AZFd, localizada entre AZFb y AZFc. Cada una de estas zonas presenta diferentes genes candidatos que intervienen en la esterilidad masculina7,8:
AZFa: DFFRY (Drosophila Fat Facets Related Y)
DBY (Dead Box Polipeptid Y)
AZFb: RBMY (RNA Binding Motif)
AZFc: DAZ (Deleted in azoospermia)
No hay correlación estricta entre la deleción y el fenotipo histológico en la biopsia testicular. Sin embargo, en la mayoría de los estudios se ha observado que la presencia de deleciones AZFa y AZFb proximales se relaciona con graves defectos en la espermatogénesis (síndrome de sólo células de Sertoli), mientras que deleciones de AZFb distal y AZFc tienen diferentes grados de fallo en la espermatogénesis9,10.
Por último, si bien la incidencia total en la población de varones estériles o infértiles de estas deleciones es baja, su importancia radica en que, en el caso de que exista algún grado de espermatogénesis y, por tanto, se consigan espermatozoides para ICSI (intracitoplasmatic sperm injection), esta alteración genética y seminal se transmitirá a los descendientes varones, de ahí que sea mandatario realizar estudios de zona AZF en todos los varones oligoastenozoospérmicos graves o azoospérmicos candidatos a ICSI.
MATERIAL Y MÉTODOS
Selección de pacientes
Se trata de un estudio prospectivo en el que se ha incluido a 237 pacientes con edades comprendidas entre 20 y 52 años desde marzo de 1996 hasta febrero de 2005, valorados en nuestra unidad de andrología, y que consultaron para evaluación del factor masculino por esterilidad y/o infertilidad. Los criterios de inclusión fueron: azoospermia u oligastenozoospermia grave, entendiendo como tal la presencia de menos de 10 millones de espermatozoides por centímetro cúbico y con una movilidad menor del 50% (+++/++). A todos los sujetos se les realizó un mínimo de dos seminogramas con un intervalo entre 15 y 30 días para confirmar sus alteraciones, incluida la recuperación de espermatozoides móviles (REM) mediante técnica Swin-Up.
En todos los casos se realizó una completa historia clínica que incluía antecedentes familiares y personales, historia sexual y existencia de factores tóxicos. Asimismo, se les expuso a examen físico general y genital, donde se valoró especialmente el tamaño y la morfología testicular. Dentro de las pruebas complementarias se solicitó un perfil hormonal completo (FSH, LH, prolactina testosterona y estradiol). De igual forma se descartaron posibles infecciones asociadas mediante cultivo seminal, detección de Chlamydias trachomatis en uretra, serología de hepatitis, sífilis y VIH. Se hizo especial énfasis en la presencia de un eventual factor genético, por lo que se efectuó un estudio de cariotipo (según la técnica habitual en el servicio de citogenética de nuestro centro) y zona AZF (según la técnica que se describiremos a continuación).
A todos los pacientes que presentaban azoospermia en sus parámetros seminales, incluidos aquellos con deleciones en la zona AZF, se les realizó biopsia testicular.
Estudio de la zona AZF
A partir de una muestra de sangre periférica se obtuvo el material genético. Se utilizó la reacción en cadena de la polimerasa (PCR) para amplificar las distintas regiones del cromosoma Y. Los fragmentos amplificados se exponen a electroforesis y se identifican mediante tinción de bromuro de etidio. A cada paciente se le realizó el estudio para 4 loci de la zona AZF. Para ello, se usaron como sitios de secuencias marcadas (sequence tagged sites o STS) para la zona AZFa: sY85; para AZFb: sY134; para AZFc: sY254, y para AZFd: sY149. Se utilizó como control interno la región determinante del cromosoma Y (SRY)11-13.
Biopsia testicular
La biopsia testicular se realizó bajo anestesia local según técnica habitual: se abrió la túnica albugínea, se expuso el parénquima testicular y se extrajeron dos muestras: una para el estudio anatomopatológico y otro para la recuperación de espermatozoides. Esta técnica de recuperación se realizó de la siguiente manera: el tejido testicular se introdujo en medio de cultivo FM y se realizó una observación directa con microscopio óptico para la búsqueda de espermatozoides móviles. Posteriormente se incubaron las placas durante 45 min y se expusieron a centrifugación a 300 g durante 5 min. Tras ello se resuspendió el pellet y se recogió el sobrenadante, que fue nuevamente centrifugado a 800 g durante 5 min. Este segundo pellet se incubó durante al menos 20 min. Es en este segundo pellet donde se encontrarán espermatozoides de mejor calidad y estará más limpio para usarlo para la microinyección14.
Anatomía patológica
Las muestras obtenidas por biopsia testicular fueron fijadas en Bouin acuoso durante 8 h, tras las cuales se siguió con la técnica histológica corriente hasta obtener cortes de 3 µm. Se utilizó la tinción de Hematoxilina-Eosina, con la que se detallan muy bien las agrupaciones celulares y las características citológicas y además permite diferenciar peculiaridades como fibrosis e hialinización. Según los resultados obtenidos, se clasificaron las muestras en 4 patrones histopatológicos:
Atrofia testicular.
Síndrome de sólo células de Sertoli.
Fallo maduración (ausencia de espermátidas).
Hipoespermatogénesis (presencia de espermátides).
RESULTADOS
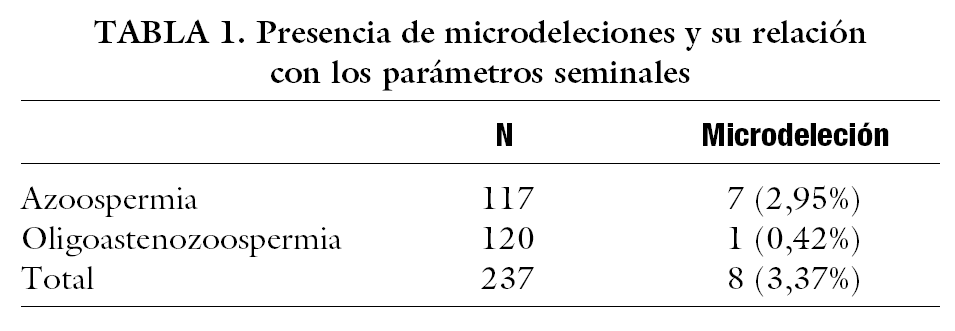
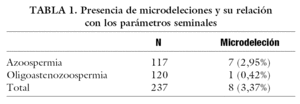
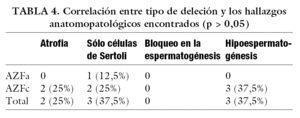
De los 237 pacientes, 117 presentaban azoospermia (49,36%) y 120 oligoastenozoospermia (50,64%). Cuando analizamos la presencia de deleciones del cromosoma Y, encontramos que 8 individuos portaban deleciones (3,38%), 7 de los cuales eran azoospérmicos (87,5%) y sólo uno oligoastenozoospérmico (12,5%) (tabla 1). De estos pacientes, 7 presentaban deleción en la zona AZFc (87,5%), mientras que sólo uno presentó deleción en la región AZFa (12,5%). No se encontró ninguna deleción de la zona AZFb. Estas diferencias fueron estadísticamente significativas (tabla 2). Con respecto a los resultados anatomopatológicos, se obtuvieron los siguientes parámetros: atrofia testicular en 2 de ellos (21,81%), síndrome de sólo células de Sertoli en 23 muestras (20,9%), bloqueo en la espermatogénesis en otros 15 (13,63%) e hipoespermatogénesis en el resto (41,81%). Analizando el fenotipo del grupo con deleción en la zona AZF (tabla 3) encontramos los siguientes parámetros anatomopatológicos: atrofia en 2 de los 7 pacientes (28,57%), síndrome de sólo células de Sertoli en 2 de ellos (28,57%) e hipoespermatogénesis en los 3 restantes (42,85%); sin embargo, estas diferencias obtenidas no resultaron estadísticamente significativas (tabla 4).
DISCUSIÓN
En nuestro medio, la prevalencia de microdeleciones es del 3,4%, muy por debajo del 10-15% global publicado en la literatura médica11. A pesar de su baja frecuencia, el estudio de microdeleciones debe realizarse a todos los pacientes con alteraciones seminales graves cuando van a ser expuestos a ICSI, dado que el trastorno se transmite al 100% de la descendencia masculina, con las implicaciones que ello conlleva.
Por otra parte, el estudio de la presencia de microdeleciones puede aportar un mayor conocimiento de la espermatogénesis. Aunque no hay estudios amplios, la relación que existe entre el tipo de deleción y el resultado anatomopatológico puede ser de gran importancia a la hora de prever la progresión en los parámetros seminales. Así, podríamos anticiparnos a la progresión hacia azoospermia en varones oligozoospérmicos con deleciones en la zona AZF, lo que permitiría plantear la criopreservación antes de que ello ocurra. O, incluso, hacer una previsión de la probabilidad de obtener espermatozoides con la técnica TESE según la zona AZF afectada, de tal forma que en pacientes que presenten deleciones en la zona AZFa y que se acompañen de alteraciones en otros parámetros, como el perfil hormonal, la expectativa de obtener espermatozoides en la biopsia testicular se reduce sustancialmente.
La relación existente entre las formas histopatológicas y el tipo de deleción hallado, demostrada hasta el momento de manera empírica, pero sin una base estadística significativa, se podrá establecer de forma más evidente con la realización de futuros estudios de tamaño muestral más amplio y protocolos más específicos.
Correspondencia:
Vanessa Figueroa Sosa.
Hospital Universitario de Canarias. Carretera Cuesta Taco, s/n.
38203 La Laguna. Santa Cruz de Tenerife. España.
Correo electrónico: vanessafigueroa@hotmail.com