INTRODUCCIÓN
Para un varón seropositivo para el VIH, tener hijos supone asumir el riesgo de transmitir la infección viral a su pareja seronegativa. La vía de contagio de la infección con una relación directa con la reproducción es el coito vaginal. Evitar infectar a la mujer exige impedir que ésta reciba el semen. Las medidas profilácticas son, por tanto, la abstinencia sexual o el uso del condón. La mayoría de las parejas serodiscordantes para el VIH (varón seropositivo y mujer seronegativa) son jóvenes, en edad reproductiva y sin hijos. En la pareja serodiscordante, el sexo seguro y la fertilidad no son posibles en la actualidad. Las parejas fértiles no precisan tratamiento médico para conseguir la gestación. En el varón seropositivo fértil, la actuación médica va dirigida a eliminar o reducir el riesgo de contagiar a la pareja seronegativa. El varón seropositivo subfértil o estéril precisa ayuda médica, igual que el seronegativo subfértil o estéril, para conseguir la gestación. A veces, parejas serodiscordantes deseosas de tener hijos asumen el riesgo de contagiar al otro para tener hijos, desconociendo que uno de los dos, o ambos, son estériles, con el resultado de que la mujer se infecta y no queda gestante. La actuación del andrólogo en este colectivo de parejas fue, hasta 1992, indicar la inseminación artificial de donante (IAD). La paradoja era que el varón seropositivo fértil debía renunciar a ser genéticamente padre para evitar contagiar a su pareja. La separación en el laboratorio de los espermatozoides móviles (la fracción fértil del semen y no contaminada de VIH) de los demás componentes del semen (plasma seminal, linfocitos y macrófagos) infectados del virus ha abierto un camino para ayudar a estos varones a tener hijos genéticamente propios sin contagiar a su pareja. En este trabajo, autorizado por el Comité Ético y de Investigación del Centro Médico Teknon, presentamos nuestra experiencia.
MÉTODOS
Se ha tratado a 302 varones seropositivos para el VIH-1 que deseaban tener hijos. Todas las mujeres eran seronegativas para el VIH. A todos los pacientes se les efectuó una anamnesis andrológica y específica en relación con su proceso infeccioso, así como una exploración física andrológica. Se anotó el volumen testicular medido con orquidómetro de Prader; se exploraron los conductos seminales (epidídimos y deferentes) y el pene. Se indagó la presencia de varicocele con el varón de pie y mediante la maniobra de Valsalva.
Las condiciones de recogida de la muestra de semen fueron las habituales: obtención por masturbación, tras 4 a 7 días de abstinencia sexual. El estudio del semen se inició dentro de la primera hora posteyaculación y una vez licuado a temperatura ambiente. Para la valoración seminal se siguieron los criterios de la Organización Mundial de la Salud (OMS)1. El lavado de semen comprendió 3 fases:
1. Eliminación del plasma seminal. A la muestra de semen fresco se le añadió el medio de cultivo human tubal fluid (HTF) en proporción 2:1. Se homogeneizó y centrifugó a 400 g durante 10 min. Se extrajo el sobrenadante con pipeta Pasteur dejando en el fondo del tubo los espermatozoides y demás componentes celulares presentes en el semen. Este sedimento (pellet) se resuspendió en 1 ml de HTF/HSA.
2. Centrifugación en gradiente discontinuo de PureSperm. Se usó solución isotónica de PureSperm (IVF Science, Suecia). Se utilizó el medio HTF, suplementado con un 6% de albúmina sérica humana (HSA, Grifols, Barcelona) para preparar los gradientes de PureSperm (el 90, el 70 y el 50%). En un tubo se colocó 1 ml de solución de PureSperm al 90% seguido de 1 ml al 70% y 1 ml al 50%. Esto se hizo cuidadosamente para no mezclar entre sí las capas de distintas concentraciones de PureSperm. El pellet resuspendido de la fase 1 se colocó sobre la capa del 50% de PureSperm y se centrifugó a 300 g durante 20 min. Tras la centrifugación, se eliminaron las capas del 50 y el 70% de PureSperm hasta alcanzar la capa del 90%, que se aspiró con una pipeta Pasteur.
3. Técnica de swim-up. El pellet obtenido en la fase 2 se colocó en un tubo estéril y se añadieron 4 ml de HTF/HSA. Se resuspendió el pellet y se dividió en 4 tubos (1 ml por tubo), que se centrifugaron a 200 g durante 10 min. Se extrajo el sobrenadante y se añadieron 0,5 ml de HTF/HSA. Estos tubos se dispusieron inclinados en un ángulo de 45° y se incubaron durante 1 h en atmósfera con un 5% de CO2, a una temperatura de 37 °C. Se extrajeron los sobrenadantes donde se encuentran los espermatozoides móviles, cuya fracción obtenida se dividió en 2 partes iguales. Una se usó para determinar la presencia de VIH-1 y la otra, para la reproducción asistida: inseminación artificial (IA) o fecundación in vitro (FIV) con microinyección espermática (intracytoplasmic sperm injection [ICSI]).
Determinación de VIH-1 en la fracción de espermatozoides móviles obtenida tras los lavados de semen. Técnica de la reacción en cadena de la polimerasa (PCR)
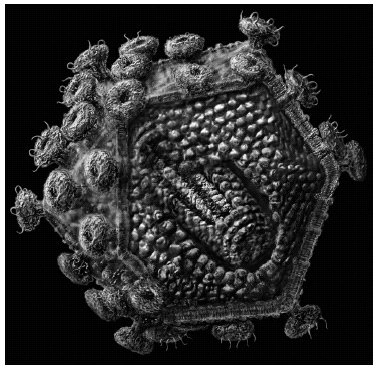
El VIH es un retrovirus, y en su ciclo se observan 2 fases: una de virión, extracelular y constituido por ARN (fig. 1), y otra de provirus intracelular, integrado en el genoma de la célula infectada y constituido por ADN. Es preciso, por tanto, estudiar si el VIH-1 está presente como provirus (ADN) o como virión (ARN) en una muestra seminal antes de usarla en la reproducción asistida.
Figura 1. Virus de la inmunodeficiencia humana (VIH) en su forma de partícula viral o virión.
La amplificación del VIH en su forma de ADN (provirus) integrado en el genoma de la célula infectada (linfocito T CD4+ y macrófagos) se hizo de acuerdo con las instrucciones de Roche Diagnostic System (Branchburg, NJ, Estados Unidos), para el test Amplicor del VIH. Los cebadores (primers) usados fueron el SK 462 y el SK 431, que amplifican la región gag del ADN viral. Tras la desnaturalización del fragmento amplificado, se efectuó la hibridación con sonda específica SK 102. La cuantificación del ARN del VIH se llevó a cabo con el test Monitor (Roche Diagnostic, Inc., Branchburg, NJ, Estados Unidos). La transcripción inversa de ARN a ADNc y la amplificación se hicieron con la polimerasa rTth. Los cebadores fueron los ya citados SK 462 y SK 431. Tras la amplificación y la desnaturalización del fragmento amplificado, se hibridó con sonda SK 102 específica del VIH-1 y CP 35 específica de QS. Para la reproducción asistida sólo se utilizaron las muestras de semen lavado y con el resultado de la técnica de PCR para el VIH-1 negativa tanto para el ADN como para el ARN viral.
Inseminación artificial
Se indicó IA si el número total de espermatozoides móviles obtenidos tras los lavados fue ≥ 4 x
Fecundación in vitro con microinyección espermática
Se indicó FIV-ICSI en el caso de obtener, tras los lavados, una cifra inferior a 4 x 106 espermatozoides, así como en parejas en que la mujer presentara obstrucción tubárica o cuando se habían efectuado 3 ciclos de IA sin conseguir gestación. En los ciclos de FIV se realizó, en todos los casos, ICSI, dada la controversia sobre la posibilidad de que el espermatozoide móvil pudiera transportar el virus. El uso de un solo espermatozoide (ICSI) reduciría el posible riesgo de transmitir el virus al ovocito. En casos de FIV-ICSI se usó semen congelado previamente lavado y testado con PCR para el VIH-1 (ADN y ARN), lo que elimina el riesgo de cancelación del ciclo por positividad en la PCR el mismo día de la punción folicular con los ovocitos ya extraídos de los ovarios2.
La estimulación ovárica (con gonadorrelina [Gn-RH] y folitropina [FSH]-hCG), la monitorización de la respuesta ovárica (con ecografías por vía vaginal y determinaciones de 17-beta-estradiol, ambos seriados), la punción folicular por vía transvaginal y ecoguiada, la identificación de los ovocitos en el líquido folicular, así como la clasificación de su estadio madurativo, se efectuaron siguiendo la metodología habitual en todo ciclo de FIV. Lo mismo se hizo con la ICSI (fig. 2). La evaluación de los pronúcleos y de la división celular del embrión, así como la eclosión (hatching) asistida, se llevó a cabo de idéntica forma a como se realiza en las parejas seronegativas.
Figura 2. Microinyección espermática (ICSI; intracytoplasmic sperm injection).
El control de que la mujer tratada se mantenía seronegativa se hizo mediante determinación de anticuerpos anti-VIH y antígeno p24 (o ADN y ARN virales mediante PCR) en días previos próximos a la IA o a la ICSI. Se repitió la misma determinación al mes de la IA o de la transferencia embrionaria. Si se produjo la gestación, la medición se repitió a los 3 y a los 6 meses y tras el parto. También se determinaron los anticuerpos anti-VIH en el recién nacido. El objetivo de estas determinaciones en la mujer antes y después de la IA (o ICSI) era comprobar su seronegatividad en el momento de efectuar la IA o la ICSI, y que no había habido seroconversión tras la IA o la transferencia de embriones. Todas las parejas dieron su consentimiento por escrito.
RESULTADOS
Características del colectivo seropositivo para el VIH
Los pacientes estudiados y tratados fueron jóvenes, en edad reproductiva, casados o con pareja estable. No se trataba de personas marginales y muchas de ellas escogieron renunciar a la paternidad por evitar contagiar a su pareja. La mayoría (70%) eran ex drogadictos. La eficacia de los tratamientos antirretrovirales ha cambiado el pronóstico del sida, que ha pasado de ser una enfermedad mortal a una enfermedad crónica. El varón infectado vive más y mejor, y tener hijos deseados es, sin duda, aumentar la calidad de vida.
Recuperabilidad de espermatozoides móviles tras el proceso de lavado seminal
En un grupo de 104 sémenes estudiados de forma consecutiva, se evaluó la tasa de recuperación de espermatozoides móviles después del doble lavado, en relación con el número total de espermatozoides móviles presentes en el eyaculado total en fresco. Se tuvieron en cuenta los sémenes cuyo estudio inicial presentara un recuento espermático normal. Los resultados se cotejaron con los de un grupo control de 155 pacientes infértiles seronegativos al VIH, en los que se realizó la técnica de PureSperm (n = 44) o la técnica de swim-up (n = 111). Los datos se presentan como media ± desviación estándar (DE) (tabla 1). En un 3,5% de los sémenes lavados, las determinaciones con PCR de ARN y/o ADN del VIH-1 fueron positivas, por lo que la reproducción asistida se canceló.
Los resultados de las IA se exponen en la tabla 2 y los de la FIV-ICSI, en la tabla 3. Los resultados de la IA en este colectivo son mejores que los obtenidos en parejas seronegativas. La explicación es que la edad media de las mujeres tratadas es menor que en el colectivo de parejas estériles y que la IA se hace en estas parejas para evitar la transmisión del virus a las mujeres y no porque éstas sean subfértiles o estériles. En el caso de la FIV-ICSI, los resultados son similares a los obtenidos en parejas seronegativas al VIH, dado que las indicaciones son las mismas que las de las parejas seronegativas.
DISCUSIÓN
Opciones reproductivas del varón seropositivo para el VIH
Las opciones reproductivas del varón infectado por el VIH son: a) utilizar condón en todos los coitos para no infectar a su pareja y renunciar a tener hijos; b) no utilizar condón en los días periovulatorios para fecundar a la mujer, corriendo riesgo de infectarla y quizá también al hijo; c) usar semen de banco; d) recurrir a la adopción, aunque esta opción sólo funciona en la teoría, pues en la práctica, hasta donde conocemos, no se dan niños en adopción a parejas en que alguno de sus miembros esté infectado por el VIH, y e) lavado de semen para separar la fracción fértil, libre del virus, los componentes seminales infectados, el plasma seminal, los linfocitos y los macrófagos, técnica iniciada por Semprini et al3.
Derecho de la persona seropositiva para el VIH a tener hijos
Aunque nadie cuestiona el derecho de una persona a tener hijos, este derecho no siempre se ha reconocido al varón con infección por el VIH. Si él y su pareja son fértiles, pueden conseguir una gestación mediante coito sin protección, asumiendo el riesgo de que ella se contagie. Pero si la pareja es subfértil o estéril, necesita ayuda médica para conseguir el embarazo. Incluso siendo fértil precisará esa ayuda para, al menos, reducir el riesgo de transmisión del virus. Esta actitud de negar la reproducción asistida a parejas serodiscordantes (varón seropositivo) sigue siendo una realidad en muchos centros, que aducen que hay riesgo de contagiar a la mujer y, por tanto, al hijo. No obstante, ello es una discriminación médica debido a una enfermedad, y la discriminación por enfermedad está prohibida por el artículo 14 de la Constitución, así como por el artículo 512 del nuevo Código Penal4. La discriminación por infección por el VIH fue específicamente prohibida en la 41 Asamblea Mundial de la Salud, el 13 de mayo de 1988, en su resolución WHA 41.24, y por la Reunión de las Comunidades Europeas y Ministros de la Salud de los Estados Miembros (Bruselas, 27 de noviembre de 1989), en su resolución 10.048/89.
La Declaración Universal de Derechos de las personas con VIH-sida (sección 5), específicamente, afirma que "cualquier discriminación de las personas que padecen sida o infección por el VIH es una violación de los derechos humanos". Sin embargo, este derecho ha sido, y sigue siendo, con frecuencia conculcado cuando el varón seropositivo para el VIH desea tener hijos.
Riesgo de transmitir la infección a la pareja y al hijo
El riesgo de enfermedad es inherente a la vida misma. En el varón seropositivo la actuación médica en ningún caso incrementará el riesgo de infectar a la pareja y al niño ni agravará el proceso viral; en todos los casos, el riesgo de transmitir la infección se reducirá. Datos propios (tablas 2 y 3), así como la experiencia acumulada de más de 1.800 ciclos de IA y FIV-ICSI, y más de 500 niños nacidos sin que se haya producido ningún contagio avalan esta afirmación5,6. En contraposición, de 92 parejas (varón seropositivo) que consiguieron gestación mediante coito no protegido, 4 mujeres se contagiaron7. Negar la reproducción asistida a un varón seropositivo para el VIH es negarle la ayuda médica a la que tiene derecho. Las ideas de unos con frecuencia coartan los derechos de otros, y la libertad de elegir es un aspecto esencial de la dignidad humana.
Reducción del virus seminal mediante el lavado
El objetivo del lavado de semen es eliminar completamente el plasma seminal que contiene viriones (partícula viral en fase de ARN, extracelular), así como los linfocitos y los macrófagos infectados. En estas células el virus está integrado en el genoma celular; por tanto, es ADN y se denomina provirus. Está probado que el proceso de preparación seminal descrito, y conocido como "lavado de semen", reduce espectacularmente la cantidad tanto de viriones como de provirus en la fracción de espermatozoides móviles obtenida tras los lavados, hasta el punto en que la sensible técnica de PCR no detecta su presencia8-13.
Presencia de VIH-1 en la fracción de espermatozoides móviles obtenida después del lavado de semen (resultados de la PCR positiva al ADN y/o ARN del VIH-A)
Los resultados positivos del PCR para el VIH a pesar de los lavados pueden deberse a:
1. La presencia de una pequeña cantidad de plasma seminal (en el caso de PCR positiva al ARN viral) o de células infectadas (en el caso de PCR positiva al ADN viral); consideramos que, con el doble lavado, el plasma seminal se elimina totalmente, y tras los lavados no se observa ninguna célula no gamética.
2. Es un resultado falso positivo. La amplificación de la región gag del genoma viral puede dar falsos positivos14. Creemos que esto es lo sucedido en los pocos casos en que la PCR para el VIH-1, tras los lavados, ha dado positivo (3,5%). En todos los casos, excepto en 2, con resultado positivo para el VIH-1, al repetir la PCR el resultado fue negativo. La repetición se hizo en la fracción seminal que iba a utilizarse para la reproducción asistida. La repetición de la PCR volvió a ser positiva en 2 casos, pero en un nuevo estudio (lavado y PCR) en otra muestra de semen obtenida unos días después, fue negativa para el VIH-1.
3. La tercera posibilidad es que el virus se adhiera fuertemente al espermatozoide o lo infecte. En este caso, los lavados del semen no eliminarían el virus. En ningún caso la repetida positividad de la PCR para el VIH-1 tras los lavados de semen ha impedido efectuar la reproducción asistida. La presencia del virus en el espermatozoide ha sido un aspecto muy controvertido y se comenta a continuación.
Presencia en la membrana espermática del receptor CD4+
EL VIH-1 tiene una glucoproteína (gp120) que se une a un receptor (el CD4), presente en la membrana de la célula que infecta. La presencia del receptor CD4 en la membrana espermática es discutida (tabla 4)15-24. Se ha postulado que la molécula galactosamil ceramida, presente en la membrana del espermatozoide, puede actuar como receptor para el VIH-122,24.
VIH-1 y espermatozoide
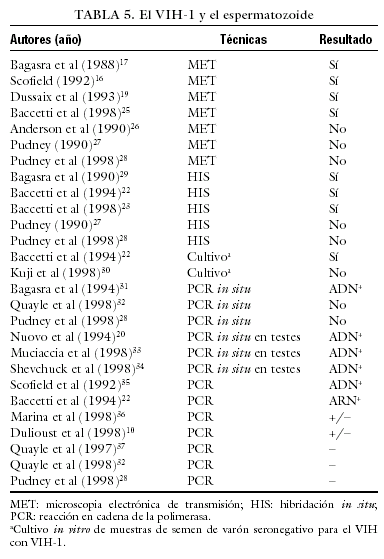
Los estudios publicados sobre la posible presencia intraespermática del VIH-1 son controvertidos. En la tabla 510,16-19,22,25-37 se exponen los estudios que se han llevado a cabo sobre este tema, la técnica empleada y los resultados obtenidos. No se trata de estudios homogéneos en cuanto al colectivo de pacientes estudiados (estadio de la infección y uso de tratamiento antirretroviral o no); la técnica de lavado de semen (sólo centrifugación en gradientes de PureSperm, sólo técnica de swim-up, o ambas), o la técnica de PCR (extracción del ARN, amplificación del ADN, primers utilizados, etc.).
Cuando el VIH entra en una célula, lo hace en forma de ARN. El ARN viral se transforma en ADN por acción de la enzima viral transcriptasa inversa. Se ha postulado que la detección del VIH-1 en forma de ADN podría deberse a una transcripción inversa parcial dentro del virión38,39. La acción de la enzima viral integrasa permite que el ADN viral se integre en el genoma de la célula infectada.
Es difícil imaginar cómo el VIH-1 puede integrarse en el genoma espermático si no entra en el espermatozoide. Por otro lado, el genoma espermático es haploide, empaquetado en cromosomas condensados e inactivos. Si el VIH-1 entra en el espermatozoide fértil, como afirman Baccetti et al40, ésta sería una vía de infección, aunque no hay ninguna evidencia clínica de que esto suceda. Si el espermatozoide transporta el VIH-1 al interior del ovocito maduro, se infectaría el embrión, el feto y el niño nacido. No obstante, ningún dato clínico sustenta esta idea.
CONCLUSIÓN
De los datos expuestos se puede concluir que el lavado de semen, junto con la determinación del VIH-1 con técnica de PCR, es una metodología válida para reducir la transmisión del virus a la mujer y permite que el varón seropositivo sea genéticamente padre.