O artigo apresenta o caso de um paciente de 40 anos sem antecendentes de doenças significativas conhecidas. No espermograma identificou-se astenozoospermia total. Na análise ultraestrutural por microscopia eletrónica de transmissão observaram-se múltiplas anomalias na baínha mitocondrial e na estrutural do flagelo (axonemas incompletos/desorganizados, ausência de fibras densas externas e segmentos de baínha fibrosa) explicativos da imobilidade espermática. As causas da patologia são desconhecidas à luz da ciência atual e as possibilidades de reprodução implicam o recurso à ICSI com baixa probabilidade de sucesso.
The article reports the case of a 40-year old man with no history of significant illness. The semen analysis identified total asthenozoospermia. Ultrastructural analysis by electron microscopy showed multiple mitochondrial sheath and flagellum structure anomalies (incomplete/disorganized axoneme, absence of outer dense fibers and fibrous sheath) that explain the sperm immotility. As far as we know, the causes have still not been determined and the possibilities of reproduction involve the use of ICSI with low probability of success.
A análise citobioquímica do esperma permite averiguar os vários parâmetros espermáticos, tais como a concentração, morfologia, vitalidade e motilidade. Muitas vezes alterações nestes parâmetros correlacionam-se com patologias clínicas conhecidas e estudadas, contudo, ainda muitas patologias estão por descrever. As novas tecnologias atualmente disponíveis nos laboratórios têm um papel cada vez mais ativo no quotidiano da análise espermática. Estas permitirão identificar os danos estruturais invisíveis na microscopia ótica, assim como, a base genética e molecular subjacente a uma dada patologia, o que possibilita a identificação do risco de transmissão de danos genéticos às gerações futuras1.
Uma das patologias passíveis de identificar num espermograma é a astenozoospermia. A imotilidade dos espermatozoides não explicada pela sua mortalidade foi já associada, em alguns casos, com a desordem autossómica recessiva síndrome de Kartagener. Esta carateriza-se pela disfunção parcial ou total das células ciliadas ou flageladas (como os espermatozoides) e encontra-se, por isso, também associada a patologias respiratórias2. No entanto, nem todos os casos de astenozoospermia total são explicados por esta síndrome e torna-se necessário analisar a ultraestrutura dos espermatozoides para aferir a integridade dos componentes essenciais para a motilidade.
Os espermatozoides deslocam-se devido ao movimento do flagelo. Este pode ser subdividido em três partes: a peça intermédia, peça principal e peça terminal. A peça intermediária é a região mais espessa do flagelo onde se encontra o axonema que se estende por todo o flagelo. O axonema é formado por nove pares de microtúbulos, que envolvem dois microtúbulos centrais. A partir de cada um dos nove pares de microtúbulos externos projetam-se dois braços de dineína (um interno e um externo) responsáveis por gerar a força motriz do flagelo3 ao induzirem o deslizamento dos microtúbulos. O movimento desta estrutura deve-se em grande parte à energia química da adenosina trifosfato (ATP) gerada nas mitocôndrias por respiração aeróbica4. Estas formam uma bainha mitocondrial, que envolve o axonema e as fibras densas externas (ODF-outer dense fibres) na peça intermediária5. As ODF envolvem cada par de microtúbulos externos na extensão da peça intermediária e da peça principal, sendo que nesta última desaparecem duas delas e são substituídas por duas colunas longitudinais de baínha fibrosa (FS-fibrous sheath). Por fim, a peça terminal apenas possuí o axonema rodeado pela membrana plasmática6.
Caso clínicoUm paciente de 40 anos recorreu à consulta de infertilidade do Centro Hospitalar de Vila Nova de Gaia/Espinho EPE. No espermograma identificou-se imobilidade total dos espermatozoides bem como múltiplas anomalias da morfologia da cauda (curta e/ou enrolada) (fig. 1).
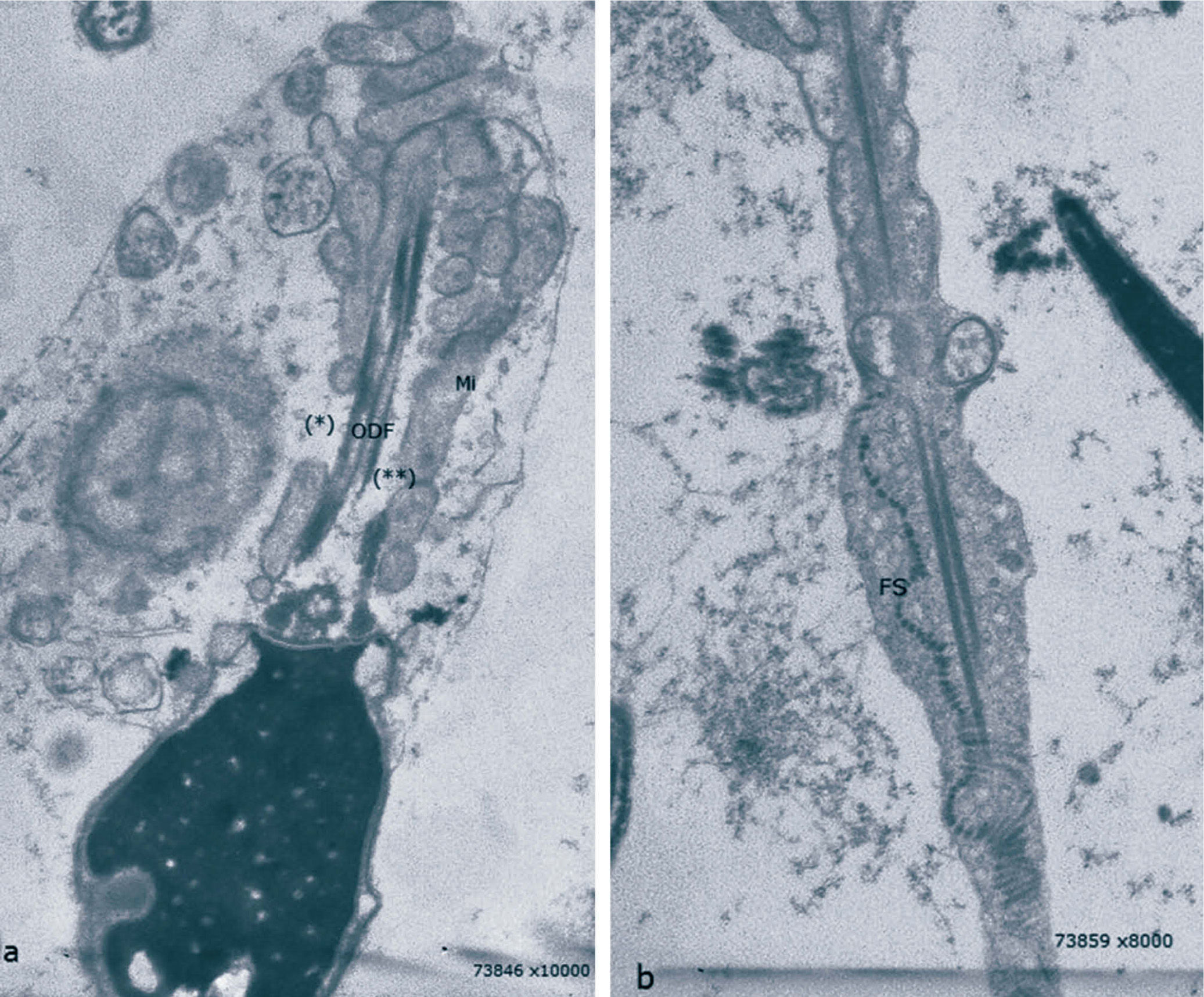
O paciente não tinha antecedentes de nenhuma doença significativa conhecida. O estudo do cariótipo revelou uma inversão pericêntrica do cromossoma Y (p11.2q11.2), heteromorfismo clinicamente irrelevante. Quanto ao estudo de microscopia eletrónica dos espermatozoides do ejaculado, as observações revelaram várias alterações mitocondriais, bem como vários axonemas desorganizados e/ou incompletos (sem microtúbulos) (fig. 2). As ODF e a FS também apresentaram algumas falhas ao nível estrutural (fig. 3). Este diagnóstico é explicativo da astenozoospermia.
Imagens de microscopia eletrónica: a) À esquerda corte longitudinal de um espermatozoide com múltiplas anomalias morfológicas da cabeça, com núcleo (Nu) e vesícula acrossómica (VA) anormal. À direita é possível observar um corte transversal de um flagelo com ausência de pares de microtúbulos e com as ODFs alteradas; b) Corte transversal da peça intermediária de um espermatozoide evidenciando um axonema com ausência de vários pares de microtúbulos e ODFs (quatro ODFs de tamanho normal, uma atrófica e quatro ausentes) envolvidos pelas mitocôndrias (Mi).
Imagens de microscopia eletrónica: a) Espermatozoide com restos citoplasmáticos indexados à peça intermediária. Baínha mitocondrial desorganizada com défice à esquerda (*). Ausência de várias estruturas do axonema à direita, como por exemplo ODFs (**); b) Flagelo em que é possível visualizar as FS desorganizadas.
O paciente realizou um ciclo ICSI, em que a microinjeção foi realizada com espermatozoides reativos a uma solução hipoosmótica. Foram injetados sete ovócitos maduros, no entanto, ocorreu falha total de fertilização.
DiscussãoA astenozoospermia grave deve-se muitas vezes a anomalias estruturais do flagelo, como o caso confirma. As alterações no conteúdo do DNA mitocondrial podem também ser responsáveis em grande parte pela ausência de motilidade. Vários estudos comprovaram a correlação estrita entre alterações no DNA mitocondrial (deleções e mutações pontuais) e a astenozoospermia7.
As mitocôndrias possuem uma função bioenergética essencial para a fertilidade masculina. Os braços de dineína exigem uma elevada concentração de ATP como fonte de energia para o movimento do flagelo. No entanto, as mitocôndrias estão limitadas à peça intermediária, ao contrário do axonema que se prolonga por toda a extensão do flagelo. Se o ATP mitocondrial fosse a única fonte energética, teria de se difundir numa distância considerável para estar disponível em toda a extensão do axonema. Estudos em ratos sugerem que a quantidade de ATP produzida na peça intermediária não é suficiente para se difundir de forma efetiva por todo o flagelo8. Simultaneamente, Narisawa et al e seus colaboradores identificaram que em situações de fosfolorização oxidativa mitocondrial insuficiente pode ocorrer fertilização, os espermatozoides ainda produzem pequenas quantidades de ATP e têm motilidade, apesar de reduzida. Estas evidências sugerem que o espermatozoide poderá ter um mecanismo alternativo de produção de energia (via glicólise), desde que tenha disponível frutose, ácido lático e/ou glucose9.
A resposta para esta necessidade metabólica parece residir na FS em que síntese de ATP parece ocorrer por glicólise. Várias enzimas glicolíticas têm sido identificadas na FS de várias espécies de mamíferos, tais como: a hexocinase, a lactato desidrogenase e o gliceraldeído-3-fosfato desidrogenase. Para além disso, as ODF e as FS desempenham também um papel mecânico na motilidade ao proporcionar um suporte rígido ao flagelo, o que determina o seu batimento planar3.
Quando alguma destas estruturas, ou várias, se encontram danificadas podem resultar graves défices da motilidade espermática, como no caso em análise. Estes danos apenas são visíveis com recurso à microscopia eletrónica de transmissão10.
Esta patologia não responde a terapia cirúrgica ou medicamentosa11. Atualmente, a alternativa reprodutiva para estes casos passa pelo recurso à ICSI, com baixa taxa de sucesso. O aconselhamento genético deve ser realizado, pois os estudos de prevalência genética da patologia são ainda pouco conclusivos12.
São ainda necessários mais estudos para compreender a base molecular da motilidade espermática, pois eventualmente, algumas situações de astenozoospermia poderão ser tratadas com recurso à estimulação das vias de sinalização ou por terapia génica3.
Responsabilidades éticasProteção de pessoas e animais. Os autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e Ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsinki.
Confidencialidade dos dados. Os autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escrito. Os autores declaram ter recebido consentimento escrito dos pacientes e/ ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.