El tratamiento de elección para pacientes con oligozoospermia severa es la inyección intracitoplasmática de espermatozoides (ICSI), pero su alto coste limita su aplicación en países cuyos sistemas de salud no cubren este procedimiento médico. La nueva técnica de vitrificación permite almacenar espermatozoides post selección espermática hasta obtener la concentración mínima para realizar ciclos de inseminación intrauterina (IIU). Se presenta este caso clínico de un recién nacido sano, tras dicha técnica, de una pareja (varón 32 años, mujer 31 años) con antecedente de 2ciclos ICSI, uno de los cuales fue exitoso, con un hijo vivo sano. Espermatozoides mótiles fueron obtenidos por swim-up, resuspendidos en medio Vitrisperm®, almacenados en pajuelas a una concentración de 0,5-1,5×106células/ml y vitrificados en contacto directo con nitrógeno líquido. Se realizó estimulación ovárica y la IIU se realizó 36h después de la administración de hCG. La muestra post desvitrificación presentó una concentración de 3,0×106espermatozoides motiles. La evolución de un desarrollo fetal normal fue controlada por ecografía 3D, con el posterior nacimiento por parto cesárea de un recién vivo sano de sexo masculino. Aunque son resultados preliminares, la congelación ultrarrápida, al preservar un alto número de espermatozoides con función conservada, genera una alternativa de tratamiento de bajo coste en pacientes con oligozoospermia severa.
Therapy for patients with severe oligozoospermia is the intracytoplasmic sperm injection (ICSI). However, its high cost limits its application in countries whose health systems do not cover this medical technique. The new vitrification technique makes it possible to store sperm after sperm selection until reaching the minimum concentration for cycles of intrauterine insemination (IUI). A clinical case is reported of a couple (male age 32, female age 31) who underwent 2 ICSI procedures, one of which was successful, resulting in the birth of a healthy, live born son. Motile sperm were obtained by swim-up, resuspended in Vitrisperm® medium, stored in straws at a concentration of 0.5 to 1.5×106cells/mL, and vitrified in direct contact by liquid nitrogen. Ovarian stimulation was induced and IUI was performed 36hours after hCG administration. The post-devitrification sample presented a concentration of 3.0×106 motile sperm. The evolution of normal fetal development was controlled by 3D ultrasound and subsequent birth by cesarean delivery of a healthy male newborn. Although these are preliminary results, ultrarapid freezing preserves the physiological function in a high number of spermatozoa. This generates a low-cost alternative treatment for patients with severe oligozoospermia.
El tratamiento de elección para pacientes con oligoastenozoospermia severa es la inyección intracitoplasmática de espermatozoides (intracytoplasmic sperm injection [ICSI]), pero su alto coste limita su aplicación en países cuyos sistemas de salud no cubren este procedimiento médico. Por ello, habitualmente estos pacientes quedan sin terapia y solo tienen la adopción como alternativa terapéutica. La nueva técnica de vitrificación permite almacenar espermatozoides post selección espermática hasta obtener una concentración mínima de espermatozoides para realizar ciclos de inseminación intrauterina (IIU)1.
La vitrificación es un método de criopreservación ultra rápida que consiste en la exposición directa de la célula en nitrógeno líquido o a sus vapores, evitando así la cristalización del agua intracelular2 y el criodaño3,4. Este método no utiliza crioprotectores permeables, que pueden implicar riesgo mutagénico5, y se realiza en espermatozoides obtenidos por métodos de selección espermática, lo que garantiza una alta motilidad, y al estar desprovistos de plasma seminal disminuye el riesgo de transmisión de infecciones virales y bacterianas.
Caso clínicoPareja con 2procedimientos de ICSI, uno de los cuales fue exitoso, con un hijo vivo sano. Factor femenino estudiado, paciente de 31 años, con ciclos ovulatorios, niveles hormonales dentro de los límites normales. En el varón, de 32 años, el estudio endocrino demostró una TSH de 2,5μU/ml (rango: 0,4-4μU/ml), tiroxina de 1,0 ng/dl (rango: 0,8-2,7ng/dl), PRL de 16ng/ml (rango: 1-18ng/ml), FSH de 5,7mIU/ml (rango: 1-12mIU/ml), insulina basal de 13μU/ml (rango: 2-20μU/ml) y testostenona total de 470ng/dl (rango: 270-1.070ng/dl). El cultivo de semen y las determinaciones de Clamidia trachomatis y Mollicutes fueron negativos. La ecografía testicular fue descrita sin hallazgos patológicos y microcalcificaciones. La variación de los parámetros espermáticos principales fue de volúmenes bajos, entre 1,1 a 1,3ml, viabilidad del 80%, concentración entre 2,4 y 4,5×106espermatozoides motiles/ml, movilidad total (PR+NP) entre el 12 y el 25%, morfología entre el 7 y el 12%. La determinación de fragmentación del ADN por técnica de TUNEL fue de menos del 10%.
Obtención de muestrasLas muestras de líquido seminal fueron obtenidas por masturbación con una abstinencia mínima de 2días. Las muestras se mantuvieron a 37°C en estufa de cultivo durante 30-60min hasta su licuefacción. Posteriormente se realizó un espermiograma y la determinación de la integridad del ADN.
Integridad del ADNLa integridad del ADN se evaluó utilizando el test de TUNEL. Esta técnica se basa en la incorporación de nucleótidos marcados en las roturas existentes en el ADN. Se empleó el protocolo del kit comercial In-situ Cell Death Detection Kit, Fluorescein, del Laboratorio Roche.
Swim-upLos espermatozoides fueron separados del líquido seminal por swim-up. Para ello, se procedió a lavar la muestra disponiendo alícuotas de 600μl de semen en tubos Falcon. A cada tubo con la muestra se añadieron 5ml de human tubal fluid (HTF) y se centrifugaron a 400g durante 5min. Para la selección de los espermatozoides se adicionó lentamente al pellet, HTF suplementado con HSA (albúmina sérica humana, Sigma, St Lois, EE.UU.) al 1% y se incubó al menos 45min a 37°C. Finalmente, se procedió a retirar cuidadosamente el sobrenadante y depositarlo en un tubo Falcon estéril.
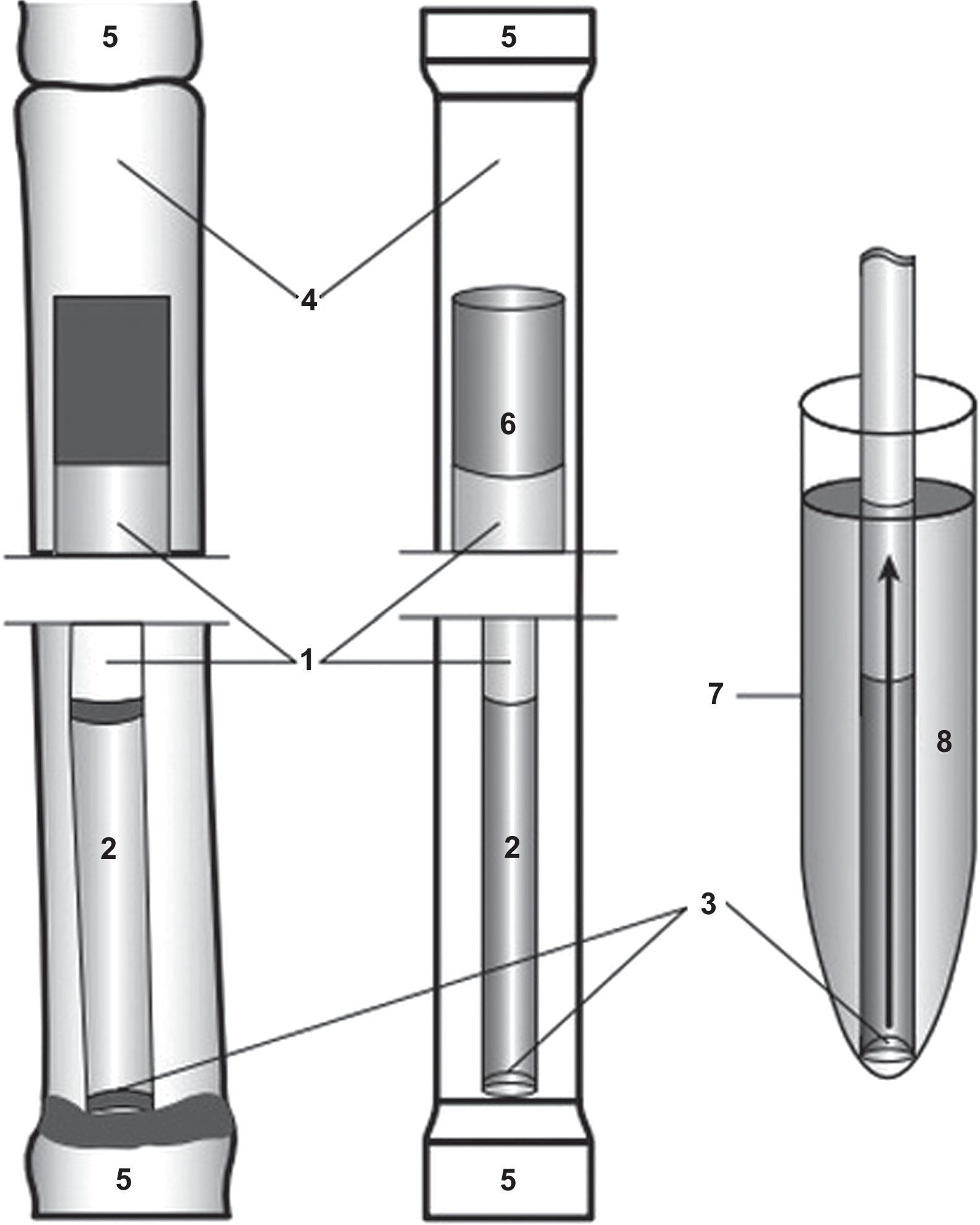
Vitrificación y desvitrificación de las muestrasVitrificaciónLos espermatozoides seleccionados por swim-up fueron vitrificados, para lo cual, en un tubo eppendorf se depositaron 200μl de HTF con 1% HSA que contenían aproximadamente 1-1,5millones de espermatozoides. Posteriormente se adicionaron 200μl de medio Vitrisperm® y se dejó equilibrar la solución durante 5min. Se vitrifican volúmenes de 100μl que contienen 1,5×106espermatozoides que se colocan en pajuelas de 0,25ml y cada una se introduce en otra pajuela de 0,5ml que es sellada con calor (fig. 1). Posteriormente las pajuelas se sumergen en N2L durante 5s, se guardan en la porta-pajuelas y se almacenan en N2L para su conservación.
DesvitrificaciónLas pajuelas se cortan en uno de sus extremos y se coloca el contenido de hasta 3pajuelas en un tubo Falcon que contiene 6ml de HTF+HSA 1% a 37°C (en baño de agua a 37°C) para su descongelación. Luego se equilibra la solución que contiene los espermatozoides durante 5min a 37°C en estufa de cultivo, se realiza una centrifugación a 1.800rpm durante 5min y el pellet es resuspendido en 0,5ml de HTF-HSA 1%. Las muestras post desvitrificación utilizadas para la IIU presentaron una concentración de 3,0×106espermatozoides/ml, motilidad mayor de 60% y fragmentación del ADN menor al 10%.
Estimulación ovárica y evolución del embarazoSe realizó estimulación ovárica con letrozol (Femara, Novartis, Chile), 5mg durante 5días (3-7días del ciclo), con posterior seguimiento ecográfico. Al obtener un folículo de 20mm se administraron 5.000UI de hCG (Gonacor, Ferring, Chile) y después de 36h se realizó la IIU.
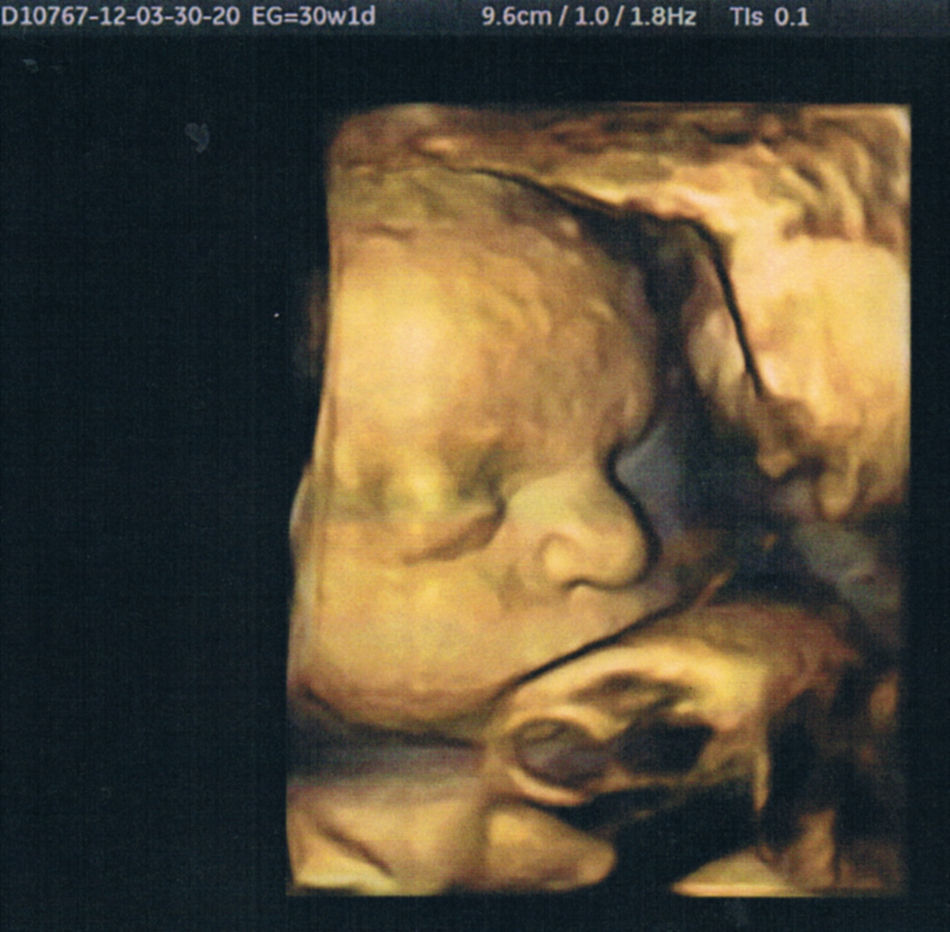
Dieciséis días después de la inseminación la paciente presentó una βhCG positiva, y en la quinta semana de gestación, mediante ecografía transvaginal, se confirmó la presencia de un embarazo intrauterino. La evolución de un desarrollo fetal normal fue confirmada y controlada por ecografía 3D (fig. 2), con el posterior nacimiento por parto cesárea de un recién vivo de 3.849g, de sexo masculino, Apgar 9 al minuto, 10 a los 5min y un examen físico dentro de los límites normales.
DiscusiónLa vitrificación es una forma de criopreservación ultrarrápida, posible de ser utilizada en la preservación de gametos para reproducción asistida. Este tipo de criopreservación consiste en elevar la viscosidad de los líquidos intra y extracelulares deteniendo finalmente todos los procesos celulares6. Una de las ventajas de la vitrificación es evitar la formación de cristales de hielo intracitoplasmáticos, los cuales inducen daño y pérdida de la función celular; estos son el principal obstáculo que presenta la criopreservación tradicional, razón por lo cual la vitrificación se ha planteado como una solución a la criopreservación lenta7,8.
La congelación y descongelación no parecen ser inocuas para los espermatozoides, y transcurrido el tiempo la movilidad de estos, al igual que la viabilidad y la integridad del ADN, pueden presentar una evidente disminución desde el momento en que son descongelados3,4. De ahí la importancia de disminuir el tiempo de tratamiento post descongelación, tanto por la presencia de crioprotectores —que también son tóxicos para la célula— como por las múltiples centrifugaciones, que incrementan la producción de especies reactivas de oxígeno9,10. Todas estas situaciones ocurren cuando se congela semen, y consecuentemente las muestras descongeladas deben ser tratadas para eliminar el plasma seminal y los crioprotectores. En cambio, en la vitrificación no se utilizan crioprotectores permeables y los espermatozoides son obtenidos por métodos de selección espermática, lo que garantiza una alta motilidad, y al estar desprovistos de plasma seminal disminuye el riesgo de transmisión de infecciones virales, Mollicutes o bacterias. El espermatozoide libre de plasma seminal y con función conservada puede ser utilizado de inmediato tras la descongelación para cualquier técnica de medicina reproductiva, en volúmenes pequeños (1-5μl) para fecundación in vitro convencional e ICSI7-11, o en volúmenes mayores para IIU (100 a 500μl)8. Este nuevo método otorga a pacientes oligoastenozoospérmicos severos una alternativa terapéutica de bajo coste, previo a las técnicas de fecundación in vitro, ya que permite almacenar espermatozoides seleccionados hasta obtener la concentración mínima para realizar ciclos de IIU12. Esta concentración mínima de 3,0×106espermatozoides/ml, pero con movilidad y función altamente conservadas, nos ha posibilitado lograr embarazos viables y que llegaron a término con recién nacidos sanos1. Esto a su vez permitirá que futuros estudios evalúen la concentración mínima para lograr el embarazo en muestras vitrificadas, especialmente en semen de donante, ya que podrían incrementar el número de pajuelas obtenidas por donante de semen, lo que, junto con la rapidez y la simplicidad de esta metodología, puede hacer disminuir ostensiblemente su coste, permitiendo a un mayor número de parejas la posibilidad de acceder a estos procedimientos, especialmente en países que no cuentan con cobertura económica de salud para realizar tratamientos de medicina reproductiva.
Responsabilidades éticasDerecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor para correspondencia.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Protección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
FinanciaciónUniversidad de la Frontera.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.