La extracción dental a causa de enfermedad periodontal, caries o traumatismos es el procedimiento quirúrgico más habitual en todo el mundo. Evian y cols.1 describieron la secuencia histológica de acontecimientos que se producen en el alveolo de extracción del ser humano tras la extracción dental. Muchos estudios, sobre todo casuísticos, documentan la pérdida de altura y anchura del hueso alveolar, especialmente en las áreas de corticales óseas finas faciales o vestibulares, después de la extracción dental, 2-5 corroborando así la necesidad de conservar el alveolo mediante injertos y técnicas de regeneración ósea dirigidas6,8,13,15. Se ha demostrado que los injertos alveolares, a pesar de favorecer la formación de tejidos duros, retrasan la cicatrización16-18. Araújo y cols.19 refirieron recientemente que el posicionado de un injerto en los alveolos de extracción no impide la remodelación de las paredes alveolares, sino que favorece la neoformación ósea en los márgenes, lo que mejora el perfil de la cresta. No obstante, la actual falta de ensayos clínicos controlados aleatorizados, conjuntamente con la falta de estándares reconocidos en cuanto al cuidado de los alveolos de extracción, sugieren la necesidad de directrices clínicas claras, basadas en indicios científicos fundamentados.
Sin embargo, se acepta ampliamente que la formación rápida del hueso en los alveolos de extracción es un resultado deseable cuando se prevé una colocación inmediata o precoz de implantes. Suba y cols.20 sugirieron, en un estudio canino reciente, que la aplicación de factores de crecimiento en el alveolo de extracción puede acelerar precozmente la formación ósea. En este estudio de boca dividida, se combinó beta-fosfato tricálcico (β-TCP) con plasma rico en plaquetas y se posicionó en los alveolos premolares de extracción (grupo de estudio). Los lados de extracción contralaterales se injertaron exclusivamente con β-TCP (control). A las 6 semanas, los datos histomorfométricos revelaron un porcentaje de relleno óseo en el grupo de estudio (45,9 %) significativamente superior al del control (30,8 %). La diferencia fue estadísticamente significativa. Sin embargo, a las 24 semanas, el porcentaje de relleno óseo tanto en el grupo de estudio como en el de control fue similar, sin observarse diferencias estadísticas. Los investigadores concluyeron que la adición de plasma rico en plaquetas a la matriz osteoconductora cerámica puede acelerar la formación de hueso en los alveolos de extracción, pero sugirieron que se precisan más investigaciones en el ser humano. Cuando se programa una colocación de implante inmediata o precoz, es deseable que se produzca una formación ósea y una estabilización volumétrica más rápidas, ya que pueden ser beneficiosas para la estabilidad del implante y la posterior osteointegración. Por ello, es idóneo realizar un estudio que examine, en momentos precoces, los efectos del factor de crecimiento en la regeneración ósea mediada dentro de los alveolos de extracción. En consecuencia, el objetivo principal de este estudio fue examinar los parámetros histológicos e histomorfométricos de la regeneración ósea humana en los alveolos de extracción con injertos de factor de crecimiento derivado de plaquetas (PDGF).
El β-TCP es una forma porosa multicristalina con una relación de Ca:PO4 similar al mineral óseo natural. Los amplios estudios clínicos animales y humanos, realizados a lo largo de los últimos 25 años, han demostrado la biocompatibilidad del β-TCP, no habiéndose publicado informes con reacciones adversas21-27. El β-TCP rellena los defectos óseos físicamente, impidiendo el colapso del tejido blando en el defecto óseo y aportando una matriz o estructura de soporte para la neoformación ósea que posteriormente se remodela y, al final, es sustituida por hueso autógeno. Esto se ha demostrado en numerosos estudios clínicos animales y humanos21,23,27-38.
El PDGF es el factor de crecimiento más ampliamente estudiado en periodoncia. Desde las observaciones iniciales de regeneración periodontal inducida por PDGF (hueso, cemento y ligamento periodontal), realizadas a finales de la década de 198039, se han publicado casi 100 estudios que demuestran sus efectos en el ligamento periodontal y las células del hueso alveolar, así como la regeneración del periodonto, tanto en animales como en el ser humano. Estos estudios han mostrado claramente el mecanismo de acción del PDGF, evidenciando la presencia de receptores celulares superficiales de PDGF en el ligamento periodontal y en las células óseas alveolares, así como elucidando los efectos estimuladores del PDGF en la proliferación y quimiotaxis de estas células40,41. En numerosos estudios animales39, 42-48, se ha demostrado que el uso del PDGF de secuencia recombinante humana isoforma BB (rhPDGF-BB) favorece la regeneración de los tejidos periodontales, incluyendo el hueso, el cemento y el ligamento periodontal. Además, un estudio clínico muy reciente que incluía 180 pacientes, ha demostrado la seguridad y eficacia de la combinación de rhPDGF-BB y β-TCP en los defectos periodontales49.
Métodos y materiales
Selección de pacientes
Se seleccionaron pacientes (n = 11) de edades comprendidas entre los 25 y 75 años que precisaban extracciones de premolares maxilares, consintieron al tratamiento, aceptaron participar en el estudio, no presentaban los criterios de exclusión presentados en la tabla 1 y estaban dispuestos a que se les colocara una corona implantosoportada para la sustitución del diente extraído.
Procedimientos quirúrgicos
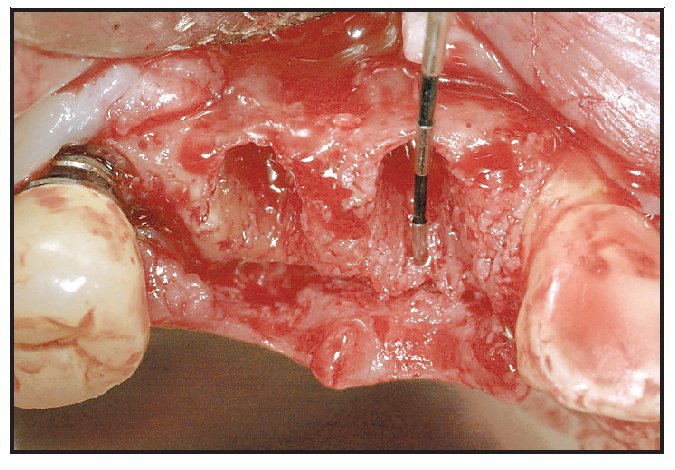
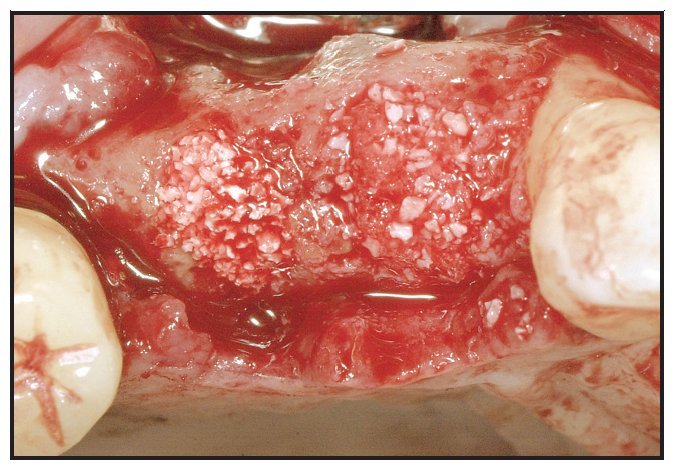
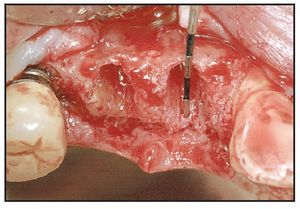
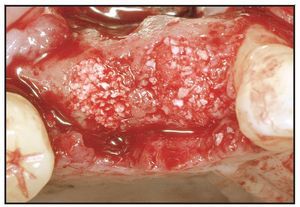
Los alveolos de extracción se asignaron aleatoriamente al tratamiento, bien con rhPDGF-BB y β-TCP (GEM21, Osteohealth), bien con rhPDGF-BB y un xenoinjerto (BioOss Collagen, Osteohealth). Después de la administración de un anestésico local, se efectuaron las extracciones dentales, utilizando técnicas mínimamente traumáticas, seguidas de un desbridamiento del alveolo y, antes de colocar el injerto óseo, se eliminó todo el hueso interradicular (figura 1). El material de injerto fue suministrado en «kit»: recipiente con β-TCP y jeringa separada con una solución de rhPDGF-BB (0,3 mg/ml). En el momento de la intervención, el médico saturó completamente las partículas de β-TCP o el xenoinjerto sustituto con la solución de rhPDGF-BB. Se añadió una jeringa de 0,5 ml de rhPDGF-BB para saturar completamente el material de injerto (bien 0,5 ml de β-TCP tal como lo envasa el fabricante, bien una porción del envase de 0,5 ml de colágeno que contiene el xenoinjerto). En una única jeringa (0,5 ml) había suficiente cantidad de rhPDGF-BB para tratar cada defecto sin necesidad de solución adicional. Tras hidratar adecuadamente el injerto y unir el rhPDGF-BB (15 minutos), se introdujo laxamente el material de injerto en los alveolos (figura 2). El injerto óseo se cubrió con injerto de tejido conectivo palatino pediculado para la contención y el cierre primario del injerto50. Para la sutura se utilizó Vicryl 4.0. Se dieron las instrucciones y medicaciones postoperatorias rutinarias, cuidando que ninguna prótesis contactara con la zona durante las dos primeras semanas de cicatrización.
Figura 1 La extracción dental se efectuó utilizando técnicas atraumáticas para conservar el alojamiento alveolar.
Figura 2 Injertos óseos saturados con rhPDGF-BB colocados laxamente en los alveolos. Se utilizó ,β-TCP en el lugar del segundo premolar y colágeno con xenoinjerto en el lugar del primer premolar.
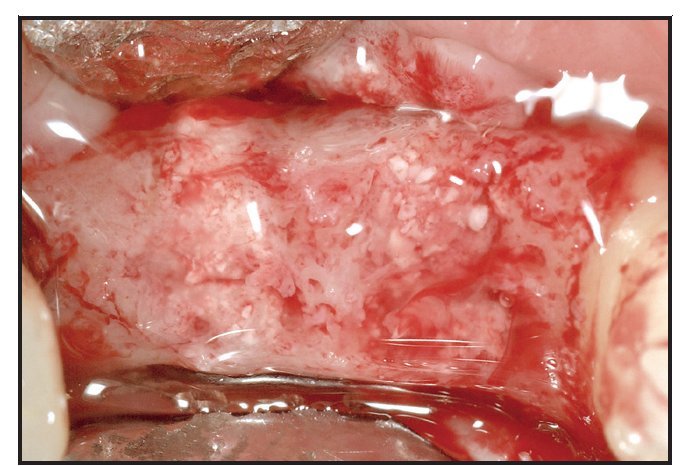
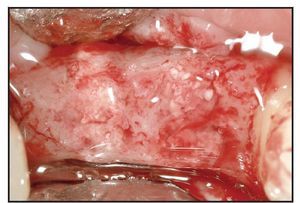
Ningún paciente desarrolló complicaciones postoperatorias. La toma de biopsias se programó para el momento del posicionado del implante, que se seguía de una fase de cicatrización de 12 semanas (figura 3).Figura 3 Vista de los alveolos injertados a los tres meses del postoperatorio y antes de tomar muestras.
Biopsias de núcleos
En la visita de posicionado del implante a los 3 meses, se tomó una biopsia con una trefina de 2,7 mm de diámetro interno (3,5 mm de diámetro externo). Las biopsias se dejaron dentro de la trefina y se colocaron en formalina tamponada neutra al 10 % para su fijación. Los implantes se posicionaron en los lugares de osteotomía creados después de las biopsias con la trefina.
Preparación histológica
Las muestras tomadas se introdujeron en formalina tamponada neutra al 10 % y se enviaron al Hard Tissue Research Laboratory, University of Minnesota, en donde se deshidrataron con una serie graduada de alcoholes durante 9 días. Después de la deshidratación, se infiltraron las muestras con una resina fotopolimerizable de inclusión (Technovit 7200 VLC, Kulzer). Tras 20 días de infiltración bajo constante agitación a una presión atmosférica normal, se moldearon y polimerizaron las muestras a luz de 450 nm, a una temperatura nunca superior a 40º C. A continuación, se prepararon las muestras utilizando la técnica de corte y pulido de Donath y Breuer51,52. Las muestras fueron cortadas a un grosor de 150 μm con el sistema de corte y pulido EXAKT (EXAKT Technologies). Después de ello, se pulieron los núcleos a un grosor de 45 a 65 μm utilizando una serie de discos de pulido (papel de lija) de grano 800 a 2.400 con el sistema de micropulido EXAKT. A continuación, se sometieron a un pulido final con 0,3 μm de pasta de pulido de alumina. Los cortes se tiñeron con azul de Stevenel y picrofucsina de Van Gieson para el examen histológico mediante evaluación microscópica de campo claro y polarizada.
Histomorfometría
Después de la preparación histológica no decalcificada, los núcleos se evaluaron morfométricamente. Todos los núcleos se digitalizaron al mismo aumento utilizando un microscopio Zeiss Axiolab y una cámara digital Nikon Coolpix 4500. Las mediciones histomorfométricas se completaron utilizando una combinación de Adobe PhotoShop (Adobe Systems) y el programa de dominio público NIH Image53. Se evaluaron al menos dos cortes de cada núcleo. Los parámetros evaluados incluyeron el área total del núcleo, el porcentaje de neoformación ósea y el porcentaje de material residual del injerto.
Resultados
Histología
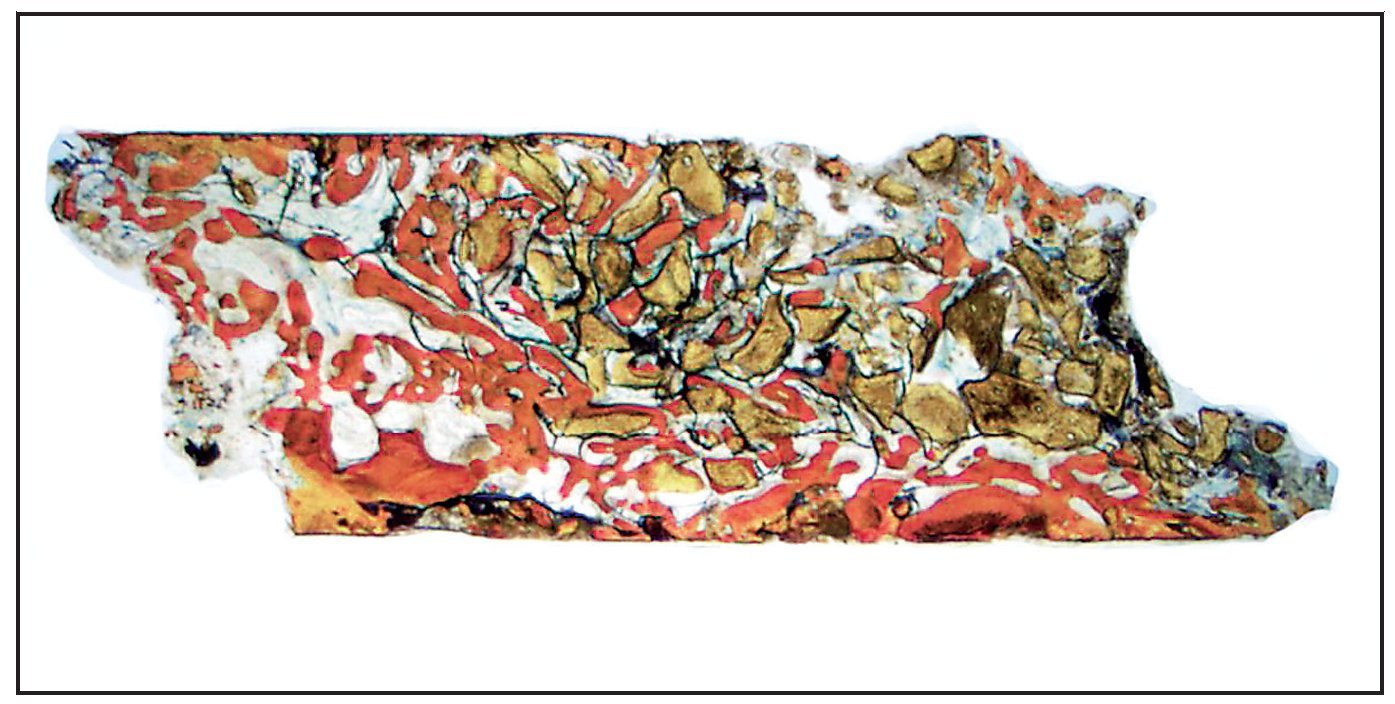
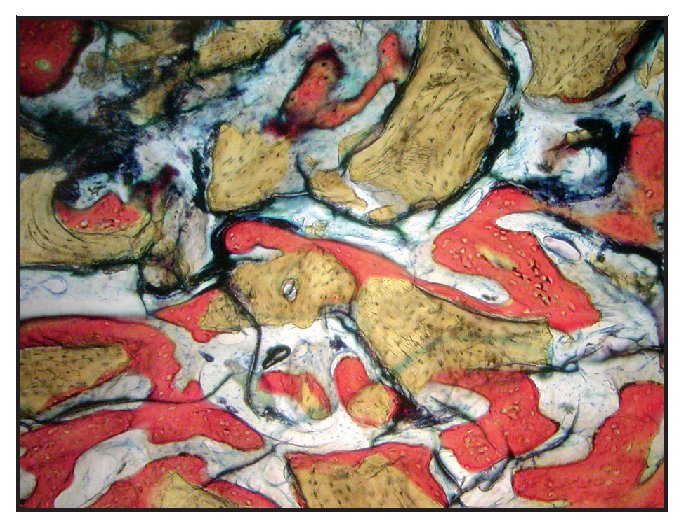
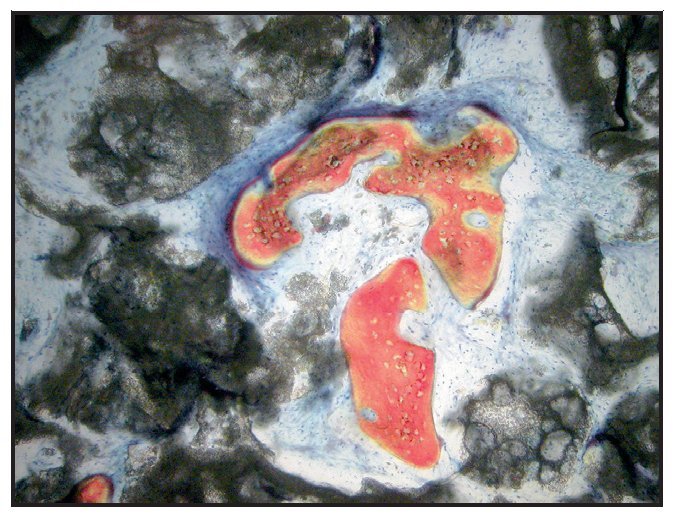
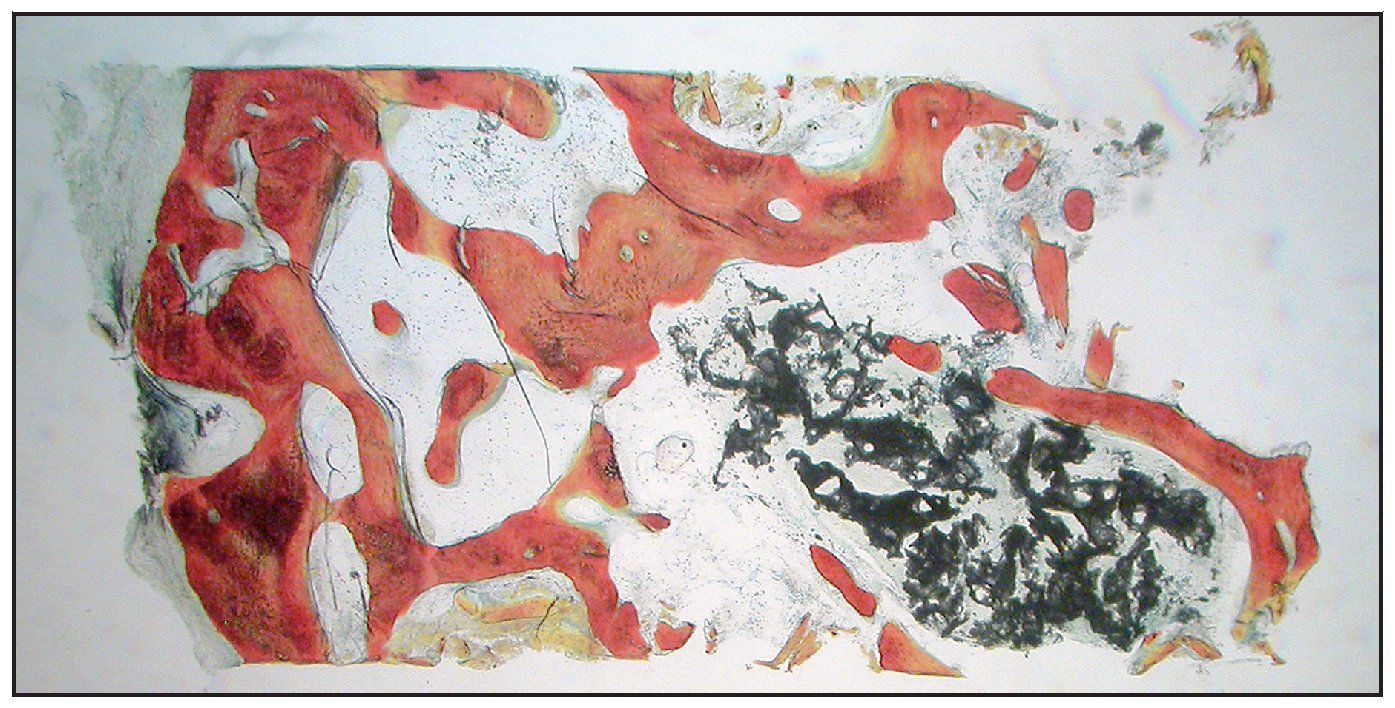
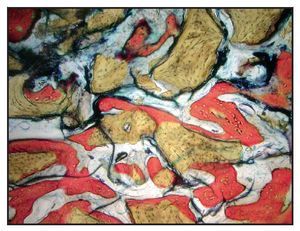
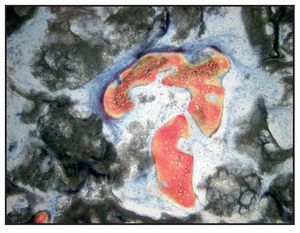
En la mayoría de las muestras, la evaluación cualitativa de los núcleos reveló más hueso nuevo en la región coronal de las muestras con xenoinjerto (figuras 4a y 4b), en comparación con las muestras con β-TCP (figuras 5a y 5b). La mayor parte de hueso vital se observó en la porción apical en ambos grupos. El hueso tendió a formarse a través de la aposición sobre las partículas del xenoinjerto, mientras que, con el β-TCP, el hueso nuevo era más de sustitución del material de injerto. En una de las zonas de β-TCP no pudo iniciarse la toma de muestras ni el procedimiento de implante a los tres meses. No se incluyeron los datos de esta zona como parte de los resultados histomorfométricos. La sustitución del β-TCP fue especialmente evidente en una muestra a largo plazo (11 meses). Esta muestra presenta un 39 % de hueso nuevo y un 10 % de β-TCP (figura 6).
Figura 4a Muestra tratada utilizando un xenoinjerto con rhPDGF-BB. Se muestra el núcleo completo, recogido a los tres meses (aumento: x25).
Figura 4b Puede apreciarse hueso nuevo (rojo) que se forma directamente en las partículas del xenoinjerto (oscuro) (aumento: x150)
Figura 5a Muestra tratada utilizando -TCP con rhPDGF-BB. Se muestra el núcleo completo, recogido a los tres meses (aumento: x25).
Figura 5b Puede apreciarse hueso nuevo (rojo) formándose independientemente de las partículas del -TCP (negro) (aumento: x150).
Figura 6 Muestra tratada utilizando -TCP con rhPDGF-BB. Se muestra el núcleo completo, recogido a los once meses (aumento: x25). Puede apreciarse hueso nuevo (rojo) formándose independientemente en las partículas del -TCP (negro). Las partículas de -TCP han sido sustituidas en gran medida por hueso (aumento: x25).
Histomorfometría
El tratamiento con rhPDGF-BB yβ-TCP dio lugar a un promedio del 21 % (rango 15 % al 31 %) de formación de hueso vital y a un promedio del 24 % de material de injerto particulado residual de β-TCP (cinco pacientes). El tratamiento con rhPDGF-BB y un xenoinjerto dio lugar a un promedio del 24 % (rango, 10 % al 51 %) de formación de hueso vital y a un promedio del 17 % de material particulado del xenoinjerto residual (seis pacientes).
Discusión
En muchas aplicaciones de injerto óseo oral, se ha estado utilizando la combinación de xenoinjertos y colágeno19, 54-56. Se ha establecido la teoría de que la presencia de colágeno disperso en el material de injerto óseo mineralizado derivado de bovinos favorece la capacidad de unión del rhPDGF-BB y ralentiza su posterior liberación, en comparación con el β-TCP, actualmente comercializado como portador del rhPDGF-BB. Decididamente se precisan más estudios de unión y liberación para evaluar los portadores potenciales de esta molécula particular bioactiva.
Mientras que se ha demostrado claramente que el rhPDGF-BB ofrece un planteamiento terapéutico eficaz para las aplicaciones de regeneración periodontal49, se dispone de pocos indicios sobre la regeneración ósea57,58. Simion y cols. han demostrado en un pequeño estudio en perros y en dos posteriores estudios en humanos, que el rhPDGF-BB en combinación con bloques de hueso esponjoso bovino desproteinizado puede dar lugar a una regeneración ósea vertical significativa57,58. Sin embargo, otros autores han sugerido que, en modelos animales, el PDGF puede presentar un efecto negativo dosis-dependiente en la formación ósea impidiendo las acciones de los factores de crecimiento, como las osteogeninas, y reduciendo la reabsorción del injerto, o bien desempeñar un papel añadido insignificante en favorecer la regeneración ósea y la osteointegración59-61. Las diferentes respuestas documentadas muestran la importancia de estudios controlados para evaluar los portadores y la concentración óptima para la formación ósea.
La evaluación cualitativa de los núcleos en este estudio ha revelado una mayor neoformación ósea en la región coronal de las muestras con xenoinjerto, en comparación con las muestra con β-TCP. La evaluación de todo el núcleo reveló que el porcentaje de hueso vital encontrado fue similar en ambos grupos. Sin embargo, se observó más hueso vital en la porción apical de ambos grupos. Esto se debe a la contribución de dos factores. En primer lugar, el hueso nuevo se forma a partir de las caras apical y lateral del alveolo, por lo que la región coronal central fue la última en mineralizarse, lo cual se ha demostrado en estudios en animales2,62. En segundo, la técnica de recogida de núcleos no siempre se situará en la región central del alveolo, ni tampoco incluirá su extensión más apical. Los núcleos se toman de la posición del implante más deseable a partir de un plan de prótesis. Esto significa que la recogida de núcleos de los alveolos cicatrizados que previamente contenían dientes con raíces curvadas, no incluirá exclusivamente las áreas de neoformación ósea. La utilización de premolares maxilares minimizó este efecto en el estudio y ofrecía la ventaja de poder tomar núcleos de la región más central del alveolo cicatrizado. Por el contrario, la utilización de caninos o incisivos tiene el inconveniente de las exigencias protésicas, requiriendo que se tome el núcleo a partir de una posición ligeramente palatina a la región central del alveolo. Si bien un defecto más complicado, como la presencia de dehiscencias vestibulares, resulta más atractivo, este tipo de defectos no es tan uniforme y tiende a presentarse más habitualmente en pacientes con antecedentes de inflamaciones o tratamientos, como la ortodoncia. Al utilizar técnicas de extracción conservadoras, cuyo objetivo es mantener la tabla vestibular, se limita el número de pacientes con defectos óseos significativos, por lo que el alveolo premolar es un modelo realista. También se sabe que estos defectos en el alveolo de extracción cicatrizan irregularmente con relleno óseo normal en ausencia de un injerto óseo.
Conclusión
Dentro de los límites de este estudio, el PDGF combinado con β-TCP o con un xenoinjerto y colocado en defectos de alveolos de extracción, dio lugar a un volumen similar de hueso y a una conservación adecuada de la cresta, permitiendo el posicionado correcto del implante y su posterior restauración. Es evidente que se precisan más estudios con un tamaño de muestra superior y controles para evaluar el impacto de los diferentes factores de crecimiento, inclusive el PDGF, en el crecimiento óseo dentro de los alveolos de extracción y otros defectos alveolares frecuentemente observados durante la reconstrucción de implantes.
Agradecimientos
Los autores quieren expresar su agradecimiento a Mark Reynolds, DDS y Kathleen Heil, RN, por su colaboración. Este proyecto ha sido patrocinado por Luitpold Pharmaceuticals.
Correspondencia: Dr. Bradley S.
McAllister, 11525 S.W. Durham Rd., Suite D-6, Tigard, OR 97224;
fax: 503/968-5419;
e-mail: mcallister@portlandimplantdentistry.com