Objetivo: Describir las características clínico-patológicas de los tumores del estroma gastrointestinal (GIST), haciendo énfasis en grado histológico.
Material y métodos: Se realizó el estudio de 16 pacientes con diagnóstico histopatológico de tumores del estroma gastrointestinal (GIST), del Centro Oncológico Estatal ISSEMYM, desde septiembre del 2005 hasta enero del 2013, describiendo sus características clínico-patológicas principales.
Resultados: Se encontraron 16 pacientes con diagnóstico de GIST, el promedio de edad fue 54 años; nueve de los pacientes fueron hombres (56.25%) y siete (43.75%), mujeres. La localización más frecuente fue estómago, seis casos (37.5%). Según los criterios de Fletcher, 11 (68.75%) fueron de alto riesgo, dos (12.5%) de grado intermedio y tres (18.75%) de bajo grado.
Conclusiones: Los tumores del estroma gastrointestinal representan un grupo de tumores poco frecuentes, con histología variada, cuyo pronóstico depende en gran medida de su grado histológico, de ahí la importancia de realizar la clasificación adecuada según el sitio afectado desde su inicio.
Objective: Describe the clinical and pathological characteristics of the gastrointestinal stromal tumors (GIST), emphasizing the histological grade.
Material and methods: A study of sixteen patients with histopathological diagnosis of Gastrointestinal Stromal Tumors was done in the Centro Oncológico Estatal ISSEMYM, between September 2005 and January 2013, and their clinical and pathological features were described.
Results: Sixteen patients with GIST diagnosis were found the age average was 54 years; nine (56.25%) patients were men, and seven (43.75%) women. The most frequent localization was stomach, with six (37.5%) cases. According to Fletcher criteria, 11 (68.75%) were at high risk, two (12.5%) at intermediate risk and three (18.75%) low risk.
Conclusions: Gastrointestinal Stromal Tumors represent an uncommon group of tumors, with a wide histology, which forecast depends specially in the histological grade, that´s the reason why the initial classification according to the affected site is so critical.
> Introducción
Los tumores del estroma gastrointestinal son la neoplasia mesenquimatosa más frecuente intraabdominal.1 Fueron inicialmente descritos por Golden y Stout como tumores originados de células mesenquimatosas en la pared intestinal, y recibieron múltiples nombres, entre los que se incluyeron: leiomioblastoma, leiomioma y leiomiosarcoma, suponiendo que su origen era de músculo liso; otros propusieron un origen de vaina nerviosa periférica,2 sin embargo, los estudios morfológicos, de microscopía electrónica e inmunohistoquímica, demostraron que estos tumores se originan o se diferencian de las células intersticiales de Cajal o sus células precursoras.3-5
En 1998 Hirota y colaboradores, publicaron que casi todos estos tumores poseen mutaciones en el gen c-kit (CD117), lo cual conlleva a la formación de proteínas KIT con activación independiente de ligando,6 este descubrimiento revolucionó el conocimiento de este tumor. Tiempo después, se identificó que un subgrupo de estos tumores posee una mutación en el receptor alfa del factor de crecimiento derivado de plaquetas (PDGFRA), la presencia de estas mutaciones es importante ya que se correlaciona con el beneficio de la terapia "blanco" específica para esta neoplasia.7
La definición actual de tumor del estroma gastrointestinal (GIST), consiste en una neoplasia mesenquimatosa que puede surgir en cualquier sitio del tracto gastrointestinal, que típicamente expresa CD117 y presenta mutación para KIT o PDGFRA.3
La incidencia de los GIST de acuerdo al registro de vigilancia epidemiológica de los Estados Unidos de América (SEER), es de 0.32 por 100 000 habitantes por año, con una prevalencia de 1.62 por 100 000 habitantes. Un estudio francés mostró una incidencia de 1.12 por 100 000 habitantes. Sin embargo, ambos datos podrían ser subestimaciones de la incidencia real de esta neoplasia, y se espera que con la mejoría en los procedimientos diagnósticos, estos datos se incrementen.8
La mayor parte de los tumores se presentan entre la cuarta y octava década de la vida, con una media aproximada de 60 años, sin predilección por algún género; la mayor parte de los casos se presenta en el estómago (50%-60%), seguido de yeyuno e íleon (30%) y en menor cantidad duodeno, colon y recto, esófago (5% cada uno, aproximadamente), excepcionalmente se presentan en el mesenterio, omento o retroperitoneo, sin relación con algún órgano del tracto gastrointestinal a los cuales se les ha denominado "tumores del estroma extragastrointestinal". Los tumores que se presentan en la infancia, presentan aspectos clínico-patológicos distintos suficientes para considerarse de manera separada.3,4,9,10
La gran mayoría son esporádicos, sin embargo, hasta 5% se asocian a un síndrome neoplásico, ya sea neurofibromatosis tipo1, tríada de Carney o síndrome de GIST familiar, entre otros.1,3,11
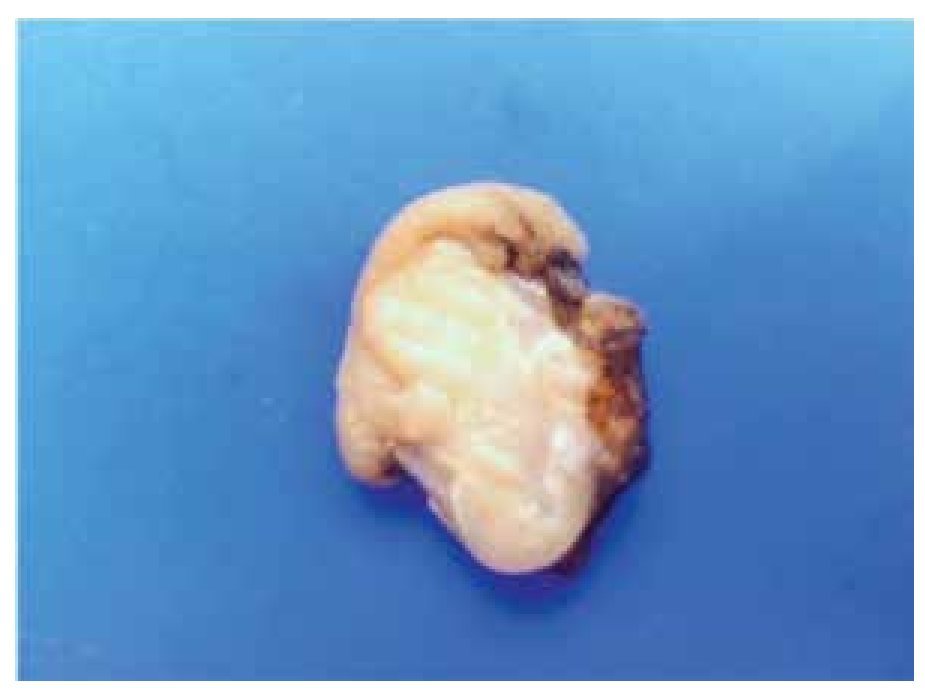
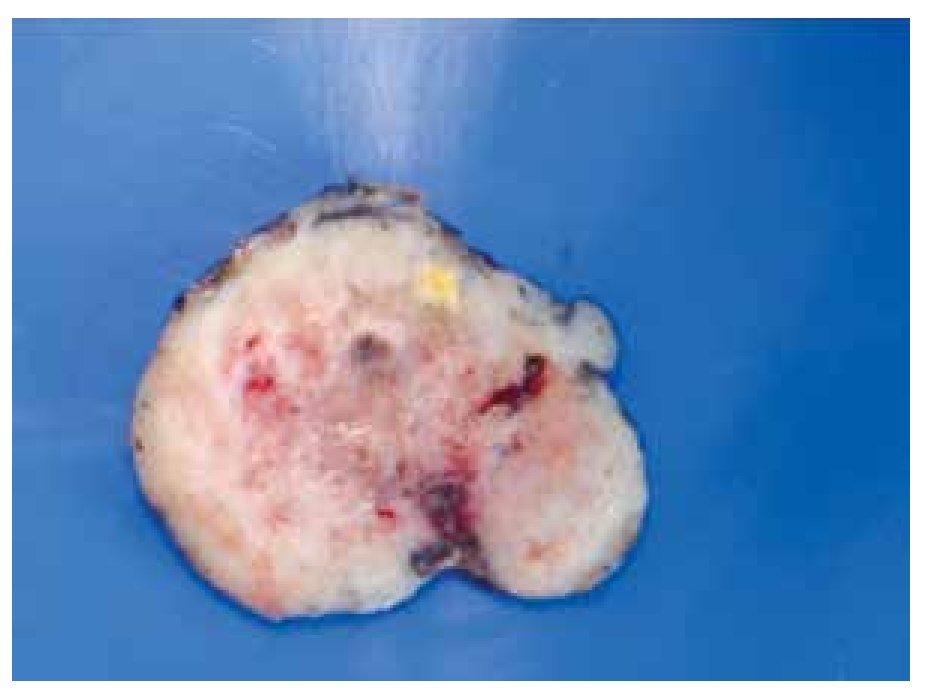
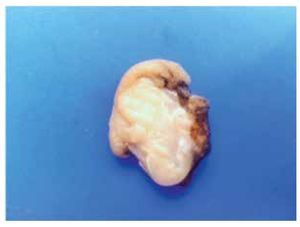
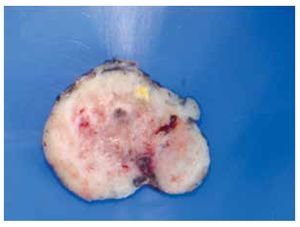
Macroscópicamente son tumores bien circunscritos, confinados a la muscularis propia del tubo digestivo (Figura 1). Presentan una superficie rosada o blanquecina con focos hemorrágicos, cambios quísticos degenerativos o necrosis11 (Figura 2).
> Figura 1. Fotografía macroscópica de un tumor submucoso duodenal de 1.8 cm.
> Figura 2. Fotografía macroscópica de lesión del estómago de 23 cm, que muestra hemorragia y necrosis.
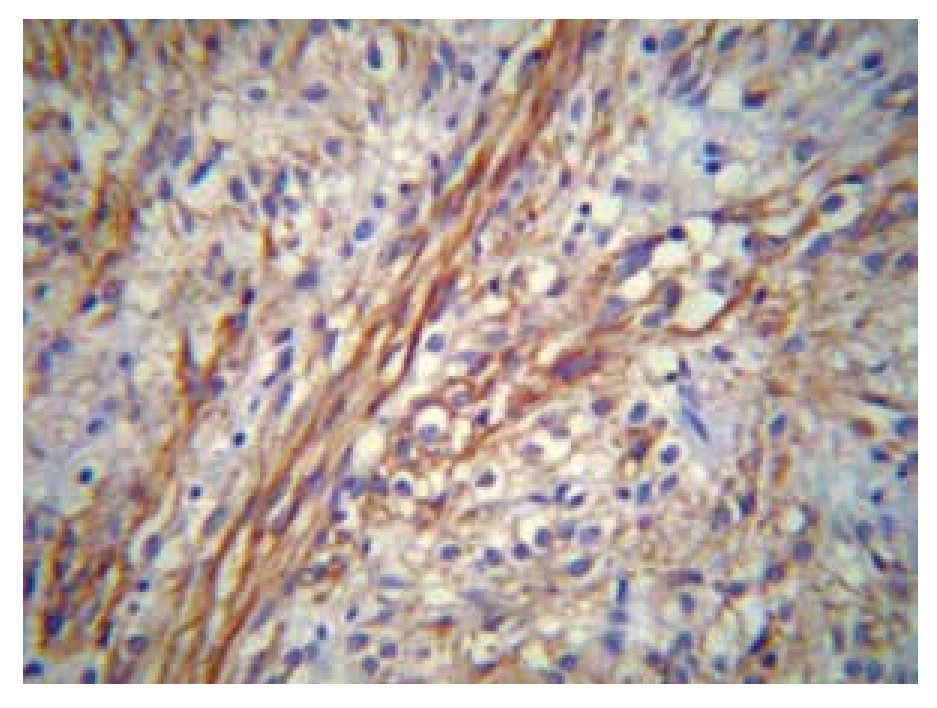
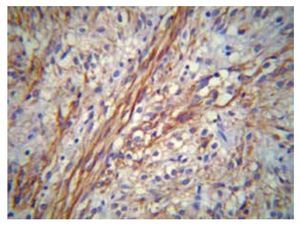
Microscópicamente, los GIST exhiben tres patrones histológicos fundamentales: fusiforme (70%), epitelioide (20%) y mixto (10%). El patrón fusiforme presenta una mejor expectativa de vida.12-16 Los GIST son neoplasias derivadas de las células intersticiales de Cajal, células "marcapaso" gastrointestinales encargadas de la regulación de la peristalsis intestinal, la presencia de áreas de aspecto estelar entre las células neoplásicas con el aspecto de una matriz laxa de fondo, es característico por la presencia de prolongaciones estelares de la célula de Cajal (Figura 3).
> Figura 3. Fotografía microscópica que muestra positividad membranal y citoplásmica para CD117 en un GIST, fusocelular y epitelioide (40x).
> Material y métodos
El presente estudio es un análisis retrospectivo, descriptivo y observacional, de serie de casos. Se analizaron los registros del archivo de patología del Centro Oncológico Estatal ISSEMYM, en el periodo comprendido entre septiembre 2005 y enero 2013, identificándose los casos diagnosticados como GIST.
Se revisaron los expedientes clínicos y el informe de patología correspondientes para la obtención de datos, adicionalmente en cada caso se reexaminaron los cortes histológicos. Se identificaron y tabularon las siguientes variables: edad, sexo, localización, tamaño, tipo y grado histológico de la lesión; perfil de inmunohistoquímica (CD117); síntomas y signos iniciales; tratamiento quirúrgico; metástasis al momento del diagnóstico y localización de éstas; si se prescribió mesilato de imatinib; fecha de último control; y si se encontraba con enfermedad, libre de ésta o falleció.
> Resultados
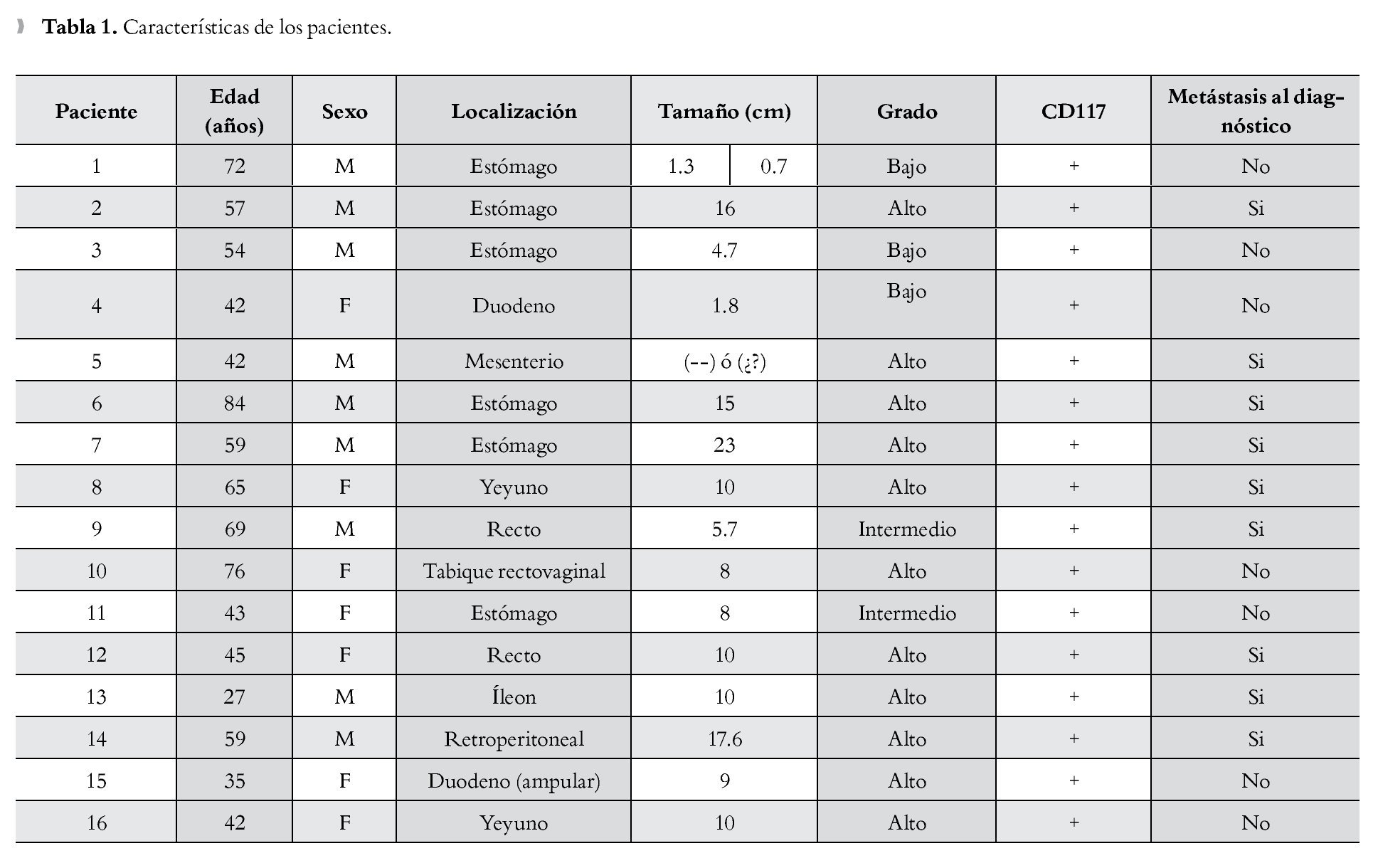
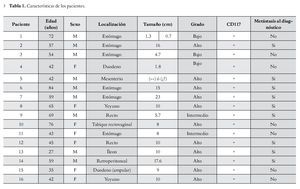
Se identificó a un total de 16 pacientes, cuyas principales características, se muestran en la Tabla 1.
La media de edad identificada fue 54 años; el rango de edad osciló entre 27 y 84 años. Nueve de los pacientes fueron hombres (56.25%) y siete (43.75%) mujeres.
La sintomatología principal fue el dolor abdominal que se presentó en el 31.25% de los pacientes, seguido de sangrado de tubo digestivo en el 25%, el 18.7% presentó pérdida de peso, en promedio 6 Kg por mes. En dos casos (12.5%) el hallazgo fue incidental; otros síntomas como cambios en los hábitos intestinales se presentaron en el 12.5% de los pacientes.
La localización más frecuente fue el estómago, encontrando seis casos (37.5%), recto dos casos (12.5%), yeyuno dos casos (12.5%), duodeno, íleon, tabique rectovaginal, mesenterio, ámpula y retroperitoneo, tuvieron un caso (6.25%) cada uno.
En cuanto al tamaño se encontró que la media fueron 9.4 cm, la lesión de menor tamaño fue de 0.7 cm y la más grande fue de 23 cm.
Al momento de la presentación se encontraron metástasis en nueve (56.2%) de los pacientes. Los sitios más comunes de metástasis fueron hígado en dos casos (22.2%), hígado y mesenterio dos casos (22.2%), páncreas e hígado un caso (11.1%), hígado e implantes peritoneales un caso (11.1%), un caso (11.1%) con metástasis en próstata, vesículas seminales, con nódulos subdiafragmáticos, nódulos paravesicales en otro caso (11.1%) y metástasis pulmonares un caso (11.1%).
Se resecaron quirúrgicamente en 14 pacientes (87.5%), y en dos se consideró irresecable el tumor. Para cuando se recabaron los datos, siete (43.75%) pacientes estaban en tratamiento adyuvante con mesilato de imatinib.
De acuerdo con los criterios de Fletcher, se clasificaron las lesiones cuando se evaluó el tamaño, localización y número de mitosis, encontramos de los 16 pacientes estudiados, 11 (68.75%) resultaron ser de alto riesgo, dos (12.5%) de grado intermedio y tres (18.75%) de bajo grado.
En relación al tipo histológico, el más frecuente fue el fusocelular con 10 casos (62.5%), de tipo mixto (epitelioide y fusocelular) se encontraron cinco casos (31.25%) y de tipo epitelioide un caso (6.25%). Los 16 casos (100%), fueron positivos para CD117, cinco casos de nueve fueron positivos para CD34, y un caso de cinco fue positivo para la proteína S100.
De los 16 pacientes, cinco (31.25%) se encontraban libres de enfermedad hasta el final del estudio, siete (43.75%) con enfermedad y cuatro (25%) fallecieron. Las cuatro muertes estuvieron relacionas con progresión de la enfermedad, tres correspondieron a un tumor de alto grado y uno de grado intermedio.
De manera significativa, el caso localizado en el tabique rectovaginal, contaba con el antecedente de una cirugía previa en ese mismo sitio, del cual se desconoce la histología, siete años previos a la actual cirugía. En un caso, el tumor infiltró páncreas, y en otro, próstata y vesículas seminales, hechos poco frecuentes, este último incluso cursó con elevación del antígeno prostático específico.
Además se identificaron asociaciones a otras neoplasias en tres casos, las cuales fueron: carcinoma papilar de tiroides, oligodendroglioma y carcinoma gástrico cada uno, que si bien no son frecuentes, se tiene que tomar en cuenta que ya algunos autores sugieren la posibilidad de más neoplasias asociadas a la tríada de Carney de las inicialmente descritas.14
> Discusión
El Centro Oncológico Estatal ISSEMYM, es el centro de referencia para pacientes oncológicos derechohabientes de los trabajadores del gobierno del Estado de México, con una población derechohabiente cercana a un millón de personas.
En esta serie, los GIST representaron tan sólo el 0.2% de los tumores malignos reportados en el COE para este periodo de tiempo (septiembre del 2005 hasta enero del 2013), sin embargo esto puede deberse a la selección de pacientes referidos.
La mayoría de los GIST permanecen silentes hasta que alcanzan un gran tamaño. Los síntomas varían de acuerdo a la localización y al tamaño. Los GIST sintomáticos se presentan muchas veces con síntomas inespecíficos incluyendo dolor abdominal, fatiga, dispepsia, náusea, anorexia, pérdida de peso, fiebre y obstrucción. Se puede presentar como sangrado gastrointestinal crónico, debido a la ulceración de la mucosa o a la ruptura del tumor. Algunos pacientes con GIST grandes pueden tener masas palpables.15
En la presente serie, los síntomas inespecíficos fueron los principales, siendo el dolor abdominal el predominante, seguido de sangrado de tubo digestivo, pérdida de peso, en promedio 6 Kg por mes; y en dos casos los pacientes se encontraban asintomáticos.
Es importante tener un alto grado de sospecha al iniciar el protocolo de estudio, ya que a pesar de ser poco frecuentes, deben considerarse dentro del diagnóstico diferencial del sangrado de tubo digestivo.16-18
El tamaño reportado en lesiones del estómago varía entre unos cuantos milímetros hasta más de 40 cm, con un tamaño promedio de 6 cm en las series de casos más grandes reportadas. Aparentemente el tamaño del tumor es uno de los factores que contribuyen a los síntomas clínicos.15
Resalta en este estudio las localizaciones extra-gastrointestinales (mesenterio, tabique rectovaginal y omento), sin embargo, este hecho, al igual que la incidencia, pueden deberse a lo seleccionado de la población estudiada, y el resto de las localizaciones concuerdan con lo informado. Algunas de éstas representan un reto terapéutico, al ser sometidos a cirugías extensas como recientemente se informaron dos casos de GIST duodenal sometidos a gastropancreatoduodenectomía.19-24
Al menos el 50% a 60% de los tumores GIST, son lesiones primarias al momento del diagnóstico.25 La enfermedad metastásica se halla entre 15% a 50% de los pacientes cuando son vistos por primera vez,26 nosotros identificamos hasta en el 56.2% enfermedad metastásica, en los sitios habitualmente descritos. Además encontramos metástasis en ganglios linfáticos en uno de los casos, esto último, es un hecho infrecuente que se ha asociado a un comportamiento agresivo, tal como en nuestro caso. Raramente los GIST se presentan con un patrón agresivo de enfermedad, caracterizado por innumerables nódulos intraperitoneales o como metástasis hepáticas; los sitios extraabdominales son infrecuentes para metástasis.10
Existe una entidad rara, llamada tríada de Carney, que ocurre generalmente en mujeres jóvenes, GIST, paraganglioma y condroma pulmonar. Sin embargo, sólo una cuarta parte de los pacientes manifiesta el síndrome completo.14
En nuestra serie se encontró un caso con un GIST en mesenterio, que estaba asociado a un oligodendroglioma parietal; además de las otras asociaciones ya comentadas, como son el carcinoma papilar de tiroides y el carcinoma gástrico.
El uso de inmunohistoquímica y actualmente de pruebas de patología molecular, ha revolucionado el diagnóstico del GIST. La expresión intensa de CD117 (proteína KIT), se observa en la mayoría de los casos de todas las variantes histológicas de los GIST, independientemente de su grado.
Además del CD117, otros marcadores útiles para el diagnóstico de los GIST son: antígeno CD34, que se expresa en el 60%-70% de los GIST, pero como lo expresan también otros tumores, no es específico; en años más recientes, se describió positividad para DOG-1. La actina es otro elemento que se expresa en los GIST en 20%-40% de los casos; mientras que la positividad a desmina es muy rara en los GIST. La proteína S100 por lo general no se encuentra positiva en los GIST.16
La trascendencia de un diagnóstico certero y preciso resulta cuando se toma en cuenta que, debido a que estos tumores son quimio y radiorresistentes, los pacientes con tumores irresecables tenían un rango medio de sobrevida de 10 a 20 meses hasta hace algunos años. En la actualidad, la sobrevida ha aumentado debido a la notable respuesta que estos tumores han tenido a la terapia biología específica con mesilato de imatinib. Los GIST presentan mutaciones activadas en el protooncogén del receptor tirosina cinasa, c-Kit o del PDFGRA, y el descubrimiento de un inhibidor específico de esta tirosina cinasa, el mesilato de imatinib, cambiaron radicalmente el pronóstico de estos pacientes.14 En esta serie, se prescribió tratamiento adyuvante con mesilato de imatinib en siete pacientes (43.75%), los cuales presentaban metástasis al momento del diagnóstico.
Los sitios más comunes de mutación de KIT en los GIST, se encuentran en el exón 11 (65%-70%); otra mutación se ha encontrado en el dominio extra-celular de KIT codificado por el codón 9, en el 10%-20% de los casos. Otras mutaciones raras en el exón 13 se han encontrado en el 1.2% de los casos, y en el exón 17 en 0.6% de los casos. Alrededor del 5%-10% de los GIST tienen mutaciones en el receptor derivado del factor de crecimiento plaquetario. En cuanto a la respuesta al tratamiento, los pacientes con mutación en el exón 11 tiene una tasa de respuesta significativamente mayor al mesilato de imatinib, que los pacientes con mutación en el exón 9.25-28
A pesar que el presente trabajo no tiene como objetivo evaluar el tratamiento, podemos concluir que un diagnóstico preciso, dando un grado histológico adecuado e incluso el resultado de las pruebas de patología molecular (determinación de mutaciones), tiene un impacto terapéutico y pronóstico importante, en el manejo de los GIST.
> Financiamiento
No se recibió ningún patrocinio para realizar este artículo.
> Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
> Agradecimientos
A Reyna Lizeth González Jiménez, secretaria del Departamento de Patología, por su invaluable ayuda en la búsqueda de información para este manuscrito.
Correspondencia:
Dr. Eduardo Gómez Plata.
Av. Solidaridad Las Torres N° 101, Toluca, Méx., México.
Teléfono: (722) 276 6820, ext. 3541.
Correo electrónico: egp44@hotmail.com