Introducción: La infección por el virus del papiloma humano (VPH) podría ser uno de los mecanismos que explique el desarrollo de neoplasias en la piel genital. La presencia de coilocitos parece estar relacionada con la aparición de lesiones malignas o pre-malignas del área genital externa; sin embargo, este hallazgo histológico no es un indicador definitivo de infección por VPH.
Objetivo: Evaluar si la infección por VPH determinada mediante inmunoperoxidasa es más frecuente en las neoplasias pre-malignas o malignas, que en las neoplasias benignas de la piel genital.
Material y métodos: Estudio analítico, observacional, retrospectivo, de casos y controles. Se estudiaron todas las biopsias de piel genital con diagnóstico de alguna neoplasia pre-maligna o maligna y un número igual de controles (lesiones benignas). La presencia de VPH se determinó mediante inmunoperoxidasa. Se utilizó Epi InfoTM versión 3.4.3 para el análisis estadístico.
Resultados: El 5.56% de las lesiones malignas o pre-malignas y 8.33% de las benignas fueron positivas por VPH. El riesgo de encontrar VPH fue menor en las lesiones malignas o pre-malignas que en las benignas (OR=0.647; 0.1015-4.1242). Esta relación no alcanzó significancia estadística (p=0.5).
Conclusión: No se pudo demostrar si la infección por VPH es más frecuente en las lesiones malignas o pre-malignas. El bajo porcentaje de positividad por VPH en estas lesiones podría ser explicado, al menos en parte, porque el genoma del VPH podría encontrarse integrado al genoma de las células neoplásicas. De esta manera, no habría una infección productiva que pudiera detectarse mediante inmunoperoxidasa.
Introduction: Human papillomavirus (HPV) infection might be one of the mechanisms that could explain the development of genital skin neoplasms. The presence of koilocytes seems to be related to the diagnosis of malignant and pre-malignant neoplasms; however this histological finding is not a definitive indicator of HPV infection.
Objective: To evaluate if HPV infection determined with immunoperoxidase is more frequent in malignant and pre-malignant neoplasms than in benign neoplasms of genital skin.
Material and methods: Analytical, observational, retrospective, case-control study. All the genital skin biopsies with diagnoses of malignant or pre-malignant neoplasms and the same amount of controls (benign lesions) were studied. The presence of HPV was determined with immunoperoxidase. Epi InfoTM v. 3.4.3 was used for the statistical analysis.
Results: The HPV was found in 5.56% of malignant and pre-malignant lesions and in 8.33% of benign lesions. The risk to find HPV was lower among malignant and pre-malignant lesions when compared with benign lesions (OR=0.647; 0.1015-4.1242). This relationship did not reach statistical significance (p=0.5).
Conclusions: We could not prove if HPV infection is more frequent in malignant or pre-malignant neoplasms of genital skin. The low percentage of HPV positivity in these lesions could be explained, at least in part, by the fact that the HPV genome may be integrated into the neoplastic cell genome. Therefore, there would not be a productive infection that could be detected by immunoperoxidase.
• Introducción
En México, según los datos del Registro Histopatológico de Neoplasias Malignas, en el 2003, el cáncer de piel fue la principal causa de cáncer en hombres mexicanos (6 555 casos) y la tercera en mujeres (7 222 casos).1 El carcinoma de células escamosas (CCE) es el segundo cáncer de piel más frecuente en la población caucásica, representando alrededor del 20% de los casos.2-5 Ocurre con más frecuencia en las áreas fotoexpuestas; sin embargo, también puede aparecer en áreas cubiertas como el área genital.2 El cáncer de vulva representa alrededor del 4% de todas las neoplasias malignas ginecológicas, siendo el CCE el tipo más frecuente.6 El cáncer de pene más frecuente es el CCE, representando el 95% de los casos de cáncer de pene y el 0.3% a 0.5% de todas las malignidades de los varones en Europa y Estados Unidos.5,7-9
Las neoplasias del área genital externa se asocian a elevada morbilidad y mortalidad si no son tratadas tempranamente, y su terapéutica no está exenta de efectos adversos. No se conocen bien los mecanismos fisiopatológicos que inducen al desarrollo de las neoplasias de los genitales externos; pero uno de los mecanismos fisiopatológicos que ha sido propuesto como explicación para el desarrollo de dichas neoplasias es la infección de las células epiteliales por el virus del papiloma humano (VPH). Existen varios mecanismos patogénicos que podrían explicar la relación entre los VPH de las mucosas y el desarrollo de cáncer epitelial, especialmente de CCE. Los genes E5, E6 y E7 del VPH son potentes oncogenes que favorecen la desregulación del ciclo celular, el aumento de la proliferación y sobrevida de las células de las malignidades asociadas a VPH.10-13
En un estudio que realizamos previamente, encontramos coilocitos en el 62.2% de las biopsias de lesiones malignas/pre-malignas del área genital, con respecto a sólo un 8.1% de las lesiones benignas de la misma área. El riesgo de encontrar coilocitos fue mayor en las lesiones malignas o pre-malignas que en las lesiones benignas (OR=18.62; 4.80-72.15; p<0.0001).14 Es importante destacar que los coilocitos son el hallazgo histológico más sugestivo de infección de las células epiteliales por VPH, por lo que podrían considerarse un buen indicador de dicha infección.15-19 Sin embargo, algunas investigaciones parecen indicar que los coilocitos no son un marcador confiable de infección por VPH. En un estudio en el que se utilizó PCR para determinar la presencia VPH en lesiones de cuello uterino, se encontró que la presencia de atipia coilocítica y de binucleación tenían una sensibilidad de 88.89% y de 75%, respectivamente, para detectar la presencia de VPH; sin embargo, su especificidad era muy baja, siendo de 29.41% y de 52.94%, respectivamente. La utilización de la presencia de coilocitos como indicador de infección por VPH podría resultar en alrededor de un 30% de falsos positivos.20 Otro estudio en el que se comparó la presencia de coilocitos con la PCR para la determinación de la infección por VPH en CCE orales y de orofaringe, reveló la presencia de coilocitos en sólo el 42.8% de las muestras positivas por PCR; mientras que el 34.5% de los casos negativos por PCR mostraron la presencia de coilocitos.15
Esto nos demuestra que la presencia de coilocitos es sugestiva de la infección por VPH; pero no es un hallazgo que demuestre con absoluta certeza esta infección.20
Es por esto que, a pesar de que nuestro anterior estudio demostró que la presencia de coilocitos está relacionada con el diagnóstico de lesiones malignas y pre-malignas del área genital, no podemos estar totalmente seguros de que esta relación pueda ser atribuida al VPH, debido a que la presencia de coilocitos no es un hallazgo patognomónico de la infección por este virus.14 Para lograr una determinación más confiable de la infección por VPH, se requiere la utilización de técnicas de inmunoperoxidasa o de biología molecular. Es por esta razón que el objetivo de la presente investigación es evaluar si la infección por VPH determinada mediante inmunoperoxidasa, es más frecuente en las neoplasias pre-malignas o malignas que en las neoplasias benignas de la piel genital en población mexicana.
• Material y métodos
Estudio analítico, observacional, retrospectivo, de casos y controles. Los casos fueron todas las biopsias de piel que habían sido diagnosticadas histopatológicamente con alguna neoplasia pre-maligna o maligna del área genital externa (papulosis bowenoide, enfermedad de Bowen, eritroplasia de Queyrat, neoplasia intraepitelial vulvar o CCE), en el Servicio de Dermatopatología del Hospital General de México "Dr. Eduardo Liceaga" entre 2008 y 2010. Los controles fueron biopsias del área genital que tuvieron diagnósticos distintos de alguna neoplasia pre-maligna o maligna, durante el mismo periodo (lesiones benignas). Todos los casos fueron estudiados y la misma cantidad de controles fueron seleccionados al azar (lotería). Se excluyeron del grupo de casos, todas las biopsias que no tenían un diagnóstico histopatológico seguro o definitivo. Se excluyeron del grupo de los controles todas las biopsias de piel que no tenían diagnóstico histopatológico definitivo o que habían tenido diagnósticos de neoplasias malignas o premalignas en el pasado. Se excluyeron de ambos grupos, todas las biopsias cuyo diagnóstico del archivo no coincidía con el del informe histopatológico y, todas las biopsias cuyos bloques no contenían suficiente tejido para trabajar o que habían sido retirados por el paciente o destruidos por el paso del tiempo. Las variables estudiadas fueron sexo, edad, tipo de lesión del área genital externa (maligna/pre-maligna vs. benigna) y presencia de VPH. La presencia de VPH se determinó mediante inmunoperoxidasa.
A partir de los bloques de parafina seleccionados, en el laboratorio de Dermatopatología se realizó la prueba de inmunoperoxidasa para VPH, utilizando un anticuerpo monoclonal de ratón anti-VPH (Clon SB24, Bio SB Inc., Santa Bárbara, California), siguiendo las instrucciones del fabricante.
Cada laminilla fue analizada con un microscopio de luz de dos cabezas (Carl Zeiss®, Jena, Alemania) con el fin de determinar la presencia de VPH. La presencia del cromógeno en el núcleo de las células (color marrón oscuro) fue utilizada como indicador de que dicha célula se encontraba infectada por el VPH. El análisis estadístico se realizó con el programa informático Epi InfoTM versión 3.4.3; se determinaron frecuencias absolutas y relativas (porcentaje) para cada variable. Se calculó el odds ratio (OR) para encontrar VPH en las lesiones malignas/pre-malignas con respecto a las lesiones benignas. La significancia estadística se determinó mediante el test exacto de Fisher (presencia de VPH).
No se realizaron intervenciones diagnósticas o terapéuticas que pudieran comprometer la integridad o hacer daño físico o moral a los pacientes. Respetamos los principios de la Declaración de Helsinki de 1975 con las modificaciones de 1993, el acuerdo que al respecto publicó la Secretaría de Salud el 26 de enero de 1982 y la Ley General de Salud de México. Este trabajo fue revisado y aprobado por las Comisiones de Ética y de Investigación del Hospital General de México "Dr. Eduardo Liceaga".
• Resultados
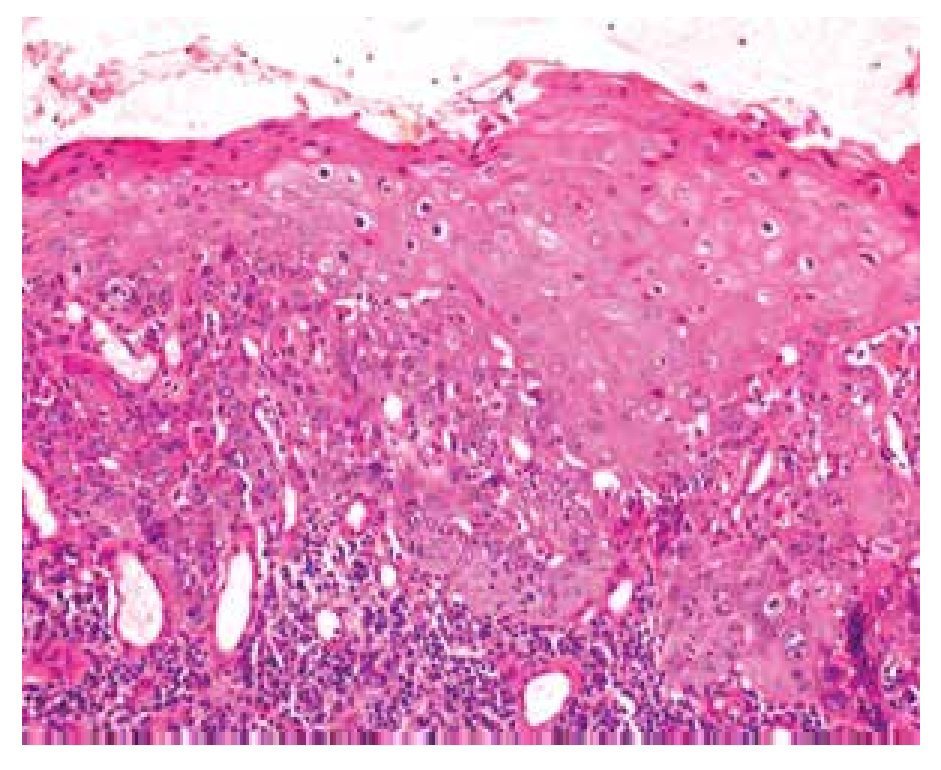
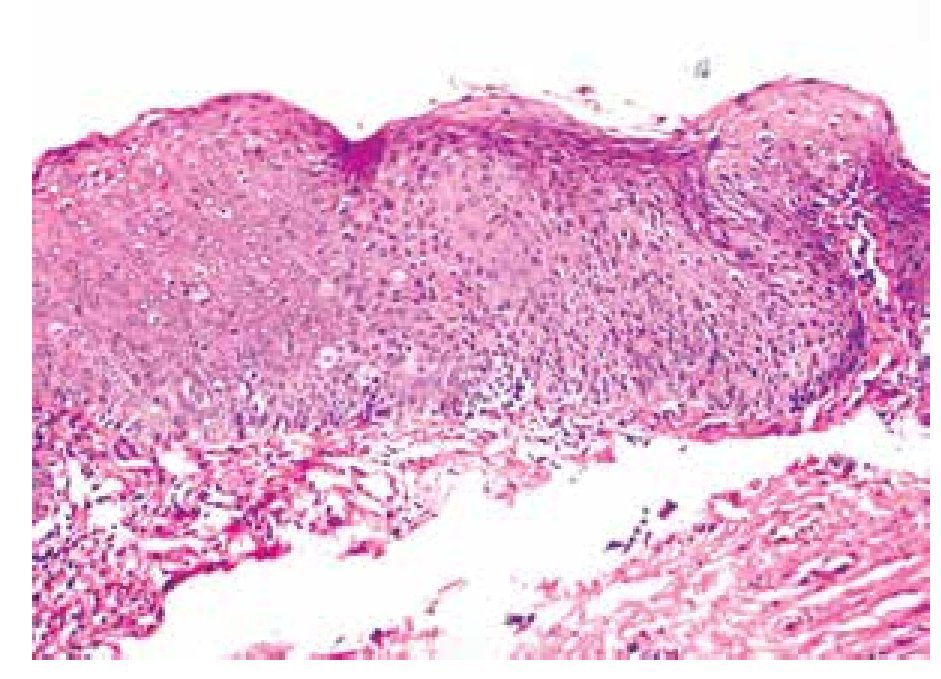
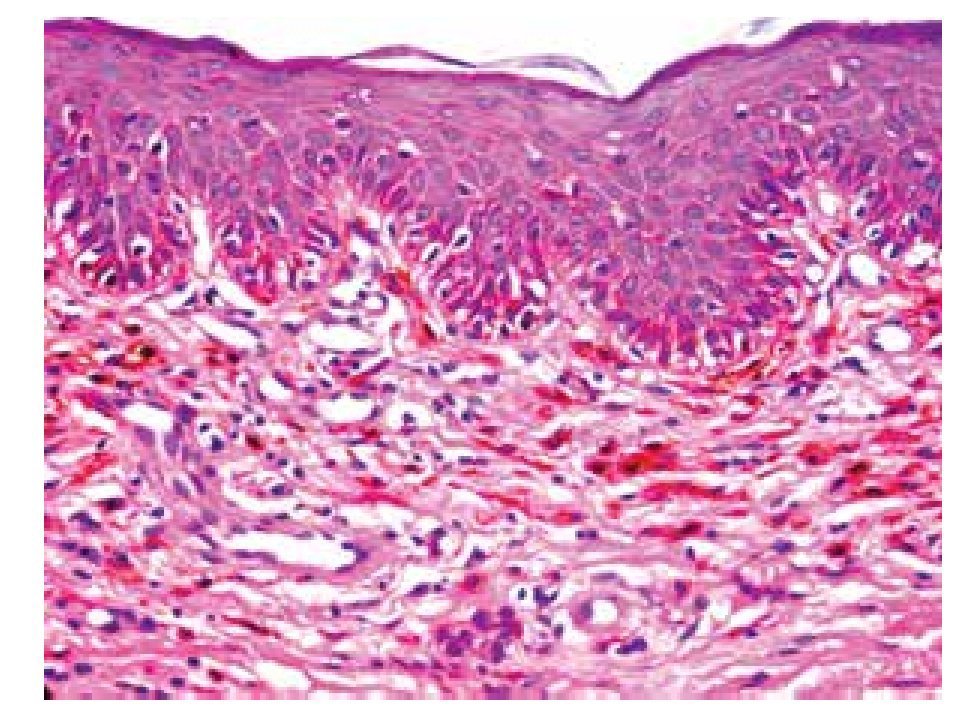
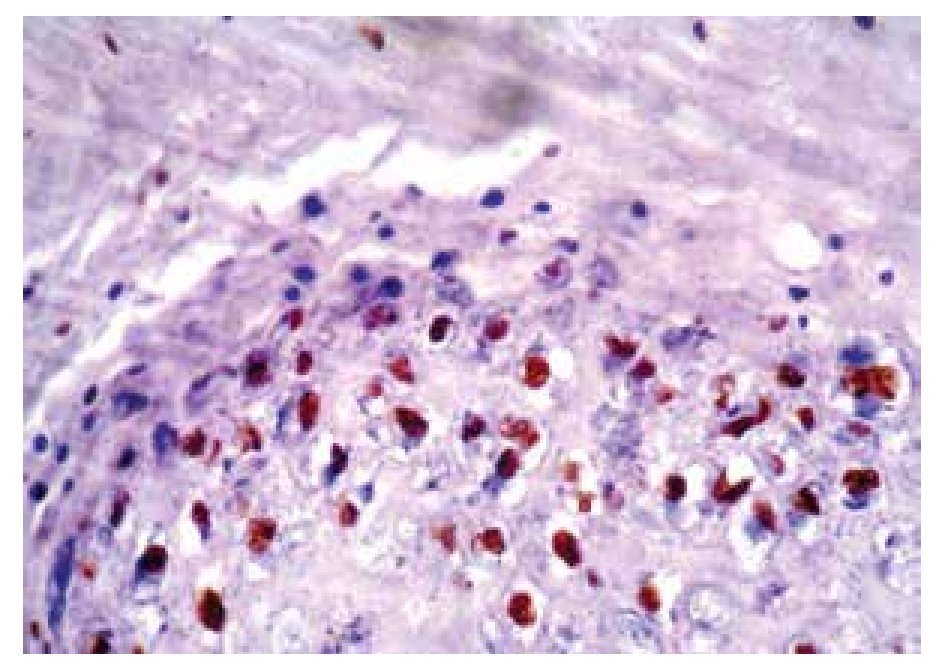
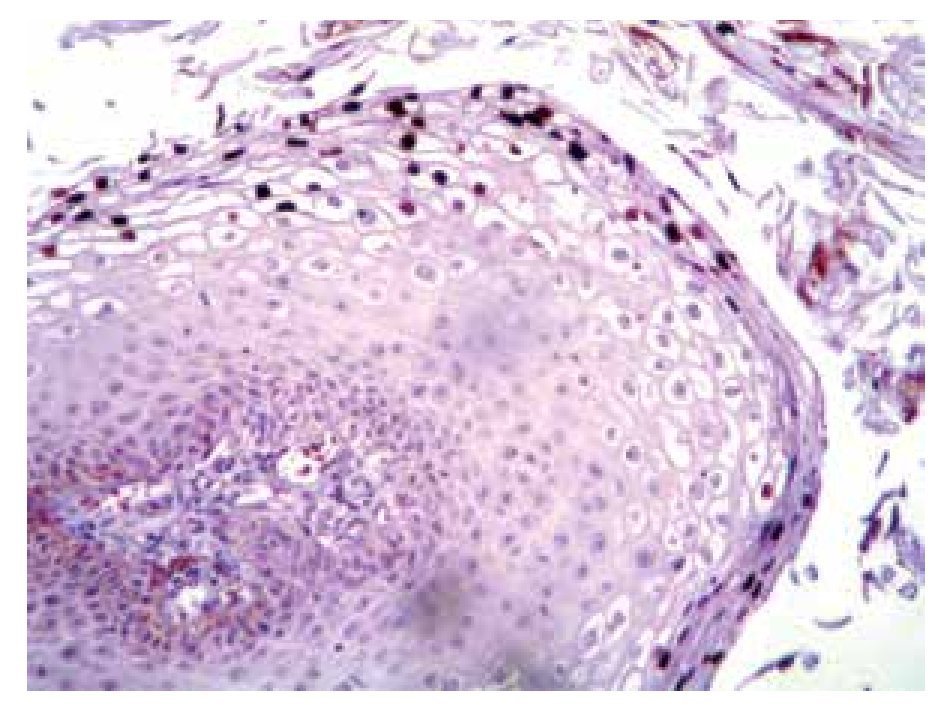
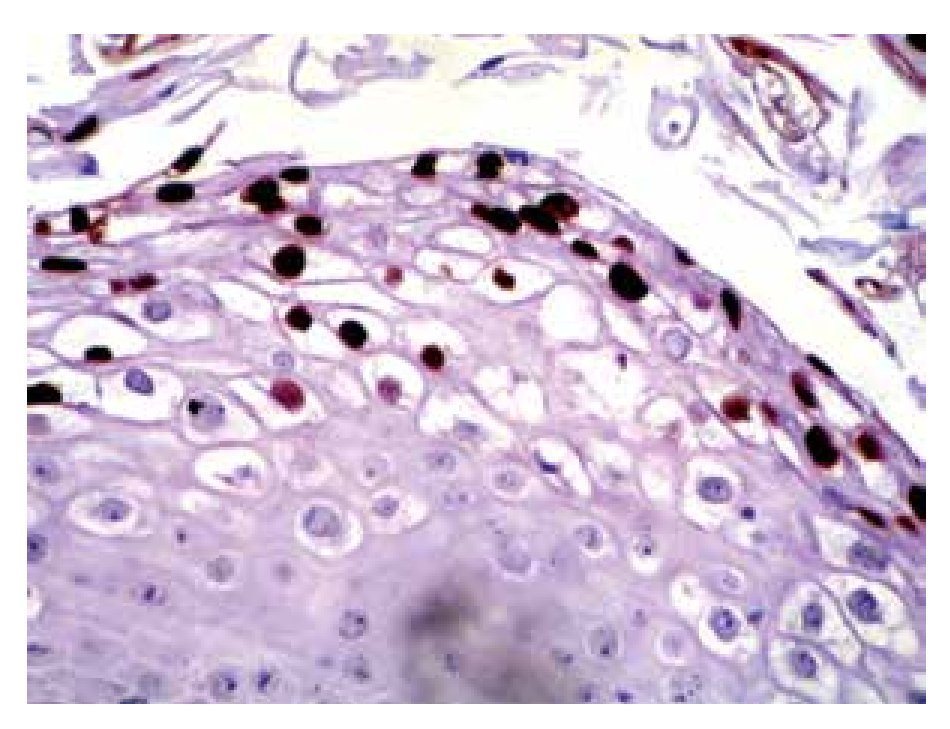
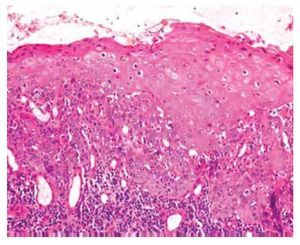
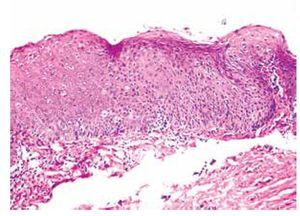
Se estudiaron 36 biopsias de pacientes con lesiones malignas/pre-malignas (Figuras 1 y 2) y 36 con lesiones benignas (Figura 3). En el grupo de lesiones malignas/pre-malignas, el 77.78% de los pacientes eran del sexo masculino; mientras que en el grupo de lesiones benignas, sólo un 41.67% de los pacientes eran del sexo masculino. La media de edad en el grupo de los pacientes con lesiones malignas o pre-malignas (casos) fue de 48.14 ± 15.66 años; mientras que la del grupo de los pacientes con lesiones benignas (controles) fue 48.89 ± 17.25 años (p=0.8474). Se detectó la presencia de VPH mediante inmunoperoxidasa en el 5.56% de las lesiones malignas/pre-malignas (Figura 4) y en el 8.33% de las lesiones benignas (Figuras 5 y 6) (p=0.5). El OR fue de 0.647 (IC95%:0.1015-4.1242; p=0.5).
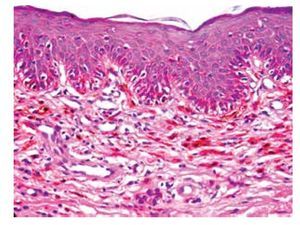
• Figura 1. Carcinoma epidermoide bien diferenciado del pene: proliferación de células escamosas atípicas con presencia de disqueratosis, que se extiende hasta la dermis media. La proliferación está rodeada por un denso infiltrado inflamatorio (H&E, 100X).
• Figura 2. Papulosis bowenoide (pene): se aprecia importante desorganización del epitelio y queratinocitos atípicos (H&E, 100X).
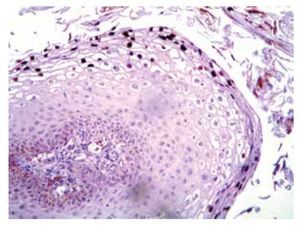
• Figura 3. Nevo azul: en la dermis se aprecian melanocitos dendríticos y abundantes melanófagos (H&E, 100X).
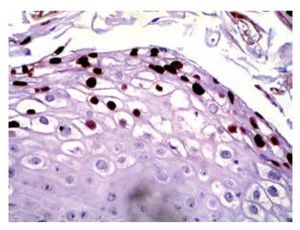
• Figura 4. Inmunoperoxidasa positiva para VPH en una biopsia de papulosis bowenoide: se aprecia el cromógeno marrón en el núcleo de las células (H&E, 400X).
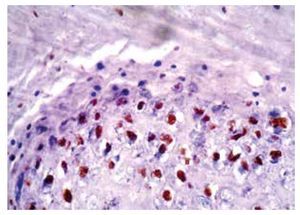
• Figura 5. Inmunoperoxidasa positiva para VPH en una biopsia de condiloma acuminado: se aprecia el cromógeno marrón en el núcleo de las células (H&E, 200X).
• Figura 6. Inmunoperoxidasa positiva para VPH en una biopsia de condiloma acuminado: se aprecia el cromógeno marrón en el núcleo de las células (H&E, 400X).
• Discusión
El hecho de que sólo hayamos encontrado VPH en el 5.56% de las lesiones malignas/pre-malignas del área genital, no coincide con lo encontrado por la mayoría de los estudios a nivel mundial. Ueda Y y colaboradores demostraron ADN de VPH en cinco de cada seis CCE de la vulva y en 17 de cada 20 casos de neoplasia intraepitelial vulvar (NIV), correspondiendo la mayoría a VPH 16.6 Tsimplaki E y colaboradores, encontraron que el 50% de los CCE de vulva y el 71.4% de las NIV eran positivas por VPH.21 Insinga RP y colaboradores, en una revisión sistemática realizada en Estados Unidos, encontraron que el 65.3% de los CCE de vulva eran positivos por algún tipo de VPH, encontrándose al VPH 16 en el 49.5% de los casos.22 Sutton BC y colaboradores, demostraron la presencia de VPH en el 69.8% de los CCE de vulva estudiados.23 Larsson GL y colaboradores, en un estudio realizado en Suecia, encontraron positividad por VPH en el 30.8% de los CCE vulvares.24
El OR para encontrar VPH en las lesiones malignas/pre-malignas con respecto a las lesiones benignas fue de 0.647 (IC95%:0.1015-4.1242; p=0.5) en nuestra investigación. Este OR es distinto al encontrado por otros estudios que, si bien es cierto no son del todo comparables con el nuestro, tienen ciertas similitudes. Madeleine MM y colaboradores encontraron un OR de 18.8 (11.9-29.8) para desarrollar cáncer de vulva cuando las mujeres eran fumadoras y positivas por VPH 16, con respecto a cuándo no eran fumadoras y negativas por VPH 16.25 Iftner A y colaboradores, en un estudio realizado con 496 pacientes inmunocompetentes, encontraron un OR de 59 (IC95%:5.4-6.45) para desarrollar CCNM en los pacientes que tenían ADN de los VPH de alto riesgo de las mucosas (VPH 16, 31, 35 y 51), con respecto a los controles con piel normal.26
El hecho de que nuestros resultados diverjan de lo reportado por la mayoría de los estudios, podría ser explicado por la técnica utilizada para estudiar la presencia del VPH y por el estado en el que suele encontrarse el genoma del VPH en las células neoplásicas. La integración de los genomas de los VPH de alto riesgo al genoma celular es considerada un paso importante en la progresión neoplásica, se cree que ocurre temprano en el proceso de carcinogénesis.27-30
De hecho, muchas lesiones de alto grado y carcinomas cérvico-uterinos que son positivos por VPH, tienen el genoma viral integrado en el genoma celular. Se ha reportado que la frecuencia de integración de VPH 16, aumenta en paralelo con la severidad de las lesiones cervicales.27 Lace MJ y colaboradores demostraron que la mayoría de los carcinomas de cabeza y cuello que son positivos por VPH, también presentan integrado el genoma del virus.31 Elango KJ y colaboradores, demostraron que el genoma del VPH se encontraba integrado en el 83% de los CCE de lengua que eran positivos por el virus.32
La función represora de la proteína E2 sobre la expresión de las proteínas E6 y E7 del VPH, se pierde cuando el ADN viral se integra al genoma celular, un fenómeno que no está relacionado con el ciclo de replicación del virus, sino con la transformación neoplásica.12,33 Al integrarse el genoma del VPH al genoma celular, ocurre una alteración estructural del marco abierto de lectura de E2. De esta manera, puede ocurrir libremente la transactivación del promotor de E6 y E7 por los factores de transcripción celulares, independientemente del grado de diferenciación celular.12,33 Esto favorece que las proteínas E6 y E7 se expresen en grandes concentraciones en células que todavía están proliferando, dándoles una ventaja de crecimiento sobre las células vecinas no infectadas y generando un fenotipo celular inmortalizado.27-29,31
Como nos hemos podido percatar, la integración del genoma viral al genoma celular favorece la desregulación del ciclo celular; pero a la vez causa la disrupción o el silenciamiento de los genes involucrados en la replicación viral.31 Adicionalmente al efecto sobre el gen E2, destaca el efecto que tiene la integración sobre el gen L1, el gen que codifica la proteína mayor de la cápside viral. Durante la integración, el gen L1 y, en un menor grado, la región de control largo del genoma del VPH son hipermetilados.34,35 La metilación es un destino que el ADN del VPH comparte con la mayoría de las secuencias foráneas de ADN, que se integran a los cromosomas de las células de los mamíferos.34,35 Se ha demostrado que el gen L1 se encuentra hipermetilado en varios cánceres relacionados con la infección por VPH, como el carcinoma cérvico-uterino, el carcinoma de pene, entre otros.34 El efecto neto de la hipermetilación de L1 es la supresión de su transcripción, con la consecuente interrupción de la síntesis de la proteína mayor de la cápside viral.34,35 Esto podría explicar el bajo porcentaje de positividad por VPH encontrado en las lesiones malignas/pre-malignas de nuestro estudio. Como la técnica de inmunoperoxidasa aplicada en nuestro estudio utiliza un anticuerpo que va dirigido contra antígenos de la cápside viral, no sería extraño que ocurrieran falsos negativos si consideramos que el genoma del VPH suele encontrarse integrado en el genoma de las células neoplásicas y, por ende, el gen L1 suele encontrarse hipermetilado.34,35 De hecho, Griesser H y colaboradores, en un estudio realizado con muestras de citología cervical positivas por ADN del VPH, demostraron que las lesiones displásicas leves y moderadas tenían mayor riesgo de progresión, si en ellas no se podía detectar la proteína L1 de la cápside viral mediante inmunohistoquímica.36 Por ende, la falta de detección de la proteína L1 mediante inmunohistoquímica no siempre es sinónimo de ausencia de infección por VPH; sino que puede ser causada por la integración del genoma viral, con la consecuente reducción de la síntesis de la proteína L1 a niveles que no se puedan detectar mediante inmuhistoquímica.36 Esto demuestra que, en la actualidad, la técnica de inmunohistoquímica no es el mejor método para la investigación de la participación de VPH en la transformación neoplásica. Por estas razones, recomendamos la realización de estudios adicionales sobre esta materia, en los que se utilicen pruebas moleculares, como la hibridación cromogénica in situ, para la detección de la infección por VPH.
Otro factor que pudo haber influido en nuestros resultados es el origen de las muestras utilizadas para el estudio. Como se trató de un estudio retrospectivo en el que se trabajó con bloques de parafina, que son el producto del trabajo rutinario de una unidad hospitalaria, no se puede estar seguro que las condiciones de fijación y procesado de los mismos hayan sido óptimas. Khoury T y colaboradores y Qiu J y colaboradores, en estudios realizados con muestras de cáncer de mama, demostraron que el retraso en la colocación de las muestras a fijar en formol tiene un efecto negativo en la capacidad para detectar, mediante inmunohistoquímica, la positividad para receptores de estrógeno y progesterona.37,38 Este efecto negativo se mantuvo independientemente del clon del anticuerpo utilizado para dicha detección.38 Sin embargo, Otali D y colaboradores demostraron que una fijación muy prolongada en formol también puede afectar los resultados de la inmunohistoquímica. De la misma forma, cada uno de los pasos del procesado del tejido, especialmente el establecimiento del ambiente hidrofóbico mediante xilol, pueden tener efectos negativos sobre la detección de los antígenos mediante inmunohistoquímica.39 Por lo tanto, también recomendamos la realización de estudios prospectivos sobre este tema en los que se puedan controlar estrictamente las condiciones de fijación y procesado de las muestras.
• Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
• Financiamiento
No se recibió ningún patrocinio para realizar este artículo.
Correspondencia:
Dr. José Manuel Ríos Yuil.
Servicio de Dermatopatología,
Hospital General de México "Dr. Eduardo Liceaga".
Dr. Balmis N° 148, Colonia Doctores, Delegación Cuauhtémoc,
C.P. 06720, México D.F., México.
Teléfono: (52) 55 5004 3845.
Correo electrónico: jmriosyuil@hotmail.com