¿ Introducción
La leucemia linfoide aguda (LLA) es una neoplasia caracterizada por la proliferación descontrolada de células linfoides inmaduras, cuyo origen es la médula ósea. De forma general, la supervivencia es en promedio de 20% a 45% a cinco años,1-4 pero siendo menor en países en vías de desarrollo.5-6 A pesar de contar con una alta tasa de remisiones completas, alrededor de 60% de los pacientes clasificados como de riesgo alto al diagnóstico, presentarán recaída medular,7,8 Entre de los principales factores relacionados con una recaída, la positividad de enfermedad mínima residual posterior a la etapa de consolidación o durante al mantenimiento se ha vuelto un factor significativo tanto en adultos9 como en población pediátrica.10 Pullarkat y colaboradores, en 200 pacientes registraron la relación significativa entre las alteraciones citogenéticas de pronóstico adverso [(t9,22)(q34;q11)] y el riesgo de recaída en comparación con aquellos pacientes con un cariotipo normal.11 Otros factores asociados son la edad y el tiempo de duración de la primera remisión completa. El tratamiento es con base en un régimen de rescate y para el caso de una segunda remisión, someter a un trasplante de progenitores hematopoyéticos. La supervivencia en promedio posterior a una recaída es de alrededor de 7% a cinco años.12 Semejante a esto, Oriol y colaboradores registraron en 589 pacientes una frecuencia de recaída de 50% con un tiempo promedio de recaída de 11 meses; los principales factores de buena respuesta son la edad menor de 30 años y una primera remisión mayor de dos años.
La supervivencia en promedio de dicha serie fue de 10% a cinco años.13 En el Hospital General de México, desde 2007 se han instaurado protocolos semejantes al esquema italiano GIMEMA 0496, basados en una pre-inducción con esteroides,14 en éste informe presentamos los resultados de los protocolos de recaídas a nivel de médula ósea .
¿ Métodos
Pacientes: Se estudiaron pacientes atendidos en el Servicio de Hematología desde septiembre de 2007 a noviembre de 2009. El diagnóstico de LLA se basó en los hallazgos morfológicos y se corroboró mediante inmunofenotipo. El tratamiento inicial fue con base en los protocolos institucionales HGMLAL07 y HGMLAL09 y la profilaxis al sistema nervioso central se realizó mediante la administración de quimioterapia intratecal con triple droga (citarabina, metotrexato, dexametasona). Durante el seguimiento se realizó la evaluación de la médula ósea posterior a cada ciclo de quimioterapia y en caso de presentar recaída medular se propuso un esquema de rescate. La detección del transcrito de fusión BCR-ABL (BCR, Breakpoint Cluster Region / ABL, toma su nombre del virus Abelson causante de leucemia) se realizó con oligonucleótidos específicos mediante la técnica de reacción de cadena de polimerasa punto final (RT-PCR). Contamos con el consentimiento informado institucional de todos los pacientes previo al inicio del esquema de rescate.
Criterios de recaída medular: Se consideró a los pacientes con recaída medular a los que presentaban más de 10% de blastos linfoides en sus médulas de seguimiento y se consideró como leucemia refractaria a los pacientes que no respondieran al esquema de inducción para la remisión inicial. Se consideró una recaída a sistema nervioso central asociada, si en el líquido cefalorraquídeo se identificaba la presencia de blastos o síntomas neurológicos. Al momento de la recaída, los pacientes podrían o no contar con blastos en sangre periférica, trombocitopenia o anemia.
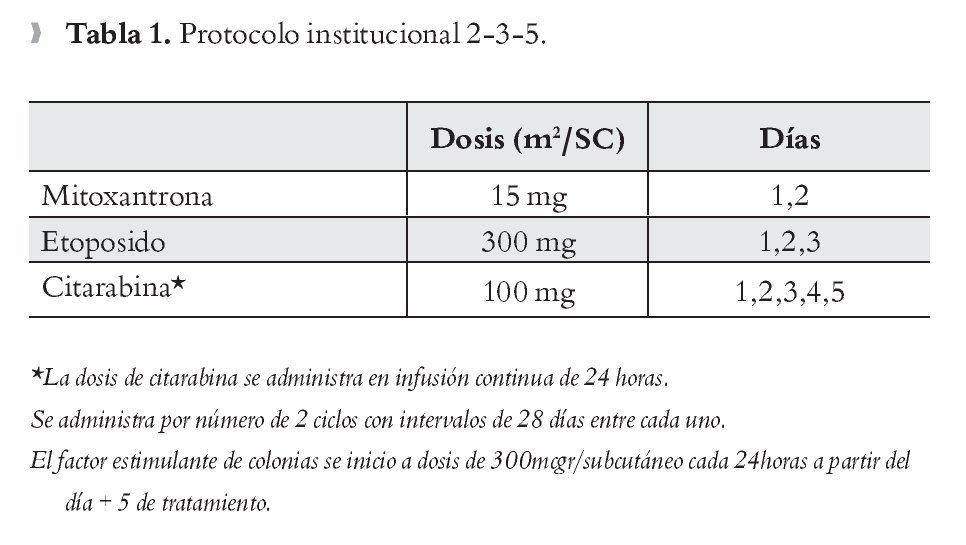
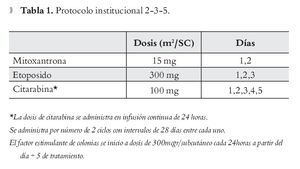
Protocolo de tratamiento: Al momento de la recaída los pacientes recibieron diversos protocolos de tratamiento; hyperCVAD-DAMTX-ARAC [ciclofosfamida, vincristina, adriamicina, dexametasona - dosis altas de metotrexato-citarabina],15 IDA-FLAG [idarrubicina, fludarabina, citarabina, factor estimulante de granulocitos]16 o el protocolo institucional 2-3-5 (Tabla 1). Posterior a obtener una segunda remisión completa, los pacientes fueron sometidos a un régimen de tratamiento rotatorio de quimioterapia con intervalos de cada 21 días entre cada uno.
Criterios de segunda remisión: Se consideró en segunda remisión hematológica a los pacientes que contaran con menos de 5% de blastos linfoides en su médula ósea de control, posterior al primer ciclo del esquema de rescate y que contaran en sangre periférica con más de 1.5 x 103/μL y más de 100 x 103/μL.
Análisis estadístico: Se estimó la supervivencia mediante el método de Kaplan-Meier, la supervivencia global se estimo desde la fecha del momento de la recaída hasta la última fecha registrada (fecha de muerte, última fecha registrada en el expediente). El valor pronóstico de las diferentes variables estudiadas se estimó mediante el método de Ji cuadrada.
¿ Resultados
Desde septiembre de 2007 a noviembre de 2009 se estudió a 40 pacientes atendidos en el Servicio de Hematología del Hospital General de México con el diagnóstico de recaída medular. Hombres 22 (55%); mujeres 18 (45%). Media de edad: 27.7 años (16 a 47). De acuerdo con el tipo de riesgo, 27.5% (n= 11) se consideraron como riesgo habitual. La cifra promedio de leucocitos fue de 65 .8 x 103/μL con una media de 46.5 103/μL (rango de 0.8 103/μL a 207 103/μL). Sólo 82.5% (n=33) contaron con inmunofenotipo: estirpe B 93.9% (n=31) y estirpe T 6.1% (n=2). Se contó con 30 pruebas de reacción de cadena de polimerasa punto final (RT-PCR) para la determinación del transcrito BCR-ABL siendo en 16.6% (n=5) positivas. En cuanto al sitio de recaída, 5% de los pacientes (n=2) contaba con recaída tanto a nivel de médula ósea, como a sistema nervioso central.
Resultados del tratamiento: Todos los pacientes iniciaron algún tratamiento en base a los diversos esquemas de rescate. En 70% (n= 28) se inició el régimen institucional 2-3-5; a 7.5% (n=3) se les inició tratamiento con base en el esquema IDA-FAG y a 22.5% (n=9) con el esquema Hyper-CVAD. El tiempo promedio entre el diagnóstico y la recaída fue de 144.6 días, con una mediana de 96.5 (rango de 31 a 646). A todos los pacientes se les administró factor estimulante de colonias de granulocitos (FEC-G) hasta el momento de la recuperación medular. La profilaxis antibiótica se realizó en todos los pacientes mediante fluoroquinolonas, betalactámicos y sulfas, esta última como profilaxis para P jirovecci. Se integró una segunda remisión en 15% de los casos (n=6); se registró una mortalidad de 42.5% (n=17). La principal causa de muerte fue la sepsis asociada a neutropenia febril seguida de las hemorragias. La supervivencia promedio fue de 113 días, con una media de 50 días (rango de dos a 646 días).
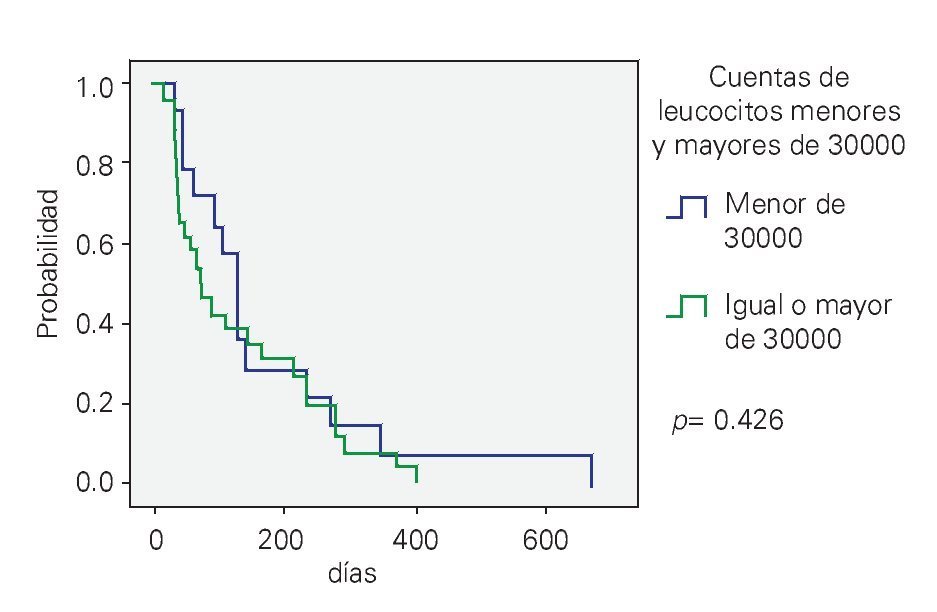
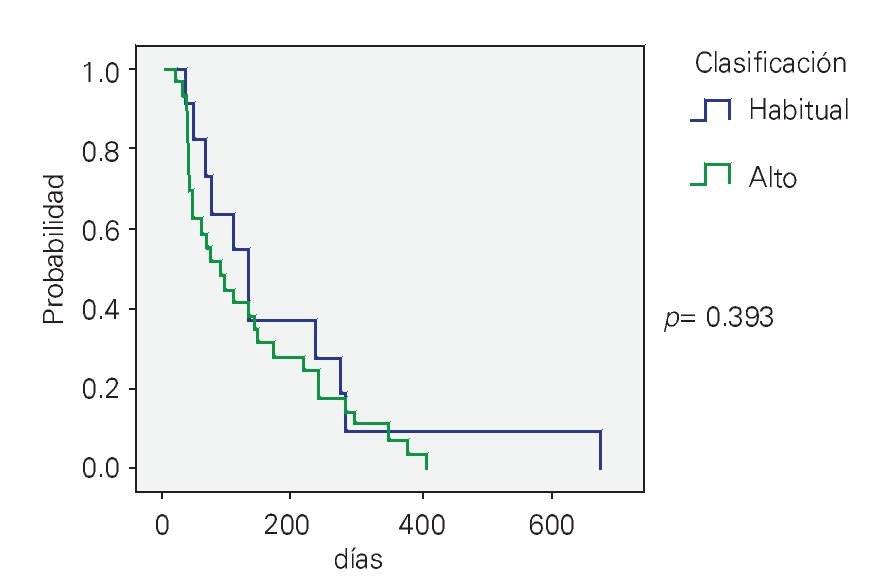
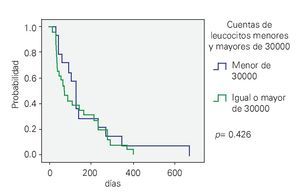
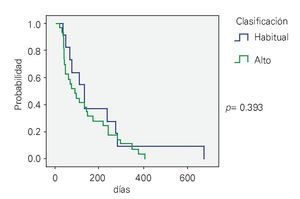
Factores pronósticos: Diferentes variables fueron analizadas; no se encontró una diferencia estadísticamente significativa entre aquellos pacientes con una cifra > 30 x I03/μL vs. < 30 x I03/μL (p = 0.426) (Figura 1), riesgo habitual vs. riesgo alto (p = 0.393) (Figura 2), la presencia del transcrito BCR-ABL (p = 0.541). Sólo el inmunofenotipo B mostró impacto sobre la supervivencia vs. el inmunofenotipo T (p = 0.007).
¿ Figura 1. Supervivencia Global acorde a la cifra de leucocitos.
¿ Figura 2. Supervivencia global acorde al tipo de riesgo.
¿ Discusión
La LLA es la leucemia aguda que se atiende con mayor frecuencia en nuestro hospital, diversos factores clínicos como moleculares se han implicado con el riesgo de recaída a médula ósea. De estos últimos, la presencia de genes de resistencia a multidrogas (MDR)17 al igual que los polimorfismos de diversos genes que se encuentran implicados en la resistencia a los diversos agentes quimioterápicos.18 Diversas alteraciones citogenéticas específicas están implicadas también con la presencia de recaída, la t(9;22) (q34:q11) que codifica para el transcrito BCR-ABL se ha asociado a una supervivencia menor del 10% a cinco años,19 ésta situación se ha asociado secundario al incremento en la tasa de proliferación celular dependiente de diversas cinasas de tirosina como la SRC-cinasa al igual que la capacidad de la célula tumoral a la evasión de la apoptosis.20,21 En cuanto al seguimiento, uno de los factores que ha adquirido relevancia es la identificación de la enfermedad mínima residual (EMR, una célula leucémica por cada 104 células normales), ésta puede identificarse tanto por la técnica de reacción de cadena de polimerasa (PCR) como por citometría de flujo,22 Van der Velden y colaboradores en su serie de noventa y nueve pacientes pediátricos, la presencia de una EMR positiva permitió identificar una sub-población de pacientes con riesgo de recaída;23 esta técnica ha mostrado también ser de utilidad en el seguimiento de los pacientes adultos con LLA.24 El tratamiento de recaída se basa en la administración de un esquema de rescate con la finalidad de obtener una segunda remisión completa y someter posteriormente a un trasplante de progenitores hematopoyéticos; Jamleson y colaboradores en su serie de 15 años de seguimiento concluyó que la supervivencia de un paciente en segunda remisión es semejante a aquel trasplantado en primera remisión completa con su régimen basado en irradiación corporal total y dosis altas de etopósido.25 En nuestra serie, con los diferentes esquemas alternativos utilizados la tasa de remisiones no fue mayor a 15%, acorde a los diferentes marcadores pronósticos; sólo el inmunofenotipo T mostró ser significativo para la supervivencia, ésta es en promedio menor a cuatro meses, siendo las principales causas de muerte tanto los procesos infecciosos asociados a la neutropenia febril, como los eventos hemorrágicos secundarios a la falla medular. Semejante a esto, O'Brien en su serie de 288 pacientes con leucemia linfoide en recaída registraron una supervivencia media de tres meses con una tasa de remisiones completas de alrededor de 7%; los principales factores que utilizaron para una estimación del pronóstico fueron la duración de la primera remisión completa, el porcentaje de blastos en la médula ósea, la cifra de plaquetas y el nivel sérico de albúmina. Aquellos los cuales contaran con tres o cuatro factores de riesgo, su supervivencia a 12 meses fue de 8% y 0% respectivamente. En conclusión, los resultados de los diversos protocolos de rescate aun son desfavorables. Es necesario mejorar los regímenes de tratamiento de primera línea para evitar la recaída temprana identificando alteraciones las cuales puedan ser un blanco potencial de tratamiento como el uso de inhibidores de cinasa de tirosina de primera y segunda generación para la t(9;22) (q34;q11)26,27 y el uso del anticuerpo monoclonal anti-CD20 en aquellos pacientes con LLA-B que expresan CD20 en su superficie.28 Recientemente, nuevos blancos terapéuticos se han detectado como la inhibición de la vía NOTCH1 y la vía 3-cinasa/Akt/mTOR,29 esta última mediante el uso de rapamicina (everolimus).30-31 Finalmente, posterior a una segunda remisión se continua con la recomendación para el sometimiento a un trasplante alogénico de progenitores hematopoyéticos; hasta el momento, continúa siendo la estrategia más eficaz para el manejo de un paciente posterior a una recaída medular.
Correspondencia: Christian Omar Ramos Peñafiel.
Camino a Chapultepec 2-C. Cofradia de San Miguel, Estado de México.
Teléfono: 55 2240 5084.
Correo electrónico: leukemiaCHOP@hotmail.com