El Síndrome de Apnea Obstructiva del Sueño (SAOS) es uno de los factores más importantes para el desarrollo de hipoxia, en la edad pediátrica. Existe suficiente evidencia sobre los efectos de la hipoxia crónica como factor de riesgo de complicaciones asociadas a eventos quirúrgicos, lo que se debe a la angiogénesis secundaria que aumenta la posibilidad de hemorragias transoperatorias, así como a los efectos cardiovasculares negativos derivados del proceso inflamatorio sistémico, desencadenado por la hipoxia tisular. La adenoamigdalectomía (AA) es el tratamiento de elección en la mayoría de los casos de pacientes con SAOS. No hay consenso sobre el uso de presión aérea positiva continua (CPAP) en SAOS, para la prevención de las complicaciones trans y posoperatorias. La presente publicación tiene por objeto presentar el caso de un paciente con SAOS, en quien se utilizó CPAP previo a AA. Asimismo, presentar una revisión de la literatura médica como evidencia de las ventajas de CPAP preoperatorio en pacientes pediátricos.
The obstructive sleep apnea syndrome (OSAS) is one of the main factors for the development of hypoxia in children. There is enough evidence regarding the effects of chronic hypoxia, as a marker for complications associated with surgical events. This is secondary to angiogenesis, which increases the likelihood of intraoperative bleeding as well as the negative cardiovascular effects resulting from the systemic inflammatory process triggered by tissue hypoxia. Adenotonsillectomy (AT) is the treatment of choice for most pediatric patients with OSA. There is no agreement over the use of continuous positive airway pressure (CPAP) for OSAS in the prevention of trans and postoperative complications. We present a case in point and discuss how the use of CPAP could have an impact over OSAS prior to AT.
Introducción
Los trastornos del sueño son comunes en la infancia y adolescencia, representan un impacto importante sobre el desarrollo. Se asocian a afecciones cardiovasculares, neurocognitivas y psicosociales.1,2 Los trastornos respiratorios de sueño (TRS) son los mejor conocidos, e incluyen el ronquido en sus distintas severidades, el síndrome de resistencia a la vía aérea superior, el síndrome de hipoventilación alveolar y el Síndrome de Apnea Obstructiva del Sueño (SAOS), como su forma más severa.1
El SAOS en pediatría, es definido como la obstrucción parcial o completa de la vía aérea superior durante el sueño, que ocurre por lo menos una vez por hora de sueño y que se asocia a somnolencia diurna.
En la población general, los TRS ocurren en el 9% de las mujeres y en 24% de los hombres, mientras que el SAOS evidente ocurre en 2% de las mujeres y en 4% de los hombres.3 La Sociedad Torácica Americana (American Thoracic Society), define el SAOS infantil, como "El trastorno que se caracteriza por episodios repetidos de obstrucción parcial o completa de la vía aérea durante el sueño, que resulta en una alteración de la ventilación normal y los patrones de sueño".4
La literatura sugiere una prevalencia de SAOS en niños de 0.1% a 13%. Siendo más común en niños con sobrepeso u obesos, con un pico entre los dos y los ocho años, que coincide con el pico de edad de hiperplasia linfoide.5 En los niños, ésta enfermedad afecta a ambos géneros de igual forma, se asocia con todos los tipos morfológicos y es una entidad con tratamiento primariamente quirúrgico, mediante la adenoamigdalectomía (AA). En adultos existe una mayor incidencia en hombres, la obesidad está frecuentemente presente y las intervenciones no quirúrgicas son la primera línea de tratamiento, como la presión aérea positiva continua (CPAP) y la disminución de peso.6
La hipertrofia adenoamigdalina es la causa predominante de los trastornos obstructivos del sueño en niños. Otros factores de riesgo para TRS incluyen las anormalidades craneofaciales, la obesidad, trastornos en senos paranasales, sibilancias recurrentes, alergias nasales, historia familiar de SAOS,1 colapso faríngeo causado por hipotonía palatina, macroglosia, glosoptosis, hipoplasia mandibular, estenosis subglótica, laringomalacia y traqueomalacia.7
La estructura craneofacial anormal es considerada como factor de riesgo importante en el SAOS pediátrico, debido a que: 1) la apnea del sueño es común y severa en niños con fenotipo asociado a distintas anormalidades craneofaciales, como el síndrome de Pierre-Robin y el síndrome de Down, y 2) se ha demostrado mediante mediciones cefálicas que hay más alteraciones estructurales en los niños con SAOS.
Muchos argumentos sugieren que el SAOS es causado por alteraciones en mecanismos neuromusculares, que tienden a incrementar el colapso de la vía aérea (tono neuromuscular, propiedades del tejido, incremento de la resistencia, entre otros). Esto se explica porque los niños obesos con SAOS y amígdalas grandes no se obstruyen durante la vigilia (tono motor alto), y la remoción de amígdalas y adenoides en niños obesos con SAOS, no cura o resuelve el SAOS en un número significativo de éstos sujetos.8
El SAOS es la indicación más común de polisomnografía (PSG) en la edad pediátrica. La Academia Americana de Pediatría (American Academy of Pediatrics) recomienda que todos los niños sean evaluados clínicamente para búsqueda de ronquido, ya que el SAOS es frecuentemente subdiagnosticado. La American ThoracicSociety y la American Academy of Pediatrics recomiendan la PSG, como el examen diagnóstico de elección para niños con sospecha de SAOS.9,10
Las implicaciones de los trastornos respiratorios del sueño, SAOS o apnea central del sueño, son significativas y pueden introducir un riesgo predecible en el cuidado del paciente pediátrico. Existen importantes consideraciones fisiopatológicas, anatómicas y farmacológicas asociadas a niños con éstas enfermedades.6
Las consecuencias del SAOS en niños, incluyen hipoxemia, hipercapnia, hipertensión pulmonar, convulsiones hipóxicas, cefaleas, somnolencia diurna, retraso del desarrollo, problemas del comportamiento y aumento del riesgo de broncoaspiración.7
Existen otras consecuencias del SAOS, como el retraso en el crecimiento y alteraciones conductuales. En la patogénesis asociada al retraso en el crecimiento en niños con SAOS, intervienen varios mecanismos que incluyen el incremento en el consumo energético en reposo, dificultad para tragar secundaria a la hipertrofia amigdalina, además de liberación anormal de hormona de crecimiento.
Por otro lado, existe una asociación bien documentada (PSG, asesoría neuropsicológica) entre el SAOS y el trastorno de déficit de atención e hiperactividad. Asimismo se ha demostrado asociación entre los TRS y los trastornos de aprendizaje, bajo rendimiento académico y otros trastornos del comportamiento.1
En contraste con los pacientes adultos, los niños afectados tienen a preservar su arquitectura de sueño, por lo que la somnolencia diurna excesiva (SDE) no es una característica predominante. A pesar de la ausencia relativa de SDE, los niños con SAOS e incluso los niños roncadores no apnéicos, tienden a presentar secuelas neurocognitivas significativas, por ejemplo, problemas de aprendizaje, disminución en la atención, hiperactividad e incluso menores coeficientes intelectuales.5
El SAOS se ha asociado a una remarcada condición inflamatoria, similar a la del síndrome metabólico, incluyendo el incremento de citocinas, hipertensión arterial, resistencia a la insulina e incremento en el riesgo de eventos cardiovasculares (enfermedad arterial coronaria, insuficiencia cardiaca y enfermedad vascular cerebral).6
La inflamación es el mecanismo que puede asociar el SAOS con los trastornos cardiovasculares. La proteína C reactiva (PCR) es el marcador de inflamación sistémica más ampliamente estudiado en niños. Encontrándose más elevado en niños con SAOS, comparado con controles sanos. El tejido adiposo es fuente importante de citocinas inflamatorias, por lo que la obesidad parece jugar un papel esencial. Se ha descrito también que los niños con SAOS tienen niveles plasmáticos elevados de P-selectina, un marcador de activación plaquetaria asociado al aumento de riesgo cardiovascular.5
La asociación entre SAOS, obesidad y riesgo cardiovascular ha sido difícil de acertar, puesto que los sujetos con estas patologías comparten factores de riesgo. En niños se ha encontrado que los factores como la regulación de la presión arterial, la función cardiaca, la función autonómica y la función endotelial relacionados con SAOS, se comportan como variables independientes.8
Se han reportado cambios en la geometría ventricular de los niños con SAOS, encontrándose incremento en el índice de masa del ventrículo izquierdo y un mayor engrosamiento de su pared. La hipoxia intermitente que ocurre en los niños con SAOS, puede inducir elevaciones en la presión de la arteria pulmonar.5
Niños y adultos pueden sufrir secuelas cardiovasculares severas como cor pulmonale e hipertensión pulmonar.6
Algunos hallazgos sugieren un papel causal del SAOS en la homeostasis lipídica, independientemente del grado de adiposidad, pero la compleja interacción entre insulina, obesidad, SAOS y disfunción metabólica requiere investigaciones posteriores.5
Presentación del caso
Masculino de tres años de edad, sin antecedentes de importancia, que acudió a la consulta externa de Otorrinolaringología del Servicio de Pediatría del Hospital General de México, refiriendo dificultad respiratoria durante el sueño, ronquido, apneas observadas por el familiar responsable, cianosis peribucal ocasional y SDE. A la exploración física, se encontró en adecuado estado nutricional, sin hipoxia diurna, con datos de respiración oral e hipertrofia amigdalina grado III. Como parte de su abordaje se le solicitaron estudios para descartar una alteración alérgica concomitante, éstos incluyeron: biometría hemática en la que no se evidenció eosinofilia, niveles de inmunogobulina E dentro de los valores de referencia para la edad, y citología de moco nasal sin presencia de eosinófilos. La radiografía lateral de cráneo mostró hipertrofia adenoidea con disminución del calibre de la vía aérea superior.
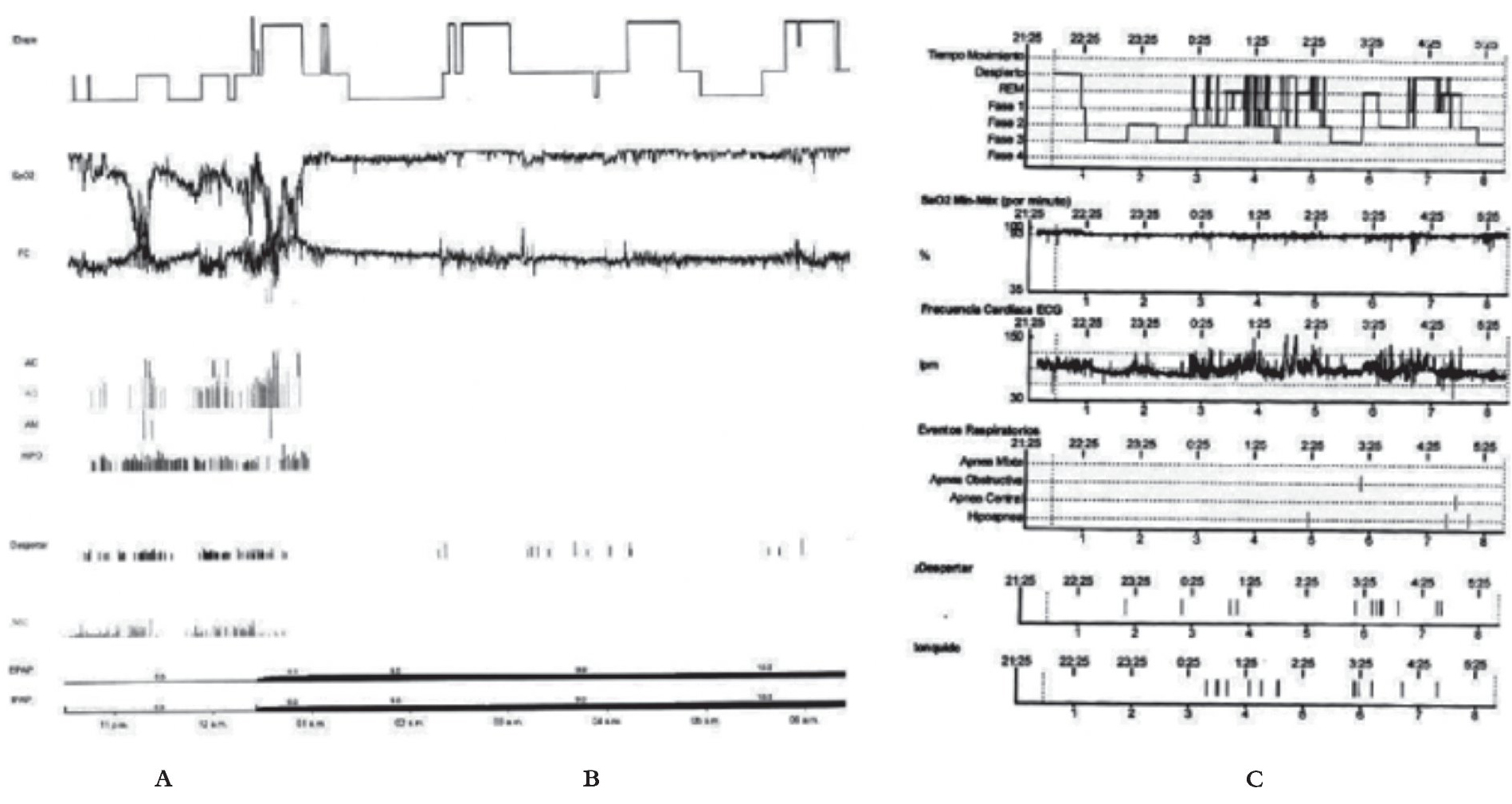
Se realizó estudio polisomnográfico con equipo Alice 5 Philips Respironics®de 32 canales, con montaje de electroencefalograma (derivaciones monopolares C3-A2, C4-A1, O1-A2 y O2-A1), electrooculograma derecho e izquierdo, electromiografía de músculos tibiales anteriores derecho e izquierdo, termistor, cánula nasal, esfuerzo torácico, abdominal y ronquido, el cual reportó índice de apnea/hipopnea (IAH) de 112.8 eventos respiratorios por hora de sueño (esto clasifica al trastorno con un grado de intensidad severo), duración media de los eventos de 10.5 segundos y máxima de 20 segundos. Saturación media de 83% y saturación mínima de 58% (Figura 1A). Se realizó durante el estudio, titulación del equipo de CPAP, encontrándose disminución del índice de apnea/hipopnea <1 evento por hora de sueño, con una presión de 10 cm H2O (Figura 1B).
Figura 1. Resumen de los estudios polisomnográficos, donde se observan las variables hipnográficas y cardiorespiratorias del paciente, A) antes de la adenoamigdalectomía, B) con uso de CPAP y C) en el estudio polisomnográfico de control posoperatorio.
Se instauró tratamiento con CPAP a 10 cm H2O, interfaz nasal y rampa de 20 minutos para dormir, durante tres meses. No existe información en la literatura sobre el tiempo que debe usarse la presión positiva de forma prequirúrgica, aunque se sabe que después de un mes de uso, se revierten muchas de las alteraciones metabólicas inducidas por SAOS.
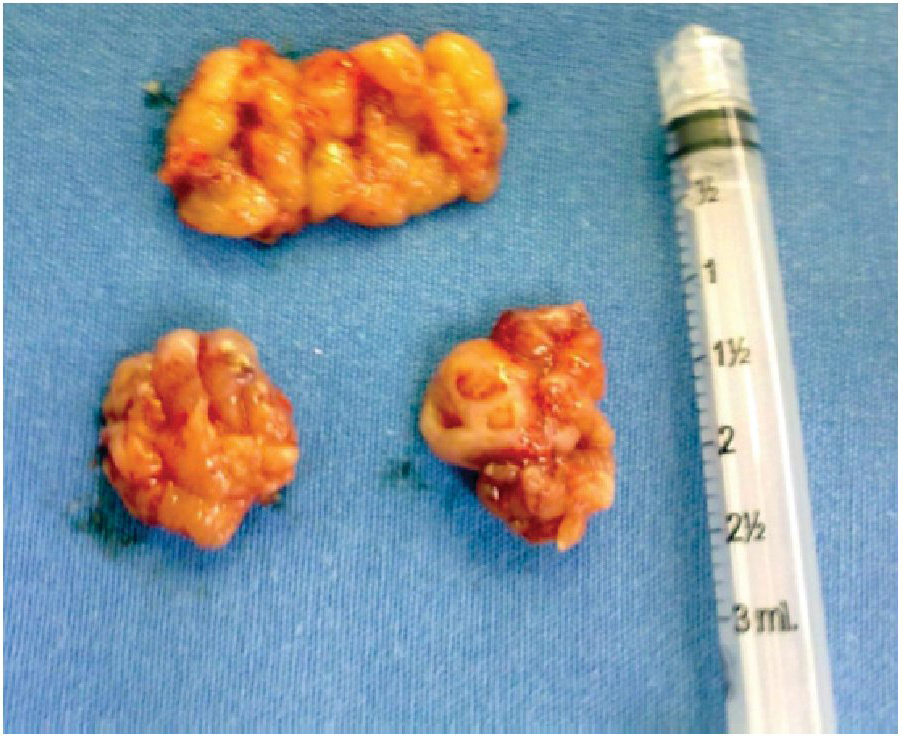
Posteriormente, como tratamiento de elección en estos casos, el paciente fue sometido a AA, procedimiento que se llevó a cabo sin complicaciones, haciendo la resección de tejido adenoideo que ocupaba el 95% de la rinofaringe y amígdalas palatinas con evidencia macroscópica de hipertrofia (Figura 2). El paciente se egresó a las 24 horas de estancia hospitalaria.
Figura 2. Adenoides y amígdalas palatinas extraídas durante la adenoamigdalectomía. Visión macroscópica.
Se realizó estudio PSG de control posoperatorio dos semanas después, con equipo polisomnográfico Cadwell® de 32 canales, con montaje de electroen- de 32 canales, con montaje de electroen- de 32 canales, con montaje de electroencefalograma (derivaciones monopolares C3-A2, C4-A1, O1-A2 y O2-A1), electrooculograma derecho e izquierdo, electromiografía de músculos tibiales anteriores derecho e izquierdo, termistor, cánula nasal, esfuerzo torácico, abdominal y ronquido en el cual se reportó un IAH <1 por hora de sueño (sin relevancia clínica), así como una saturación media de oxígeno de 92.46% y una mínima de oxígeno de 88.84% (Figura 1C). Ambos estudios se realizaron dentro de las instalaciones de la Clínica de Trastornos del Sueño de la Universidad Nacional Autónoma de México.
Discusión
En niños, el reconocimiento temprano del SAOS y la pronta corrección de las anormalidades de la vía aérea superior es primordial. A la edad de cuatro años, se alcanza el 60% de desarrollo esquelético facial, llegando al 90% a los 12 años. Los niños con obstrucción faríngea protegen la permeabilidad de la vía aérea durmiendo en posición prona o lateral, extendiendo la cabeza y desplazando anteriormente la lengua. Éste desplazamiento es asociado con estrechamiento de los arcos dentales superiores e inferiores y desplazamiento posterior de la mandí- mandíbula, lo cual origina retrusión mandibular y alargamiento facial (todos conocidos como factores de riesgo para SAOS). Por lo que el tratamiento quirúrgico temprano es necesario para prevenir el desarrollo craneofacial anormal, y el daño irreversible en los reflejos dilatadores de la faringe.
En adultos y niños, la evaluación preoperatoria de la vía aérea superior es necesaria para determinar el nivel de obstrucción y el plano óptimo de abordaje quirúrgico. La endoscopía y el análisis cefalométrico son útiles para clasificar el tipo de obstrucción. Existen tres tipos principales de obstrucción de la vía aérea superior: 1) estrechamiento orofaríngeo (hipertrofia amigdalina, úvula grande, pilares medializados), 2) arco palatino bajo con lengua relativamente grande, se subdivide en: 2a) anormalidades predominantemente orofaríngeas, y 2b) anormalidades oro e hipoíngeas, y 2b) anormalidades oro e hipongeas, y 2b) anormalidades oro e hipofaríngeas y, 3) obstrucción hipofaríngea (retrognatia, epiglotitis) con orofaringe normal.11
Mediciones del flujo espiratorio forzado durante la aplicación externa de presión positiva/negativa, han permitido la medición de la propensión de la vía aérea superior al colapso. Esto se conoce como presión faríngea crítica de cierre (Pcrit), la cual es afectada tanto por factores anatómicos como por no anatómicos. En los adultos con SAOS, frecuentemente se observan Pcrit positivas, lo que indica que la vía aérea puede colapsarse durante el sueño debido incluso a presiones inspiratorias negativas leves, si esto no es protegido por la acción de los músculos dilatadores. Resultados similares se han encontrado en niños. Se ha sugerido que la obesidad se asocia con valores de Pcrit mayores, explicando en cierto grado la mayor predisposición que tienen los sujetos obesos para desarrollar colapso. Aunque no se ha estudiado, es posible que exista déficit en la vía aérea superior en niños obesos también.8
Debe considerarse el estudio preoperatorio extenso (ecocardiograma, electrocardiograma, biometría hemática completa, PSG nocturna), lo cual contribuirá a la toma de decisión sobre la conducta terapéutica.12
En la literatura médica se reporta que 10% de los niños diagnosticados con SAOS son obesos, 46% de los niños con obesidad tienen diagnóstico polisomnográfico de SAOS. El 55% de los niños sometidos a cirugía bariátrica tienen SAOS. La hipertrofia amigdalina y adenoidea limita el tamaño de la vía aérea superior, en niños con y sin obesidad. Se sugiere que un 45% de los niños obesos con SAOS tienen evidencia de hipertrofia adenoamigdalina. La prevalencia de obesidad entre niños de dos a cinco años se ha incrementado del 5% al 12.4%, entre seis y 11 años del 6.5% al 17% y entre 12 y 19 años del 5% al 17.6%, en los últimos 20 años.8
El tratamiento de los niños con SAOS depende de las anormalidades subyacentes, el sitio de obstrucción y la presencia o ausencia de anormalidades neurológicas o funcionales contribuyentes. La AA es considerada como el tratamiento cardinal del SAOS en edad pediátrica, en pacientes con índice de apneahipopnea moderado a severo en la PSG basal. Tiene una eficacia superior a la adenoidectomía o amigdalectomía solas. Sin embargo, estudios han demostrado que la cura quirúrgica completa sólo ocurre en 25% a 50% de los casos. Esto es debido a la presencia de obesidad principalmente, y al riesgo de colapso muscular de la vía aérea, ya que los grupos de pacientes asociados a riesgo mayor de SAOS persistente, a pesar de la cirugía son aquellos que presentan SAOS inicial severo, obesidad e historia familiar positiva para SAOS.5
La disminución de peso es el tratamiento a largo plazo más efectivo en niños obesos con SAOS. Dado que la hipertrofia adenoamigdalina se asocia en niños con SAOS obesos y no obesos, la AA puede estar indicada a pesar de no resolver el problema completamente.13
Debe realizarse una PSG de control meses después de la AA. Si existen síntomas residuales de TRS asociados a deterioro funcional, debe considerarse el inicio de tratamiento con CPAP.1
El uso de CPAP también está indicado en los casos en los cuales la AA no está indicada o está contraindicada, y antes de la cirugía en niños con SAOS severo.5 Ocasionalmente, se requiere un sistema de presión aérea positiva binivel (BiPAP).13
La Academia Americana de Medicina de Sueño (American Academy of Sleep Medicine) recomienda que todos los pacientes candidatos a titulación de CPAP, deben recibir una adecuada educación, demostraciones personalizadas y un adecuado ajuste de la mascarilla. La presión debe incrementarse hasta que desaparezcan los eventos respiratorios. La presión mínima inicial debe ser de 4 cm H2O, tanto en pacientes pediátricos como en el caso de los adultos, con una presión máxima recomendada de 15 cm H2O. Si el paciente no tolera el uso del CPAP, debe cambiarse por BiPAP.14
No existen estudios en niños que muestren el efecto del tratamiento con CPAP en morbilidad cardiovascular. Sin embargo si los hay con respecto a la AA, que es el tratamiento de elección. Estudios demuestran una disminución en la presión diastólica, seis meses después del tratamiento quirúrgico exitoso. Por otro lado, niños con SAOS residual o recurrente tienen un aumento en la presión sistólica y diastólica por causas aún no esclarecidas.11
El riesgo quirúrgico asociado a SAOS existe en muchos niveles. Durante el intraoperatorio, los pacientes con SAOS muestran sensibilidad incrementada a los efectos depresivos respiratorios de las benzodiacepinas y opiáceos.3 Además, la presencia de SAOS aumenta el riesgo de obstrucción de la vía aérea. La ventilación con mascarilla y la intubación endotraqueal es más difícil, sobre todo si se asocia a obesidad. El cuidado anestésico de éstos pacientes es un reto. En muchas ocasiones, el SAOS no es diagnosticado y es imposible adecuar un plan anestésico para su beneficio.
En una revisión de AA por SAOS en niños jóvenes, se encontró aumento significativo en las complicaciones respiratorias antes de los tres años de edad y se realizan algunas recomendaciones de rutina a la admisión de éstos pacientes.15
Los factores de riesgo principales para complicaciones posoperatorias respiratorias incluyen: edad (>2.3 años), índice de apnea/hipopnea preoperatorio elevado (>1 evento por hora de sueño), disminución en la saturación basal de oxígeno (<70% a 80%) y presencia de alteraciones craneofaciales.16
La AA en SAOS se asocial a sangrado posquirúrgico en 3% de los casos, dolor y descompensación respiratoria (20%), edema pulmonar, obstrucción de la vía aérea superior y ocasionalmente la muerte. La adenoidectomía sola tiene un riesgo menor de sangrado posoperatorio (<0.5%). Se recomienda el monitoreo activo de los pacientes con alto riesgo, en la Unidad de Terapia Intensiva. Se ha reportado que los niños con dificultad respiratoria en el posoperatorio, se benefician con CPAP.17
La hemorragia post-AA es complicación infrecuente pero grave. El sangrado primario, que es aquel que ocurre dentro de las primeras 24 horas, aparece en <1% de los pacientes. El sangrado secundario, que tiene una incidencia del 4% ocurre entre los cinco y 12 días tras el evento quirúrgico. Los factores que incrementan el riesgo de hemorragia incluyen: técécnica quirúrgica, edad mayor a cinco años, infección amigdalina crónica y uso preoperatorio de aspirina y otros antiinfl amatorios no esteroideos. Las compliantiinflamatorios no esteroideos. Las complicaciones de la hemorragia pos-AA incluyen: hematemesis, anemia, hipovolemia y muerte. Debido al elevado riesgo potencial de estas complicaciones, los niños con evidencia de hemorragia pos-AA deben regresar a quirófano de forma urgente, para control hemostático en la fosa amigdalina afectada.18
La hipoxia crónica tisular trae como consecuencia adaptaciones fisiológicas sistémicas, que incluyen: policitemia, pérdida de masa corporal, pérdida de peso, disminución del metabolismo y angiogénesis. Este último es un proceso altamente complejo y coordinado que requiere múltiples factores reguladores, receptores y vías de señalización intracelular. Existen por lo menos dos vías principales y una gran cantidad de vías complementarias, responsables de la angiogénesis: subregulación del factor de crecimiento endotelial (VEFG) dependiente del factor 1 inducible por hipoxia (HIF-1), un mecanismo independiente de HIF-1, uno dependiente de ciclo-oxigenasa 2 (COX-2) y subregulación de la angiopoetina-1 (Ang-2), principalmente.19
Sin embargo, no existen estudios que comprueben el efecto de la hipoxia secundaria a SAOS sobre la angiogénesis y su impacto en el riesgo de la hemorragia posquirúrgica.
La Sociedad Americana de Anestesiólogos (American Society of Anesthesiologist) publicó en 2006, una guía para el manejo de pacientes perioperatorios con apnea obstructiva del sueño, donde se sugieren herramientas de detección preoperatoria en pacientes con riesgo, es decir, aquellos que tengan signos y síntomas clínicos sugerentes, divididos en tres clases: 1) Predisposición física (IMC>35, o > percentil 95 para la edad, anormalidades craneofaciales, talla de cuello >17 en hombres y 16 en mujeres, obstrucción nasal anatómica e hipertrofia amigdalina severa), 2) historia de obstrucción aparente de la vía aérea durante el sueño y 3) datos clínicos de somnolencia.20
El uso crónico de CPAP (>1 mes) ha mostrado revertir los efectos respiratorios y cardiacos en pacientes con SAOS severo, por lo que se recomienda retrasar la cirugía hasta que el tratamiento con CPAP pueda ofrecer beneficios.3 Se ha identificado también, que el CPAP es superior a la presión positiva automática de la vía aérea (APAP) en la disminución de riesgos cardiovasculares, aunque ambos tienen efectos similares en la reducción de la intensidad del SAOS.21
Un estudio mostró que el uso de CPAP mejora la función autonómica cardiovascular después de seis semanas de tratamiento. Existe mejoría en el tono vagal en sujetos con niveles elevados de renina, por lo cual el CPAP puede ser útil para reducir el riesgo de desarrollar manifestaciones clínicas de disfunción autonómica.22
El uso de CPAP disminuye los niveles séricos de diversos factores asociados a riesgo cardiovascular, como la PCR, homocisteina, colesterol total, índice colesterol total/lipoproteínas de alta densidad, índice apolipoproteína B/apolipoproteína A-1.23
A pesar de la relación demostrada entre el uso del CPAP y la disminución de riesgos quirúrgicos cardiovasculares y respiratorios, no existe en la literatura médica información sobre el uso del CPAP para disminuir otros riesgos perioperatorios como la hemorragia, o su efecto fisiopatológico sobre los mecanismos de angiogénesis secundaria a hipoxia crónica. No existe tampoco, un consenso para el uso generalizado de CPAP en pacientes con SAOS sometidos a AA. Proponemos líneas de investigación futuras en éste campo que potencialmente puedan aplicarse en nuestro medio.
Correspondencia:
Dr. Alberto Palacios Ávila.
Hospital General de México, Edificio del Departamento de Medicina Experimental.
Dr. Balmis 148, Colonia Doctores.
C.P. 06726. México D.F., México.
Teléfono: 562326 8590.
Correo electrónico:apalaciosavila@gmail.com