¿ Introducción
Los quistes hepáticos se clasifican en congénitos y adquiridos.1 Los quistes hepáticos congénitos (QHC) pueden ser únicos ("quistes solitarios o simples") o distribuirse difusamente en el parénquima hepático ("poliquistosis hepática"). Esta última entidad se transmite de forma autosómica dominante en la mayoría de los casos1 y puede estar asociado con quistes en otros órganos (riñón, páncreas, bazo, etc.). Los adquiridos pueden ser parasitarios (quiste hidatídico) o consecuencia de patologías traumáticas, neoplásicas o inflamatorias.
Los QHC son una entidad rara que se presentan en 4% a 5% de la población adulta2 con una incidencia establecida en autopsias de 0.14% a 0.30%.3 En la actualidad con el avance en los procedimientos diagnósticos de imagen cada vez es más frecuente detectarlos. Se originan por un defecto congénito del desarrollo y organización de las vías biliares, con formación excesiva de conductos en la etapa fetal, falta de unión e involución de algunos de ellos, con dilatación quística posterior de estos conductos aberrantes intrahepáticos.4,5 Los quistes pueden ser únicos o múltiples. El revestimiento del quiste es de epitelio cubico o columnar similar al de las vías biliares, recubierto por una membrana basal y tejido fibroso, rodeados de parénquima hepático normal, sin comunicación con la vía biliar. El líquido quístico habitualmente es amarillento o marrón claro, con una composición parecida a la del suero. Se cree que su crecimiento es propiciado por factores hormonales en la edad adulta.6 Son más frecuentes en mujeres con una relación 5:1 después de la quinta década de la vida. En la mayoría de los casos son asintomáticos y no requieren tratamiento,7 reservando el mismo para los que producen síntomas (distensión abdominal con tumoración palpable, dolor abdominal, disnea, saciedad precoz, ictericia) ocasionados por el crecimiento del quiste con compresión a órganos vecinos. Las complicaciones intra-quísticas (hemorragia, infección) ocurren en menos de 5% de los casos. La infección se produce por vía hematógena y la malignización del revestimiento es excepcional.8 En la comunidad médica no existe en la actualidad un acuerdo generalizado acerca de cuál es procedimiento de elección para el tratamiento de los QHC sintomáticos.
Este trabajo tiene la finalidad de presentar los casos y los resultados a largo plazo de dos pacientes con QHC, no parasitarios gigantes resueltos quirúrgicamente con destechamiento de los mismos y aplicación de argón plasma.
¿ Métodos
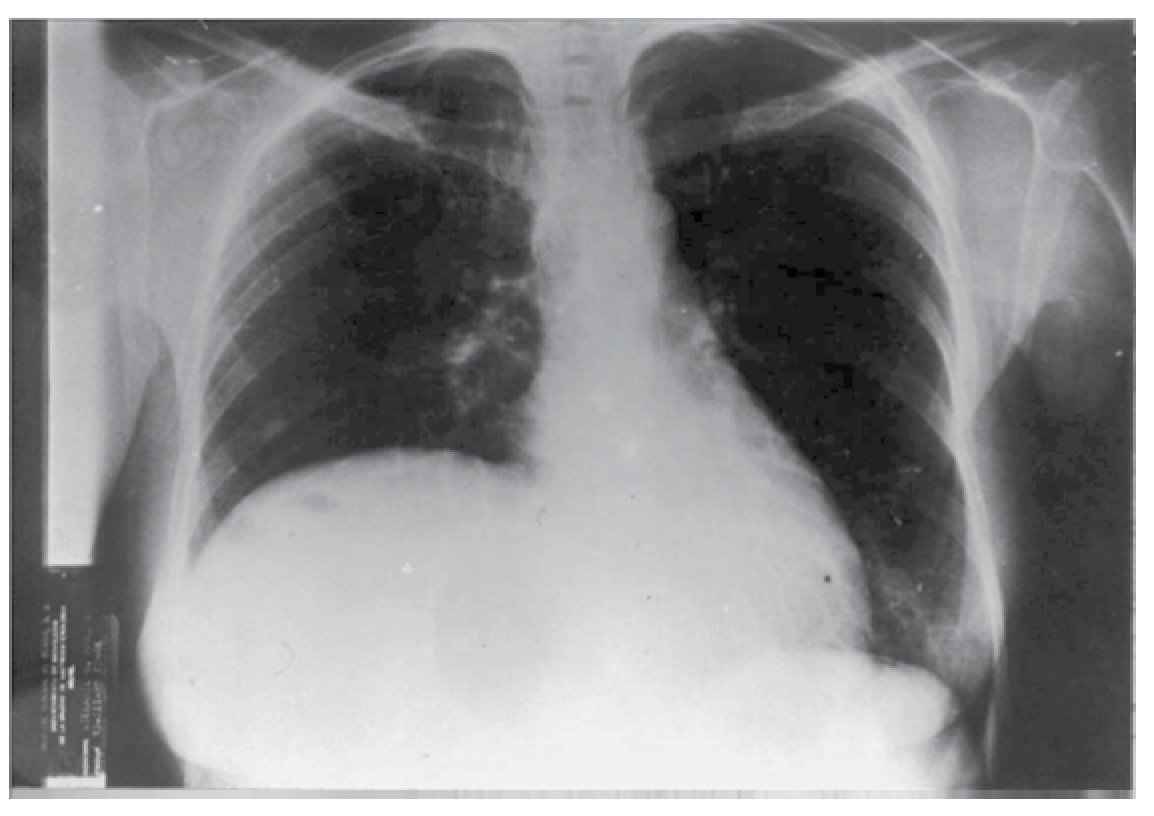
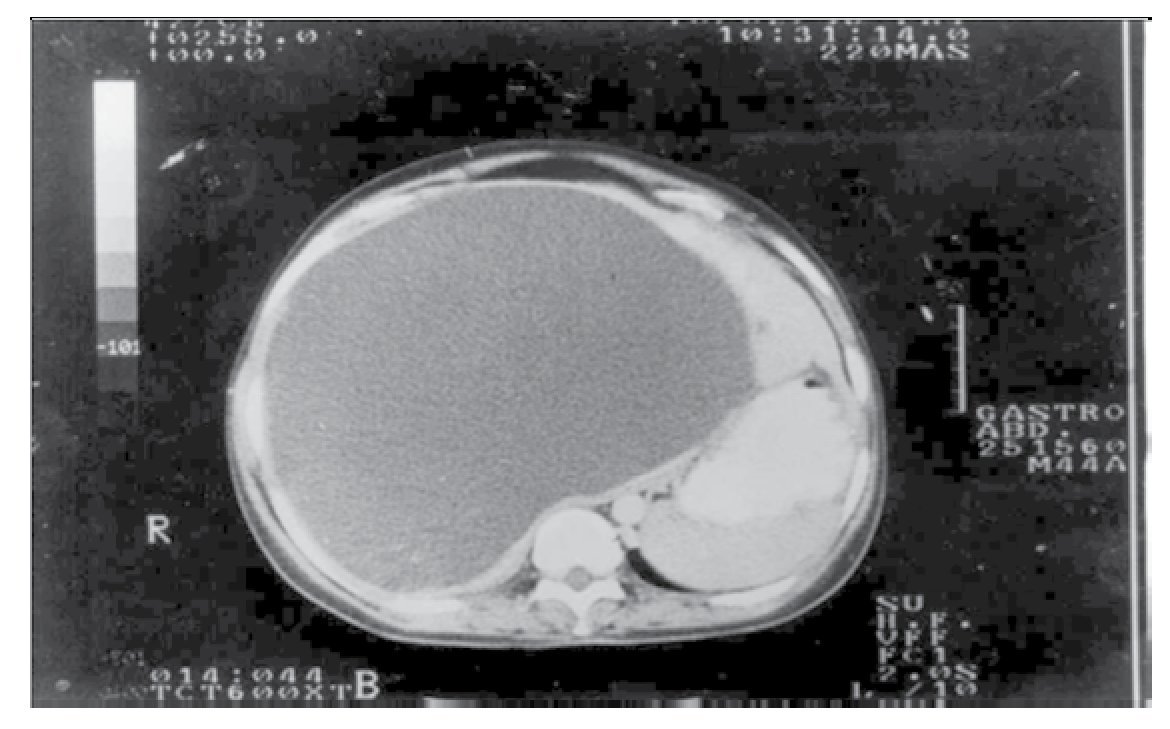
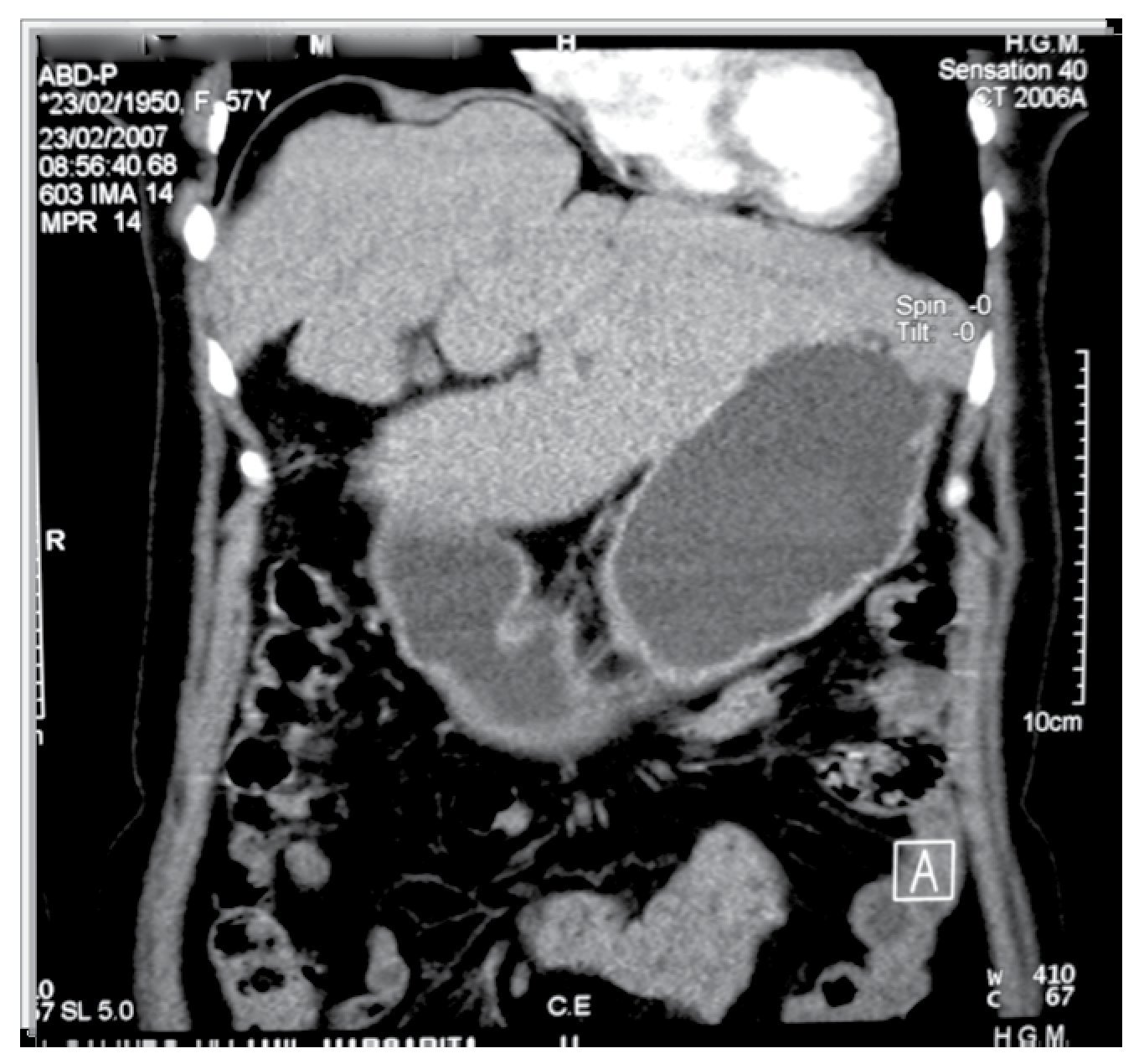
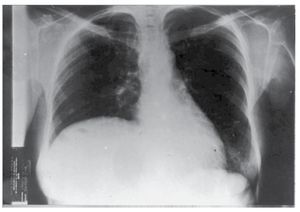
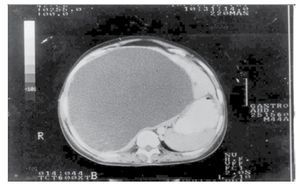
Caso 1: Femenino de 42 años, padecimiento de dos años de evolución con sensación de pesantez y dolor opresivo de intensidad creciente en hipocondrio derecho, nauseas, plenitud prandial temprana y vómito posprandial inmediato, pérdida de 10 kg. Seis meses previos con dificultad respiratoria que progresó de grandes a pequeños esfuerzos. A la exploración física se encontró adelgazada, elevación de hemidiafragma derecho, hepatomegalia hasta 2 cm arriba de la cicatriz umbilical, blanda, lisa, dolorosa, sin datos de irritación peritoneal. Se realizaron exámenes de laboratorio que incluyeron: biometría hemática completa, química sanguínea, pruebas de funcionamiento hepático, pruebas de coagulación, electrolitos séricos; reportados dentro de parámetros normales. Intradermorreacción de Casoni negativa. Telerradiografía de tórax PA (Figura 1) y lateral con elevación de hemidiafragma derecho. Ultrasonografía con quiste único del hígado lóbulo derecho, la tomografía computarizada corroboró la presencia de quiste hepático gigante no parasitario del lóbulo derecho (Figura 2).
¿Figura 1. Radiografía de tórax con elevación del hemidiafragma derecho (Caso 1).
¿Figura 2. Tomografía computarizada de abdomen. Gran tumoración quística lóbulo derecho del hígado (Caso 1).
Caso 2: Femenino de 56 años de edad con antecedente de punción simple de quiste hepático cinco años previos. Padecimiento de 18 meses de evolución con dolor de moderada intensidad y sensación de pesantez en epigastrio e hipocondrio izquierdo que dificulta sus actividades cotidianas, plenitud prandial temprana y ocasionalmente náuseas y vómito. Con la exploración física se evidenció hepatomegalia del lóbulo izquierdo dura, dolorosa, de superficie lisa.
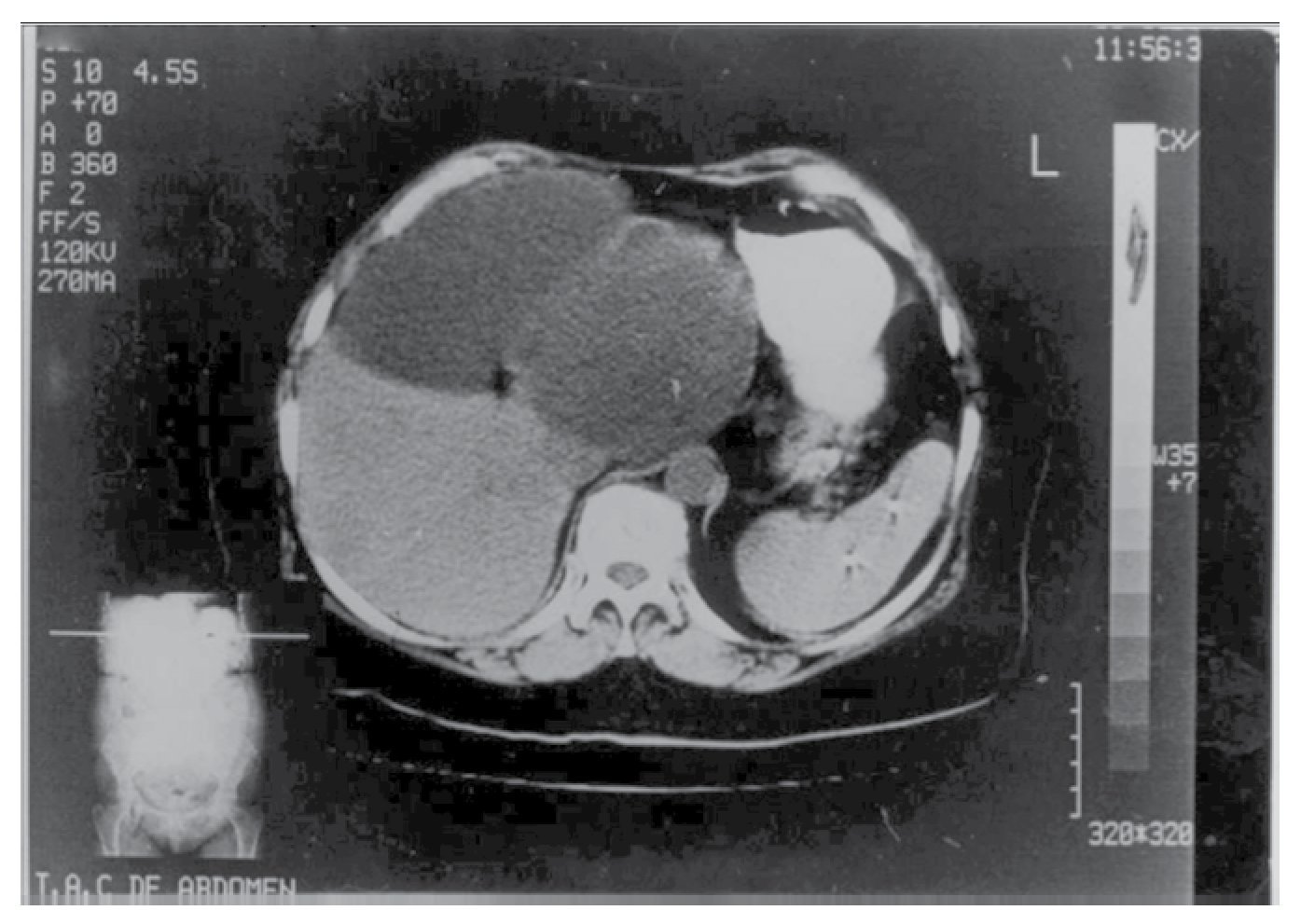
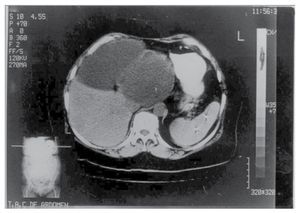
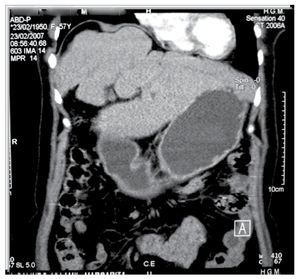
Exámenes de laboratorio (biometría hemática, química sanguínea, pruebas de funcionamiento hepático y pruebas de coagulación) en rangos normales. Intradermorreacción de Casoni negativa. Ultrasonografía hepática revela dos imágenes quísticas, una en lóbulo izquierdo y otra en lóbulo derecho del hígado. La tomografía computarizada corroboró los dos quistes (Figura 3).
¿Figura 3. Tomografía computarizada de abdomen. Dos grandes quistes en lóbulo derecho e izquierdo del hígado (Caso 2).
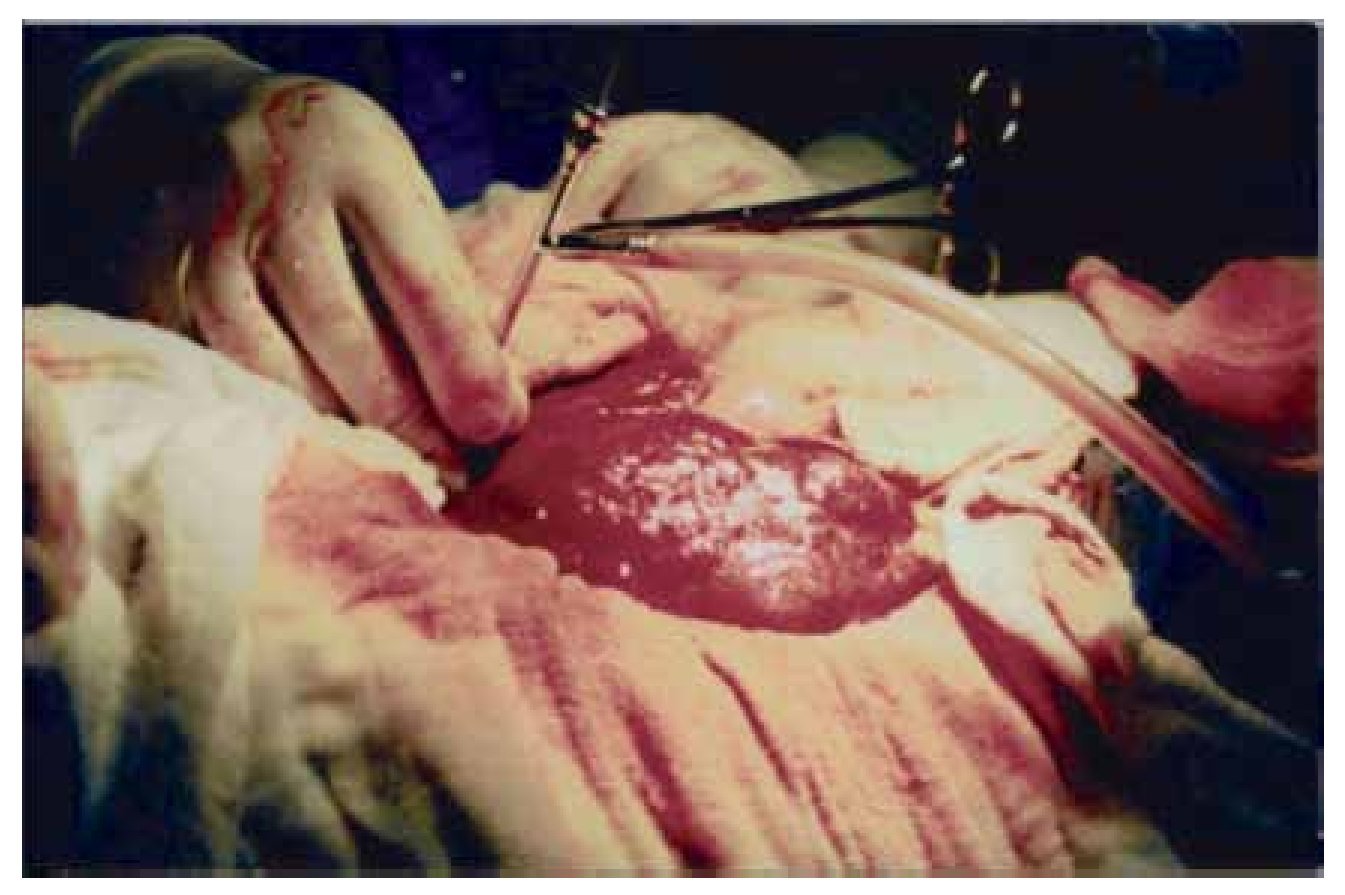
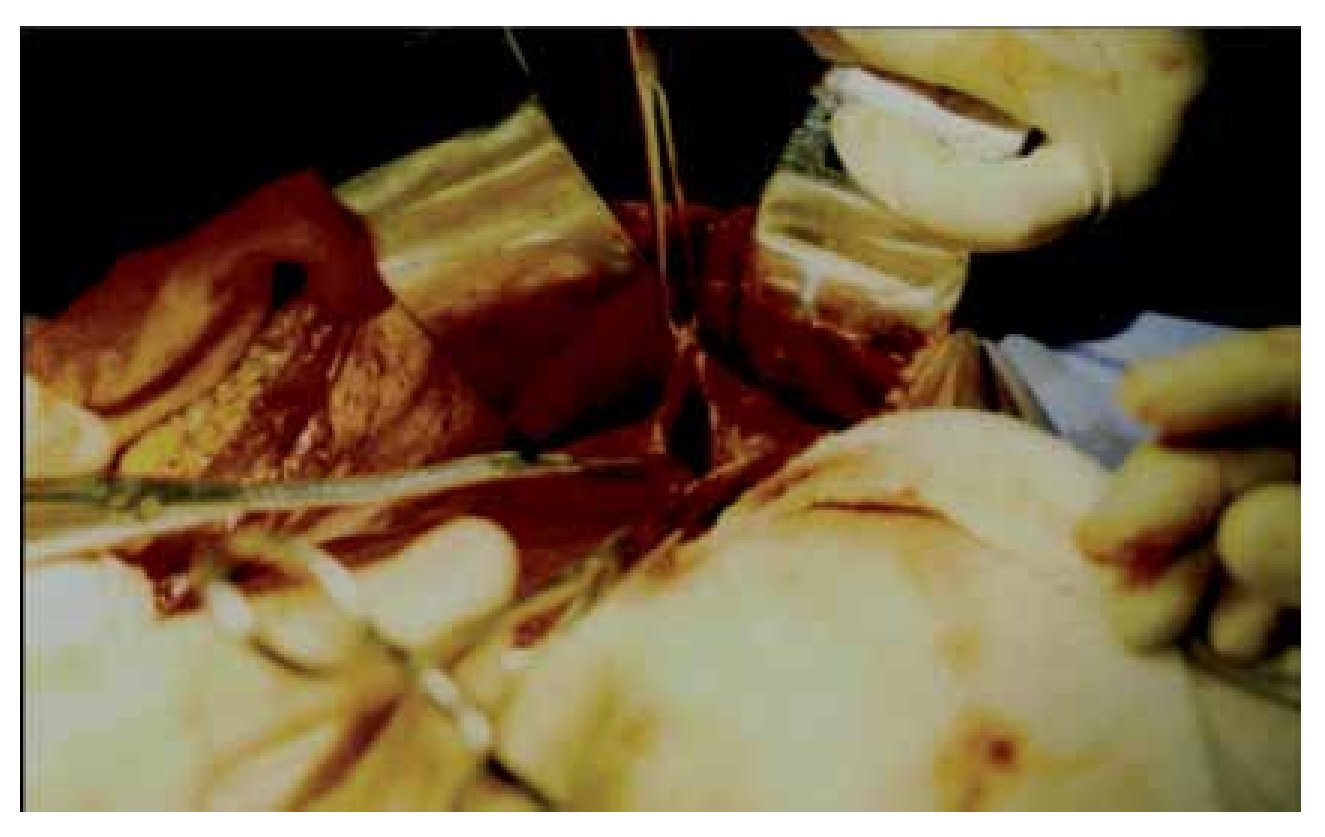
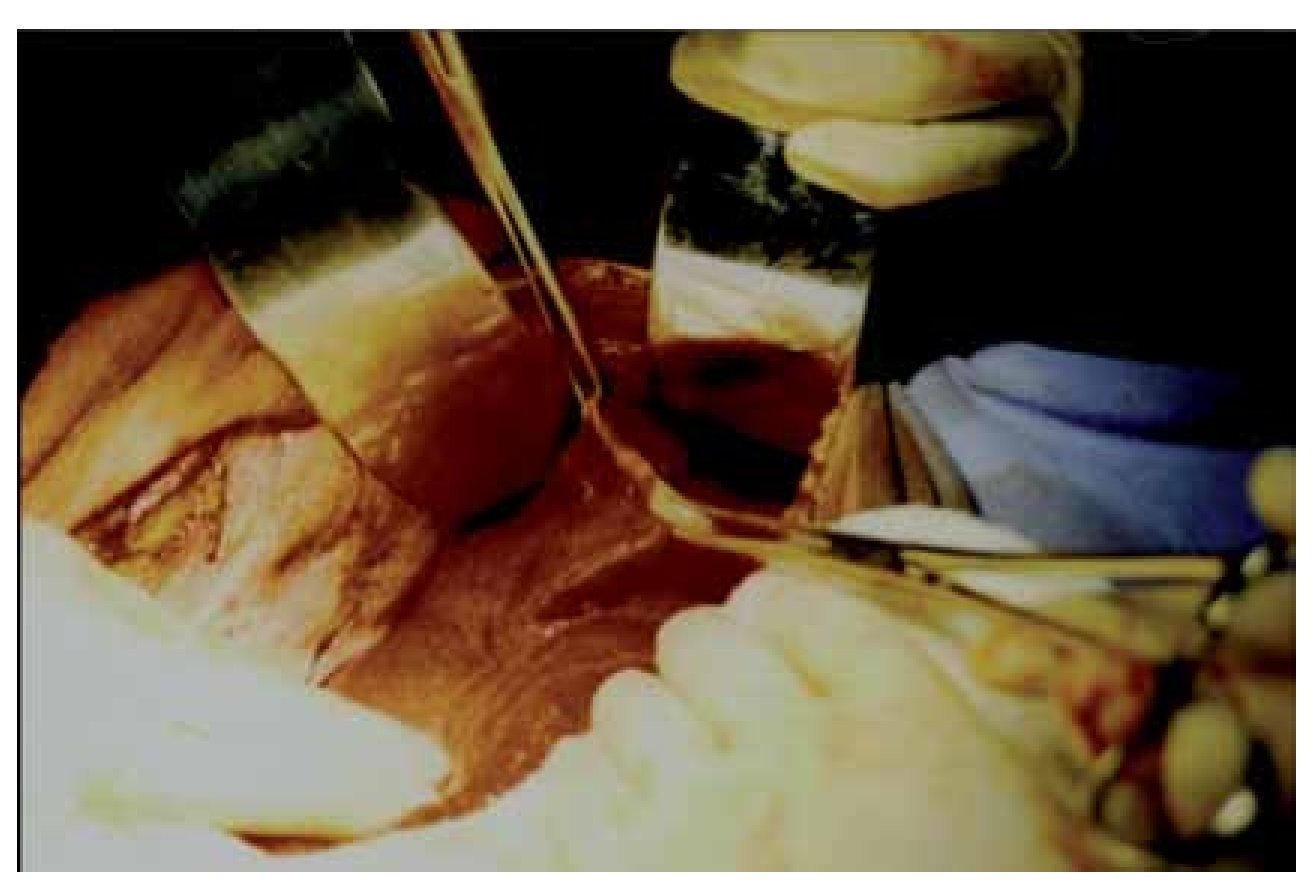
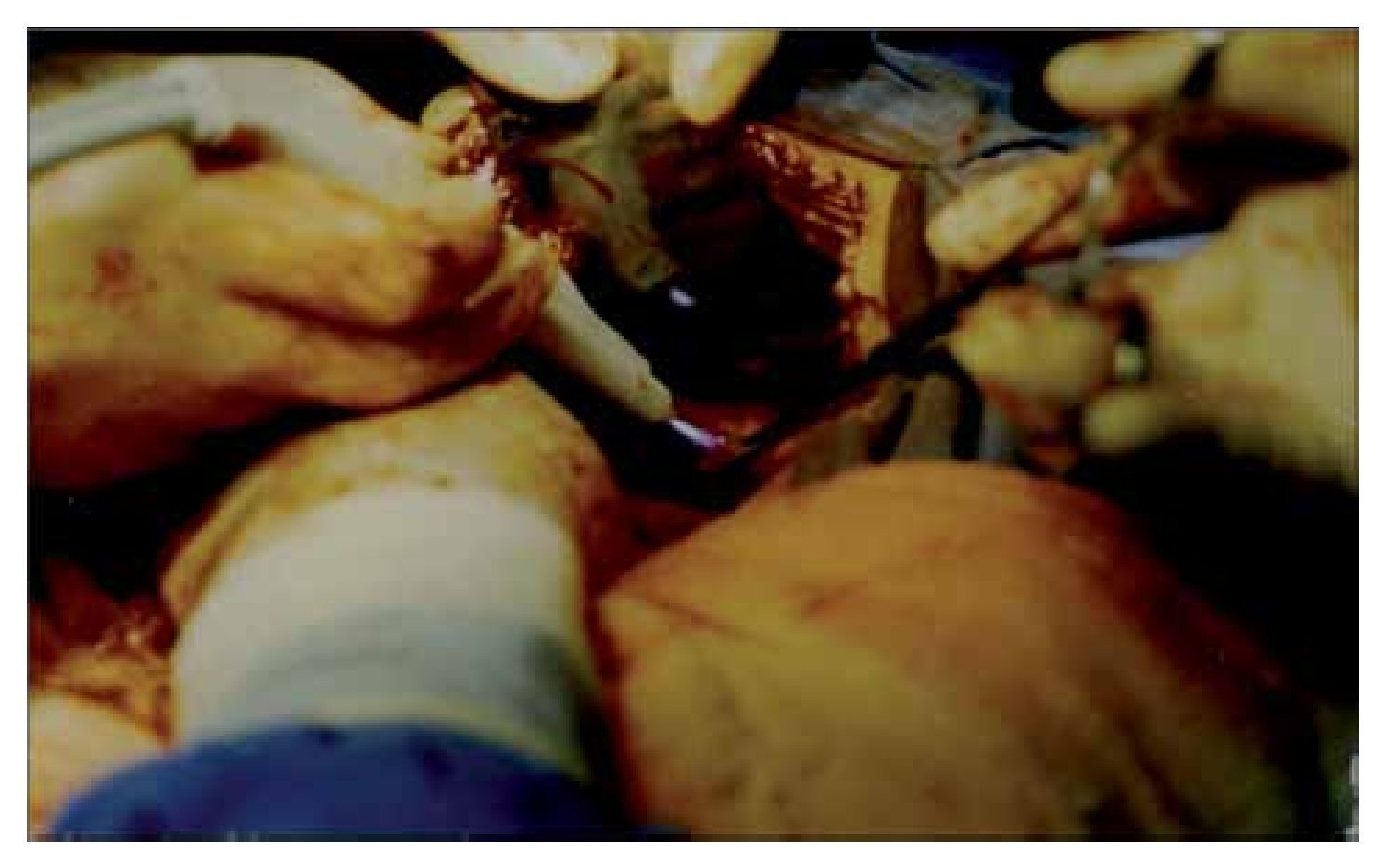
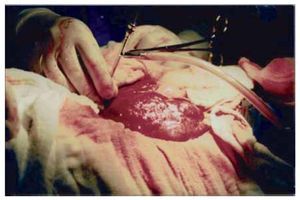
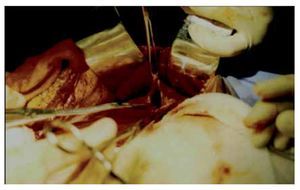
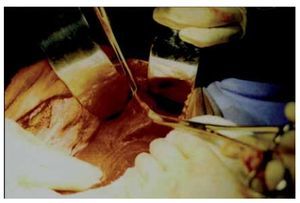
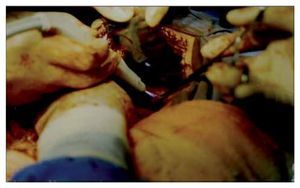
En ambos casos se realizó laparotomía paramedia supra-umbilical derecha. Punción y aspiración del contenido del quiste (Figura 4). En el caso 1 se aspiraron 3000 mL de líquido amarillento marrón; en el caso 2 se aspiró 2500 mL de líquido xantocrómico de los dos quistes, los cuales estaban separados por una membrana. Se realizó apertura y destechamiento de la superficie de los quistes (Figura 5 y 6) y se aplicó argón plasma (AP) en el borde de resección y superficie del quiste adosada al hígado (Figura 7). Durante el transoperatorio la hemorragia fue mínima y prácticamente sin drenaje de líquido por los drenes. La evolución posoperatoria fue satisfactoria y sin complicaciones. Después de 10 y 12 años de realizado el procedimiento, se encuentran asintomáticas, con función hepática normal y sin recidiva de los quistes corroborados por tomografía computarizada de abdomen (Figura 8).
¿Figura 4. Aspiración del contenido del quiste.
¿Figura 5. Disección del techo del quiste hepático.
¿Figura 6. Apertura del quiste y destechaminento del mismo.
¿Figura 7. Aplicación argón plasma en la pared del quiste adosada al hígado.
¿Figura 8. Tomografía computarizada (Caso 1) diez años después de su cirugía, sin evidencia de recidiva quística.
¿ Discusión
Los QHC descritos desde 1852 por Douglas9 y Bristowe10 son malformaciones congénitas que se originan por un defecto del desarrollo y organización de las vía biliares,4,5 como consecuencia de la formación aberrante de conductos biliares que no involucionan y que no se conectan al árbol biliar. Pueden ser únicos o múltiples, siendo los primeros los más comunes (95% de los casos). Frecuentemente se localizan en el lóbulo derecho del hígado.5 El revestimiento del quiste es de epitelio cubico o columnar similar al de las vía biliares, excepcionalmente escamoso, recubierto por una membrana basal y tejido fibroso, rodeados de parénquima hepático normal, sin comunicación con la vía biliar. El quiste contiene cantidades variables de líquido de aspecto diverso pero habitualmente es amarillento claro o marrón con una composición semejante a la del suero.
Son asintomáticos en la mayoría de los casos y no comprometen la función hepática, a diferencia de lo que ocurre con los quistes renales que pueden ocasionar insuficiencia renal.11 La mayoría de las veces son hallazgos incidentales al realizar estudios de imagen abdominal.
Son más frecuentes entre la cuarta y sexta década de la vida y predominan en mujeres (4-5:1), su crecimiento puede estar influenciado por factores hormonales posterior al climaterio.6 Los menores a 10 cm, excepcionalmente producen síntomas. La sintomatología habitualmente se produce por quistes de gran tamaño por efecto de masa o que ocasionan compresión de órganos vecinos2 e incluye dolor, dispepsia, sensación de saciedad, vómito, disnea, ictericia por obstrucción de vías biliares o manifestaciones de hipertensión portal por obstrucción de la vena porta. En menos de 5% de los casos puede ocurrir infección del contenido del quiste con vía de acceso hematógeno siendo el principal agente causal la Escherichia coli. La degeneración maligna es excepcional y cuando ocurre habitualmente es un carcinoma de células escamosas derivado de la presencia de epitelio escamoso en su estructura.8
Los métodos diagnósticos de elección son la ultrasonografía hepática y la tomografía computarizada. Debe establecerse el diagnóstico diferencial con quistes parasitarios (quiste hidatídico) sobretodo en áreas endémicas, cistadenomas, cistadenocarcinoma, quistes traumáticos y abscesos. Hallazgos "atípicos" en los métodos de imagen como son calcificaciones, engrosamiento o irregularidad de la pared del quiste, presencia de elementos sólidos o septos en su interior obligan a realizar una investigación más cuidadosa del origen.12
Con los QHC asintomáticos no se recomienda tratamiento y sólo debe realizarse seguimiento periódico con controles clínicos y ultrasonográficos. Los quistes sintomáticos definitivamente requieren tratamiento; sin embargo, en la comunidad médica no existe acuerdo general sobre cuál es el mejor procedimiento.2 Para tomar esta decisión deben tenerse en cuenta varios factores, entre otros: certeza diagnóstica; tamaño y localización del quiste; estado clínico del paciente; y fundamentalmente recursos y experiencia médica para tratarlos.
A lo largo de la historia se han utilizado diferentes procedimientos que en términos generales se pueden dividir en quirúrgicos y no quirúrgicos. Dentro de los métodos no quirúrgicos se encuentran:
a) La punción simple guiada o no por métodos de imagen con extracción de líquido del quiste. Es un método sencillo, barato, con mínima mortalidad, con buena respuesta sintomática pero con alta recurrencia (95% a 100%) y con riesgo de hemorragia e infección, por lo que no se recomienda como tratamiento definitivo.13
b) Punción con extracción del líquido y administración de sustancias esclerosantes dentro del quiste. Se han utilizado diferentes sustancias: Colohidroclactato de urea (Mathe, 1949);14 Glucosa hipertónica (Grabastald, 1954);15 Formalina (Rosemberg, 1956);16 Fenol (Pearman, 1966);17 Pantopaque (Goldstein, 1976)18 para el tratamiento de los quistes renales, las cuales se emplearon también en quistes hepáticos con malos resultados y efectos tóxicos severos de algunos de ellos por lo que se han abandonado.
c) Punción con extracción de líquido y aplicación de alcohol absoluto.19,20 Método utilizado a partir de 1985 bajo el fundamento que el alcohol fija las células epiteliales e impide sigan secretando. Después del tratamiento la capa de células epiteliales se encuentra ausente y la capa de células parenquimatosas hepáticas es normal. Es un procedimiento sencillo de bajo costo, mínima morbi-mortalidad y baja recurrencia.21 Tiene el inconveniente de no ser útil en quistes gigantes ya que se requieren de varias sesiones y hay riesgos potenciales en cada sesión de provocar además de dolor, hemorragia, sepsis, colangitis esclerosante, trombosis venosa y arterial.22
Entre los métodos quirúrgicos para tratar los QHC están:
a) Resección quirúrgica por enucleación o resección hepática, considerado en alguna época el procedimiento de elección.23 La resección hepática es un procedim iento mayor con alta morbilidad y mortalidad que requiere personal y equipamiento altamente especializado, con alto costo y no indicado en quistes de grandes dimensiones que son los que realmente ocasionan la sintomatología. En la actualidad sólo se recomienda en casos poco frecuentes de trasformación maligna.
b) Cistoyeyuno anastomosis. Empleado con la finalidad de derivar el líquido del quiste al tubo digestivo, con el gran inconveniente de convertir una cavidad estéril en una contaminada con la consecuente formación de un absceso; este procedimiento no es utilizado en la actualidad.24
c) Destechamiento o fenestración del quiste,2,25,26 también llamada marzupialización de la pared del quiste. Consiste en el drenaje libre del mismo hacia la cavidad abdominal. El procedimiento es quirúrgicamente sencillo, con baja morbilidad y mortalidad; permite tomar biopsias. Es un buen tratamiento sintomático, pero con el riesgo de recidiva al dejar parte del epitelio secretor del quiste y con limitación para su realización en quistes profundos o de segmentos posteriores.27
A un gas que tiene la capacidad de conducir energía eléctrica (conductor eléctrico), se le denomina plasma, ya que contienen partículas cargadas. Cuando los átomos de algunos gases (argón, helio, hidrógeno, nitrógeno) se exponen a altos niveles de energía, se ionizan y se transforman en un plasma.28 El argón es un gas noble (inerte a los tejidos). Trasmite corriente eléctrica monopolar de alta frecuencia, entregada por vía del argón ionizado sin contacto con el tejido y ocasiona diferentes efectos térmicos en el mismo:28-30 1) destrucción de tejido (desvitalización térmica); 2) coagulación por debajo del tejido desvitalizado y 3) desecación. Tan pronto como una porción de tejido pierde su conductividad eléctrica como resultado de la desecación, el AP automáticamente cambia de dirección para localizar áreas que aún tienen conductividad. Este proceso continúa hasta que toda la superficie cercana al aplicador del AP ha sido desecada. Como resultado de estas características la coagulación con AP produce áreas de profundidad uniforme de desvitalización, coagulación y desecación aún en áreas muy extensas de aplicación, las cuales automáticamente se limitan a 3 mm a 4 mm de profundidad. Además, no produce escarificación, carbonización, ni humo. Algunas mediciones in vitro e in vivo han demostrado que la profundidad del efecto térmico depende fundamentalmente de la potencia aplicada al dispositivo y del tiempo de aplicación, pero se limita a una profundidad de 3 mm a 4 mm con la potencia máxima (80 W) con un tiempo razonable de aplicación.
En los dos casos incluidos en este trabajo, se corroboró el diagnóstico de QHC no parasitario gigante sin repercusión en el funcionamiento hepático. Ambas pacientes requerían tratamiento por la sintomatología que presentaban. Una de ellas tenía el antecedente de tratamiento con punción simple varios años atrás con recidiva del quiste. Dado el tamaño de los quistes, las buenas condiciones generales de las pacientes, aunada la experiencia quirúrgica del personal de la unidad de Gastroenterología y la disponibilidad de equipo, se optó por tratar a las pacientes con manejo quirúrgico con resección del techo del quiste, procedimiento que ha demostrado en diferentes estudios su eficacia. La utilización de AP facilitó enormemente la resección al minimizar la hemorragia. Y su aplicación en el fondo del quiste en teoría puede destruir el epitelio secretor, sin daño del parénquima hepático con la consecuente limitación de la recidiva. Ambos casos presentaron una evolución posoperatoria satisfactoria, con seguimiento de más de 10 años se mantienen asintomáticas con función hepática normal y sin evidencia de recidiva. Lo que sugiere que este método es altamente eficaz para el control de esta patología. Sin embargo, se requiere serie más grandes de pacientes para demostrarlo.
¿ Conclusiones
Los QHC son entidades patológicas poco frecuentes. La mayoría son asintomáticos y no requieren tratamiento. Sólo deben ser tratados los que por su crecimiento o localización ocasionan sintomatología.
Debido a su baja incidencia, no existen series grandes de casos que permitan establecer con certeza un plan de manejo específico y universalmente aceptado. Se han descrito una gran variedad de procedimientos quirúrgicos y no quirúrgicos con resultados variables.
El destechamiento asociado a la aplicación de AP en la superficie del quiste y en el borde de resección que informamos en este estudio, resultó ser un método eficaz para tratar los QHC gigantes sintomáticos ya que es un procedimiento sencillo con baja morbilidad y sin mortalidad. El AP produce necrosis por coagulación evitando la hemorragia durante el procedimiento, permite destruir la capa epitelial de la superficie del quiste remanente, sin daño del parénquima hepático, lo que evita la recidiva. Nuestras pacientes después de 10 años de seguimiento están asintomáticas y sin recidiva. Sin embargo, se requiere su aplicación en más casos para corroborar su eficacia.
Correspondencia: Dr. José Francisco Salas Gordillo.
Dr. Balmis 148, Col. Doctores C.P. 06720
Teléfono: 2789 2000, ext: 1044, 1047, 1048.
Correo electrónico:jfjsg@hotmail.com.