Antecedentes: Los individuos con síndrome de Down (SD) presentan niveles elevados de ácido úrico (AU).
Objetivo: Evaluar la variación producida con la práctica de ejercicio físico en los niveles urinarios de AU en individuos con SD.
Material y métodos: Se ha analizado a 29 individuos con SD de ambos sexos y edades de 4 a 52 años. Se analizaron 37 individuos sanos, sin trisomía 21 de ambos sexos y edades de 5-72 años (controles). Se utilizó el método de Duncan et al para determinar el AU. La creatinina (Cr) se determinó por el método de Jaffé, modificado por Varley y Gowenlock.
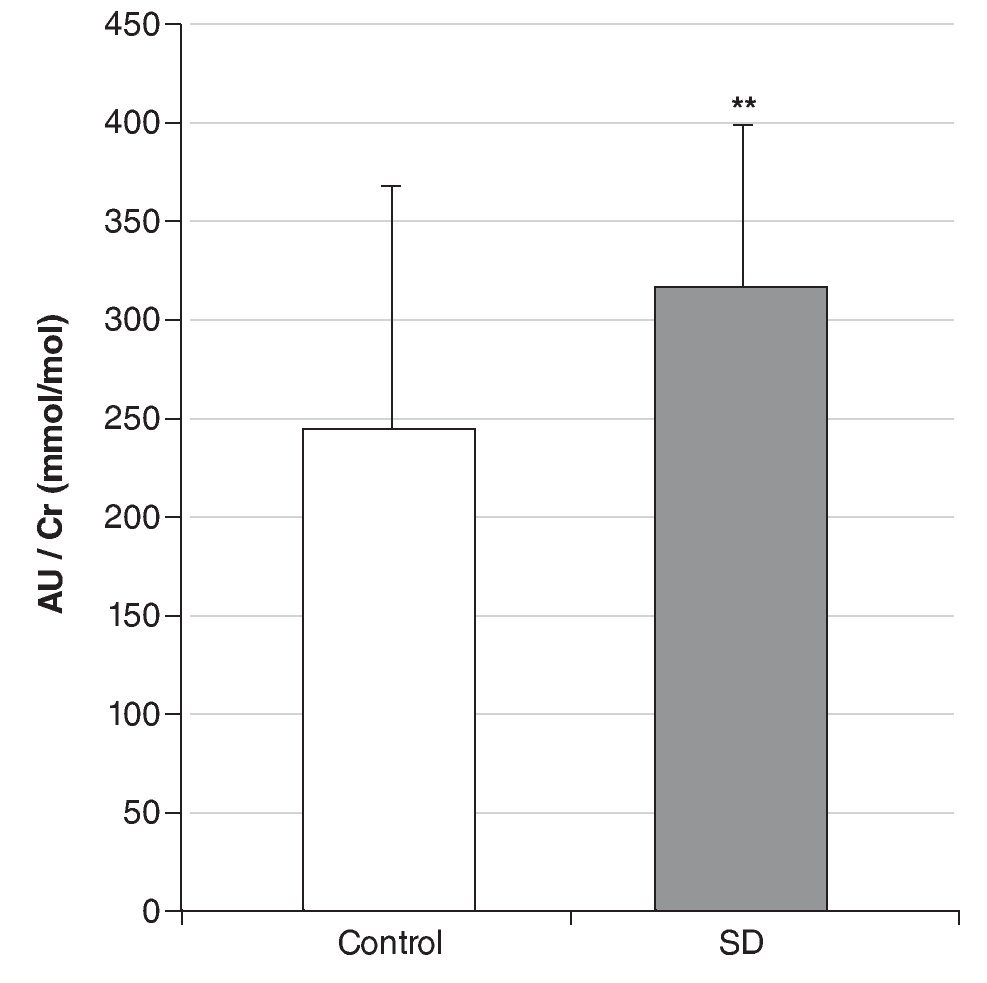
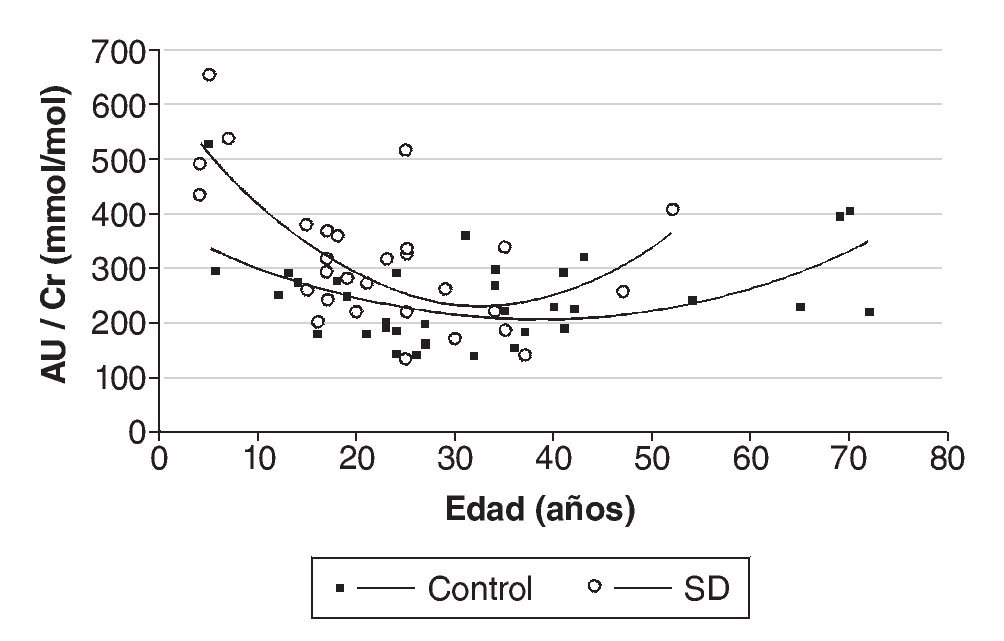
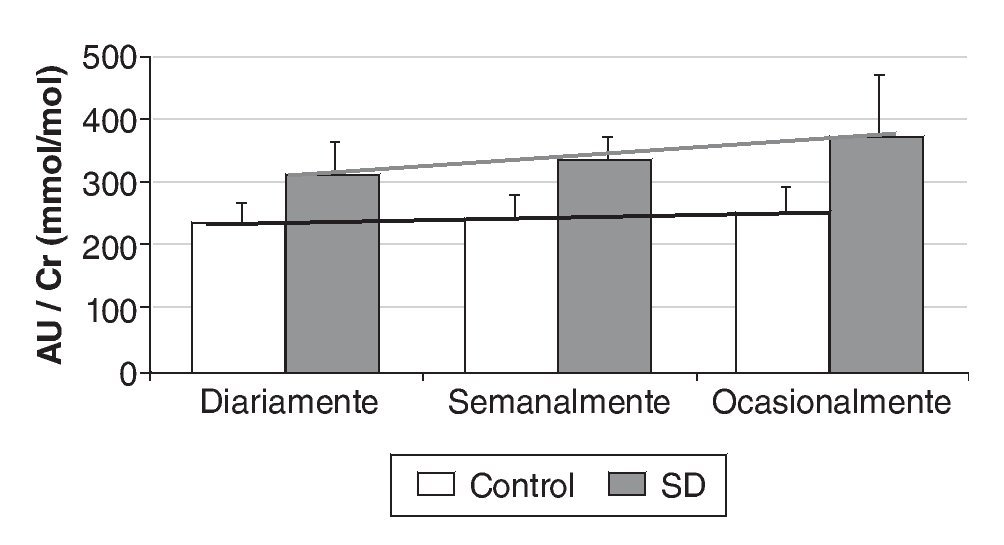
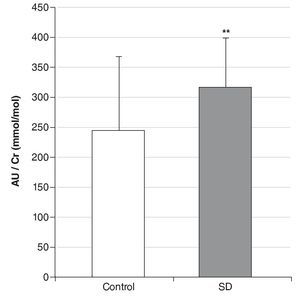
Resultados: Los valores de AU urinario referenciados a Cr son significativamente mayores (p < 0,01) en individuos con SD que en controles (315 ± 123 mmol/mmol frente a 244 ± 83 mmol/mmol), y no varían significativamente ni con el sexo, ni con la edad. Sin embargo, tanto en el grupo control, como en el de SD aparece una correlación negativa entre el ratio AU/Cr y la edad hasta los 20 años, que se hace positiva a partir de esta edad. Nuestros resultados muestran una correlación más acentuada en personas con SD. El AU disminuye un 19% en SD y un 6,4% en controles cuando el deporte pasa de practicarse ocasionalmente a diariamente.
Conclusiones: El AU urinario está aumentado en individuos con SD. El AU urinario no varía significativamente con el sexo. La práctica diaria de ejercicio físico con intensidad moderada reduce la excreción urinaria de AU en el SD.
Background: Down's syndrome (DS) individuals have elevated uric acid (UA) urinary levels.
Objective: To evaluate urinary UA levels variation with physical exercise practice in DS individuals.
Material and methods: We analysed 29 individuals with DS and 37 individuals without DS (control group) matched by age and sex. Urinary UA levels were determined by Duncan method. Creatinine (Cr) was assessed according to the spectrophotometric Jaffé method.
Results: We reported that individuals with DS have significant elevated urinary UA levels compared to controls (315 ± 123 mmol/mmol vs 245 ± 84 mmol/mmol), and we did not observed any significant variation with respect to sex or age. However, up to 20 years a negative correlation between ratio UA/Cr and age was obtained. This correlation was positive starting from 20 years. According to our results this correlation is more accentuated in DS individuals. Urinary UA levels decrease 19.0% in DS individuals and 6.4% in controls when sport is practiced more than occasionally to daily.
Conclusions: Urinary UA is increased in DS individuals. Urinary UA does not vary significantly according to sex. The daily practice of physical exercise of moderate intensity reduces the urinary excretion of UA in DS individuals.
Pagina nueva 1
Introducción
El ácido úrico (AU) en el ser humano es el producto final del metabolismo de las purinas ingeridas con la alimentación o producidas por la célula, por la acción de la xantino oxidasa en la xantina y la hipoxantina, y se excreta principalmente a través de la orina y las heces. Aumenta con una dieta rica en proteínas y después del tratamiento con corticoides y uricosúricos. Se encuentra en la sangre en forma de urato monosódico en concentraciones muy superiores a las del resto de primates, ya que el ser humano carece de la enzima urato oxidasa. Tanto el ácido libre, como sus sales (los uratos), son poco solubles en agua, y pueden precipitar y cristalizar en el riñón formando cálculos renales. Además, cuando el AU se encuentra en concentraciones elevadas (hiperuricemia), puede depositarse en los tejidos cartilaginosos y provocar la enfermedad conocida como gota.
El síndrome de Down (SD) es el primer síndrome cromosómico clínicamente definido1, y está causado por la presencia de tres copias del cromosoma 21 (Lejeune et al, 1959)2.
Es uno de los defectos congénitos humanos más importantes, con una incidencia en 1 de cada 700-1.000 nacimientos3. En el 95% de los casos se debe a una trisomía primaria del cromosoma 21. Entre el 3 y el 5% puede producirlo una translocación de un cromosoma 21 a otro cromosoma del grupo D (13-15), frecuentemente el 14, o a otro cromosoma del grupo G (21-22)4. Aproximadamente el 2-4% de los pacientes con SD presenta mosaicismo, con diferentes porcentajes entre la línea celular normal y la línea celular con trisomía5.
Los individuos con SD muestran una marcada hipotonía, estatura corta, sobrepeso, fisuras palpebrales oblicuas y epicantus. Además de las características faciales y físicas, el SD es una de las causas principales de retraso mental y defectos congénitos cardíacos, así como también de anomalías congénitas del aparato digestivo, diversas anomalías renales y urológicas6-8, alteraciones del sistema inmune y endocrino, un riesgo mayor de leucemia y aparición temprana de la enfermedad de Alzheimer9.
En este trabajo se han utilizado muestras de orina por las ventajas que supone el uso de este tipo de muestras, así como por la escasez de este tipo de estudios en el SD. Las muestras de orina se usan frecuentemente para la determinación de parámetros bioquímicos e indicadores biológicos, especialmente para compuestos de corta vida biológica, como fármacos, metales y algunos pesticidas que se emplean en la actualidad (Barr et al, 2005)10. La orina presenta muchas ventajas frente a otro tipo de muestras biológicas, como sangre o líquido cefalorraquídeo, ya que permite obtenerla de forma no invasiva y, además, proporciona un volumen suficientemente grande para su uso en multitud de determinaciones. Todas estas ventajas hacen de la orina la muestra de elección idónea en estudios poblacionales.
Los objetivos de este trabajo se han centrado en: a) analizar la concentración urinaria de AU en individuos con SD, y b) determinar la influencia de la dieta y la práctica de ejercicio físico en los niveles urinarios de AU.
Material y métodos
Se ha analizado a un grupo de 29 individuos con SD de ambos sexos (13 mujeres y 16 varones) y edades entre 4 y 52 años, seleccionados en centros de día, colegios públicos y concertados de educación especial y pisos tutelados de la Comunidad de Madrid. De los 29 individuos con SD, 26 presentaban trisomía completa; 2 presentaban mosaico, y 1, traslocación. Se analizó también a 37 individuos sanos, sin trisomía 21 de ambos sexos (24 mujeres y 13 varones) y edades de 5-72 años, que en su mayoría eran hermanos de los individuos con SD.
Las características citogenéticas de la serie con SD analizada en este trabajo se habían analizado previamente mediante cultivo de linfocitos de sangre periférica11, para lo que se emplearon 3 técnicas para examinar los cromosomas en detalle: bandas GTG, bandas CBG y bandas RHG. Las proporciones encontradas muestran una distribución de acuerdo con la observada en la epidemiología del SD4, en la que la trisomía primaria completa es la anomalía más frecuente, en nuestro caso de un 93,3%.
Las determinaciones se realizaron en el Departamento de Medicina Celular y Molecular del Centro de Investigaciones Biológicas, del Consejo Superior de Investigaciones Científicas (CSIC), y se utilizaron muestras de orina de primera hora de la mañana en ayunas. Junto con la muestra de orina se recogió un cuestionario en el que se incluían datos sociodemográficos, práctica de ejercicio físico y hábitos alimentarios. La realización de este trabajo fue aprobada por el Comité de Bioética del CSIC. Todos los integrantes del estudio, o sus representantes legales, dieron conformidad para incluirlos en el estudio.
Para la determinación del AU se utilizó el método ultravioleta de la uricasa de Duncan et al12, con pequeñas modificaciones. Los valores obtenidos se referencian a la creatinina (Cr), determinada por el método de Jaffé13, modificado según Varley y Gowenlock14.
Para el análisis estadístico se utilizó el software SPSS 18.0. Los resultados se expresan como media ± desviación estándar (DE). El tipo de distribución de los grupos se determinó mediante el test de Kolmogorov-Smirnov, resultando distribución normal para ambos grupos. Para la comparación de grupos se empleó el test de la t de Student y el test ANOVA. Se consideran diferencias significativas cuando p < 0,05.
Resultados
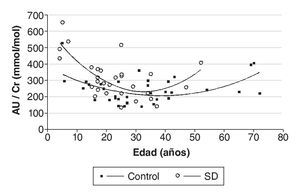
Los valores de AU urinario referenciados a Cr son significativamente mayores en individuos con SD que en el grupo control (p < 0,01) (fig. 1), y las medias ± DE obtenidas fueron de 245 ± 84 mmol/mmol para el grupo control y 315 ± 123 mmol/mmol para el grupo con SD. En la muestra analizada, los niveles de AU no varían significativamente con el sexo ni con la edad. Sin embargo, aparece una correlación negativa entre el ratio AU/Cr y la edad hasta los 20 años, tanto en controles (r = -0,70; p < 0,05), como en SD (r = -0,83; p < 0,01), que se hace positiva a partir de esta edad (fig. 2).
Figura 1 Comparación del ratio ácido úrico/creatinina (AU/ Cr) entre el grupo con síndrome de Down (SD) y el grupo control. *Indica diferencias significativas (p < 0,01).
Figura 2 Variación del ratio ácido úrico/creatinina (AU/Cr) con la edad. El gráfico muestra líneas de tendencia polinómicas de 2.º orden.
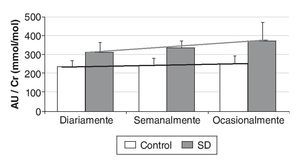
El AU no varía de forma significativa con la práctica de ejercicio físico de intensidad moderada, aunque se observa una disminución del 19,0% en SD y del 6,4% en el grupo control cuando éste pasa de practicarse ocasionalmente a diariamente (fig. 3).
Figura 3 Variación del ratio ácido úrico/creatinina (AU/Cr) según la frecuencia de la práctica de ejercicio físico.
No se han encontrado variaciones significativas en la excreción urinaria de AU con la dieta, aunque un consumo mayor de ciertos tipos de alimentos (carne, legumbres, frutos secos y fruta) hacen aumentar ligeramente los niveles de AU en la orina.
Discusión
El AU total del cuerpo, como urato, es un equilibrio entre producción y eliminación. Aproximadamente, dos terceras partes del urato producido cada día es excretado en orina, y una tercera parte eliminado directamente en saliva y secreciones intestinales experimentadas por uricólisis bacteriana15. La eliminación está también afectada por variaciones diurnas: la excreción renal de AU está reducida y la secreción intestinal incrementada durante el sueño16.
Diversos autores17-20 han encontrado niveles séricos elevados de AU en SD, lo que apoya los datos obtenidos en este trabajo en muestras de orina, pero el origen de esta anomalía bioquímica no está totalmente claro. Coburn et al17 indican que el incremento de los niveles de AU en sangre puede estar causado por un descenso en la eficacia en la excreción, más que por un aumento en su síntesis. Nishida et al21 indican que la disfunción glomerular puede contribuir a la hiperuricemia en el SD. Aunque algunos autores atribuyen este incremento de AU en SD a alteraciones en la filtración glomerular17,18, la formación de AU también puede ocurrir a través del sistema de la xantina oxidasa con la producción consiguiente de superóxido. Se ha encontrado un descenso en los niveles de hipoxantina y xantina en niños con SD20, que indica un incremento en la conversión de hipoxantina a xantina, la cual se vuelve a convertir en AU y superóxido.
Puukka et al22 han encontrado que los niveles eritrocitarios de adenosina deaminasa y la actividad de adenina fosforil transferasa están correlacionados con incrementos de concentraciones plasmáticas de uratos en individuos con SD. El incremento en la dosis génica de adenosina deaminasa específica de ácido ribonucleico de doble hebra (codificada en el cromosoma 21) puede causar un aumento en la actividad de la enzima y podría contribuir al aumento de AU en el SD.
En individuos con SD se muestra un incremento significativo en las mutaciones de ácido desoxirribonucleico (ADN) mitocondrial y una reducción en la expresión genética de adenosina trifosfatasa, enzima encargada de la biosíntesis de adenosina trifosfato23. El descenso de los niveles de adenosina trifosfato origina la acumulación de adenosina monofosfato deaminasa que es deaminada por la adenosina monofosfato deaminasa en inosina monofosfato, y convertida por la inosina 5'-monofosfato en inosina, que puede entrar en la sangre y producir hipoxantina. La xantina oxidasa convierte la hipoxantina en xantina, con la formación consiguiente de todavía más superóxido. La hipoxantina intracelular formada a partir de inosina puede también entrar en sangre, y ser convertida por xantina oxidasa en AU con la formación de superóxido. Este mecanismo podría explicar, al menos en parte, el incremento en los niveles de AU.
El hecho de que en este trabajo se haya obtenido una correlación negativa entre el ratio AU/Cr y la edad hasta los 20 años —que se hace positiva a partir de esta edad— podría atribuirse al mayor peso relativo de los órganos internos, a un elevado ratio ADN/proteína y al crecimiento acelerado de los órganos durante la infancia, hechos que ya pusieron de manifiesto Stapleton et al24. También la menor musculatura en los individuos más jóvenes podría explicar estos resultados. En relación con el sexo, nuestros resultados apoyan los obtenidos por Garcez et al25, que tampoco encuentran diferencias entre varones y mujeres con SD en los niveles de AU en suero.
El descenso en los niveles urinarios de AU obtenidos en este trabajo, en relación con la práctica de ejercicio físico, también se ha observado en músculo y muestras de sangre26, y en muestras de saliva27. En un estudio realizado en Jerusalén, Slater et al28 observaron que, en varones activos que realizaban ejercicio físico, la concentración de AU sérico era significativamente más baja que en varones inactivos, y obtuvieron una correlación inversa entre la concentración sérica de AU y la actividad física. Aunque las células humanas carecen de la enzima uricasa (que transforma el AU en alantoína), si el AU se somete a sistemas productores de radicales libres y especies reactivas de oxígeno (ROS), pueden originarse —mediante reacciones de oxidación no enzimáticas— varios productos de oxidación, como alantoína, ácido glioxílico, urea, oxalato, etc.29. También se ha observado que otros agentes pueden oxidar el AU, como el citocromo C30. Estos hechos podrían explicar, al menos en parte, la disminución de AU con la práctica de ejercicio físico, por el incremento en la generación de radicales libres y ROS que conlleva.
El hecho más importante del trabajo ha sido la confirmación de que el ejercicio físico practicado diariamente disminuye los niveles urinarios de AU en el SD. De esta forma, la práctica deportiva podría servir para mejorar la calidad de vida de estas personas.
Conclusiones
— El AU urinario está aumentado en individuos con SD.
— El AU urinario no varía significativamente con el sexo.
— Hasta los 20 años de edad, el ratio AU/Cr disminuye, para luego ir aumentando progresivamente.
— La práctica frecuente de ejercicio físico reduce la excreción urinaria de AU, aunque no de forma significativa, en la población estudiada.
— En la muestra analizada, la dieta no influye de forma significativa en los niveles de AU urinario, ni en el SD, ni en el grupo control.
Las limitaciones del estudio se deben a que, normalmente, los individuos con SD tienden, generalmente, al sedentarismo, y es complicado obtener individuos que practiquen ejercicio físico de forma habitual. De ahí la ventaja de difundir trabajos como el que nos ocupa ahora, en el que se muestran las ventajas que puede conllevar la práctica de ejercicio físico, porque ello posibilitará que, de esta forma, sean conscientes de que es una herramienta que permite mejorar su calidad de vida.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Nuestro agradecimiento a todas las personas con síndrome de Down, a sus familias y a todos los voluntarios, que con su participación desinteresada han hecho posible la realización de este trabajo. A los centros colaboradores. A la Fundación Inocente, Inocente, sin cuya ayuda no se habría podido llevar a cabo este trabajo.
aEste trabajo forma parte de un proyecto financiado por la Fundación Inocente, Inocente.
*Autor para correspondencia.
Correo electrónico:acasado@cib.csic.es (A. Casado Moragón).
Recibido el 29 de septiembre de 2012;
aceptado el 21 de diciembre de 2012