La mielopatía es una enfermedad que afecta de manera significativa la movilidad y la independencia del paciente. En personas con discapacidades intelectuales como el síndrome de Down, el efecto negativo de la mielopatía se magnifica. La mielopatía en el síndrome de Down puede estar relacionada con inestabilidad atlantoaxial o una enfermedad degenerativa. Nuestra experiencia con estos pacientes nos ha llevado a formular la hipótesis de que su mielopatía no se suele diagnosticar hasta que es muy grave. En este estudio nos proponemos determinar si los pacientes con síndrome de Down presentan mielopatía más grave que los que no tienen síndrome de Down.
MétodosLlevamos a cabo una revisión retrospectiva de historiales médicos de pacientes con síndrome de Down que recibieron tratamiento para la mielopatía por parte del Tufts Neurosurgical Practice. Ocho pacientes cumplían los criterios y se les evaluó la gravedad de la mielopatía según la escala de Nurick. Comparamos a los pacientes con mielopatía cervical espondilótica con los pacientes con síndrome de Down que recibieron tratamiento para la mielopatía cervical espondilótica, según la información en Furlan et al. y Fehlings et al..
ResultadosLa media del grado de Nurick para pacientes con síndrome de Down fue de 4,2 (DE 0,84, n = 5). La media del grado de Nurick según la información en Furlan et al. fue de 2,8 (DE 0,68, n = 81) y según Fehlings et al. fue de 3,14 (DE 0,97, n = 278). Las pruebas t independientes de las muestras arrojaron un valor p< 0,000 y 0,016 con Furlan et al. y Fehlings et al., respectivamente.
ConclusionesLos pacientes con síndrome de Down de nuestro estudio acudieron a Neurocirugía con una mielopatía más grave que la de los pacientes sin síndrome de Down. Para los médicos es importante atender a personas con síndrome de Down para darse cuenta de la presentación de mielopatía y considerar la afección en el diagnóstico diferencial de un paciente con síndrome de Down y con deterioro funcional.
Myelopathy is a condition that significantly impacts a person's mobility and independence. In people with intellectual disabilities, such as Down syndrome, the negative impact of myelopathy is magnified. Myelopathy in Down syndrome may be related to atlanto-axial instability or degenerative pathology. Our experience with these patients has led us to hypothesize that their myelopathy is commonly undiagnosed until very severe. In this study we seek to determine whether patients with Down syndrome present with more severe myelopathy than those without Down syndrome.
MethodsWe performed a retrospective medical record review of patients with Down syndrome who were treated for myelopathy by the Tufts Neurosurgical Practice. Eight patients met the criteria and were graded for severity of myelopathy on the Nurick Scale. We compared the patients with cervical spondylotic myelopathy and Down syndrome to patients who were treated for cervical spondylotic myelopathy as reported in Furlan et al. and Fehlings et al.
ResultsThe average Nurick grade for patients with Down syndrome was 4.2 (SD 0.84, n=5). The average Nurick grade as reported by Furlan et al. was 2.8 (SD 0.68, n=81) and by Fehlings et al. was 3.14 (SD 0.97, n=278). The independent samples t-test resulted in a P value<.000 and .016 with Furlan et al. and Fehlings et al. respectively.
ConclusionsThe patients with Down syndrome in our study presented to neurosurgery with more severe myelopathy than patients without Down syndrome. It is important for physicians caring for people with Down syndrome to be aware of the presentation of myelopathy and consider the condition in the differential diagnosis of a Down syndrome patient with functional decline.
La mielopatía es una afección común de la columna en que la médula espinal se comprime y se daña1. Puede estar causada por lesión aguda, degeneración progresiva o inestabilidad vertebral. Lo más frecuente es que se deba a la degeneración del disco y a la estenosis del conducto raquídeo. Si no se trata, el estrechamiento del conducto raquídeo y la compresión de la médula pueden causar desmielinización y necrosis, que son irreversibles2. Puede afectar a la columna cervical, torácica y lumbar. La mielopatía cervical espondilótica (MCE) es predominante y en el ámbito mundial es la enfermedad de la médula espinal que se trata con más frecuencia2,3. La intervención neuroquirúrgica está indicada cuando la mielopatía es sintomática y progresiva1. El resultado favorable está estrechamente correlacionado con el tratamiento precoz: para los pacientes con mielopatía es importante que los identifiquen rápidamente, porque las personas con discapacidad grave tienen menos probabilidades de mejorar con el tratamiento2.
Hay varias condiciones bien estudiadas en personas con síndrome de Down (SD) que pueden causar mielopatía. Una es la inestabilidad atlantoaxial causada por la laxitud del ligamento transverso. Puede provocar la compresión de la columna cervical4. La inestabilidad atlantoaxial afecta a un 10-20% de las personas con SD, pero es asintomática en el 98-99% de los casos5. El peligro que supone la inestabilidad atlantoaxial para los pacientes pediátricos con SD ha dado lugar a recomendaciones específicas para radiografías de la columna cervical por parte de los médicos que administran el tratamiento en casos de cambios en la función neurológica6.
La MCE de la columna cervical subaxial es frecuente en personas con SD, aunque no se suele diagnosticar. En personas con SD, algunos estudios han hallado una prevalencia del 45% de MCE de moderada a grave7. Los primeros síntomas en la historia natural de la MCE suelen ser la torpeza y el cambio en la marcha, pero pueden llegar a ser tan graves como la incontinencia y la tetraplejía8. La alta prevalencia de MCE en personas con SD se debe principalmente a los cambios degenerativos que producen estenosis del conducto raquídeo9.
La torpeza y la marcha anormal son los síntomas más frecuentes que se notan con la aparición de la MCE8. En caso de que el dolor sea el síntoma que más motive a la búsqueda de tratamiento, la mielopatía puede ser insidiosa, porque a menudo no duele. Cuando hay dolor a causa de la MCE, mucha gente se queja de dolor de hombro o dolor referido8.
Muchas personas con MCE sufren una disminución estabilizada de síntomas10. En una situación típica, una persona puede notar un nuevo síntoma, como la menor destreza con una extremidad, que permanecerá sin cambios durante un tiempo. Los síntomas pueden permanecer inmutables durante años, y luego, de repente, empeorar, o surgir nuevos síntomas de la mielopatía en desarrollo. Esta característica de progreso por etapas de la mielopatía puede modificar la búsqueda de tratamiento de una persona. Si un síntoma inicial es problemático pero no es grave y está estabilizado, la persona puede resistirse a buscar tratamiento o a aceptar cualquier tratamiento no conservador. En el momento en que se reduzca su función o empeore la discapacidad, la persona puede estar interesada en un tratamiento que conlleve una operación quirúrgica.
A lo largo de las últimas décadas, ha aumentado enormemente el índice de diagnóstico y tratamiento de la mielopatía11. En asociación con este aumento se ha producido una mejora en la rapidez de la gente en la búsqueda de evaluación neuroquirúrgica en casos de sospecha de MCE. El diagnóstico se lleva a cabo mediante el examen detallado y los antecedentes del paciente combinados con los hallazgos radiológicos. Aunque las radiografías y las TC pueden ser modalidades radiográficas útiles para el diagnóstico de la mielopatía, la RM es la herramienta más adecuada y definitiva para casi todas las etiologías3.
Los tratamientos para la mielopatía van desde opciones conservadoras, como la terapia física, hasta tratamientos neuroquirúrgicos, como la descompresión y la fusión. La gravedad de los síntomas es la consideración principal para el tratamiento recomendado. Otra consideración importante es la gravedad de los hallazgos radiológicos12. A una persona con síntomas leves pero graves hallazgos radiológicos también se le puede recomendar el tratamiento neuroquirúrgico, para prevenir el deterioro repentino de la función.
Las probabilidades de lograr un resultado favorable dependen de la gravedad de los síntomas y del momento en que se administra el tratamiento. Si un paciente sufre solo síntomas leves de espondilosis cervical y hay una mínima evidencia de que ha evolucionado a mielopatía, puede recomendársele tratamiento conservador. Este tratamiento puede incluir ejercicios, inmovilización o una combinación de ambos. La inmovilización se ejerce mediante un collarín cervical o un recurso más rígido, como el corsé Minerva. El objetivo de estos tratamientos es reforzar los músculos del cuello y reducir el movimiento de la columna cervical. Con ello se pretende disminuir el pinzamiento del nervio espinal y frenar el avance de la mielopatía. Para personas con mielopatía radiográfica y sintomáticamente demostrable pero que aún no es grave, podría ser recomendable el tratamiento sin cirugía con terapia física e inyecciones terapéuticas de larga duración.
Si está indicada la intervención quirúrgica, hay una variedad de procedimientos para descomprimir el nervio espinal e inmovilizar las vértebras de la zona afectada. La descripción detallada de estos procedimientos y de sus indicaciones queda fuera del alcance de este documento.
En el tratamiento de la mielopatía, los resultados quirúrgicos han mejorado constantemente, y en muchos casos la cirugía da resultados satisfactorios para el paciente. Fehlings et al. realizaron un análisis integral de los resultados del tratamiento quirúrgico para la mielopatía, con los que comparamos los de nuestra cohorte de pacientes con SD. Los investigadores concluyen que el tratamiento quirúrgico de la MCE es seguro y alivia notablemente los síntomas en la mayoría de los pacientes13.
Hay diferentes sistemas de puntuación que se utilizan para cuantificar la gravedad de la disfunción neurológica de una persona en relación con la mielopatía. Los más frecuentes y mejor estudiados son la escala mJOA y la escala de Nurick. Para este estudio optamos por la escala de Nurick para la MCE porque se ha utilizado mucho en la literatura como escala de discapacidad y es suficientemente amplia para evaluar a personas en una revisión retrospectiva de historiales médicos. Además, se ha evaluado meticulosamente en comparación con una variedad de escalas, y se ha concluido que es precisa y válida14. En este estudio incluimos la consideración de la mielopatía en la columna cervical, torácica y lumbar. Aunque la escala de Nurick está pensada para valorar la discapacidad en la mielopatía cervical, también funciona como calificación de la discapacidad global en la mielopatía torácica y lumbar.
La escala de Nurick es un sistema de 6 puntos en el que la discapacidad menos grave recibe un 0 (solo radiculopatía) y la discapacidad más grave recibe un 5 (no ambulatoria). La escala es la siguiente:
Grado 0: signos o síntomas de afectación de la raíz, pero sin muestras de enfermedad de la médula espinal.
Grado 1: signos de enfermedad de la médula espinal, pero sin dificultad para caminar.Grado 2: ligera dificultad para caminar, pero sin impedir el trabajo a jornada completa.Grado 3: dificultad para caminar que impide el trabajo a jornada completa o la capacidad de hacer todas las tareas de casa, pero sin ser tan grave como para requerir la ayuda de otra persona para caminar.
Grado 4: capaz de caminar solo con la ayuda de otra persona o de un andador.
Grado 5: en silla de ruedas o postrado en la cama15.
Sujetos y métodosEl comité de revisión del Tufts Medical Center aprobó esta revisión retrospectiva de historiales clínicos. Se evaluaron los pacientes de la base de datos de Tufts Neurosurgical Practice para hallar los que tenían SD y habían recibido tratamiento para la mielopatía. Excluimos a los que recibieron tratamiento de urgencia por lesión traumática o cuyo tratamiento era específico para una lesión traumática reciente.
Los investigadores estudiaron de forma independiente a cada paciente con SD y mielopatía y los calificaron según la escala de Nurick. Cuando había discrepancias entre los investigadores en cuanto al grado de un paciente, se utilizó el grado más bajo (que corresponde a una discapacidad más leve) para reducir el riesgo de error de tipo 1 en nuestro análisis.
Además de calificarlo según la escala de Nurick, se revisaron los historiales de todos los pacientes incluidos para encontrar hallazgos radiográficamente relevantes y datos del historial de los pacientes.
El grado de Nurick de los pacientes con SD se comparó con el de los pacientes de Furlan et al. y Fehlings et al.13,16. Se trata de grandes estudios contemporáneos sobre el grado de mielopatía en la población global de pacientes neuroquirúrgicos. En estos estudios también se utilizó la escala de Nurick. Los análisis estadísticos del grupo de pacientes con SD comparados con la población de pacientes global se realizaron con el software de estadística SPSS de IBM.
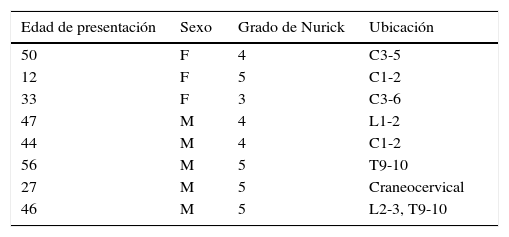
ResultadosHubo 8 pacientes con SD y mielopatía tratados en Tufts Neurosurgical Practice entre 2007 y 2015. En nuestro estudio incluimos a estos 8 pacientes. De estos 8, 4 tenían mielopatía cervical, uno craneocervical, otro torácica, otro lumbar y el último tenía tanto mielopatía torácica como lumbar (tabla 1).
Pacientes neuroquirúrgicos con síndrome de Down en el Tufts Medical Center entre 2007 y 2015 con grado de Nurick y nivel espinal de mielopatía
| Edad de presentación | Sexo | Grado de Nurick | Ubicación |
|---|---|---|---|
| 50 | F | 4 | C3-5 |
| 12 | F | 5 | C1-2 |
| 33 | F | 3 | C3-6 |
| 47 | M | 4 | L1-2 |
| 44 | M | 4 | C1-2 |
| 56 | M | 5 | T9-10 |
| 27 | M | 5 | Craneocervical |
| 46 | M | 5 | L2-3, T9-10 |
En nuestro análisis inicial, consideramos solo los 5 pacientes con MCE comparados con las muestras de pacientes presentadas en Furlan et al. y en Fehlings et al.13,16 (tabla 2).
Comparación del grado medio de Nurick de pacientes con síndrome de Down y mielopatía cervical espondilótica solo de los estudios de Fehlings et al. y Furlan et al
| Grupo de pacientes (n) | Grado medio de Nurick (DE) | % de diferencia | p |
|---|---|---|---|
| Fehlings et al. (278) | 3,14 (0,97) | 29 | 0,016 |
| Furlan et al. (81) | 2,84 (0,68) | 39 | <0,000 |
| Síndrome de Down (5) | 4,20 (0,84) | - | - |
Observamos que los 5 pacientes con MCE y SD presentaban una diferencia estadísticamente significativa entre el grado medio de Nurick de los pacientes de Furlan et al. y Fehlings et al.13,16. La diferencia en el grado medio de Nurick para pacientes con SD en comparación con Fehlings et al. fue del 29%, y con Furlan et al., del 39%. Utilizamos pruebas t de muestras independientes con el programa SPSS Statistics de IBM, versión 24, para comparar el grupo con SD con los grupos de Fehlings et al. y de Furlan et al.
Así, los pacientes con mielopatía toracolumbar se incluyeron como parte de nuestro análisis (tabla 3).
Comparación del grado medio de Nurick de pacientes con síndrome de Down y mielopatía cervical y toracolumbar de los estudios de Fehlings et al. y Furlan et al
| Grupo de pacientes (n) | Grado medio de Nurick (DE) | % de diferencia | p |
|---|---|---|---|
| Fehlings et al. (278) | 3,14 (0,97) | 33 | < 0,000 |
| Furlan et al. (81) | 2,84 (0,68) | 42 | < 0,000 |
| Síndrome de Down (8) | 4,38 (0,74) | - | - |
Observamos que los 8 pacientes con mielopatía y SD presentaban una diferencia estadísticamente significativa entre el grado medio de Nurick en comparación con Furlan et al. y Fehlings et al., del 33 y del 42%, respectivamente13,16.
La diferencia porcentual es mayor cuando en nuestro análisis incluimos todas las zonas de la columna. Sin embargo, para ambos grupos, la diferencia es estadísticamente significativa en comparación con Fehlings et al. y Furlan et al.13,16.
DiscusiónNuestra conclusión es que los pacientes con SD presentan una discapacidad más grave por la MCE que la población global de pacientes con MCE. Además, cuando los pacientes con SD y mielopatía compresiva en cualquier zona de la columna se comparan con otros pacientes, los que tienen SD presentan discapacidades más graves.
Optamos por Furlan et al. y Fehlings et al. para la comparación con los pacientes de este estudio porque son contemporáneos y porque poseen un grupo de pacientes grande y variado. Asimismo, en estos estudios se utiliza la escala de Nurick, que en nuestra opinión es la más útil para este estudio porque se centra en la discapacidad. Como medida bruta de la evolución de la mielopatía, la gravedad de la discapacidad de un paciente es una clave útil. La otra escala típicamente utilizada para calificar la gravedad de la MCE es la mJOA. Esta escala es más detallada, pero temíamos que como medida no tuviera la especificidad que necesitábamos. Dicho de otro modo, algunos elementos de la escala mJOA podrían indicar que nuestros pacientes tenían mielopatía avanzada más por los síntomas del SD que por los síntomas de la mielopatía.
Alguien podría criticarnos argumentando que la escala de Nurick no sirve para personas con mielopatía lumbar y torácica. En principio se diseñó para medir la discapacidad en la MCE, no la mielopatía lumbar o torácica. Sin embargo, como medida solo atañe a la discapacidad y no mide, por ejemplo, la fuerza o el tono muscular de un brazo. Si combinase la medición de la función motora específica en los brazos como la mJOA, no presentaría un grado de discapacidad comparable entre personas con mielopatía lumbar y mielopatía cervical. Como medida global de la discapacidad, la escala de Nurick nos permite hacer una comparación ecuánime entre pacientes con diferentes focos de mielopatía.Los pacientes con SD de nuestro estudio tenían discapacidad grave como consecuencia de la mielopatía. De los 8 pacientes globales, la mitad tenían un grado de Nurick de 5, que equivale a un paciente en silla de ruedas o postrado en la cama. Tres de los pacientes tenían incontinencia de orina o heces secundaria a la mielopatía. La media de edad de los pacientes con grado 5 de Nurick fue de 35 años, entre los que había un paciente que tenía 12 años cuando acudió a Tufts Neurosurgical Practice. La media de edad de los pacientes con todos los grados de mielopatía en Fehlings et al. fue de 56 años, y en Furlan et al., de 57 años, casi 20 años más que los pacientes de este estudio. La discapacidad grave se encuentra en los pacientes con SD que son significativamente más jóvenes que los pacientes típicos con mielopatía.
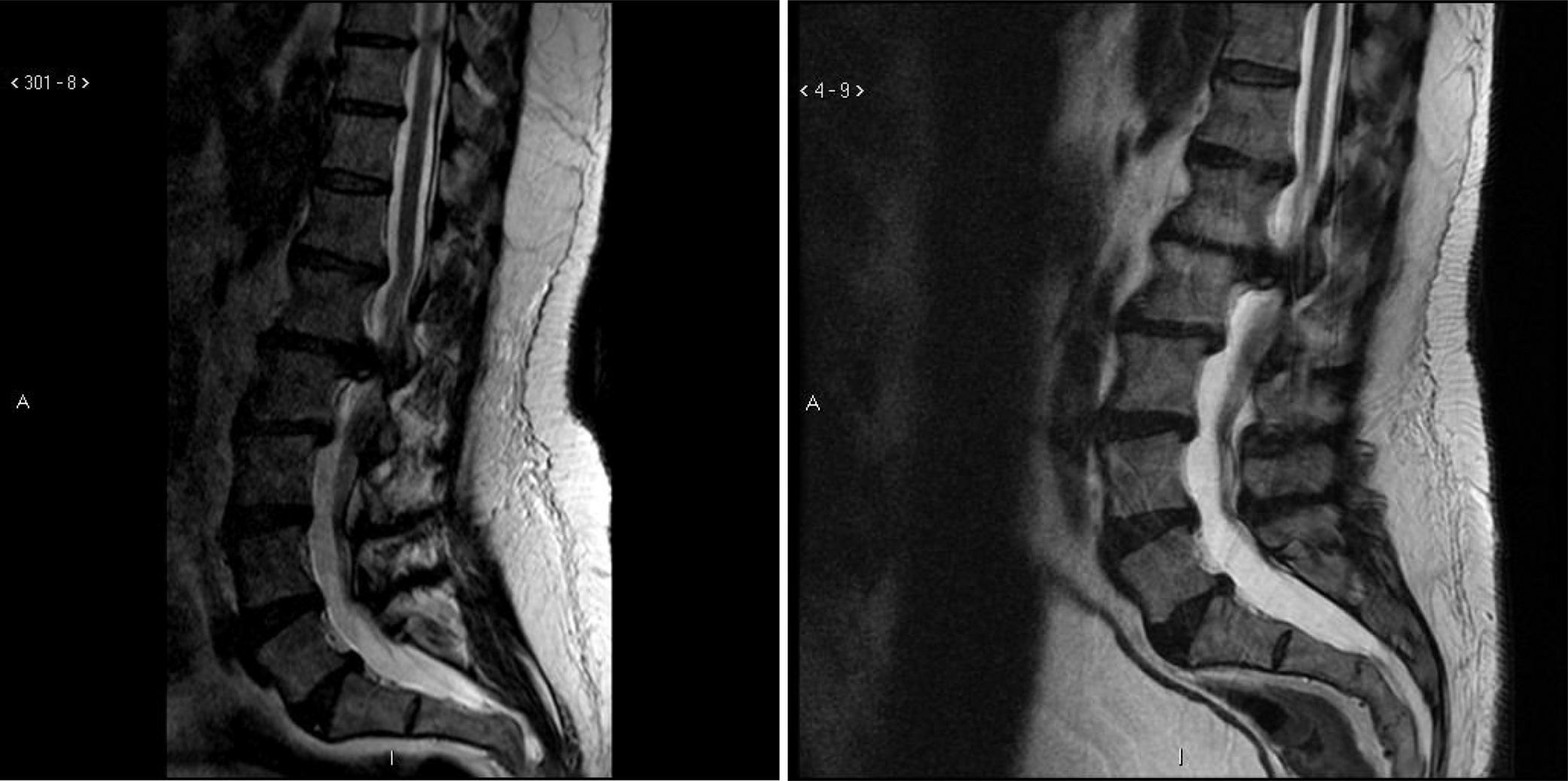
Caso ilustrativoEste varón de 47 años con SD acudió a Tufts Neurosurgical Practice con incontinencia fecal incipiente y unos antecedentes de unos 4 años de incontinencia urinaria. Antes de experimentar los síntomas había sido muy activo en equipos de deportes organizados. Durante los últimos 10 años había tenido pie caído bilateral y su equilibrio había empeorado. Sus padres y entrenadores observaron una reducción muy significativa de su capacidad deportiva en los últimos 3 años, y en ese momento ya no podía ni siquiera saltar. Tenía discapacidades graves por las que tenía que recurrir al uso de aparatos y de asistencia diaria. En el nuevo chequeo de la incontinencia, el paciente se sometió a una RM de la columna lumbar, que reveló una gran hernia discal en L1-L2 que comprimía significativamente el saco dural y el cono medular (fig. 1).
Cabe destacar que el paciente se había sometido a una RM lumbar casi 5 años antes que mostró la misma hernia discal impresionante. El paciente se sometió a cirugía descompresiva por microdisquectomía y, en el seguimiento, sus cuidadores observaron una mejora significativa de la marcha y de la fuerza del pie. En los casos de mielopatía grave y de larga duración no siempre se experimentan mejoras tras la cirugía descompresiva. En pocas palabras, solo la mitad de los pacientes de este estudio vieron mejoras significativas y sustanciales de su discapacidad con el tratamiento neuroquirúrgico.
Es importante explorar los posibles motivos por los que una persona con SD puede sufrir una mielopatía más grave. Una hipótesis es que las personas con SD desarrollan síntomas graves más rápido que las que no tienen SD. Esto parece poco probable y no se ha visto reflejado en la cohorte de pacientes de este estudio. Es importante apuntar que no se ha descrito un mecanismo de ese tipo para la evolución más agresiva de la mielopatía en el SD. Mientras que la prevalencia de estenosis espinal es mayor en personas con SD y se desarrolla a una edad más temprana, esto no parece afectar la velocidad de desarrollo de los síntomas. Además, muchas personas con SD tienen estenosis cervical asintomática. Esto indica que la MCE no se desarrolla tan a menudo en personas con SD y estenosis como en personas neurológicamente normales con estenosis.
Otro motivo por el que una persona con SD podría presentar una mielopatía más grave es que las personas con SD pueden tener una menor reserva funcional. Una persona con SD puede tener un solo método para llevar a cabo una tarea que funcione con las limitaciones de la discapacidad intelectual. Si hay algo que altere ese método concreto, la persona con SD quizás carezca de la flexibilidad necesaria para adaptarse a las nuevas limitaciones. Por ejemplo, una persona con SD podría caminar con una estrategia de marcha menos estable17. Las estrategias de marcha atípicas pueden requerir una coordinación neuromuscular más compleja. Un déficit neurológico incipiente provocado por una estenosis espinal podría eliminar la coordinación necesaria para mantener la cinemática menos estable. Una persona con una estrategia de marcha estable podría ser capaz de adaptarse a la nueva limitación de la menor coordinación neuromuscular secundaria a mielopatía. La persona con SD podría no ser capaz de adaptarse a la menor coordinación y esto podría reducir la movilidad y aumentar la discapacidad.
El retraso en el diagnóstico y/o el tratamiento es un factor probable, como demuestra el caso del ejemplo. Es de gran ayuda prestar más atención a otros posibles diagnósticos. Bosma et al. plantean la hipótesis de que «la atención de los médicos de pacientes con SD con dificultad para caminar y disfunción vesical puede estar centrada sobre todo en trastornos cerebrales o en la subluxación atlantoaxial»4. El problema sería simplemente la poca atención prestada a causas no psicológicas o la atención excesiva hacia la compresión atlantoaxial como causa de mielopatía, sin estudiar minuciosamente el resto de la columna.
Otro posible motivo por el que las personas con SD tienen una mielopatía más grave es que no informan ellos mismos de sus síntomas. La torpeza y la alteración de la marcha son síntomas tempranos típicos de la MCE. Probablemente, una persona neurológicamente normal buscaría rápidamente atención médica en cuanto notase más torpeza o cambios en la marcha. Aparentemente, las personas con SD tienen una fuerte propiocepción, como las personas neurológicamente normales, así que es probable que también noten la torpeza incipiente18. Sin embargo, todos tienen obstáculos que superar para acudir a la consulta médica, y para una persona con SD, es probable que haya más barreras. Sea cual sea la barrera específica para la persona con SD (comunicación, cognición o memoria), es probable que la gran responsabilidad de detectar el déficit incipiente y de buscar solución para ello recaiga sobre su cuidador. En nuestro estudio hubo casos de debilidad sutil y precoz de una extremidad, como un cambio en el movimiento del brazo al bailar, que no se había tratado. Si un síntoma temprano de mielopatía incipiente en una persona con SD puede ser tan sutil como un cambio en la forma de bailar, los médicos deben estar muy atentos a la información que ofrezcan sus cuidadores.
¿Cuáles son las directrices actuales en la evaluación de una persona con SD que presenta un declive neurológico o un déficit nuevo en las actividades de la vida diaria? Hay pocas directrices claras sobre cómo actuar con un paciente que presenta síntomas que podrían estar relacionados con la mielopatía. Como se mencionaba anteriormente, el peligro que supone la inestabilidad atlantoaxial para los pacientes pediátricos con SD ha dado lugar a recomendaciones específicas para radiografías de la columna cervical por parte de los médicos que administran el tratamiento en casos de cambios en la función neurológica6. Special Olympics hizo una clara recomendación y requerimiento de comprobar la inestabilidad atlantoaxial antes de dar por bueno para competir a un participante con SD19. Parece ser que la gran cantidad de atención hacia la inestabilidad atlantoaxial en el SD se debe al éxito de Special Olympics para promocionar sus directrices desde hace décadas. En cuanto al resto de la columna, hay una escasez de directrices claras para médicos. Bosma et al. hacen la recomendación de que «en pacientes con SD y ataxia, trastorno progresivo de la marcha, debilidad en brazos o piernas o disfunción vesical, en el diagnóstico diferencial se debería considerar la mielopatía cervical por espondiloartrosis inferior, ya que se trata de un trastorno infraestimado de graves consecuencias»4. En el mismo documento se recomienda el estudio por RM cuando haya «sospecha de mielopatía cervical»3. Es una base sólida para una guía clínica en la evaluación de un paciente con declive neurológico, pero es importante que los médicos tengan en cuenta toda la columna. Probablemente, centrarse en la inestabilidad atlantoaxial, aunque es importante, puede hacer que se pase por alto la mielopatía producida en la columna subaxial. Aunque la columna cervical es el sitio más común para la mielopatía, creemos que también es importante que los médicos presten una atención total a toda la columna en cuanto descubran un déficit neurológico.
Nuestros hallazgos evidencian que los médicos y cuidadores deberían incrementar su sensibilización con la mielopatía en el SD. Recomendamos que se considere la mielopatía ante déficits neurológicos sin explicación, cambios en las actividades de la vida diaria o algún deterioro funcional nuevo en una persona con SD. Esto debería llevar a una exploración física que prestase atención a la posible mielopatía y luego, si fuera necesario, a una RM de la columna cervical, torácica y lumbar. La mielopatía es un problema frecuente en el SD y los síntomas pueden ser imperceptibles e internos, de modo que el índice de sospecha debería ser bajo. Aunque al principio los síntomas pueden ser imperceptibles, pueden provocar una discapacidad grave y posiblemente irreversible. El resultado tiende a ser favorable para las personas que reciben tratamiento para la mielopatía en una fase temprana de la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Una revisión previa del resumen de esta investigación fue presentada en la reunión anual de la New England Neurosurgical Society el 24 de junio de 2016.