Acaulospora alpina y Ambispora fennica se reportan por primera vez para México. Estos taxones se aislaron de la rizósfera de Adiantum capillus-veneris, Baccharis conferta, Quercus candicans, Q. crassifolia, Salvia lavanduloides y Selaginella lepidophylla que crecen en los bosques templados de México. Los especímenes revisados se describen en extenso y se comparan con las especies de hongos micorrizógenos arbusculares más parecidas.
Acaulospora alpina and Ambispora fennica are reported for the first time for Mexico. These taxa were found in rhizospheric soil of Adiantum capillus-veneris, Baccharis conferta, Quercus candicans, Q. crassifolia, Salvia lavanduloides, and Selaginella lepidophylla that grow in temperate forests of Mexico. The revised specimens are described in detail and compared with the most similar species of arbuscular mycorrhizal fungi.
Los hongos micorrizógenos arbusculares (HMA; Phylum Glomeromycota) forman micorriza arbuscular con el 75% de las angiospermas, contribuyen a la nutrición y crecimiento vegetal, brindan protección a su hospedero contra patógenos de la raíz, mejoran la estructura del suelo, y favorecen la diversidad florística y la productividad de los ecosistemas (Brundrett, 2009; Montesinos-Navarro, Verdú, Querejeta, Sortibrán, Valiente-Banuet, 2016; Van der Heijden, Bardgett y Straalen, 2008). En México se han registrado 108 especies de HMA (Chimal-Sánchez, García-Sánchez y Hernández-Cuevas, 2015; Montaño et al., 2012); no obstante, poco se sabe sobre la riqueza específica de estos hongos en los ecosistemas templados (Montaño et al., 2012), a pesar de la importancia que tienen en el desarrollo, establecimiento y supervivencia de las plantas del sotobosque, y emblemáticas de este tipo de ambientes, como es el caso de los encinos (Olivera-Morales et al., 2011). El reconocimiento de las comunidades de HMA es un paso esencial para evaluar la diversidad fúngica del país y su posible uso potencial en el desarrollo de estrategias de conservación y manejo conjunto de la vegetación y sus simbiontes, los HMA.
Se reconoce que en los ecosistemas templados, como en el caso de los bosques de coníferas y encino en México (Rzedowski, 2006), la simbiosis ectomicorrízica predomina sobre la micorrízica arbuscular (Read y Pérez-Moreno, 2003); sin embargo, los estudios realizados en México sobre los HMA en estos ambientes sugieren que la diversidad de Glomeromycota puede ser también alta, con presencia de especies exclusivas en estos tipos de vegetación (Daniels y Trappe, 1979; González-Cortés et al., 2012), dado que tienen una elevada diversidad vegetal, endemismos y son centro de diversificación de géneros como Quercus L. y Pinus L. (Romero-Rangel, Rojas-Zenteno y Rubio-Licona, 2015). Como parte de 2 estudios realizados en ecosistemas templados de México, enfocados a evaluar la diversidad de HMA en la rizósfera de Quercus candicans Née y Q. crassifolia Humb. et Bonpl. en un bosque de encino-pino en Chapa de Mota, Estado de México, y en distintas plantas medicinales que crecen en el sotobosque, de un bosque de pino-encino en Taxco de Alarcón, Guerrero, se registran y describen en extenso, por primera vez para México, 2 especies de HMA.
Materiales y métodosEn el bosque de encino-pino de Chapa de Mota se eligieron 2 sitios (S) de muestreo en la localidad Las Ánimas. Durante la estación de lluvias (septiembre-2015), en ambos sitios se seleccionaron 7 individuos de Q. crassifolia (S1; 19°44′48″N, 99°38′25″O; 2,598m snm) y Q. candicans (S2; 19°45′02″N, 99°30′29″O; 2,678m snm). Para el caso del bosque de pino-encino de Taxco de Alarcón, en la estación de lluvias (agosto-2015), se estableció un sitio de muestreo en la localidad de Agua Escondida (18°35′13″N, 99°39′13″O; 2,410m snm) y se eligieron 3 individuos de 4 especies reportadas como medicinales: Adiantum capillus-veneris L., Baccharis conferta Kunth, Salvia lavanduloides Kunth y Selaginella lepidophylla (Hook. et Grev.) Spring.
De cada uno de los individuos de los encinos y las plantas medicinales se recolectó una muestra de suelo (500g) para extraer las esporas de HMA, por el método de tamizado húmedo y decantación (Gerdemann y Nicolson, 1963), seguido de centrifugación (1,000rpm) en sacarosa al 60% (Invam, 2015). Las esporas se montaron en preparaciones permanentes con alcohol polivinílico lactoglicerol (PVLG) con y sin reactivo de Melzer en proporción 1:1 (Invam, 2015). La determinación taxonómica de los HMA se basó en el reconocimiento, comparación y contraste de los caracteres morfológicos de sus esporas y la reacción al Melzer de las capas de la pared esporal. Esta información se contrastó con las descripciones de las especies de Glomeromycota conocidas y disponibles en: http://schuessler.userweb.mwn.de/amphylo/ (Schüßler y Walker, 2010) y http://invam.caf.wvu.edu/ (Invam, 2015). Para describir las paredes de las esporas se siguió la terminología empleada por Oehl, Sýkorová, Redecker, Wiemken y Sieverding (2006). Los caracteres morfológicos de las esporas se observaron con un microscopio óptico con contraste de interferencia de Nomarski (Nikon Optiphot-II). Las esporas y sus caracteres morfológicos se midieron con una reglilla micrométrica acoplada a uno de los oculares del microscopio y la coloración se obtuvo con la fórmula de porcentajes de azul, magenta, amarillo y negro propuestas por el Invam (2015).
De esta manera se reportan por primera vez para México 2 especies de HMA, Acaulospora alpina Oehl, Sýkorová et Sieverd. y Ambispora fennica Walker, Vestberg y Schüβler, de 2 ecosistemas templados. Los ejemplares examinados están disponibles en el Laboratorio de Biosistemática de Leguminosas, Universidad Autónoma Metropolitana-Iztapalapa (AS-016) y en el Laboratorio de Zonas Áridas de la Facultad de Estudios Superiores-Zaragoza, Universidad Nacional Autónoma de México.
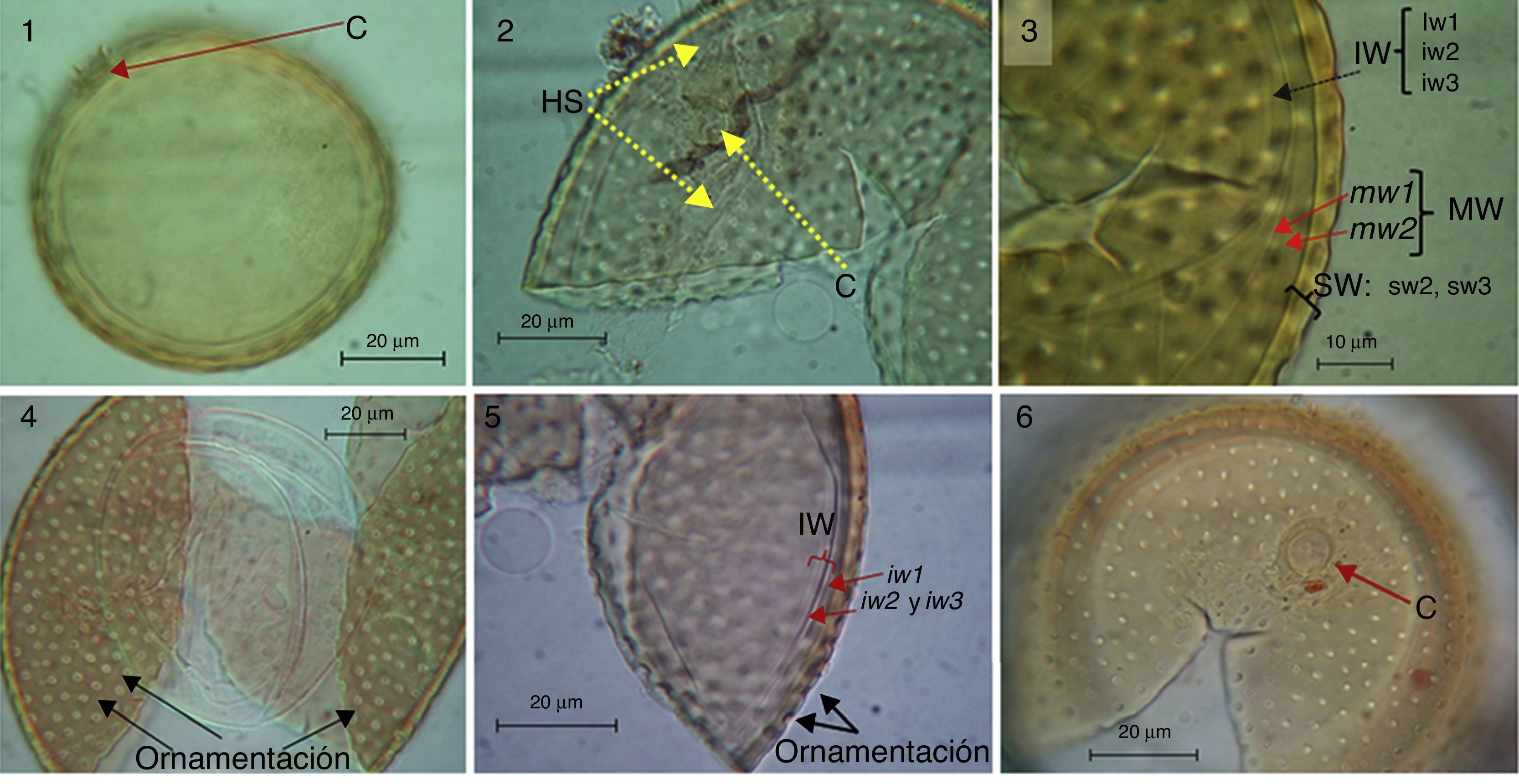
DescripciónAcaulospora alpina Oehl et al. (2006) Mycologia 98 (2): 286-294 (figs. 1–6).
Acaulospora alpina: 1-2, esporas en PVLG formadas lateralmente sobre el cuello de la hifa del sáculo esporífero (HS) y con presencia de una cicatriz (C). 3-4, esporas mostrando su patrón de ornamentación (perforaciones cónicas) y las capas que constituyen a la pared externa (SW), intermedia (MW) e interna (IW) de las esporas que no reaccionaron al reactivo de Melzer. 5-6, esporas en PVLG mostrando su patrón de ornamentación en la capa sw2, la pared interna (IW) constituida de 3 capas (iw1-iw3) y la cicatriz (C).
Diagnosis. Esporas solitarias en el suelo, de color amarillo (0/10/80/0) a naranja intenso (0/40/100/0), globosas, de 71-84.9μm de diámetro (figs. 1–6). Las esporas se forman lateralmente sobre el cuello de la hifa del sáculo esporífero, cuando maduran se desprenden y presentan una cicatriz que evidencia su formación acaulosporoide (figs. 1 y 2). Las esporas están constituidas por una pared separable en 3 grupos, una pared externa (SW), una intermedia (MW) y una interna (IW; fig. 3). La SW consiste de 3 capas (sw1, sw2 y sw3). La capa más externa sw1 es hialina (0/0/5/0), menor a 0.8μm de grosor y ausente en las esporas maduras. La capa sw2 es de color amarillo (0/10/80/0) a naranja intenso (0/40/100/0), laminada, de 2.5-3μm de grosor, incluyendo una ornamentación uniforme conformada por perforaciones de fondo cónico de 2.5-2.8μm de diámetro (fig. 4). Oehl et al. (2006) indicaron que, debido a la forma cónica de las perforaciones, estas con frecuencia parecen tener un punto central obscuro, pero no hay una segunda depresión o una proyección dentro de las mismas (fig. 4). La distancia entre las perforaciones es de 3 a 5μm. La capa interna sw3 (<1μm) es similar en color a la capa sw2, a la cual está adherida.
La MW es hialina (0/0/5/0), está compuesta por 2 capas semiflexibles (mw1 y mw2) fuertemente adheridas y que en conjunto miden 1μm de grosor (fig. 3). La IW es hialina (0/0/5/0) y está constituida por 3 capas adheridas (iw1, iw2, iw3; fig. 5). La capa iw1 es menor a 1μm de grosor y sin excrecencias como en otras especies de Acaulospora. La capa iw2 es de mayor grosor (2μm) que la capa iw1; mientras que la capa iw3 es muy delgada (<0.5μm) y su detección se dificulta, ya que está fuertemente adherida a la capa iw2. Ninguna de las capas en SW, MW e IW reaccionó al reactivo de Melzer (figs. 3 y 4); aunque Oehl et al. (2006) reportaron que en algunas de las esporas la capa iw2 llega a presentar una ligera reacción al reactivo de Melzer con una tenue tonalidad rosa.
Resumen taxonómicoLocalidad tipo. Acaulospora alpina se registró por primera vez en suelo (pH=3.5-5.5) de pastizales alpinos y montañosos con vegetación dominada por Carex curvula All. y/o Nardus stricta L. en los Alpes Suizos, en altitudes entre 1,600 y 2,800m snm (Oehl et al., 2006).
Material examinado. México, Estado de México, Chapa de Mota, Las Ánimas (19°45′02″N; 99°30′29″O; altitud 2,678m snm). Los ejemplares se registraron en suelo rizosférico de Q. candicans y Q. crassifolia (pH=4.6-5.4). Preparaciones: 1-Q. candicans, 2-Q. candicans, 3-Q. candicans, 4-Q. candicans y 1-Q. crassifolia. México, Guerrero, Taxco de Alarcón, Agua Escondida (18°35′13″N, 99°39′13″O; altitud 2, 410m snm). Ejemplares adicionales se encontraron en el suelo rizosférico de A. capillus-veneris y S. lavanduloides. Preparaciones: 5-A. capillus-veneris y 65-S. lavanduloides.
Comentarios taxonómicosAcaulospora alpina presenta tamaño similar a A. taiwania Hu (75-80μm de diámetro), A. paulinae Blaszk. (60-95μm) y A. undulata Sieverd. (55-85μm); pero difiere de estas por la ornamentación de la capa sw2, que consiste de perforaciones cóncavas y no cónicas como en A. alpina (Oehl et al., 2006; Oehl, Palenzuela, Sánchez-Castro, Kuss, Sieverding E, Alves da Silva, 2012). Asimismo, difiere de A. herrerae Furrazola, Oehl (70-95μm), de A. nivalis Oehl, Alves da Silva (81-100×75-82μm), de A. baetica Palenzuela, Oehl (69-96×65-92μm) y de A. sieverdingii Oehl, Alves da Silva (60-80μm) que forman esporas de tamaño similar, pero cuya ornamentación de la capa sw2 consiste de perforaciones irregulares a diferencia de A. alpina en donde son regulares (Furrazola et al., 2013; Oehl, Palenzuela et al., 2012; Palenzuela, Azcón-Aguilar, Barea, Alves da Silva y Oehl, 2015). Con excepción de A. undulata, las especies mencionadas, difieren de A. alpina por la presencia de una capa interna con excrecencias y una reacción al reactivo de Melzer con tonalidades de morado a morado obscuro.
Morfológicamente, A. alpina puede distinguirse de otras especies del género que forman esporas de mayor tamaño como: A. cavernata Blaszk. (115-170μm), A. excavata Ingleby, Walker (100-180μm), A. foveata Trappe, Janos (>185μm) y A. punctata Oehl, Sieverding (105-129μm), cuya ornamentación de la capa sw2 tiene perforaciones cóncavas y no cónicas como en A. alpina. También difiere de otras especies como A. scrobiculata Trappe (100-240μm), A. lacunosa Morton (100-180μm), A. reducta Pereira, Oehl (135-205μm) y A. minuta Oehl, Alves da Silva (175-230μm) que, además de presentar esporas más grandes que A. alpina, tienen perforaciones irregulares sobre la superficie de sw2 en contraste con la ornamentación regular de A. alpina (Oehl et al., 2006; Oehl, Palenzuela et al., 2012; Pereira et al., 2015).
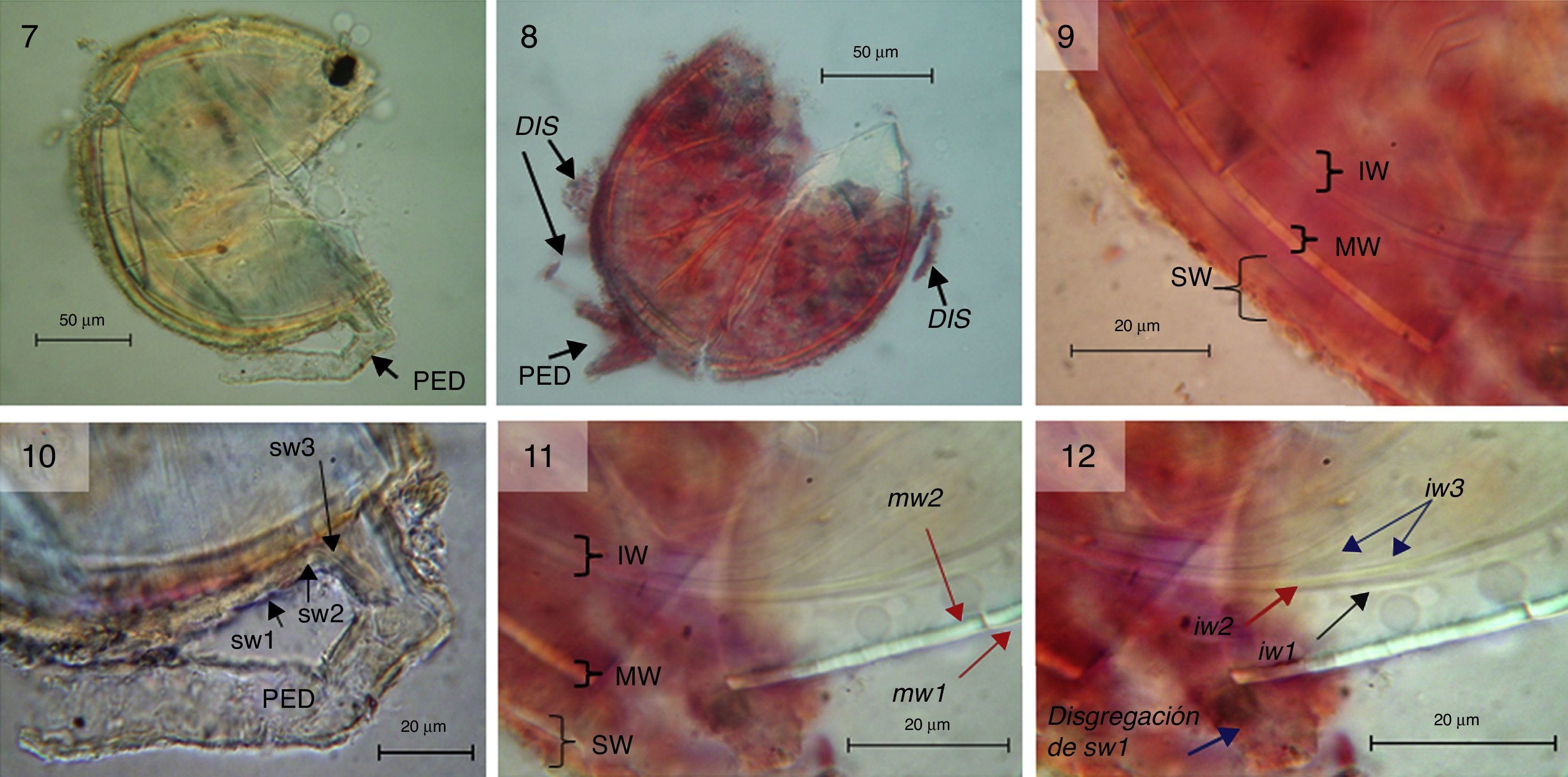
Ambispora fennica Walker, Vestberg y Schüβler. (2007) Mycological Research III: 137-153 (figs. 7–12).
Ambispora fennica. 7, espora con pedicelo (PED) en PVLG. 8-9, esporas mostrando la pared externa (SW), intermedia (MW) e interna (IW), con reacción al Melzer de la capa más externa de SW en donde se observa que se disgrega (DIS). 10, detalle de las 3 capas (sw1, sw2 y sw3) que componen la pared del pedicelo y que son continúas con la pared externa (SW) de la espora. 11-12, composición y número de capas de la pared de la espora: intermedia con 2 capas (mw1-mw2) e interna con 3 capas (iw1-iw3).
Diagnosis. Esta especie forma esporas de tipo acaulosporoide y glomoide en el suelo (Walker et al., 2007); en este trabajo su descripción y comparación se basó únicamente en las esporas del tipo acaulosporoide. Estas corresponden a esporas solitarias, de color blanco con tonalidad amarilla (0/10/40/0), globosas, con diámetro de 147-180μm (figs. 7 y 8). Las esporas se forman lateralmente sobre un pedicelo unido a la hifa del sáculo esporífero, el cual se desprende cuando las esporas maduran, quedando solo restos del pedicelo o una cicatriz que evidencia su origen acaulosporoide (fig. 7). Las esporas están constituidas por una pared separable en 3 grupos: SW, MW e IW (fig. 9). La SW consiste de 3 capas (sw1, sw2 y sw3); la capa sw1 es blanca con una tonalidad amarilla (0/10/40/0), lisa, semipermanente, de 3.4-4.1μm de grosor, se disgrega y cambia a rojo púrpura (20/60/60/0) con el reactivo de Melzer (figs. 8 y 9). La capa sw2 es hialina (0/0/5/0), lisa, laminada de 3.5-3.7μm de ancho. La capa sw3 es hialina (0/0/5/0), lisa, semiflexible, menor a 1.3μm de grosor; presente, pero difícil de observar porque está fuertemente adherida a la capa sw2 (figs. 9 y 10). La MW está constituida por 2 capas (mw1, mw2), hialinas (0/0/5/0), lisas, de 2.2-2.7μm de grosor, fuertemente adheridas y que se fragmentan con facilidad dando la impresión de ser una sola capa (figs. 9–11). La IW está constituida por 3 capas (iw1, iw2, iw3), hialinas (0/0/5/0), lisas y sin excrecencias (fig. 12). La capa iw1 es semiflexible, con 1.2μm de grosor. La capa iw2 es laminada, de 2-3μm y la capa iw3 es flexible, forma pliegues y su grosor es menor a 1μm (figs. 11 y 12). Solo la capa sw1 reacciona al reactivo de Melzer. El pedicelo es curvado, con una amplitud de 16μm en la base de la espora, es de color similar al de las esporas y está constituido por una pared con 3 capas continuas de la capa SW de las esporas (figs. 7, 8 y 10).
Resumen taxonómicoLocalidad tipo. Ambispora fennica fue descrita originalmente de una comunidad vegetal de pastos y trébol, en la localidad de Kurikka Ostrobothnia al oeste de Finlandia (Walker et al., 2007).
Material examinado. México, Estado de México, Chapa de Mota, Las Ánimas (19°45′02″N; 99°30′29″O; altitud 2,678m snm). Los ejemplares se registraron en el suelo rizosférico de Quercus crassifolia. Preparaciones: 1-Q. crassifolia, 2-Q. crassifolia, 3-Q. crassifolia y 4-Q. crassifolia. México, Guerrero, Taxco de Alarcón, Agua Escondida (18°35′13″N, 99°39′13″O; altitud 2,410m snm). Ejemplares adicionales se encontraron en el suelo rizosférico de B. conferta y S. lepidophylla. Preparaciones: B. conferta -18,19, 35, 49 y 58; S. lepidophylla -40, 41, 42, 43 y 59.
Comentarios taxonómicosAmbispora fennica se distingue con facilidad de A. appendicula (Spain, Sieverd. y Schenck) Walker (250μm), A. leptoticha (Schenck, Smith) Walker, Vestberg, Schüβler (205μm) y A. jimgerdemannii (Schenck, Nicolson) Walker (200-250μm) porque presentan esporas acaulosporoides más grandes y sus capas intermedias (mw1 y mw2) están ornamentadas con depresiones hemisféricas cóncavas; lo cual no se presenta en A. fennica (Spain, Sieverding y Oehl, 2006; Walker et al., 2007). Asimismo, se diferencia de aquellas especies que forman esporas de menor tamaño y tienen capas ornamentadas como A. granatensis Palenz., N. Ferrol et Oehl. (92-145μm; papilas en sw1; Palenzuela, Barea, Ferrol y Oehl, 2011) y A. reticulata Oehl et Sieverd. (<150μm, perforaciones sobre mw1; Oehl, Castillo, Schneider, Säle y Sieverding, 2012).
Ambispora fennica difiere también de A. fecundispora (Schenck, Smith) Walker en tamaño (147-180μm vs.107μm), color (hialinas con tonalidad amarilla vs. café obscuro) y composición de la pared (SW, MW, IW vs. solo SW y IW) esporal (Schenck y Smith, 1982). Por el contrario, A. fennica puede ser confundida con A. gerdemannii (Rose, Daniels, Trappe, Walker, Vestberg, Schüβler), que posee esporas con características estructurales muy similares en cuanto a grupos (ambas con SW, MW y IW) y capas (ambas con sw1, sw2, sw3, mw1, mw2, iw1, iw2 y iw3). Sin embargo, puede distinguirse porque esta última forma esporas acaulosporoides ligeramente más grandes (150-250μm), de color amarillo intenso (0/20/100/0) y posee una capa (sw1) que no se disgrega en gránulos finos durante su montaje con PVLG y PVLG con Melzer como en A. fennica (figs. 8 y 12), sino que forma una superficie con fisuras profundas, dando la apariencia de estar conformada por grandes placas angulares (Walker et al., 2007). Las esporas de A. fennica no se compararon con las de A. callosa (Sieverd.) Walker, Vestberg, Schüβler, ya que esta forma preferentemente esporas del tipo glomoide y no acaulosporoide (Walker et al., 2007).
DiscusiónLos bosques templados de coníferas y encinares (Rzedowski, 2006) son el segundo tipo de vegetación en importancia por su amplia distribución en México, y centros de diversificación de los géneros Quercus y Pinus, estos albergan el 50% de las especies de pinos y cerca del 40% (161 spp.) de las especies de encino estimadas en el mundo, de las cuales 109 especies de encinos son endémicas (Romero-Rangel et al., 2015; Valencia, 2004). Así, los 2 nuevos registros de HMA, A. alpina y A. fennica, reportados en Chapa de Mota, Estado de México y Taxco de Alarcón, Guerrero, resaltan la importancia de estos bosques en la conservación de los Glomeromycota. Además, cabe mencionar que la presencia de todos los caracteres morfológicos que caracterizan a las esporas de ambas especies de HMA descritas permite asegurar su presencia en estos bosques y agregarlos como 2 nuevos registros de HMA que incrementan a 110 especies la riqueza de Glomeromycota conocida en los ecosistemas de México (Chimal-Sánchez et al., 2015), lo cual representa el 42% de las especies descritas (aprox. 260 spp.) en el mundo (Oehl, Sieverding, Palenzuela, Ineichen y Gladstone, 2011; Schüßler y Walker, 2010).
Acaulospora alpina se registró con mayor abundancia en el suelo asociado a Q. candicans, mientras que A. fennica solo se registró en el suelo asociado a Q. crassifolia; especies de encinos dominantes en los bosques de encino-pino del Estado de México (Rubio-Licona, Romero-Rangel y Rojas-Zenteno, 2011), en especial de la localidad Las Ánimas (Martínez-Bernal Com. Pers.). Asimismo, A. alpina se registró también en el suelo de las plantas medicinales A. capillus-veneris y S. lavanduloides del bosque de pino-encino en la localidad Agua Escondida, mientras que A. fennica lo fue en suelo de B. conferta y S. lepidophylla; lo cual sugiere que la riqueza de HMA pudiera estar estrechamente relacionada con la identidad de las plantas en los bosques templados estudiados (Romero-Rangel et al., 2015), ya que las especies vegetales ejercen una fuerte influencia sobre la comunidad de HMA (Scheublin, Ridgway, Young y Van der Heijden, 2004) y, en particular, algunas especies de Quercus sobre otros hongos (Chávez-Vergara et al., 2016). Sin embargo, es necesario probar esta hipótesis para determinar si la abundancia de A. alpina y A. fennica es promovida por la identidad del hospedero o por factores abióticos (e.g. propiedades del suelo), debido a que los suelos en los que se desarrollan las plantas de la mayoría de los encinares son ácidos, lo que limita la disponibilidad del fósforo, de manera que los HMA pueden estar favoreciendo, a través de su micelio, la captación de este nutriente esencial al colonizar las raíces de las plantas, por lo que serían cruciales en el mantenimiento de estos bosques (Romero-Rangel et al., 2015).
En conclusión, los nuevos registros de A. alpina y A. fennica en los bosques templados estudiados sugieren la posibilidad de que otras especies de HMA aún no registradas para México e incluso no conocidas a nivel mundial se encuentren asociadas a la flora que resguardan los ecosistemas templados del país. No obstante, hay que resaltar que los pocos estudios realizados en estos ambientes, han contribuido con nuevos registros de HMA, como Diversispora epigaea (Daniels et Trappe) Walker, Schüβler en Morelos (Daniels y Trape, 1979) y Acaulospora koskei Blaszk., Pacispora coralloidae Oehl, Sieverd. y Scutellospora cerradensis Spain, Miranda en Michoacán (González-Cortés et al., 2012), las cuales parecen ser especies exclusivas de los bosques templados, ya que no se han reportado en otros ecosistemas de México (Montaño et al., 2012). Esto, en conjunto con los nuevos registros aquí reportados, resalta que la conservación de los bosques templados contribuye al resguardo de la diversidad de los Glomeromycota del país.
Lucía Varela Fregoso agradece el apoyo de la División de Ciencias Biológicas y de la Salud de la Universidad Autónoma Metropolitana, Unidad Iztapalapa, para ocupar la Cátedra Divisional «Ramón Riba y Nava Esparza».
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.